Surgam 300 Mg Tabletten
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Surgam® 300 mg Tabletten Wirkstoff: Tiaprofensäure
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Tablette enthält 300 mg Tiaprofensäure.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Tabletten.
Weiße Tabletten mit gewölbter zylindrischer Form. Die eine Seite besitzt als Prägung drei einzelne Balken, angeordnet als Dreieck. Die andere Seite weist eine Bruchrille auf. Auf der einen Seite der Bruchrille ist die Tablette mit der Prägung „SURGAM" versehen, auf der anderen Seite mit „300".
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Symptomatische Behandlung von Schmerz und Entzündung bei
- akuten Arthritiden (einschließlich Gichtanfall),
- chronischen Arthritiden, insbesondere rheumatoider Arthritis (chronische Polyarthritis),
- Spondylitis ankylosans (Morbus Bechterew) und anderen entzündlichrheumatischen Wirbelsäulenerkrankungen,
- Reizzuständen bei degenerativen Gelenk- und Wirbelsäulenerkrankungen (Arthrosen und Spondylarthrosen),
- entzündlichen weichteilrheumatischen Erkrankungen,
- schmerzhaften Schwellungen oder Entzündungen nach Verletzungen.
4.2 Dosierung, Art und Dauer der Anwendung Dosierung
So weit nicht anders verordnet, werden folgende Dosierungsrichtlinien empfohlen:
Dosierung für Erwachsene:
Der empfohlene Tagesdosisbereich liegt für Erwachsene bei 600 mg Tiaprofensäure pro Tag, verteilt auf 2 Einzelgaben.
Die Einzeldosis beträgt 1 Surgam 300 mg Tablette (entsprechend 300 mg Tiaprofensäure). Über den Tag verteilt, sollte die Gesamtdosis 2 Surgam 300 mg Tabletten (entsprechend 600 mg Tiaprofensäure) nicht überschreiten.
Art und Dauer der Anwendung
Surgam 300 mg Tabletten werden unzerkaut mit reichlich Flüssigkeit während oder nach den Mahlzeiten eingenommen.
Über die Dauer der Anwendung entscheidet der behandelnde Arzt.
Bei rheumatischen Erkrankungen kann die Einnahme von Surgam 300 mg Tabletten über einen längeren Zeitraum erforderlich sein.
Nebenwirkungen können reduziert werden, indem die niedrigste wirksame Dosis über den kürzesten, zur Symptomkontrolle erforderlichen Zeitraum angewendet wird (siehe Abschnitt 4.4).
Besondere Patientengruppen Ältere Patienten:
Bei älteren Patienten kann es erforderlich sein, die Dosis zu reduzieren bzw. die Dosierungsintervalle zu verlängern. Wegen des möglichen Nebenwirkungsprofils (siehe Abschnitt 4.4) sollten ältere Menschen besonders sorgfältig überwacht werden.
Patienten mit eingeschränkter Nierenfunktion:
Bei Patienten mit eingeschränkter Nierenfunktion (Niereninsuffizienz) kann es erforderlich sein, die Dosis zu reduzieren bzw. die Dosierungsintervalle zu verlängern.
Kinder und Jugendliche:
Surgam 300 mg Tabletten sind zur Behandlung von Kindern und Jugendlichen nicht geeignet, da keine ausreichenden Erfahrungen vorliegen (siehe Abschnitt 4.3).
4.3 Gegenanzeigen
Surgam 300 mg Tabletten dürfen nicht angewendet werden bei:
- Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile,
- Patienten mit Asthma bronchiale (auch in der Anamnese), unabhängig davon, ob es durch Stoffe wie Acetylsalicylsäure bzw. nichtsteroidale Antirheumatika ausgelöst wurde, und bei bekannten Reaktionen von Bronchospasmus, Rhinitis oder Urtikaria nach der Einnahme von Acetylsalicylsäure oder anderen nichtsteroidalen Entzündungshemmern in der Vergangenheit.
Es besteht das Risiko einer Kreuzreaktion zwischen Acetylsalicylsäure und nichtsteroidalen Entzündungshemmern, einschließlich der Gruppe, zu der Tiaprofensäure gehört. Diese pseudoallergischen Reaktionen können sich durch Symptome wie Ausschlag, Urtikaria, Angioödem oder möglicherweise noch schwerwiegendere Manifestationen (z. B. Schwellungen des Kehlkopfes, Bronchokonstriktion, Schock) äußern.
- ungeklärten Blutbildungs- und Blutgerinnungsstörungen,
- bestehenden oder in der Vergangenheit wiederholt aufgetretenen peptischen Ulzera oder Hämorrhagien (mindestens 2 unterschiedliche Episoden nachgewiesener Ulzeration oder Blutung) oder Darmgeschwüren,
- gastrointestinalen Blutungen oder Perforation in der Anamnese im Zusammenhang mit einer vorherigen Therapie mit nichtsteroidalen Antirheumatika/Antiphlogistika (NSAR),
- zerebrovaskulären oder anderen aktiven Blutungen,
- schwerer Herzinsuffizienz,
- schweren Nieren- und Leberfunktionsstörungen,
- Kindern und Jugendlichen,
- Schwangerschaft im letzten Drittel (siehe Abschnitt 4.6 und 5.3).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Nebenwirkungen können reduziert werden, indem die niedrigste wirksame Dosis über den kürzesten, zur Symptomkontrolle erforderlichen Zeitraum angewendet wird (siehe Abschnitt 4.2 und gastrointestinale und kardiovaskuläre Risiken weiter unten).
Gastrointestinale Sicherheit
Die Anwendung von Surgam 300 mg Tabletten in Kombination mit NSAR, einschließlich selektiver Cyclooxigenase-2-Hemmer, sollte vermieden werden.
Ältere Patienten:
Bei älteren Patienten kommt es unter NSAR-Therapie häufiger zu unerwünschten Wirkungen, vor allem zu gastrointestinalen Blutungen und Perforationen, auch mit letalem Ausgang (siehe Abschnitt 4.2). Daher ist bei älteren Patienten eine besonders sorgfältige ärztliche Überwachung erforderlich.
Gastrointestinale Blutungen, Ulzera und Perforationen:
Gastrointestinale Blutungen, Ulzera oder Perforationen, auch mit letalem Ausgang, wurden unter allen NSAR berichtet. Sie traten mit oder ohne vorherige Warnsymptome bzw. schwerwiegende gastrointestinale Ereignisse in der Anamnese zu jedem Zeitpunkt der Therapie auf.
Das Risiko gastrointestinaler Blutung, Ulzeration oder Perforation ist höher mit steigender NSAR-Dosis, bei Patienten mit Ulzera in der Anamnese, insbesondere mit den Komplikationen Blutung oder Perforation (siehe Abschnitt 4.3), und bei älteren Patienten. Diese Patienten sollten die Behandlung mit der niedrigsten verfügbaren Dosis beginnen. Für diese Patienten sowie für Patienten, die eine begleitende Therapie mit niedrig dosierter Acetylsalicylsäure (ASS) oder anderen Arzneimitteln, die das gastrointestinale Risiko erhöhen können, benötigen (siehe Abschnitt 4.5), sollte eine Kombinationstherapie mit protektiven Arzneimitteln (z. B. Misoprostol oder Protonenpumpenhemmern) in Betracht gezogen werden (siehe unten und Abschnitt 4.5).
Patienten mit einer Anamnese gastrointestinaler Toxizität, insbesondere in höherem Alter, sollten jegliche ungewöhnlichen Symptome im Bauchraum (vor allem gastrointestinale Blutungen), insbesondere am Anfang der Therapie, melden. Vorsicht ist angeraten, wenn die Patienten gleichzeitig Arzneimittel erhalten, die das Risiko für Ulzera oder Blutungen erhöhen können, wie z. B. orale Kortikosteroide, Antikoagulanzien wie Warfarin, selektive SerotoninWiederaufnahmehemmer oder Thrombozytenaggregationshemmer wie ASS (siehe Abschnitt 4.5).
Wenn es bei Patienten unter Surgam 300 mg Tabletten zu gastrointestinalen Blutungen oder Ulzera kommt, ist die Behandlung abzusetzen.
NSAR sollten bei Patienten mit einer gastrointestinalen Erkrankung in der Anamnese (Colitis ulcerosa, Morbus Crohn) nur mit Vorsicht angewendet werden, da sich ihr Zustand verschlechtern kann (siehe Abschnitt 4.8). Bei diesen Patienten ist eine besonders sorgfältige ärztliche Überwachung erforderlich.
Kardiovaskuläre und zerebrovaskuläre Wirkungen
Eine angemessene Überwachung und Beratung von Patienten mit Hypertonie und/oder leichter bis mittelschwerer kongestiver Herzinsuffizienz in der Anamnese sind erforderlich, da Flüssigkeitseinlagerung und Ödeme in Verbindung mit NSAR-Therapie berichtet wurden.
Klinische Studien und epidemiologische Daten legen nahe, dass die Anwendung von manchen NSAR (insbesondere bei hohen Dosen und bei Langzeitbehandlung) möglicherweise mit einem geringfügig erhöhten Risiko von arteriellen
thrombotischen Ereignissen (zum Beispiel Herzinfarkt oder Schlaganfall) verbunden ist. Es liegen keine ausreichenden Daten vor, um ein solches Risiko für Tiaprofensäure auszuschließen.
Patienten mit unkontrolliertem Bluthochdruck, kongestiver Herzinsuffizienz, bestehender ischämischer Herzerkrankung, peripherer arterieller Verschlusskrankheit und/oder zerebrovaskulärer Erkrankung sollten mit
Tiaprofensäure nur nach sorgfältiger Abwägung behandelt werden. Vergleichbare Abwägungen sollten auch vor Initiierung einer länger dauernden Behandlung von Patienten mit Risikofaktoren für kardiovaskuläre Ereignisse (z. B. Bluthochdruck, Hyperlipidämie, Diabetes mellitus, Rauchen) gemacht werden.
Bei diesen Patienten ist eine besonders sorgfältige ärztliche Überwachung erforderlich.
Hautreaktionen
Unter NSAR-Therapie wurde sehr selten über schwerwiegende Hautreaktionen, einige mit letalem Ausgang, einschließlich exfoliativer Dermatitis, Stevens-JohnsonSyndrom und toxischer epidermaler Nekrolyse (Lyell-Syndrom), berichtet (siehe Abschnitt 4.8). Das höchste Risiko für derartige Reaktionen scheint zu Beginn der Therapie zu bestehen, da diese Reaktionen in der Mehrzahl der Fälle im ersten Behandlungsmonat auftraten. Beim ersten Anzeichen von Hautausschlägen, Schleimhautläsionen oder sonstigen Anzeichen einer Überempfindlichkeitsreaktion sollten Surgam 300 mg Tabletten abgesetzt werden.
Störungen an den ableitenden Harnwegen
Reizungen an den ableitenden Harnwegen und Entzündungen der Harnblase sind mit Tiaprofensäure und anderen NSAR berichtet worden. Tiaprofensäure scheint häufiger als andere NSAR mit einer Cystitis in Zusammenhang gebracht werden zu können. Unspezifische, manchmal schwerwiegende Cystitiden wurden beobachtet, wenn die Behandlung mit Tiaprofensäure Monate nach Beginn der Symptome fortgesetzt worden ist (siehe Abschnitt 4.8). Obwohl diese Symptome reversibel sind, hat das Nichterkennen bei einigen Patienten zu extensiven Untersuchungen und sogar chirurgischer Intervention geführt. Deshalb muss beim Auftreten solcher Symptome Tiaprofensäure sofort abgesetzt werden. Eine komplette Rückbildung nach Absetzen ist die Regel (siehe Abschnitt 4.8).
Wenn während der Anwendung von Surgam 300 mg Tabletten Störungen an den ableitenden Harnwegen (Pollakisurie, Dysurie oder Hämaturie) auftreten, wird dem Patienten empfohlen, unverzüglich den Arzt aufzusuchen, auch dann, wenn diese Symptome bereits aus der Krankenvorgeschichte bekannt sind.
Tiaprofensäure kann eine Salz- und Wasserretention mit Ödemen verursachen. Zu Beginn der Therapie sollten bei Patienten mit Bluthochdruck, Herzinsuffizienz, Leberzirrhose oder nephrotischem Syndrom in der Anamnese und bei Patienten unter einer Therapie mit Diuretika das Urinvolumen und die Nierenfunktion sorgfältig überwacht werden.
Sonstige Hinweise
Surgam 300 mg Tabletten sollten nur unter strenger Abwägung des Nutzen-RisikoVerhältnisses angewendet werden:
- bei induzierbaren Porphyrien.
Eine besonders sorgfältige ärztliche Überwachung ist erforderlich:
- bei Magen-Darm-Beschwerden,
- bei Patienten mit chronischer Niereninsuffizienz (besonders sorgfältige Überwachung der Nierenfunktion ist erforderlich),
- bei Leberfunktionsstörungen,
- direkt nach größeren chirurgischen Eingriffen,
- bei Erkrankungen der Prostata oder des Urogenitaltraktes,
- bei Patienten, die an rezidivierender Rhinosinusitis, Heuschnupfen, Nasenpolypen, chronisch obstruktiven Atemwegserkrankungen oder chronischen Atemwegsinfektionen (besonders gekoppelt mit heuschnupfenartigen Erscheinungen) oder chronischer Urtikaria leiden, da für sie ein erhöhtes Risiko für das Auftreten allergischer Reaktionen besteht. Diese können sich äußern als Asthmaanfälle (sog. Analgetika-Asthma), Quinke-Ödem oder Urtikaria.
Schwere akute Überempfindlichkeitsreaktionen (zum Beispiel anaphylaktischer Schock) werden sehr selten beobachtet. Bei ersten Anzeichen einer schweren Überempfindlichkeitsreaktion nach Einnahme von Surgam 300 mg Tabletten muss die Therapie abgebrochen werden.
- bei einer Überempfindlichkeit gegen Acetylsalicylsäure und andere Schmerz- oder Rheumamittel aus der Gruppe der nichtsteroidalen Analgetika/Antiphlogistika,
- bei Patienten, die auf andere Stoffe allergisch reagieren, da für sie bei der Anwendung von Surgam 300 mg Tabletten ebenfalls ein erhöhtes Risiko für das Auftreten von Überempfindlichkeitsreaktionen, wie z. B. Hautreaktionen, Juckreiz oder Nesselfieber, besteht.
Surgam 300 mg Tabletten können vorübergehend die Thrombozytenaggregation hemmen. Patienten mit einer Gerinnungsstörung sollten daher sorgfältig überwacht werden.
Bei länger dauernder Gabe von Surgam 300 mg Tabletten ist eine regelmäßige Kontrolle der Leberwerte, der Nierenfunktion sowie des Blutbildes erforderlich.
Bei längerem Gebrauch von Schmerzmitteln können Kopfschmerzen auftreten, die nicht durch erhöhte Dosen des Arzneimittels behandelt werden dürfen.
Ganz allgemein kann die gewohnheitsmäßige Einnahme von Schmerzmitteln, insbesondere bei Kombination mehrerer schmerzstillender Wirkstoffe, zur dauerhaften Nierenschädigung mit dem Risiko eines Nierenversagens (AnalgetikaNephropathie) führen.
Bei älteren Patienten ist eine besonders sorgfältige ärztliche Überwachung erforderlich.
Bei Anwendung von NSAR können durch gleichzeitigen Konsum von Alkohol wirkstoffbedingte Nebenwirkungen, insbesondere solche, die den Gastrointestinaltrakt oder das zentrale Nervensystem betreffen, verstärkt werden.
Bezüglich weiblicher Fertilität siehe Abschnitt 4.6.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Tiaprofensäure (wie andere NSAR) sollte nur mit Vorsicht zusammen mit den folgenden Arzneistoffen eingenommen werden:
Andere nichtsteroidale Antirheumatika (einschließlich selektiver Cyclooxigenase-2-Inhibitoren und Salicylate):
Die gleichzeitige Gabe mehrerer NSAR kann das Risiko gastrointestinaler Ulzera und Blutungen auf Grund eines synergistischen Effekts erhöhen. Daher soll die gleichzeitige Anwendung von Tiaprofensäure mit anderen NSAR vermieden werden (siehe Abschnitt 4.4).
Digoxin, Phenytoin, Lithium:
Die gleichzeitige Anwendung von Surgam 300 mg Tabletten mit Digoxin-, Phenytoin- oder Lithiumpräparaten kann die Plasma- bzw. Serumkonzentrationen dieser Arzneimittel erhöhen. Eine Kontrolle der Plasma- bzw. Serumkonzentrationen ist nötig.
Diuretika,_ACE-Hemmer,_Angiotensin-II-Rezeptorantagonisten,
Betarezeptorenblocker:
Surgam 300 mg Tabletten können die Wirkung von Diuretika und Antihypertensiva (Betarezeptorenblockern, ACE-Hemmern, Angiotensin-II-Rezeptorantagonisten) abschwächen. Die gleichzeitige Einnahme von Surgam 300 mg Tabletten und Diuretika oder ACE-Hemmern kann das Risiko für eine Beeinträchtigung der Nierenfunktion und/oder Hyperkaliämie erhöhen. Bei Patienten mit eingeschränkter Nierenfunktion (z. B. exsikkierte Patienten oder ältere Patienten) kann die gleichzeitige Einnahme eines ACE-Hemmers oder Angiotensin-II-Rezeptorantagonisten mit einem Arzneimittel, das die Cyclooxigenase hemmt, zu einer weiteren Verschlechterung der Nierenfunktion, einschließlich eines möglichen akuten Nierenversagens, führen. Daher sollte eine solche Kombination, vor allem bei älteren Patienten, nur mit Vorsicht angewendet werden. Die Patienten müssen zu einer adäquaten Flüssigkeitseinnahme aufgefordert werden, und eine regelmäßige Kontrolle der Nierenwerte sollte nach Beginn einer Kombinationstherapie in Erwägung gezogen werden.
Glukokortikoide:
Durch die gleichzeitige Einnahme von Surgam 300 mg Tabletten mit Glukokortikoiden erhöht sich das Risiko für Nebenwirkungen im Magen-Darm-Trakt, insbesondere für gastrointestinale Ulzera oder Blutungen (siehe Abschnitt 4.4).
Thrombozytenaggregationshemmer wie Acetylsalicylsäure und selektive SerotoninWiederaufnahmehemmer (SSRI):
Erhöhtes Risiko gastrointestinaler Blutungen (siehe Abschnitt 4.4).
Methotrexat:
Die Gabe von Surgam 300 mg Tabletten innerhalb von 24 Stunden vor oder nach Gabe von Methotrexat kann zu einer erhöhten Konzentration von Methotrexat und einer Zunahme seiner toxischen Wirkung führen.
Eine gleichzeitige Gabe von hoch dosiertem Methotrexat wird nicht empfohlen, da es zu einer Beeinträchtigung der renalen Clearance und der Plasmaproteinbindung von Methotrexat kommen kann. Auch eine niedrig dosierte Gabe sollte daher mit Vorsicht erfolgen.
Probenecid und Sulfinpyrazon:
Arzneimittel, die Probenecid oder Sulfinpyrazon enthalten, können die Ausscheidung von Tiaprofensäure verzögern.
Antikoagulanzien, Plättchenaggregationshemmer und Thrombolytika:
Eine gleichzeitige Verabreichung von Tiaprofensäure mit Antikoagulanzien (z. B. Heparin, Warfarin), Plättchenaggregationshemmern (z. B. Ticlopidin, Clopidogrel) und Thrombolytika kann zu einem erhöhten Blutungsrisiko führen (siehe Abschnitt 4.4). Falls eine gleichzeitige Verabreichung unvermeidbar ist, werden vorsichtshalber eine Kontrolle der Gerinnungswerte und eine engmaschige Überwachung der Patienten empfohlen.
Ciclosporin:
Das Risiko einer nierenschädigenden Wirkung durch Ciclosporin wird durch die gleichzeitige Gabe bestimmter NSAR erhöht. Dieser Effekt kann auch für eine Kombination von Ciclosporin mit Tiaprofensäure nicht ausgeschlossen werden.
Sulfonylharnstoffe:
Die Möglichkeit einer Interaktion muss in Betracht gezogen werden bei gleichzeitiger Einnahme von Arzneistoffen, die zu einem beträchtlichen Anteil an Plasmaproteine gebunden sind (hierzu zählen Sulfonylharnstoffe). Bei gleichzeitiger Therapie wird daher eine Kontrolle der Blutzuckerwerte empfohlen.
4.6 Schwangerschaft und Stillzeit
Schwangerschaft
Tiaprofensäure überschreitet die Plazentaschranke.
Über die Sicherheit einer Anwendung von Surgam 300 mg Tabletten in der Schwangerschaft liegen für den Menschen keine ausreichenden Erfahrungen vor. Tierstudien mit Tiaprofensäure haben Reproduktionstoxizität aufgezeigt (siehe Abschnitt 5.3).
Die Hemmung der Prostaglandinsynthese kann die Schwangerschaft und/oder die embryofetale Entwicklung negativ beeinflussen. Daten aus epidemiologischen Studien weisen auf ein erhöhtes Risiko für Fehlgeburten sowie kardiale Missbildungen und Gastroschisis (Bauchspalte) nach der Anwendung eines Prostaglandinsynthesehemmers in der Frühschwangerschaft hin. Es wird angenommen, dass das Risiko mit der Dosis und der Dauer der Therapie steigt.
Bei Tieren wurde nachgewiesen, dass die Gabe eines Prostaglandinsynthesehemmers zu erhöhtem prä- und postimplantären Verlust und zu embryofetaler Letalität führt. Ferner wurden erhöhte Inzidenzen verschiedener Missbildungen, einschließlich kardiovaskulärer Missbildungen, bei Tieren berichtet, die während der Phase der Organogenese einen Prostaglandinsynthesehemmer erhielten.
Während des ersten und zweiten Schwangerschaftstrimesters sollte
Tiaprofensäure nur gegeben werden, wenn dies unbedingt notwendig ist. Falls Tiaprofensäure von einer Frau angewendet wird, die eine Schwangerschaft anstrebt, oder wenn es während des ersten oder zweiten
Schwangerschaftstrimesters angewendet wird, sollten die Dosis so niedrig und die Behandlungsdauer so kurz wie möglich gehalten werden.
Während des dritten Schwangerschaftstrimesters können alle Prostaglandinsynthesehemmer:
• den Fetus folgenden Risiken aussetzen:
- kardiopulmonale Toxizität (mit vorzeitigem Verschluss des Ductus arteriosus und pulmonaler Hypertonie);
- Nierenfunktionsstörung, die zu Nierenversagen mit Oligurie und Oligohydramniose fortschreiten kann;
• die Mutter und das Kind am Ende der Schwangerschaft folgenden Risiken aussetzen:
- mögliche Verlängerung der Blutungszeit, ein
thrombozytenaggregationshemmender Effekt, der selbst bei sehr geringen Dosen auftreten kann;
- Hemmung von Uteruskontraktionen mit der Folge eines verspäteten oder verlängerten Geburtsvorganges;
- verstärkte Ödembildung bei der Mutter.
Daher ist Tiaprofensäure während des dritten Schwangerschaftstrimesters kontraindiziert.
Stillzeit
Tiaprofensäure geht in die Muttermilch über. Da keine ausreichenden Erfahrungen zur Sicherheit für den Säugling vorliegen, wird eine Anwendung von Surgam 300 mg Tabletten in der Stillzeit nicht empfohlen.
Fertilität
Die Anwendung von Tiaprofensäure kann (wie die Anwendung anderer Arzneimittel, die bekanntermaßen die Cyclooxigenase/Prostaglandinsynthese hemmen) die weibliche Fertilität beeinträchtigen und wird daher bei Frauen, die schwanger werden möchten, nicht empfohlen. Bei Frauen, die Schwierigkeiten haben, schwanger zu werden, oder bei denen Untersuchungen zur Infertilität durchgeführt werden, sollte das Absetzen von Tiaprofensäure in Betracht gezogen werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Da bei der Anwendung von Surgam 300 mg Tabletten in höherer Dosierung zentralnervöse Nebenwirkungen wie Müdigkeit und Schwindel auftreten können, können im Einzelfall die Reaktionsfähigkeit verändert und die Fähigkeit zur aktiven Teilnahme am Straßenverkehr und zum Bedienen von Maschinen beeinträchtigt werden. Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zu Grunde gelegt:
Sehr häufig (> 10 %)
Häufig (> 1 % - < 10 %)
Gelegentlich (> 0,1 % - < 1 %)
Selten (> 0,01 % - < 0,1 %)
Sehr selten (< 0,01 %)
Ohne Häufigkeitsangabe (die Häufigkeit konnte anhand der Daten nicht berechnet werden).
Bei den folgenden unerwünschten Arzneimittelwirkungen muss berücksichtigt werden, dass sie überwiegend dosisabhängig und interindividuell unterschiedlich sind.
Herzerkrankungen
Ödeme, Bluthochdruck und Herzinsuffizienz wurden im Zusammenhang mit NSAR-Behandlung berichtet.
Klinische Studien und epidemiologische Daten legen nahe, dass die Anwendung von manchen NSAR (insbesondere bei hohen Dosen und bei Langzeitbehandlung) möglicherweise mit einem geringfügig erhöhten Risiko von arteriellen thrombotischen Ereignissen (zum Beispiel Herzinfarkt oder Schlaganfall) verbunden ist (siehe Abschnitt 4.4).
Sehr selten: Palpitationen, Schmerzen in der Brust, Bluthochdruck,
Herzinsuffizienz.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Störungen der Blutbildung (Anämie, Leukopenie, Agranulozytose, Thrombozytopenie). Erste Anzeichen können sein: Fieber, Halsschmerzen, oberflächliche Wunden im Mund, grippeartige Beschwerden, starke
Abgeschlagenheit, Nasenbluten und Hautblutungen.
Sehr selten: hämolytische Anämie.
Ohne Häufigkeitsangabe: Anämie infolge von Blutungen.
Bei der Langzeittherapie sollte das Blutbild regelmäßig kontrolliert werden. Die Blutungszeit kann verlängert sein.
Erkrankungen des Nervensystems
Häufig: zentralnervöse Störungen wie Kopfschmerz, Schwindel, Müdigkeit.
Sehr selten: Sensibilitätsstörungen, Zittern, Krämpfe, Störungen der Geschmacksempfindung.
Weiterhin wurde von Benommenheit berichtet.
A ugenerkrankungen
Sehr selten: Sehstörungen (Verschwommen- oder Doppeltsehen).
Erkrankungen des Ohrs und des Labyrinths Häufig: Tinnitus.
Erkrankungen des Gastrointestinaltrakts
Die am häufigsten beobachteten Nebenwirkungen betreffen den Verdauungstrakt. Peptische Ulzera, Darmgeschwüre, Perforationen oder okkulte oder manifeste Blutungen, manchmal tödlich, können auftreten, insbesondere bei älteren Patienten (siehe Abschnitt 4.4).
Übelkeit, Erbrechen, Diarrhö (auch blutig), Blähungen, Verstopfung, Verdauungsbeschwerden, abdominale Schmerzen, Teerstuhl, Hämatemesis, ulzerative Stomatitis und Verschlimmerung von Colitis (z. B. Colitis ulcerosa) und Morbus Crohn (siehe Abschnitt 4.4) sind nach Anwendung berichtet worden. Weniger häufig wurde Gastritis beobachtet.
Insbesondere das Risiko für das Auftreten von Magen-Darm-Blutungen (in Zusammenhang mit Geschwüren, Schleimhautdefekten,
Magenschleimhautentzündungen) ist abhängig vom Dosisbereich und der Anwendungsdauer.
Die genannten Nebenwirkungen treten mit folgenden Häufigkeiten auf:
Sehr häufig: Magen-Darm-Beschwerden wie Magenschmerzen, Übelkeit, Erbrechen und Durchfall, geringfügige Magen-Darm-Blutverluste, die eine Blutarmut verursachen können.
Häufig: Dyspepsie, Flatulenz, Bauchkrämpfe, Inappetenz, gastrointestinale Ulzera (unter Umständen mit Blutung und Durchbruch).
Gelegentlich: Hämatemesis, Meläna, blutiger Durchfall.
Sehr selten: Stomatitis, Glossitis, Ösophagusläsionen, Beschwerden im Unterbauch (z. B. blutende Kolitiden), Verschlimmerung eines Morbus Crohn/einer Colitis ulcerosa, Obstipation, Pankreatitis, diaphragmaartige intestinale Strikturen. Ohne Häufigkeitsangabe: Gastritis, ulzerative Stomatitis.
Der Patient ist anzuweisen, bei Auftreten von stärkeren Schmerzen im Oberbauch oder bei Meläna oder Hämatemesis das Arzneimittel abzusetzen und sofort einen Arzt aufzusuchen.
Erkrankungen der Nieren und Harnwege
Gelegentlich: Ausbildung von Ödemen (z. B. peripheren Ödemen), insbesondere bei Patienten mit hohem Blutdruck, Herzinsuffizienz, Leberzirrhose oder eingeschränkter Nierenfunktion.
Sehr selten: nephrotisches Syndrom, Nierengewebsschädigungen (interstitielle Nephritis, Papillennekrose), die mit akuter Niereninsuffizienz, Proteinurie und/oder Hämaturie einhergehen können.
Die Nierenfunktion sollte daher regelmäßig kontrolliert werden.
Weiterhin sehr selten: Reizungen und Entzündungen der Harnblase mit Symptomen wie Blasenschmerzen, Pyurie, Pollakisurie, Dysurie oder Hämaturie.
In diesen Fällen sind Surgam 300 mg Tabletten sofort abzusetzen, um eine Verschlimmerung zu vermeiden und die Rückbildung dieser Symptome zu gewährleisten.
Weiterhin wurde von Salz- und Wasserretention (siehe Abschnitt 4.4) berichtet.
Erkrankungen der Haut und des Unterhautzellgewebes Gelegentlich: Urtikaria, Alopezie.
Sehr selten: bullöse Exantheme, Ekzeme, Erytheme, Photosensibilisierung, Purpura (auch allergische Purpura), schwere Verlaufsformen von bullösen Hautreaktionen wie Erythema exsudativum multiforme, Stevens-Johnson-Syndrom und toxische epidermale Nekrolyse (Lyell-Syndrom).
Weitere Reaktionen an der Haut siehe Abschnitt 4.8 „Erkrankungen des Immunsystems“.
Infektionen und parasitäre Erkrankungen
Sehr selten ist im zeitlichen Zusammenhang mit der systemischen Anwendung von NSAR eine Verschlechterung infektionsbedingter Entzündungen (z. B. Entwicklung einer nekrotisierenden Fasciitis) beschrieben worden. Dies steht möglicherweise im Zusammenhang mit dem Wirkmechanismus der NSAR.
Wenn während der Anwendung von Surgam 300 mg Tabletten Zeichen einer Infektion neu auftreten oder sich verschlimmern, wird dem Patienten daher empfohlen, unverzüglich den Arzt aufzusuchen.
Es ist zu prüfen, ob die Indikation für eine antiinfektiöse/antibiotische Therapie vorliegt.
Gefäßerkrankungen Sehr selten: Bluthochdruck.
Erkrankungen des Immunsystems
Häufig: Überempfindlichkeitsreaktionen wie Hautausschlag und Hautjucken.
Sehr selten: schwere allgemeine Überempfindlichkeitsreaktionen, die sich als Angioödeme (Schwellungen z. B. von Gesicht, Zunge und innerem Kehlkopf mit Einengung der Luftwege), Luftnot bis zum Asthmaanfall, Tachykardie, Blutdruckabfall bis zum lebensbedrohlichen anaphylaktischen Schock äußern können.
Weiterhin wurde von Asthma, besonders bei Patienten, die allergisch auf Acetylsalicylsäure und andere NSAR reagieren, berichtet.
Beim Auftreten einer dieser Erscheinungen, die schon bei Erstanwendung vorkommen können, ist sofortige ärztliche Hilfe erforderlich.
Sehr selten: allergisch bedingte Vaskulitis und Pneumonitis.
Leber- und Gallenerkrankungen
Häufig: Erhöhung der Serumtransaminasen.
Gelegentlich: Leberschäden (Hepatitis mit oder ohne Gelbsucht, sehr selten fulminant verlaufend, auch ohne Prodromalsymptome).
Die Leberwerte sollen daher regelmäßig kontrolliert werden.
Psychiatrische Erkrankungen
Häufig: Schlaflosigkeit, Erregung, Reizbarkeit.
Sehr selten: Angstgefühle, Albträume, Gedächtnisstörungen, Desorientiertheit, Depression und andere psychotische Reaktionen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des NutzenRisiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
a) Symptome einer Überdosierung
Als Symptome einer Überdosierung können zentralnervöse Störungen mit Kopfschmerzen, Schwindel, Benommenheit und Bewusstlosigkeit sowie Abdominalschmerzen, Übelkeit und Erbrechen auftreten. Blutungen im MagenDarm-Trakt sowie Funktionsstörungen der Leber und Nieren sind möglich. Ferner kann es zu Hypotension, Atemdepression und Zyanose kommen.
b) Therapiemaßnahmen bei Überdosierung
Eine frühzeitige Magenspülung ist indiziert.
Ein spezifisches Antidot existiert nicht.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe:
Phenylpropionsäurederivat, nichtsteroidales Antiphlogistikum/Antirheumatikum, ATC-Code: M01AE11.
Tiaprofensäure ist ein nichtsteroidales Antiphlogistikum/Antirheumatikum, das sich über die Prostaglandinsynthesehemmung in den üblichen tierexperimentellen Entzündungsmodellen als wirksam erwies. Beim Menschen reduziert Tiaprofensäure entzündlich bedingte Schmerzen, Schwellungen und Fieber. Ferner wird die ADP- und die kollageninduzierte Plättchenaggregation gehemmt.
5.2 Pharmakokinetische Eigenschaften
Nach oraler Applikation wird Tiaprofensäure zum Teil schon im Magen und anschließend vollständig aus dem Dünndarm resorbiert. Nach hepatischer Metabolisierung werden die pharmakologisch weitgehend inaktiven Metaboliten vollständig eliminiert, hauptsächlich renal, aber auch biliär. Die Plasmahalbwertszeit beträgt beim Gesunden 1,5-2,7 Stunden, sie ist bei Nierenkranken und im höheren Alter auf 5,8 bzw. 4,7 Stunden erhöht. Die Plasmaproteinbindung liegt bei 98-99 %. Maximale Plasmaspiegel werden nach 1-3 Stunden erreicht. Die erforderliche therapeutisch wirksame Plasmakonzentration dürfte größer als 5 pg/ml sein. Die absolute Bioverfügbarkeit liegt bei ca. 100 %.
Bioverfügbarkeit
Eine im Jahr 1986 durchgeführte Bioverfügbarkeitsuntersuchung an 12 Probanden ergab für Surgam 300 mg Tabletten:
|
Surgam 300 mg Tabletten | |
|
Maximale Plasmakonzentration (Cmax) [mg/l] |
37,3 + 2,6 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax) [h] |
1,53 + 0,16+ |
|
Fläche unter der Konzentrations-Zeit-Kurve (AUC) [mg x h/l] |
206 + 13 |
Angabe der Werte als Mittelwert und Streubreite + Vom Zeitpunkt der letzten Tabletteneinnahme
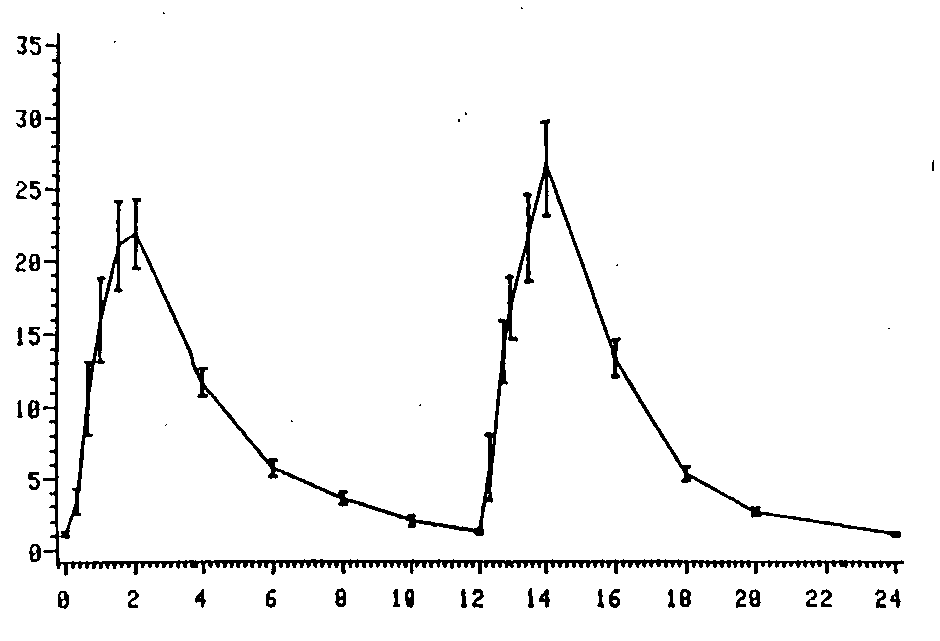
Mittlere Plasmaspiegelverläufe in einem Konzentrations-Zeit-Diagramm:
5.3 Präklinische Daten zur Sicherheit
a) Akute Toxizität
Die LD50 liegt je nach Verabreichungsweg und Tierart zwischen 190-780 mg Tiaprofensäure pro kg Körpergewicht. Vergiftungssymptome waren erhöhte Reizbarkeit, Tremor, Zyanose, Atem- und Koordinationsstörungen sowie Sedation. In der Sektion wurden Aszites, Peritonitis sowie Hypertrophie und Blutfülle der mesenterialen Lymphknoten als Folge gastrointestinaler Läsionen gefunden (siehe Abschnitt 4.9).
b) Chronische Toxizität
Untersuchungen zur chronischen Toxizität wurden per os an Ratte, Hund und Pavian durchgeführt. Magen-Darm-Läsionen traten dosisabhängig bei allen Tierarten auf mit Blutspuren in den Fäzes, Anämien und reaktiven Veränderungen der Milz und des Knochenmarks. Die Serumharnstoffkonzentrationen waren gelegentlich erhöht (siehe auch Abschnitt 4.8).
c) Mutagenes und tumorerzeugendes Potenzial
Tiaprofensäure wurde in einer Standardtestbatterie aus In-vitro- und In-vivo-Tests zum mutagenen Potenzial geprüft. Die Tests ergaben keine Hinweise auf ein genotoxisches Potenzial von Tiaprofensäure.
Langzeituntersuchungen an Ratte und Maus ergaben keine Hinweise auf ein tumorerzeugendes Potenzial von Tiaprofensäure.
d) Reproduktionstoxizität
Embryo- und fetotoxische Wirkungen wurden bei der empfindlichsten Spezies bei einer Dosis von 10 mg/kg KG beobachtet. Beim Kaninchen wurde ab einer Dosis von 75 mg/kg KG die Implantation der Blastozyste beeinträchtigt. Eine Verlängerung der Tragzeit und des Geburtsvorganges trat bei Ratten nach Verabreichung von 16 mg/kg KG im letzten Trächtigkeitsdrittel auf. Dadurch kam es zu einer erhöhten Totgeburtenrate und zu einem Anstieg der
Neugeborenensterblichkeit. Die Fertilität der Elterntiere war bei der Ratte bis zu einer Dosis von 25 mg/kg KG nicht gestört.
6.
6.1
6.2
6.3
6.4
6.5
PHARMAZEUTISCHE ANGABEN
Liste der sonstigen Bestandteile
Maisstärke, Magnesiumstearat (Ph. Eur.) (pflanzlich), Talkum, Poloxamer 188.
Inkompatibilitäten
Bisher keine bekannt.
Dauer der Haltbarkeit
Die Dauer der Haltbarkeit beträgt 3 Jahre.
Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
Art und Inhalt des Behältnisses
Weiße opake PVC/PVA-Aluminium-Blister.
Surgam 300 mg Tabletten:
20 Tabletten 50 Tabletten 100 Tabletten
7. INHABER DER ZULASSUNG
Sanofi-Aventis Deutschland GmbH 65926 Frankfurt am Main
Postanschrift:
Postfach 80 08 60 65908 Frankfurt am Main
Tel.: (01 80) 2 22 20 101
Fax: (01 80) 2 22 20 111
8. ZULASSUNGSNUMMER
710.02.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
03.05.1983/02.12.2004
10. STAND DER INFORMATION
Oktober 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig.
17
0,06 €/Anruf (dt. Festnetz); max. 0,42 €/min (Mobilfunk).