Terazosin Winthrop 10Mg
Fachinformation
(Zusammenfassung der Merkmale des Arzneimittels)
Terazosin Winthrop® 2 mg Terazosin Winthrop® 5 mg Terazosin Winthrop® 10 mg
1. BEZEICHNUNG DER ARZNEIMITTEL
Terazosin Winthrop® 2 mg Tabletten
Terazosin Winthrop® 5 mg Tabletten
Terazosin Winthrop® 10 mg Tabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Terazosin Winthrop 2 mg
1 gelbe Tablette enthält 2,374 mg Terazosinhydrochlorid 2 H2O, entsprechend 2 mg Terazosin.
Terazosin Winthrop 5 mg
1 rote Tablette enthält 5,935 mg Terazosinhydrochlorid 2 H2O, entsprechend 5 mg Terazosin.
Terazosin Winthrop 10 mg
1 blaue Tablette enthält 11,87 mg Terazosinhydrochlorid 2 H2O, entsprechend 10 mg Terazosin.
Terazosin Winthrop enthält Lactose (siehe Abschnitt 4.4).
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM Tablette.
Terazosin Winthrop 2 mg
Gelbe, runde, beidseitig flache Tablette mit abgeschrägtem Rand und einem Durchmesser von ca. 7 mm. Terazosin Winthrop 5 mg
Rote, runde, beidseitig flache Tablette mit abgeschrägtem Rand und einem Durchmesser von ca. 7 mm. Terazosin Winthrop 10 mg
Blaue, runde, beidseitig flache Tablette mit abgeschrägtem Rand und einem Durchmesser von ca. 7 mm.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Terazosin Winthrop ist angezeigt zur Behandlung der klinischen Symptome sowie der Blasenentleerungsstörungen bei benigner Prostatahyperplasie (BPH).
4.2 Dosierung und Art der Anwendung
Dosierung
Für die benötigten unterschiedlichen Dosierungen stehen entsprechende Tablettenstärken zu 1, 2, 5 und 10 mg Terazosin zur Verfügung.
Soweit nicht anders verordnet, gelten folgende Dosierungsempfehlungen:
Grundsätzlich sollte die Behandlung einschleichend mit der niedrigsten Dosierung 1 mg Terazosin begonnen und langsam bis zur individuellen Wirkdosis gesteigert werden gemäß folgendem Dosierungsschema:
Dosissteigerung auf die Erhaltungsdosis bei BPH:
|
Dosierungsstufen |
Tagesdosis Terazosin |
Tablette/Tag |
Mindesttherapiedauer dieser Dosierstufe vor dem Wechsel zur nächsthöheren Dosierung zur Erzielung der urodynamischen Wirkung |
|
1. Stufe (Tag 1-7) |
1 mg |
1 x 1 mg Terazosin |
7 Tage |
|
2. Stufe (Tag 8-21) |
2 mg |
1 x 1 gelbe Tabl. Terazosin Winthrop 2 mg |
14 Tage |
Vorübergehende Nebenwirkungen können bei jeder Dosierungsstufe auftreten. Bleiben Nebenwirkungen bestehen, sollte die Dosis reduziert werden.
Der therapeutische Bereich liegt in der Regel bei 2 bis 5 mg pro Tag. Die Dosis soll langsam gesteigert werden, bis die gewünschte Wirkung erreicht ist. Es ist keine weitere Symptomverbesserung bei Erhöhung der Dosis über 10 mg einmal täglich zu erwarten.
Mit einer Verbesserung der Beschwerden kann frühestens zwei Wochen nach Therapiebeginn gerechnet werden.
Bei gleichzeitiger Gabe von Terazosin Winthrop und anderen blutdrucksenkenden Mitteln gelten die obigen Dosisrichtlinien nur, wenn diese Arzneimittel in ihrer Dosis reduziert oder abgesetzt werden (siehe auch Abschnitt 4.4).
Anwendung bei älteren Patienten und bei Patienten mit Niereninsuffizienz
Pharmakokinetische Untersuchungen bei älteren Patienten und bei Patienten mit Niereninsuffizienzzeigten, dass keine größeren Veränderungen hinsichtlich der empfohlenen Dosierung notwendig sind. Jedoch sollte bei diesen Patienten die Dosis so niedrig wie möglich gehalten werden und eine Dosissteigerung nur unter genauer Beobachtung vorgenommen werden.
Anwendung bei Patienten mit Leberinsuffizienz
Bei Patienten mit eingeschränkter Leberfunktion sollte Terazosin besonders vorsichtig dosiert werden, da Terazosin größtenteils über die Leber abgebaut wird. Bei Patienten mit schwerwiegender Leberfunktionsstörung liegen keine klinischen Erfahrungen vor (siehe Abschnitt 4.4).
Anwendung bei Kindern
Terazosin Winthrop ist bei Kindern nicht indiziert.
Art der Anwendung
Die erste Tablette Terazosin Winthrop einer Stärke und jede 1. Tablette bei Dosiserhöhung sollte abends vor dem Zubettgehen eingenommen werden. Alle folgenden Tabletten derselben Stärke können entweder abends oder morgens eingenommen werden.
Die Einnahme der Tabletten soll mit ausreichend Flüssigkeit (z. B. ein Glas Wasser) erfolgen.
Die Dauer der Behandlung wird vom behandelnden Arzt festgelegt. Die Therapie mit Terazosin ist eine Langzeittherapie, die nur nach ärztlicher Anweisung unterbrochen werden sollte.
Im Fall einer Therapieunterbrechung ist spätestens nach einer zweitägigen Unterbrechung erneut eine schrittweise Dosissteigerung durchzuführen, beginnend mit 1 mg Terazosin abends vor dem Zubettgehen.
4.3 Gegenanzeigen
- Terazosin Winthrop ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegen den Wirkstoff Terazosin bzw. andere Chinazoline (z. B. Prazosin, Doxazosin, Alfuzosin) oder gegen einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
- Miktionssynkopen in der Vorgeschichte.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Behandlung mit Terazosin Winthrop bedarf der regelmäßigen ärztlichen Kontrolle.
Vor allem nach Einnahme der ersten Dosis („Effekt der 1. Dosis“) oder bei Dosiserhöhung kann es zu übermäßigem Blutdruckabfall, besonders im Stehen und beim Lagewechsel, kommen. In diesen Fällen treten Beschwerden wie Schwäche, Schwindel und in sehr seltenen Fällen Bewusstseinsverlust, gelegentlich eingeleitet durch supraventrikuläre Tachykardie, auf.
Damit ist auch zu rechnen, wenn die Einnahme nach einer Unterbrechung von zwei oder mehr Tagen wieder aufgenommen wird (siehe Abschnitt 4.2). Diese Störungen halten in der Regel nur kurze Zeit an und treten meist bei Fortführung der Behandlung nicht mehr auf. Da die Wahrscheinlichkeit einer solchen Nebenwirkung bei Verabreichung einer höheren als der empfohlenen Anfangsdosis größer ist, sollte die Dosierungsanleitung sorgfältig befolgt werden.
Nach Dosiserhöhung und nach Wiederaufnahme einer unterbrochenen Einnahme sollten abrupte Lagewechsel oder langes Stehen vermieden werden. Dies gilt insbesondere für ältere Patienten.
Der Patient sollte auf die Gefahr des Auftretens orthostatischer Dysregulation und von Priapismus hingewiesen werden und Verhaltensmaßregeln für diese Situationen erhalten. Hinsichtlich des Priapismus sollte der Patient darauf hingewiesen werden, dass er beim Auftreten sofort einen Arzt aufsucht, da anderenfalls die Gefahr einer permanenten erektilen Dysfunktion besteht.
Kombination mit anderen Antihypertensiva
Wegen der Gefahr übermäßiger Blutdrucksenkung ist Vorsicht angebracht bei gleichzeitiger Anwendung von Terazosin und Thiaziden oder anderen antihypertensiven Arzneimitteln. Soll während der Therapie mit Terazosin ein Thiazid-Diuretikum oder ein anderes antihypertensives Arzneimittel hinzugefügt werden, so muss Terazosin reduziert oder abgesetzt werden; eine erneute Dosistitration ist erforderlich. Bei Verabreichung von Terazosin zusätzlich zu anderen Antihypertensiva ist die Dosis der anderen Antihypertensiva vor Therapiebeginn zu reduzieren und nach Terazosin-Einstellung anzupassen.
Terazosin sollte aufgrund der vasodilatatorischen Wirkung bei folgenden kardialen Zuständen vorsichtig eingesetzt werden:
- Lungenödem durch Aorten- oder Mitralklappenstenose,
- High-output-Herzinsuffizienz,
- Rechtsherzinsuffizienzdurch Lungenembolie oder Perikarderguss,
- Linksherzinsuffizienz mit niedrigem Füllungsdruck.
Bei Patienten mit schwerer koronarer Herzkrankheit kann ein zu rascher oder zu starker Blutdruckabfall zu einer Verschlechterung der Angina-Pectoris-Beschwerden führen.
Vorsicht ist angebracht bei gleichzeitiger Anwendung von Arzneimitteln, die möglicherweise den Leberstoffwechsel beeinflussen (z. B. Cimetidin).
Patienten, die gleichzeitig eine Stauung der oberen Harnwege, einen chronischen Harnwegsinfekt oder Blasensteine aufweisen, sind nicht mit Terazosin zu behandeln.
Terazosin sollte bei Patienten mit einer Überlaufblase, Anurie oder fortgeschrittenem Nierenversagen nicht eingesetzt werden.
Die gleichzeitige Anwendung von Phosphodiesterase-5-Inhibitoren (z. B. Sildenafil, Tadalafil, Vardenafil) und Terazosin kann bei einigen Patienten zu einer symptomatischen Hypotonie führen. Um das Risiko für die Entwicklung einer orthostatischen Hypotonie zu vemindern, sollten die Patienten stabil auf die AlphablockerTherapie eingestellt sein, wenn sie Phosphodiesterase-5-Inhibitoren anwenden.
Bei einigen Patienten, die gleichzeitig oder bis kurz vorher mit Tamsulosin behandelt wurden, trat während Kataraktoperationen das sog. „Intraoperative Floppy Iris Syndrome“ (IFIS, eine Variante des Syndroms der engen Pupille) auf. Da auch bei der Anwendung anderer Alphablocker vereinzelt das Auftreten einer IFIS gemeldet wurde, kann ein Gruppeneffekt nicht ausgeschlossen werden. IFIS kann zu Komplikationen während der Operation führen. Deshalb sollten Kataraktchirurgen und Augenärzte vor einer Kataraktoperation darüber informiert werden, ob die Patienten aktuell Alphablocker anwenden oder diese früher erhielten.
Anwendung bei Patienten mit Leberinsuffizienz
Terazosin sollte bei Patienten mit eingeschränkter Leberfunktion besonders vorsichtig eingesetzt werden. Da keine klinischen Erfahrungen bei Patienten mit schwerer Leberfunktionsstörung vorliegen, wird die Anwendung von Terazosin bei diesen Patienten nicht empfohlen.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Terazosin Winthrop nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei Patienten, die neben Terazosin ACE-Hemmer oder Diuretika erhielten, wurde im Vergleich zu den übrigen Patienten häufiger von Schwindel und anderen Nebenwirkungen berichtet. Daher ist bei gleichzeitiger Gabe von Arzneimitteln, die den Blutdruck beeinflussen (z. B. ACE-Hemmer, Betarezeptorenblocker, Calciumantagonisten, Diuretika), wegen der Gefahr eines massiven Blutdruckabfalls Vorsicht geboten (siehe Abschnitt 4.2 und Abschnitt 4.4).
Eine Kombination mit anderen Alpharezeptorenblockern wird nicht empfohlen.
Gleichzeitige Anwendung von Phosphodiesterase-5-Inhibitoren (z. B. Sildenafil, Vardenafil, Tadalafil) kann bei manchen Patienten zu einer symptomatischen Hypotonie führen (siehe Abschnitt 4.4).
4.6 Schwangerschaft und Stillzeit
Entfällt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Die Behandlung mit Terazosin Winthrop bedarf der regelmäßigen ärztlichen Kontrolle. Durch individuell auftretende unterschiedliche Reaktionen kann das Reaktionsvermögen so weit verändert sein, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr, zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Maße bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenwirken mit Alkohol.
Der Patient ist darauf hinzuweisen, dass Nebenwirkungen im Zusammenhang mit einem Blutdruckabfall auftreten können und unter welchen Umständen sie bevorzugt auftreten (siehe Abschnitt 4.4). Innerhalb der ersten 12 Stunden nach Einnahme der Initialdosis und nach Dosissteigerung sollte der Patient nicht am Straßenverkehr teilnehmen und keine gefährlichen Arbeiten ausführen.
4.8 Nebenwirkungen
Zu Beginn der Behandlung, bei Einnahme der nächsthöheren Dosisstufe oder bei erneuter Einnahme nach kurzer Einnahmepause kann es zu übermäßigem Blutdruckabfall kommen.
Wie andere Alpharezeptorenblocker kann Terazosin Synkopen verursachen. Diese treten meistens innerhalb von 30 bis 90 Minuten nach der Tabletteneinnahme auf. In klinischen Studien zum Bluthochdruck traten synkopiale Episoden in einer Häufigkeit von ungefähr 1 % auf. Als Ursache wurde zumeist orthostatische Dysregulation angenommen, obwohl die Synkopen gelegentlich mit einer Tachykardie mit Frequenzen von 120 bis 160 Herzschlägen pro Minute eingeleitet wurden.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Systemorganklasse |
Häufig (> 1/100 bis < 1/10) |
Gelegentlich (> 1/1.000 bis < 1/100) |
Selten (> 1/10.000 bis < 1/1.000) |
Sehr selten (< 1/10.000) |
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) |
|
Herzerkrankungen |
Brustschmerzen (Angina Pectoris), Palpitationen, orthostatische Dysregulation |
Tachykardie |
Vorhofflimmern | ||
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Atemnot, „verstopfte Nase“, Rhinitis, Nasenbluten | ||||
|
Erkrankungen des Blutes und des Lymphsystems |
Thrombozyto penie |
|
Systemorganklasse |
Häufig (> 1/100 bis < 1/10) |
Gelegentlich (> 1/1.000 bis < 1/100) |
Selten (> 1/10.000 bis < 1/1.000) |
Sehr selten (< 1/10.000) |
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) |
|
Augen erkrankungen |
Sehstörungen (verfälschtes Farben- /Verschwom- mensehen) |
IFIS (Intraoperative Floppy Iris Syndrome), siehe Abschnitt 4.4 | |||
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit |
Verstopfung, Diarrhö, Erbrechen | |||
|
Psychiatrische Erkrankungen |
Wahrneh-mungs- und Stimmungs-beeinträchtigungen | ||||
|
Erkrankungen des Nervensystems |
Benommenheit, Schwindel |
Kopfschmer zen | |||
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Potenzstörungen, abnormale Ejakulation (z. B. Hämatosper- mie) |
Blasenentlee- rungsstö rungen, Priapismus, verminderte Libido | |||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Müdigkeit, Schwächege fühl |
Ödeme, Gewichtszu nahme, Synkope |
Angioödem |
anaphylaktoide Reaktionen | |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Pruritus, unspezifische Hautreaktion (z. B. Urtikaria) |
Sonstiges
Über Hernienbildung wurde berichtet.
Folgende Nebenwirkungen wurden in klinischen Studien oder nach der Markteinführung beobachtet:
Fieber, Bauchschmerzen, Nacken-, Rücken-, Schulterschmerzen, Gefäßerweiterung, Arrhythmie, Mundtrockenheit, Dyspepsie, Blähungen, Gicht, Arthralgie, Arthritis, Gelenkbeschwerden, Muskelschmerzen, Parästhesien, Ängstlichkeit, Depression, Schlaflosigkeit, Bronchitis, grippeähnliche Symptome, Pharyngitis, Sinusitis, Erkältungszeichen, Exanthem, Husten, Schwitzen, Konjunktivitis, Tinnitus, Impotenz, häufiger Harndrang, Blaseninfektion, Urininkontinenz.
Kontrollierte klinische Studien lassen das mögliche Auftreten einer Hämodilution vermuten, wodurch bestimmte Blutbildwerte wie Hämatokrit, Hämoglobin, Leukozyten, Gesamteiweiß und Albumin erniedrigt erscheinen.
Die Behandlung mit Terazosin länger als 24 Monate hatte keinen signifikanten Einfluss auf die Werte des prostataspezifischen Antigens (PSA).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachts fall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizi nprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Eine Überdosierung von Terazosin Winthrop führt in der Regel zu Hypotonie, unter Umständen verbunden mit Synkopen.
Bei Hypotonie infolge einer Überdosierung sollte in erster Linie das kardiovaskuläre System stabilisiert werden.
Zur Normalisierung von Blutdruck und Herzfrequenz sollte der Patient auf dem Rücken in Kopftieflage gebracht werden. Bei Vorliegen einer schweren Hypotonie sollten Plasmaexpander und Vasopressoren gegeben werden.
Die Nierenfunktion sollte überwacht und, falls erforderlich, unterstützt werden. Da Terazosin im Plasma vorwiegend proteingebunden vorliegt, ist eine Dialyse als Therapiemaßnahme nicht indiziert.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Urologikum,
ATC-Code: G04CA03.
Terazosin ist ein postsynaptischer Alpha 1-Rezeptorenblocker.
Studien zeigen, dass eine Alpha 1-Rezeptorenblockade neben der antihypertensiven Wirkung ebenfalls zu einer Verbesserung des Harnflusses bei Patienten mit chronischen, obstruktiven Blasenentleerungsstörungen, wie bei der benignen Prostatahyperplasie (BPH), führt. Die Symptome der BPH werden einerseits durch eine Vergrößerung der Prostata verursacht, andererseits durch einen erhöhten Tonus der glatten Muskulatur des Blasenausgangs und der Prostata hervorgerufen, der einer Regulation durch Alpha 1-Rezeptoren unterliegt.
Phenylephrin-induzierte Kontraktionen menschlichen Prostatagewebes wurden in vitro durch die Alpha 1-Rezeptoren-blockierende Wirkung von Terazosin aufgehoben.
Der günstige Effekt von Terazosin ist auch noch 24 Stunden nach der letzten Dosis nachweisbar, sodass eine tägliche Einmalgabe von Terazosin aus reicht. Etwa 2 Wochen nach Beginn der Terazosin-Therapie wurde eine Besserung der Beschwerden, etwas später eine Zunahme der Harnflussrate beobachtet.
5.2 Pharmakokinetische Eigenschaften
Absorption
Terazosin wird nach oraler Gabe schnell und fast vollständig resorbiert. Die orale Bioverfügbarkeit beträgt 7896 %. Durch Nahrungsaufnahme wird die Bioverfügbarkeit nicht wesentlich beeinflusst. Maximale Plasmakonzentrationen werden bereits !^-11^ Stunden nach oraler Einnahme erreicht.
Verteilung
Ungefähr 90-94 % der Substanz werden an Plasmaproteine gebunden.
Elimination
Etwa 40 % der verabreichten Substanzmenge werden über den Urin und 60 % über die Faeces aus geschieden.
Die Metabolisierung von Terazosin erfolgt hauptsächlich in der Leber über eine Hydrolyse der Amidbindung, eine O-Demethylierung und zu einem geringen Maße über eine Piperazinring-Spaltung und eine N-Desalkylierung. Es konnten 7 verschiedene Metaboliten nachgewiesen werden.
Etwa 10 % des Wirkstoffs werden unverändert über den Urin, 20 % über die Faeces ausgeschieden.
Die Eliminationshalbwertszeit liegt zwischen 8-14 Stunden. Die Elimination von Terazosin wird bei eingeschränkter Nierenfunktion nur unwesentlich beeinträchtigt.
Dialysierbarkeit und Verhalten bei forcierter Diurese
Aufgrund der hohen Proteinbindung von Terazosin ist keine signifikante Ausscheidung durch eine Hämodialyse zu erwarten. Bei funktionell anephrischen Patienten werden etwa 7-10 % der Substanz über die Dialyse ausgeschieden.
Bioverfügbarkeit
Eine im Jahr 1999 durchgeführte Bioäquivalenzstudie mit 24 Probanden (Alters durchschnitt 28,6 Jahre) ergab nach Einmalgabe einer Tablette Terazosin 5 mg im Vergleich zu einem Referenzpräparat gleicher Stärke:
Angaben der Werte als Mittelwert und Streubreite
Maximale
Plasmakonzentration (Cmax), ng/ml:
Testpräparat
Referenzpräparat
91,8 ± 22,3
93,8 ± 26,6
Zeitpunkt der maximalen Plasmakonzentration
1,35 ± 0,78
1,49 ± 0,85
(tmax), h:
Fläche unter der
Konzentrations-Zeit-Kurve 1.127,0 ± 311,7 1.177,5 ± 333,1
(AUC), ng/ml*h:
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat (Konzentrations-Zeit-Diagramm):
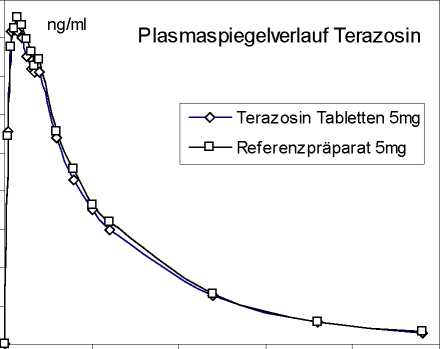
0 10 20 30 40 50
Zeit (h)
90 80 70 60 50 40 30 20 10 0
Aufgrund der Dosislinearität der Kinetik von Terazosin kann eine Bioäquivalenz von Terazosin Winthrop 2 mg und 10 mg zur entsprechenden Stärke des Referenzproduktes angenommen werden.
5.3 Präklinische Daten zur Sicherheit
Reproduktionstoxizität
Untersuchungen zur Embryotoxizität an Ratten und Kaninchen haben keine Hinweise auf ein teratogenes Potenzial von Terazosin ergeben. Embryotoxische Wirkungen traten oberhalb von Tages dosen von 60 mg/kg/Tag (Ratte) bzw. 22 mg/kg/Tag (Kaninchen) auf.
Ab einer Dosis von 8 mg/kg/Tag wurde bei Ratten eine Verlängerung der Tragzeit beobachtet. Die postnatale Entwicklung der Jungen war verzögert. Dosen ab 30 mg/kg/Tag verursachten Fertilitätsstörungen bei Ratten (verminderte Trächtigkeitsrate). Dies wird auf eine Spermatogenesestörung zurückgeführt.
Die Plazentagängigkeit von Terazosin wurde an Ratten nachgewiesen.
Untersuchungen zur Ausscheidung in die Muttermilch liegen nicht vor.
Mutagenität und Kanzerogenität
In-vitro- und In-vivo-Untersuchungen zur Mutagenität ergaben keine Hinweise auf ein genotoxisches Potenzial von Terazosin.
Langzeituntersuchungen an Mäusen und Ratten ergaben keine für die therapeutische Anwendung relevanten Hinweise auf ein tumorerzeugendes Potenzial von Terazosin.
6. PHARMAZEUTISCHE ANGABEN 6.1. Liste der sonstigen Bestandteile Terazosin Winthrop 2 mg
Lactose-Monohydrat, Cellactose (bestehend aus Cellulosepulver und Lactose-Monohydrat), Croscarmellose-Natrium, Magnesiumstearat (Ph. Eur.) [pflanzlich], Chinolingelb (E 104).
Terazosin Winthrop 5 mg
Lactose-Monohydrat, Cellactose (bestehend aus Cellulosepulver und Lactose-Monohydrat), Croscarmellose-Natrium, Magnesiumstearat (Ph. Eur.) [pflanzlich], Eisen(III)-Oxid (E 172).
Terazosin Winthrop 10 mg
Lactose-Monohydrat, Cellactose (bestehend aus Cellulosepulver und Lactose-Monohydrat), Croscarmellose-Natrium, Magnesiumstearat (Ph. Eur.) [pflanzlich], Indigocarmin (E 132).
6.2 Inkompatibilitäten
Inkompatibilitäten sind bisher nicht bekannt.
6.3 Dauer der Haltbarkeit
3 Jahre.
Dieses Arzneimittel soll nach Ablauf des auf der Packung angegebenen Verfalldatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses Terazosin Winthrop 2 mg
PVC/Aluminium-Blister-Packung mit 28, 84, 98 Tabletten Klinikpackung mit 280 (10 x 28) Tabletten
Terazosin Winthrop 5 mg
PVC/Alumimium-Blister-Packung mit 28, 84, 98 Tabletten Klinikpackung mit 280 (10 x 28) Tabletten
Terazosin Winthrop 10 mg
PVC/Aluminium-Blister-Packung mit 28, 84, 98 Tabletten Klinikpackung mit 280 (10 x 28) Tabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Winthrop Arzneimittel GmbH
65927 Frankfurt am Main Telefon: (01 80) 2 02 00 101
Telefax: (01 80) 2 02 00 111
8. ZULASSUNGSNUMMERN
61101.00.00
61101.01.00
61101.02.00
Terazosin Winthrop 2 mg Terazosin Winthrop 5 mg Terazosin Winthrop 10 mg
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Erteilung der Zulassung: 16.12.2004 Verlängerung der Zulassung: 18.03.2013
10. STAND DER INFORMATION
April 2015
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig.
Mat.-Nr.: 324580 8
0,06 €/Anruf (dt. Festnetz); max. 0,42 €/min (Mobilfunk).