Thomasin Tabletten
Seite 1 von 9
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
(R)
Thomasin Tabletten 10 mg
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Etilefrinhydrochlorid
(R)
1 Tablette Thomasin Tabletten 10 mg enthält 10 mg Etilefrinhydrochlorid.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Tablette
Die Tablette kann zum besseren Schlucken entlang der Bruchrille in zwei Hälften geteilt werden. Die Bruchrille dient nicht zum Teilen in gleiche Dosen.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Kreislaufregulationsstörungen mit Hypotonie, die im Stehtest mit Beschwerden wie Schwindel, Schwächegefühl, Blässe, Schweißausbruch, Flimmern oder Schwarzwerden vor den Augen sowie mit deutlichem Blutdruckabfall ohne Anstieg der Herzschlagrate einhergehen.
4.2 Dosierung, Art und Dauer der Anwendung
Erwachsene erhalten als mittlere Tagesdosis 30 mg (20 - 50 mg) Etilefrinhydrochlorid. 2- bis 3-mal täglich 1 Tablette, entsprechend 20 - 30 mg Etilefrinhydrochlorid.
Thomasin Tabletten ist vorzugsweise vor dem Essen mit reichlich Flüssigkeit einzunehmen. Sie sollten nicht mehr am späten Nachmittag oder Abend eingenommen werden, da ihre anregende Wirkung das Einschlafen erschweren kann.
Die Notwendigkeit der Einnahme sollte regelmäßig überprüft werden.
Kinder
Über die Anwendung bei Kindern liegen keine ausreichenden Erfahrungen vor.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen Etilefrinhydrochlorid oder einen der sonstigen Bestandteile (siehe Abschnitt 6.1)
- hypotone Kreislaufregulationsstörungen mit hypertoner Reaktion im Stehtest
- Hypertonie
- Thyreotoxikose
- Phäochromozytom
- Engwinkelglaukom
- Entleerungsstörungen der Harnblase mit Restharnbildung, insbesondere bei Prostata-Adenom
- sklerotische Gefäßveränderungen
- koronare Herzkrankheit
- Dekompensierte Herzinsuffizienz
- tachykarde Herzrhythmusstörungen
- Herzklappenstenose und Stenose der großen Arterien
- hypertrophe obstruktive Kardiomyopathie
- erstes T rimenon der Schwangerschaft (siehe Abschnitt 4.6)
- Stillzeit
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Vorsicht ist geboten bei
- Diabetes mellitus
- Hyperthyreose
- Hyperkalzämie, Hypokaliämie
- schweren Nierenfunktionsstörungen
- Cor pulmonale
- Herzrhythmusstörungen
- schwere kardiovaskuläre Erkrankungen
(R)
In diesen Fällen sollte Thomasin Tabletten in größeren Einnahmeabständen oder in verminderter Dosis und unbedingt unter ärztlicher Kontrolle eingenommen werden.
Die Anwendung von Thomasin® Tabletten kann bei Dopingkontrollen zu positiven Ergebnissen führen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
|
Wirkstoffe bzw. Wirkstoffgruppen |
mögliche Wirkung |
|
- Reserpin - Guanethidin - Mineralocorticoide (Fludrocortison) - trizyklische Antidepressiva - Sympathomimetika - Schilddrüsenhormone - Antihistaminika |
sympathomimetische Wirkungsverstärkung von Etilefrinhydrochlorid (unerwünschter Blutdruckanstieg) |
|
- MAO-Hemmer | |
|
- Dihydroergotamin | |
|
- Atropin |
Anstieg der Herzfrequenz |
|
- Alpha- bzw. Betarezeptorenblocker |
Blutdruckabfall bzw. -anstieg mit Bradykardie (verlangsamte Herzschlagfolge) |
|
- Antidiabetika |
Blutzuckersenkung wird vermindert |
|
- Herzwirksame Glykoside - Halogenierte aliphatische Kohlenwasserstoffe in Inhalationsanästhetika (z. B. Halothan) |
mögliches Auftreten von Herzrhythmusstörungen |
4.6 Fertilität, Schwangerschaft und Stillzeit
Thomasin® Tabletten darf in den ersten 3 Schwangerschaftsmonaten nicht eingenommen werden, da Tierversuche Hinweise auf eine teratogene Wirkung bei hohen Dosen Etilefrin ergeben haben und Erfahrungen beim Menschen nicht vorliegen. Ab 4. Schwangerschaftsmonat ist eine Einnahme möglich, wenn das der behandelnde Arzt befürwortet.
Etilefrinhydrochlorid kann die uteroplazentare Durchblutung beeinträchtigen und zu Gebärmuttererschlaffungen führen.
Während der Stillzeit darf Thomasin® Tabletten nicht angewendet werden, da ein Übergang von Etilefrin in die Muttermilch nicht auszuschließen ist und bei Säuglingen keine Erfahrungen vorliegen (siehe auch Abschnitt 5.3).
Es wurden keine Untersuchungen zu den Auswirkungen auf die Fertilität durchgeführt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zur Auswirkung auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Allerdings sollten Patienten darauf hingewiesen werden, dass unerwünschte Wirkungen wie Schwindel während der Behandlung mit Etilefrinhydrochlorid auftreten könnten. Deshalb sollte beim Führen von Fahrzeugen und Bedienen von Maschinen zur Vorsicht geraten werden.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen des Immunsystems
Häufigkeit nicht bekannt: Überempfindlichkeit (allergische Reaktionen)
Psychiatrische Erkrankungen
Häufig: Unruhe
Gelegentlich: Schlafstörungen, Angstgefühl
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen Gelegentlich: Tremor, Schwindelgefühl
Herzerkrankungen
Häufig: Herzrhythmusstörungen (auch ventrikulär), Tachykardie
Gelegentlich: Palpitationen
Sehr selten: Beschwerden durch Angina pectoris
Gefäßerkrankungen
Sehr selten: überschießender Blutdruckanstieg (eventuell mit Kopfschmerzen und Muskelzittern)
Erkrankungen des Gastrointestionaltrakts Häufig: Magen-Darm-Beschwerden Gelegentlich: Übelkeit
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Diaphorese
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
- Nach Einnahme hoher Dosen kann es zu Tachykardie, Arrhythmie, überschießendem Blutdruckanstieg (evtl. mit Kopfschmerzen), Schweißausbruch, Erregung, Übelkeit und Erbrechen kommen.
- Bei Säuglingen und Kleinkindern kann eine Überdosierung zu einer zentralen Atemdepression und Koma führen.
- Als Gegenmaßnahmen kommen - abhängig von der Stärke der Symptome und unter Berücksichtigung der Wirkungsdauer - in Frage:
- Entfernung des Arzneimittels aus dem Gastrointestinaltrakt durch Magenspülung, gefolgt von der Anwendung medizinischer Kohle und salinischer Abführmittel.
- In schweren Fällen sind Maßnahmen der Intensivmedizin unter Kontrolle von EKG, Blutdruck und Venendruck zu ergreifen. Eine überschießende sympathomimetische Wirkung am Herzen lässt sich mit Betarezeptorenblockern kompensieren.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Kardiostimulantien, exkl. Herzglykoside ATC- Code: C01CA01
Etilefrinhydrochlorid ist ein vorwiegend direkt und peripher wirkendes Sympathomimetikum vom Phenylethylamin-Typ mit Affinität zu adrenergen Alpha- und Betarezeptoren.
Die Blutdrucksteigerung ist neben der durch Alpha-Adrenozeptorenstimulation bedingten Vasokonstriktion auf die positiv inotrope und positiv chronotrope Wirkung am Herzen infolge eines betasympathomimetischen Effektes zurückzuführen.
5.2 Pharmakokinetische Eigenschaften
Resorption
Etilefrin wird nahezu vollständig enteral resorbiert.
Maximale Plasmaspiegel werden nach 0,88 ± 0,41 Stunden erreicht.
Die Plasmahalbwertszeit bezogen auf Gesamt-Etilefrin im Plasma beträgt nach Einnahme der Tabletten 4,15 Std.
Die biologische Verfügbarkeit von Etilefrin nach oraler Gabe wird maßgeblich durch First-pass-Extraktion in der Darmwand bestimmt. Hieraus erklärt sich eine absolute Bioverfügbarkeit von Etilefrin nach oraler Applikation von ca. 55 %.
Im Jahr 1994 wurde die Bioverfügbarkeit von Thomasin Tabletten an 16 Probanden untersucht und mit einem Referenzpräparat verglichen.
In der folgenden Tabelle werden die Ergebnisse (mittlere Plasmaspiegelverläufe mit Streubreiten im Vergleich zu einem Referenzpräparat) aufgeführt.
Max. Plasmakonz.
(Cmax)
Zeitpunkt der max. Plasmakonz. (tmax) Fläche unter der Konz.-Zeit-Kurve (AUC 0-J
Plasmakonzentration-Zeit-Profil von Etilefrin nach Verabreichung oraler Formen
Etilefrin [ng/ml]
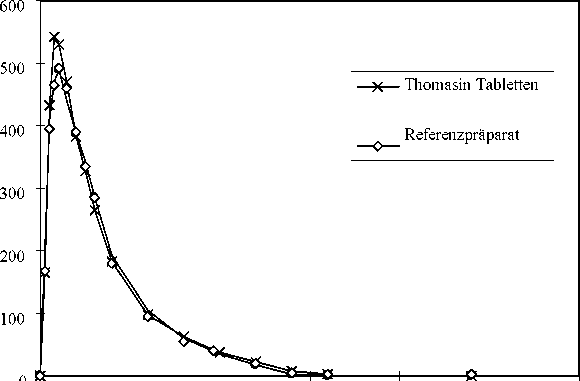
0 5 10 15 20 25 30
Zeit [h]
Verteilung
Der Plasmaspiegelverlauf von Etilefrinbase nach intravenöser Gabe lässt sich durch ein offenes Zweikompartimentmodell beschreiben. Die Verteilung erfolgt mit einer Halbwertszeit der Alpha-Phase von 15 Minuten, die Elimination mit einer Halbwertszeit der Beta-Phase von 2,4 Stunden.
Proteinbindung
Die Bindung an Plasmaproteine beträgt ca. 23 %.
Biotransformation
Etilefrin wird nur unwesentlich von der Monoaminooxidase (MAO) metabolisiert. Elimination
Innerhalb 24 Stunden nach oraler Gabe von Etilefrinhydrochlorid werden ca. 2 % der applizierten Dosis unverändert und ca. 69 % als Schwefelsäurekonjugat renal eliminiert.
5.3 Präklinische Daten zur Sicherheit
a) Akute Toxizität
Untersuchungen zur akuten Toxizität wurden an Maus und Ratte durchgeführt. Bei oraler Applikation ergab sich eine LD50 von 345 mg/kg bzw. 187 mg/kg, bei i.v. Applikation 10,5 mg/kg bzw. 5,3 mg Etilefrinhydrochlorid/kg.
b) Chronische/ subchronische Toxizität
Untersuchungen zur chronischen Toxizität wurden an Ratte und Hund durchgeführt. Es ergaben sich keine Hinweise auf toxische Nebenwirkungen.
c) Mutagenes und tumorerzeugendes Potential
Untersuchungen auf ein mutagenes Risiko von Etilefrin liegen nicht vor.
Untersuchungen auf ein tumorerzeugendes Potential von Etilefrin liegen nicht vor.
d) Reproduktionstoxizität
Im Tierversuch ergaben sich bei einer Spezies (Kaninchen) Hinweise auf teratogene Schädigungen (Gaumenspalten) in hohen Dosierungen. Bei der Ratte traten Retardierungserscheinungen ab 30 mg/kg auf.
Untersuchungen zum Übergang von Etilefrin in die Muttermilch liegen nicht vor.
6. PHARMAZEUTISCHE EIGENSCHAFTEN
6.1 Liste der sonstigen Bestandteile
Cellulosepulver, Magnesiumstearat (Ph.Eur.), Maisstärke, Mikrokristalline Cellulose, Weinsäure (Ph.Eur.)
<R)
Thomasin Tabletten ist gluten- und lactosefrei.
6.2 Inkompatibilitäten
bisher nicht bekannt
6.3 Dauer der Haltbarkeit
36 Monate
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
In der Originalverpackung aufbewahren, um den Inhalt vor Licht und Feuchtigkeit zu schützen. Nicht über 25 °C lagern.
6.5 Art und Inhalt des Behältnisses
Weiße, runde Tabletten mit Bruchkerbe in PVC/PVDC Aluminium-Blisterpackungen Packungen mit 50 (N2) bzw.100 Tabletten (N3)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
APOGEPHA Arzneimittel GmbH
Kyffhäuserstr. 27
01309 Dresden
Tel.: 0351 3363-3
Fax: 0351 3363-440
8. ZULASSUNGSNUMMER(N)
3000572.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
02.06.1999 / 08.04.2009
10. STAND DER INFORMATION
Oktober 2014
11. VERKAUFSABGRENZUNG
Apothekenpflichtig