Tiamon Mono Retard
Fachinformation
1. Bezeichnung des Arzneimittels
Tiamon Mono retard
35 mg Hartkapseln, retardiert
2. Qualitative und quantitative Zusammensetzung
Jede retardierte Hartkapsel enthält 35 mg Dihydrocodeinhydrogentartrat, entsprechend 23,4 mg Dihydrocodein.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1
3. Darreichungsform
Hartkapsel, retardiert
Die Kapseln bestehen aus einem violett opaken Oberteil und aus einem gelb transparenten Unterteil und sind mit stecknadelkopfgroßen, weißen bis schwach beigen Körnern gefüllt.
4. Klinische Angaben
4.1 Anwendungsgebiete
Zur Kurzzeitanwendung:
Zur symptomatischen Behandlung des Reizhustens (unproduktiver Husten).
4.2 Dosierung, Art und Dauer der Anwendung
Dosierung:
Erwachsene und Jugendliche über 14 Jahren nehmen vorzugsweise zur Nacht und, falls erforderlich morgens je 1 retardierte Hartkapsel (entsprechend 35 bis 70 mg Dihydrocodeinhydrogentartrat) ein.
Tiamon Mono retard ist aufgrund des hohen Wirkstoffgehaltes nicht geeignet für Kinder unter 14 Jahren. Hierfür stehen Arzneimittel in anderen Zubereitungsformen zur Verfügung.
Art der Anwendung:
Die retardierten Hartkapseln können unabhängig von den Mahlzeiten unzerkaut mit etwas Flüssigkeit eingenommen werden.
Dauer der Anwendung:
Die Dauer der Anwendung bestimmt der Arzt. Sie ist abhängig vom Verlauf der Erkrankung. Die Behandlung mit Tiamon Mono retard soll nicht länger als einige Tage dauern.
4.3 Gegenanzeigen
Tiamon Mono retard darf nicht angewendet werden:
- bei Überempfindlichkeit gegenüber Dihydrocodein oder einem der in Abschnitt 6.1 genannten sonstigen Bestandteile,
- bei Asthma bronchiale,
- bei Ateminsuffizienz, Atemdepression,
- bei Koma,
- chronischer Husten bei Kindern (evtl. Frühsymptom eines Asthma bronchiale),
- am Ende der Schwangerschaft,
- drohende Fehlgeburt,
- in der Stillzeit.
Tiamon Mono retard ist für Kinder unter 14 Jahren nicht geeignet.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Tiamon Mono retard sollte nur bei strenger Diagnosestellung und mit Vorsicht angewendet werden:
- bei Abhängigkeit von Opioiden,
- bei Bewusstseinsstörungen,
- bei gleichzeitiger Anwendung von speziellen stimmungsaufhellenden Arzneimitteln (MAO-Hemmer),
- in den ersten 4 Monaten der Schwangerschaft,
- bei chronischer Verstopfung,
- Hypothyreose,
- bei Störung des Atemzentrums oder der Atemfunktion,
- bei Zuständen mit erhöhtem Hirndruck,
- bei eingeschränkter Leberfunktion,
- vorbestehende Anfallsleiden.
Hinweis:
Bei produktivem Husten mit erheblicher Schleimbildung ist die antitussive Behandlung mit Tiamon Mono retard nur unter strenger Nutzen-Risiko-Abwägung mit besonderer Vorsicht durchzuführen.
Patienten mit einer seltenen hereditären Fructose-Intoleranz, Glucose-Galactose-Malabsorption oder Saccharase-Isomaltase-Mangel sollten Tiamon Mono retard nicht einnehmen.
Bei einer vorbestehenden Opiatabhängigkeit (auch solcher in Remission) ist mit schnellen Rückfällen zu rechnen.
Dihydrocodein wird von Heroinabhängigen als Ersatzstoff betrachtet. Auch Abhängige von Alkohol oder Sedativa neigen zu Missbrauch und Abhängigkeit von Dihydrocodein.
Bei Persistieren des Hustens über einen Zeitraum von 2 - 3 Wochen hinaus muss eine diagnostische Abklärung durch den Arzt erfolgen.
Da die Anwendung von Tiamon Mono retard bei Asthma bronchiale kontraindiziert ist, sollte besonders beachtet werden, dass chronischer Husten bei Kindern häufig ein frühes Symptom eines Asthma bronchiale sein kann. Zur Dämpfung dieser Hustenzustände ist Tiamon Mono retard nicht geeignet.
Die Behandlung von Patienten mit Z.n. Cholezystektomie sollte mit Vorsicht erfolgen. Infolge der Kontraktion des Sphinkter Oddi können herzinfarktähnliche Symptome sowie eine Symptomverstärkung bei bestehender Pankreatitis auftreten.
Dihydrocodein hat ein Abhängigkeitspotential. Bei längerem Gebrauch entwickeln sich Toleranz, psychische und physische Abhängigkeit. Es besteht Kreuztoleranz zu anderen Opioiden. Aufgrund des Abhängigkeitspotentials von Dihydrocodein ist eine längerfristige Anwendung von Tiamon Mono retard zur symptomatischen Behandlung von Reizhusten nicht sinnvoll.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei gleichzeitiger Anwendung oder binnen 14 Tagen nach Beendigung der Therapie mit Antidepressiva vom MAO-Typ sind Wirkungen auf das Zentralnervensystem wie Erregungszustände, hohes Fieber sowie Veränderungen von Atmungs- und Kreislauffunktionen möglich.
Zu einer Verstärkung der dämpfenden und atemhemmenden Wirkung (wie Müdigkeit und Benommenheit) kann es bei gleichzeitiger Anwendung von Tiamon Mono retard mit folgenden Mitteln kommen:
Beruhigungs- und Schlafmitteln, Psychopharmaka (Phenothiazine, wie z. B. Chlorpromazin, Thioridazin, Perphenazin), anderen zentraldämpfenden Arzneimitteln, Antihistaminika (wie z. B. Promethazin, Meclozin), Antihypertonika.
Tiamon Mono retard vermindert zusammen mit Alkohol die psychomotorische Leistungsfähigkeit stärker als die Einzelkomponenten.
Durch trizyklische Antidepressiva (wie z.B. Imipramin, Opipramol, Amitryptilin) kann eine Tiamon Mono retard-bedingte Minderung der Atmung verstärkt werden.
Die Wirkung von Schmerzmitteln wird verstärkt. Bestimmte stark wirksame Schmerzmittel wie z. B. Buprenorphin (sogenannte partielle Opioidagonisten/-antagonisten) können die Wirkung von Tiamon Mono retard abschwächen.
Für Cimetidin und andere Arzneimittel, die den Leberstoffwechsel beeinflussen, ist zu beachten:
Unter Morphinbehandlung wurden eine Hemmung des Abbaus und dadurch erhöhte Plasmakonzentrationen von Morphin beobachtet. Für Dihydrocodein ist eine derartige Wechselwirkung nicht auszuschließen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft:
Ausreichende Erfahrungen mit der Anwendung von Dihydrocodein an schwangeren Frauen liegen nicht vor. Beim Menschen wurde eine Assoziation zwischen Missbildungen des Respirationstraktes und der Anwendung von Codein in den ersten drei Monaten der Schwangerschaft festgestellt.
Hinweise auf andere Missbildungen liegen auch aus epidemiologischen Studien mit Narkoanalgetika vor. Tiamon Mono retard darf daher während der Schwangerschaft, insbesondere während der ersten drei Monate nur nach strenger Indikationsstellung und sorgfältiger Nutzen-Risiko-Abwägung angewendet werden.
Bei nahender Geburt oder drohender Frühgeburt ist eine Anwendung von Tiamon Mono retard kontraindiziert, da Dihydrocodein die Plazentaschranke passiert und beim Neugeborenen zu Atemdepression führen kann (siehe auch Abschnitt 4.3 Gegenanzeigen). Neugeborene sind gegenüber Opioiden besonders empfindlich.
Bei längerfristiger Einnahme von Dihydrocodein kann sich eine Opioidabhängigkeit des Feten entwickeln. Berichte über Entzugssymptome beim Neugeborenen nach wiederholter Anwendung von dem strukturverwandten Codein im letzten Trimenon der Schwangerschaft liegen vor.
Stillzeit:
Dihydrocodeinhydrogentartrat geht in die Muttermilch über, so dass gestillte Säuglinge DihydrocodeinWirkungen zeigen. Tiamon Mono retard darf in der Stillzeit daher nicht angewandt werden. Falls eine Behandlung mit Tiamon Mono retard während der Stillzeit unbedingt erforderlich ist, wird empfohlen, das Stillen zu unterbrechen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Dieses Arzneimittel kann auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen soweit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt wird. Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol oder Medikamenten, die ihrerseits das Reaktionsvermögen beeinträchtigen können.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10), häufig (> 1/100 bis <1/10), gelegentlich (> 1/1.000 bis < 1/100), selten (> 1/10.000 bis < 1/1.000), sehr selten (< 1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Mögliche Nebenwirkungen:
Endokrine Erkrankungen:
Hyperprolaktinämie
Psychiatrische Erkrankungen:
Sehr selten: Euphorie
Erkrankungen des Nervensystems:
Häufig: leichte Kopfschmerzen, leichte Schläfrigkeit, Schwindelgefühl, Somnolenz.
Gelegentlich: Schlafstörungen, Verwirrtheitszustände, Wahrnehmungsstörungen (z. B. Halluzinationen), Stimmungsänderungen, Konvulsionen (insbesondere bei Patienten mit Epilepsie und Prädisposition zu Krampfanfällen), Parästhesien.
Augenerkrankungen:
Sehr selten: Funktionsstörungen der Augen, z. B. Miosis und Skotom.
Herzerkrankungen:
Selten wurde über das Auftreten von Angina pectoris berichtet.
Gefäßerkrankungen:
Sehr selten: Kreislaufversagen
Bei hohen therapeutischen Dosen und bei Intoxikationen kann es zu Blutdruckabfall kommen.
Erkrankungen der Atemwege, des Brustraums und Mediastinums:
Beeinträchtigung der Atmung (Dyspnoe, Atemdepression).
Bei Überdosierung kann es besonders bei Kindern zu Atemlähmung kommen.
Bei Patienten mit vorher bestehenden Lungenfunktionsstörungen und hohen therapeutischen Dosen können Lungenödeme auftreten.
Erkrankungen des Gastrointestinaltrakts:
Übelkeit, Magen-Darm-Beschwerden, Obstipation, Erbrechen, Mundtrockenheit.
Häufig: Abdominalschmerz.
Gelegentlich: Diarrhö.
Sehr selten: Ileus.
Erkrankungen der Haut und des Unterhautzellgewebes:
Gelegentlich sind Hyperhidrosis, Pruritus und urtikarielles Exanthem beschrieben.
Selten: schwere allergische Reaktionen einschließlich Stevens-Johnson-Syndrom, Quincke-Ödeme.
Erkrankungen der Nieren und Harnwege Gelegentlich: Harnretention.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Müdigkeit.
Bei höheren Dosen oder bei besonders empfindlichen Patienten können dosisabhängig die Fähigkeit zur optischen Fixierung von Gegenständen (visuomotorische Koordination) und die Sehleistung verschlechtert sein.
Dihydrocodein kann, insbesondere bei Einzeldosen über 60 mg, den Muskeltonus der glatten Muskulatur z. B. Darmmuskulatur, Harnblasenmuskulatur erhöhen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels.
Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Bei hohen therapeutischen Dosen und bei Intoxikationen können Synkopen auftreten.
Bei Überdosierung mit Tiamon Mono retard können charakteristischerweise vor allem eine ausgeprägte Atemdepression sowie folgende andere einer Morphinvergiftung vergleichbare Symptome auftreten: Bewusstseinseinschränkungen (Somnolenz, Stupor bis hin zum Koma), meist verbunden mit Myosis, oft mit Erbrechen, Kopfschmerzen, Harn- und Stuhlverhaltung, Zyanose, Hypoxie, kalte Haut, SkelettmuskelTonusverlust und Areflexie kommen vor, manchmal Bradykardie und Blutdruckabfall, gelegentlich vor allem bei Kindern Krämpfe.
Die wichtigsten therapeutischen Maßnahmen sind:
a. Freihaltung der Atemwege und Beatmung mit Sauerstoff,
b. Verabfolgung eines Opiatantagonisten und
c. Schockbekämpfung, u. U. kombiniert mit antibiotischer Therapie (Pneumoniegefahr).
d. Giftentfernung evtl. durch Magenspülung und anschließende Adsorptionstherapie mit reichlich Medizinalkohle. Bei Überdosierung von Tiamon Mono retard beachten, dass noch eine kontinuierliche Nachresorption aus im Darm befindlichen Pellets erfolgen kann. Hier ist gegebenenfalls die Kohlegabe mehrmals zu wiederholen.
Die Wirkung von Tiamon Mono retard kann mit Opiatantagonisten, wie z.B. Naloxon, aufgehoben werden. Die Gabe von Naloxon muss wiederholt werden, da die Wirkungsdauer von Tiamon Mono retard länger ist als die von Naloxon. Wegen seiner hohen präsystemischen Elimination wird Naloxon parenteral (i.v. oder i.m.) in einer Dosis von 0,01 mg/kg Körpergewicht, bezogen auf Hydrochlorid, verabreicht. Die Wirkung ist schon wenige Minuten nach der intravenösen Gabe voll ausgeprägt. Wenn Naloxon nicht eingesetzt werden kann, sind symptomatische Maßnahmen, vor allem stabile Seitenlagerung, Beatmung und Schockbehandlung, indiziert. Ferner können Maßnahmen zum Schutz vor Wärmeverlusten und zur Volumentherapie erforderlich werden. Die weiteren Möglichkeiten zur Behandlung einer Vergiftung mit Tiamon Mono retard richten sich nach dem Ausmaß und Verlauf sowie den Krankheitszeichen.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe:
Opium-Alkaloide und Derivate ATC-Code: R05DA
Dihydrocodeinhydrogentartrat ist ein Phenanthren-Alkaloid mit opiatagonistischen Eigenschaften. Es wirkt antitussiv und zentral analgetisch. Beide Wirkungen sind dosisabhängig. Die Wirkungen kommen teilweise über den Metaboliten Morphin zustande.
5.2 Pharmakokinetische Eigenschaften
Dihydrocodeinhydrogentartrat wird nach oraler Applikation rasch zu ca. 90 % resorbiert. Die relative Bioverfügbarkeit liegt aufgrund eines ausgeprägten Leber-first-pass-Effektes nur bei 21 %. Die Eliminationshalbwertzeit liegt bei gesunden Erwachsenen zwischen 3,3 und 4,5 Stunden.
Die Substanz wird beim Menschen zu 7-18% in konjugierter Form und zu 13-22% unverändert ausgeschieden. Die renale Exkretion ist spätestens nach 24 Stunden abgeschlossen.
Die Metabolisierung kann analog der von Codein angenommen werden: Codein wird in der Leber bei großen interindividuellen Unterschieden extensiv metabolisiert. Hauptmetaboliten im Plasma sind Morphin, Norcodein und die Morphin- und Codeinkonjugate, wobei die Konjugatkonzentrationen wesentlich höher als die der Ausgangssubstanzen liegen. Die Ausscheidung erfolgt vor allem renal in Form der Morphin- und Codeinkonjugate.
Dihydrocodeinhydrogentartrat tritt in den fetalen Kreislauf über.
In der Muttermilch werden nach Einnahme von Dihydrocodeinhydrogentartrat pharmakologisch relevante Konzentrationen erreicht.
5.3 Präklinische Daten zur Sicherheit
Untersuchungen zur akuten Toxizität an verschiedenen Tierspezies (Maus, Ratte, Kaninchen) ergaben LD50-Werte zwischen 240 und 500 mg/kg KG nach subkutaner Gabe (bezogen auf Dihydrocodein). Das Vergiftungsbild war initial gekennzeichnet durch Sedierung und Muskelschwäche, später durch gesteigerte Reflexaktivität und klonische Krämpfe. Die letale Dosis beim Erwachsenen liegt im Bereich von 7 bis 14 mg Dihydrocodein pro kg Körpergewicht. (Siehe auch Ziffer 4.9 Überdosierung)
Untersuchungen zur subchronischen und chronischen Toxizität liegen nicht vor.
Untersuchungen zum mutagenen sowie tumorerzeugenden Potential liegen für
Dihydrocodeinhydrogentartrat nicht vor. In-vitro- und In-vivo-Untersuchungen mit der strukturverwandten Substanz Codein ergaben keine Hinweise auf ein mutagenes Potential. In Langzeitstudien mit Codein an Mäusen und Ratten zeigten sich keine kanzerogenen Wirkungen.
Reproduktionstoxikologische Untersuchungen mit Dihydrocodeinhydrogentartrat liegen nicht vor. Für Codein wurden beim Menschen eine signifikante Assoziation zwischen Missbildungen des Respirationstraktes und einer Therapie in den ersten vier Monaten der Schwangerschaft festgestellt. Weiterhin gibt es Hinweise auf Entzugssymptome beim Neugeborenen nach Anwendung von Codein im letzten Trimenon der Schwangerschaft.
5.4 Bioverfügbarkeit
Aus Tiamon Mono retard wird der Wirkstoff über einen längeren Zeitraum gleichmäßig freigesetzt, so dass die Plasmaspiegel entsprechend flacher verlaufen (s. Abb.). Das Ausmaß der Bioverfügbarkeit ist jedoch mit einer Lösung vergleichbar (Faktor = 0,95), so dass man davon ausgehen kann, dass dem Organismus über 12 Stunden ausreichend Wirkstoff zur Unterdrückung des Hustens zur Verfügung steht.
Abb. 1
Plasmaspiegel nach Einnahme von 3 retardierten Hartkapseln Tiamon Mono retard (= 90 mg
Dihydrocodein-Base) im Vergleich zur dreimaligen Gabe einer 30 mg Dihydrocodein-Lösung (= 90 mg Dihydrocodein-Base)
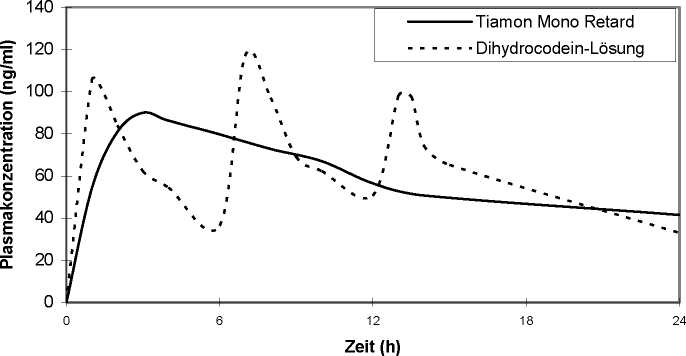
Tabelle:
Pharmakokinetische Parameter von Tiamon Mono retard, retardierten Hartkapseln nach Einnahme von 3 retardierten Hartkapseln (= 90 mg Dihydrocodein-Base nach Einmalgabe im Vergleich zu einer 30 mg-
Dihydrocodein Lösung nach Mehrfachgabe (= 90 mg Dihydrocodein-Base). (N = 4 gesunde Probanden; Mittelwert für AUC0->24, Mittelwerte ± Standardabweichung für Cmax, für Tmax Mittelwert und Bereich).
|
Tiamon Mono retard |
Referenz | |
|
AUC0->24h (cm2) |
94,0 |
98,75 |
|
Cmax (ng/ml) |
90,0 ± 5,5 |
105,5 ± 6,2 |
|
Tmax (h) |
3,3 (3-4) |
1,00 |
6. Pharmazeutische Angaben
6.1 Hilfsstoffe
Sucrose, Maisstärke, hochdisperses Siliciumdioxid, Ethylcellulose, Schellack, Talkum, Gelatine, Titandioxid (E 171), Erythrosin (E 127), Indigocarmin (E 132), Chinolingelb (E 104).
6.2 Inkompatibilitäten
Bisher keine bekannt.
6.3 Dauer der Haltbarkeit
Die Dauer der Haltbarkeit beträgt 5 Jahre.
Dieses Arzneimittel soll nach Ablauf des Verfalldatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 30°C lagern.
6.5 Art und Inhalt des Behältnisses
Blisterpackungen bestehend aus PVC/PVDC-Folie und Aluminium/Pergamin-Folie mit 10 (N1) und 20 (N2) retardierten Hartkapseln.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
Temmler Pharma GmbH Temmlerstraße 2 D-35039 Marburg Telefon: (0 64 21) 4 94-0 Telefax: (0 64 21) 4 94-20 2
8. Zulassungsnummer
6803.00.00
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung
27.12.1985 / 31.01.2007
10. Stand der Information
Juli 2016
11. Verkaufsabgrenzung
Verschreibungspflichtig
TA020167281344490004
13.10.2016