Tissucol Duo S 2Ml Immuno
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
TISSUCOL Duo S 0,5 ml Immuno TISSUCOL Duo S 1 ml Immuno TISSUCOL Duo S 2 ml Immuno
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Bei den oben genannten Präparaten handelt es sich um biologische Zweikomponentenkleber mit den folgenden arzneilich wirksamen Bestandteilen.
TISSUCOL Duo S 0,5 ml Immuno
besteht aus folgenden 2 tiefgefrorenen Lösungen:
1 Fertigspritze mit 0,5 ml Kleberproteinlösung enthält:
Humanplasmaproteinfraktion 40-60 mg
mit Fibrinogen 35-55 mg
Blutgerinnungsfaktor XIII 5-25 I.E.1
Plasmafibronectin 1-4,5 mg
Aprotinin (bovin) 1500 KIE2
1 Fertigspritze mit 0,5 ml Thrombinlösung enthält:
Thrombin (human) 250 I.E.3
Kalziumchlorid x 2 H20 2,94 mg
TISSUCOL Duo S1 ml Immuno
besteht aus folgenden 2 tiefgefrorenen Lösungen:
1 Fertigspritze mit 1 ml Kleberproteinlösung enthält:
Humanplasmaproteinfraktion 80-120 mg
mit Fibrinogen 70-110 mg
Blutgerinnungsfaktor XIII 10-50 I.E.
Plasmafibronectin 2-9 mg
Aprotinin (bovin) 3000 KIE
1 Fertigspritze mit 1 ml Thrombinlösung enthält:
Thrombin (human) 500 I.E.
Kalziumchlorid x 2 H20 5,88 mg
TISSUCOL Duo S 2 ml Immuno
besteht aus folgenden 2 tiefgefrorenen Lösungen:
1 Fertigspritze mit 2 ml Kleberproteinlösung enthält: Humanplasmaproteinfraktion 160-240 mg
mit Fibrinogen 140-220 mg
Blutgerinnungsfaktor XIII 20-100 I.E.
Plasmafibronectin 4-18 mg
Aprotinin (bovin) 6000 KIE
1 Fertigspritze mit 2 ml Thrombinlösung enthält:
1000 I.E. 11,76 mg
Thrombin (human) Kalziumchlorid x 2 H20
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Lösungen für Fibrinkleber, farblose bis leicht gelbe und klare bis leicht trübe Lösungen
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Die Präparate sind für Fälle bestimmt, in denen eine schnelle Klebung erwünscht ist. Wegen des hohen Thrombingehaltes setzt die Verfestigung des Fibrinklebers innerhalb von Sekunden nach Vermischen der Kleberkomponenten ein.
Die Präparate haben - gegebenenfalls in Kombination mit resorbierbarem Kollagenvlies oder anderen geeigneten Trägermaterialien - folgende Anwendungsgebiete:
Gewebeklebung
• bei insuffizienzgefährdeter chirurgischer Naht;
• zur gas- und flüssigkeitsdichten Absicherung einer chirurgischen Naht;
• zum Einsparen von Nähten in mechanisch wenig belasteten bzw. Ersatz von Nähten in mechanisch nicht belasteten Bereichen um eine Verkürzung der Operationszeit und eine ungestörte Wundheilung zu erzielen;
• bei aufgrund des Gewebezustandes, der topographischen Situation oder bei einem Implantat unsicherer oder undurchführbarer chirurgischer Naht;
• zur Abdichtung von Membrandefekten (mit und ohne Trägermaterial);
• zur Fixierung von Transplantaten und Implantaten.
Blutstillung
• bei Parenchymdefekten mit diffuser Blutung (größere Gefäße sind zu ligieren, Kollagenvlies als Trägermaterial wird empfohlen);
• bei flächenhaften Blutungen aus Mikrogefäßen mit dem Risiko großer postoperativer Blutverluste oder Hämatome (gegebenenfalls mit Kollagenvlies als Trägermaterial);
• bei Blutungen, die durch chirurgische Naht oder andere Maßnahmen nicht beherrschbar sind (gegebenenfalls Kunststoffpatches oder anderes stabiles Trägermaterial verwenden);
• bei hämorrhagischen Diathesen, wenn eine Korrektur des Hämostasedefektes nicht möglich ist oder Risiken der Substitutionstherapie vermieden werden sollen;
• zur Abdichtung poröser Gefäßprothesen.
Unterstützung der Wundheilung
• bei schlecht vaskularisiertem Empfängerbett für Hauttransplantate;
• bei Hautnekrosen nach Extravasation von Zytostatika;
• bei Hautulzerationen im Rahmen aggressiver Zytostatikatherapie;
• zur Auffüllung knöcherner Defekte, vor allem auch in Verbindung mit Spongiosa.
4.2 Dosierung und Art der Anwendung
TISSUCOL Duo S Immuno darf nur von erfahrenen Chirurgen angewendet werden, die in der Anwendung von TISSUCOL Duo S Immuno geschult wurden.
Dosierung
Der Ablauf der Fibrinklebung wird aus dem folgenden Schema ersichtlich:
|
tiefgefrorene Kleberproteinlösung mit Aprotinin |
* |
aufgetaute Kleberproteinlö sung | |||
|
* |
Gemisch | ||||
|
tiefgefrorene Thrombinlösung mit |
* |
aufgetaute Thrombinlösung |
* |
* |
Kalziumchlorid
verfestigter
Fibrinkleber
*
vollständige
Resorption
Bei der Applikation, für die mehrere Methoden zur Auswahl stehen, werden gleiche Volumina beider Lösungen vermischt, und es entsteht ein visköses Gemisch, das rasch zu einer weißen, elastischen Masse wird.
Das erforderliche Volumen an Kleberproteinlösung richtet sich nach der Größe der zu klebenden oder zu beschichtenden Oberfläche bzw. nach der Größe des auszufüllenden Defektes. Außerdem hängt es von der Applikationstechnik ab.
Bei der Klebung von Flächen kann als Anhaltspunkt dienen, dass 1 ml Kleberproteinlösung für eine Fläche von mindestens 10 cm2 ausreicht. Verwendet man zur Auftragung das DUPLOJECT-System mit Sprühkopf (siehe Abschnitt 6.6), so lässt sich je nach Indikation eine Fläche von mindestens 25 cm2 bis 100 cm2 beschichten.
Vor der Anwendung sollte die Wundoberfläche möglichst trocken sein.
Es empfiehlt sich, möglichst dünne Schichten des Gemisches aufzutragen, um eine unerwünscht langsame Resorption des Fibrinklebers zu vermeiden. Beim Einsatz zur Gewebeklebung wird empfohlen, dass die initiale Verabreichung sofort die ganze zu verklebende Fläche umfasst.
Die Anwendung kann falls notwendig wiederholt werden. Aufjeden Fall sollte aber eine Re-Applikation auf einer bestehenden, durchpolymerisierten TISSUCOL DUO S Immuno-Schicht vermieden werden, da TISSUCOL Duo S Immuno nicht auf einer durchpolymerisierten Schicht haftet.
Art der Anwendung
Zur epiläsionalen Anwendung.
Um optimale Sicherheit bei der Anwendung von TISSUCOL Duo S Immuno zu gewährleisten, sollen die folgenden Empfehlungen befolgt werden:
Bei offener Chirurgie soll ein Druckregelgerät verwendet werden, dessen Maximaldruck höchstens 2,0 bar (28,5 psi) beträgt.
Bei minimal invasiven/laparoskopischen Eingriffen soll ein Druckregelgerät verwendet werden, dessen Maximaldruck höchstens 1,5 bar (22 psi) beträgt und das ausschließlich Kohlendioxidgas verwendet.
Vor dem Aufbringen von TISSUCOL Duo S Immuno muss die Wundoberfläche mittels Standardtechniken (z. B. intermittierende Anwendung von Kompressen, Tupfern, Anwendung von Saugern) getrocknet werden.
TISSUCOL Duo S Immuno darf nur gemäß den Anweisungen und unter Verwendung der Produkte und Geräte rekonstituiert bzw. verabreicht werden, die für dieses Produkt empfohlen werden (siehe Abschnitt 6.6).
Für die Sprühapplikation siehe Abschnitte 4.4 und 6.6 mit besonderen Empfehlungen zum erforderlichen Druck und Gewebeabstand je nach Art des Eingriffs und zur Länge der Applikationshilfen.
4.3 Gegenanzeigen
TISSUCOL Duo S Immuno darf nicht intravaskulär angewendet werden, insbesondere bei koronaren Bypass-Operationen ist höchste Vorsicht geboten, um jegliches Risiko der intravasalen Anwendung zu minimieren. (Siehe auch Kapitel 4.8 Nebenwirkungen).
Die Präparate dürfen nicht in die Nasenschleimhaut injiziert werden.
Für die Klebung von Nervenanastomosen sollten die Präparate wegen des hohen Aprotiningehaltes der Kleberproteinlösung - 3000 KIE pro ml - nicht verwendet werden, da durch die lange Resorptionszeit des verfestigten Fibrinklebers die Entstehung von Fibrosen nicht ausgeschlossen werden kann.
Die alleinige Anwendung von TISSUCOL Duo S Immuno ist nicht angezeigt für die Behandlung von massiven arteriellen oder venösen Blutungen.
Bekannte Überempfindlichkeit gegen Rindereiweiß oder einen der Bestandteile der Präparate, einschließlich Aprotinin. Aktuelle oder aus der Anamnese bekannte allergisch bedingte Thrombozytopenie (Typ II) auf Heparin.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Nur zur epiläsionalen Anwendung.
Bei Patienten mit allergischer Diathese bzw. Arzneimittelüberempfindlichkeit sowie Patienten, die A-protinin bereits in der Vergangenheit erhalten haben, ist eine sorgfältige Nutzen-Risiko-Abwägung nötig. Es empfiehlt sich, vor der Gabe von Aprotinin Antihistaminika zu verabreichen.
TISSUCOL Duo S Immuno darf nicht intravaskulär angewendet werden, insbesondere bei koronaren Bypass-Operationen ist höchste Vorsicht geboten, um jegliches Risiko der intravasalen Anwendung zu minimieren (siehe auch Kapitel 4.8 Nebenwirkungen). Eine unabsichtliche, intravaskuläre Verabreichung von TISSUCOL Duo S Immuno kann zu lebensbedrohlichen, thromboembolischen Komplikationen oder disseminierter intravasaler Gerinnung führen.
Eine intravasale Injektion könnte darüber hinaus bei empfindlichen Patienten Wahrscheinlichkeit und Schwere von akuten Überempfindlichkeitsreaktionen erhöhen.
Bei der Injektion in die Submukosa kann es in Einzelfällen zu einer Schädigung des Gewebes mit der Folge einer Hämatombildung kommen. Eine akute Pankreatitis kann bei Patienten mit einem intramuralen Hämatom der Duodenalwand beobachtet werden.
Abdominale Schmerzen, Übelkeit und Erbrechen innerhalb von 1 bis 3 Tagen nach der endoskopischen Blutstillung durch Injektion können Anzeichen für ein intramurales Hämatom sein.
Wenn Fibrinkleber in abgeschlossene Hohlräume eingebracht werden, sollte das Risiko von Komplikationen aufgrund einer Kompression in Betracht gezogen werden.
Vor einer Sprühanwendung von TISSUCOL Duo S Immuno mit Instrumenten anderer Hersteller wird gewarnt. Der EASYSPRAY-Druckregler und das SPRAY SET sind bei Baxter Deutschland GmbH, Unterschleißheim, erhältlich.
Beim Sprühen von Fibrinkleber kommt Druckgas zur Anwendung. Die Druckgasanwendung birgt das Risiko einer Gasembolie, eines Gasemphysems oder einer Gewebs- bzw. Organruptur in sich, die lebensbedrohlich sein können.
TISSUCOL Duo S Immuno soll nur als dünne Schicht aufgetragen werden. Eine zu dicke Schicht kann die Wirksamkeit des Produkts und die Wundheilung negativ beeinflussen.
Bei der Verwendung von Sprühgeräten mit Druckgasreglern zur Verabreichung von Fibrinklebern sind lebensbedrohliche/tödliche Luft- oder Gasembolien aufgetreten. Dieses Ereignis scheint mit der Verwendung von Spray-Sets mit höherem als dem empfohlenen Druck und/oder mit einem zu geringen Abstand zur Gewebeoberfläche zusammenzuhängen. Das Risiko scheint höher zu sein, wenn Fibrinkleber mit Luft aufgesprüht werden, als beim Sprühen mit CO2 und ist daher beim Aufsprühen von TISSUCOL Duo S Immuno auf offene Operationswunden nicht auszuschließen.
Wird TISSUCOL Duo S Immuno mittels Sprühapplikation aufgetragen, muss sichergestellt werden, dass ein Druck verwendet wird, der im vom Hersteller des Sprühgeräts empfohlenen Druckbereich liegt (siehe Tabelle 6.6 für Drücke und Abstände).
TISSUCOL Duo S Immuno soll nur per Sprühapplikation verabreicht werden, wenn der Sprühabstand exakt beurteilt werden kann. Nicht näher als im empfohlenen Abstand aufsprühen.
Beim Aufsprühen von TISSUCOL Duo S Immuno sollen Änderungen von Blutdruck, Puls, Sauerstoffsättigung und endexspiratorischem CO2 überwacht werden, da die Möglichkeit einer Luft- oder Gasembolie besteht (siehe auch Abschnitt 4.2).
Der EASYSPRAY-Druckregler und das SPRAY SET dürfen deshalb in umschlossenen Körperbereichen nicht eingesetzt werden. Das Sprühen darf ausschließlich unter Sicht, bei einem Mindestabstand von 10 cm erfolgen. Für die Anwendung von TISSUCOL Duo S Immuno in der minimal invasiven Chirurgie wird der DuploSpray MIS Regulator mit den entsprechenden Applikatoren empfohlen. Für weitere Informationen ist die Gebrauchsanweisung des Duplospray MIS Geräts heranzuziehen.
Bei der Sprühapplikation müssen Gebiete, auf die kein Kleber gesprüht werden soll, abgedeckt werden. Nur einsehbare Gebiete sollten besprüht werden.
Kleberproteinlösung und/oder Thrombinlösung, die bei der Anwendung auf Gewebe außerhalb des zu klebenden Bereichs gelangt sind, sollten nach Möglichkeit entfernt werden.
Wie bei allen proteinhaltigen Präparaten sind allergische Überempfindlichkeits-reaktionen möglich. Anzeichen von Überempfindlichkeitsreaktionen können Nesselsucht, generalisierte Urtikaria, Engegefühl in der Brust, Stenoseatmung, Hypotonie und Anaphylaxie einschließen. Wenn diese Symptome auftreten, muss die Anwendung sofort abgebrochen werden. Bereits appliziertes Produkt sollte von der Operationsstelle entfernt werden.
Es müssen die derzeit gültigen Standardmaßnahmen für eine Notfallbehandlung angewandt werden. Bei einem Schock muss die geeignete medizinische Schockbehandlung eingeleitet werden.
TISSUCOL Duo S Immuno enthält Rindereiweiß (Aprotinin). Auch bei strikt lokaler Anwendung besteht das Risiko einer anaphylaktischen Reaktion, die auf das Aprotinin zurückzuführen ist. Das Risiko scheint bei Patienten mit einer vorangegangenen Exposition erhöht zu sein, selbst wenn es zuvor gut vertragen wurde. Deshalb sollte jede Verwendung von Aprotinin oder aprotininhaltigen Produkten in der Krankenakte vermerkt werden.
Standardmaßnahmen zur Verhinderung von Infektionen, die durch aus menschlichem Blut oder Plasma hergestellten Arzneimitteln übertragen werden können, schließen die Auswahl der Spender, die Testung der Einzelspenden und der Plasmapools auf spezifische Infektionsmarker und die Durchführung effektiver Herstellungsschritte zur Inaktivierung/Abtrennung von Viren mit ein. Trotzdem sind bei der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln Infektionskrankheiten durch Übertragung von Erregern - auch bislang unbekannter Natur - nicht völlig auszuschließen.
Diese Maßnahmen werden für umhüllte Viren wie z. B. HIV, HBV und HCV für wirksam erachtet. Diese Maßnahmen können bei nicht-umhüllten Viren, wie z. B. HAV und Parvovirus B19, eingeschränkt wirksam sein. Parvovirus B19-Infektionen können bei Schwangeren (fötale Infektion) und Personen mit Immundefekten oder gesteigerter Erythropoese (z. B. hämolytische Anämie) zu schweren Erkrankungen führen.
Wird ein aus menschlichem Plasma hergestelltes TISSUCOL Duo S Immuno regelmäßig/wiederholt verabreicht, müssen geeignete Impfungen (Hepatitis A und B) in Betracht gezogen werden.
Sicherheit und Wirksamkeit des Produktes an Kindern wurde nicht untersucht.
Es wird dringend empfohlen, jede Verabreichung von TISSUCOL Duo S Immuno mit Produktnamen und Chargennummer zu dokumentieren, um die Verbindung zwischen Patient und Produktcharge herzustellen.
Es wird auf die Dokumentationspflicht gemäß Transfusionsgesetz hingewiesen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Substanzen, die oxydierend wirken (z. B. Jod, H2O2), Proteine denaturieren (z. B. Alkohol) oder Schwermetalle enthalten (z. B. Thiomersal) beeinträchtigen die Wirksamkeit des Fibrinklebers. Wenn solche Substanzen, beispielsweise als Desinfektionsmittel, verwendet werden, so sind etwaige Reste vor Beginn der Klebung mit einem sterilen Tupfer möglichst vollständig zu entfernen.
Produkte die Oxidierte Cellulose enthalten, können die Wirksamkeit von
TISSUCOL DUO S Immuno beeinflussen und sollten nicht als Trägermaterialien verwendet werden.
Die Präparate können auch bei voll heparinisierten Patienten (z. B. bei extrakorporalem Kreislauf) angewendet werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Es ist nicht bekannt, ob die Verabreichung von TISSUCOL Duo S Immuno während der Schwangerschaft und der Stillzeit negative Auswirkungen auf Mutter und Kind haben kann. Aus diesem Grund ist während der Schwangerschaft und Stillzeit eine strenge Indikationsstellung geboten.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nicht relevant.
4.8 Nebenwirkungen
Wie bei allen proteinhaltigen Arzneimitteln kann es bei wiederholter Anwendung von TISSUCOL Duo S Immuno, zum Auftreten anaphylaktischer oder anaphylaktoider Reaktionen kommen (siehe Abschnitt 4.4).
In seltenen Fällen können diese Reaktionen auch bei Patienten bei der Erstverabreichung von Apro-tinin oder TISSUCOL Duo S Immuno auftreten.
Selbst wenn eine zweite Verabreichung gut vertragen wird, kann eine darauf folgende Gabe schwere anaphylaktische Reaktionen auslösen. Die Anzeichen von allergischen/anaphylaktischen Reaktionen können von Bradykardie, Tachykardie, Blutdruckabfall, Flush, Bronchospasmus, keuchender Atmung, Atemnot, Übelkeit, Urtikaria, Angioödem, Juckreiz, Erythem und Parästhesie, bis hin zu schwerer Hypotension, anaphylaktischem Schock und Tod reichen. Bei den ersten Anzeichen oder Symptomen einer Überempfindlichkeitsreaktion ist die Anwendung sofort abzubrechen, und es sind die gebräuchlichen Notfallmaßnahmen durchzuführen. Die therapeutischen Maßnahmen richten sich nach Art und Schweregrad der allergischen Reaktion.
Bei einem Schock ist die geeignete medizinische Schockbehandlung einzuleiten.
TISSUCOL Duo S Immuno darf nicht intravaskulär angewendet werden, da dies zu anaphylaktischen und/oder thromboembolischen Komplikationen oder disseminierter intravasaler Gerinnung führen kann, die lebensbedrohlich sein können.
Speziell bei koronaren Bypass-Operationen sollte TISSCOL Duo S Immuno mit Vorsicht angewendet werden, um jegliches Risiko der intravasalen Anwendung zu minimieren. In zwei retrospektiven, nicht-randomisierten Studien der koronaren Bypass-Chirurgie zeigten jene Patienten, die Fibrinkleber erhalten haben, ein statistisch höheres Mortalitätsrisiko. Obwohl diese Studien keinen kausalen Zusammenhang belegen, kann eine Verbindung zwischen dem erhöhten Risiko und dem Einsatz von TISSUCOL Duo S Immuno nicht ausgeschlossen werden. Daher sollte dieses Produkt mit besonderer Vorsicht angewandt werden, um eine unerwünschte, intravaskuläre Verabreichung zu vermeiden.
Aufgrund des Heparingehaltes von TISSUCOL Duo S Immuno können selten Antikörper-vermittelte schwere Thrombozytopenien (Typ II) mit Thrombozytenwerten deutlich unter 100.000/pl oder einem schnellen Abfall auf weniger als 50 % des Ausgangswertes beobachtet werden. Bei nicht Sensibilisierten beginnt der Thrombozytenabfall in der Regel 6-14 Tage nach Behandlungsbeginn, bei Sensibilisierten unter Umständen innerhalb von Stunden. Die schwere Form der Thrombozytopenie kann verbunden sein mit arteriellen und venösen Thrombosen/Thrombembolien, Verbrauchskoagulopathie, evtl. Hautnekrosen an der Injektionsstelle, Petechien, Purpura und Meläna.
In solchen Fällen ist TISSUCOL Duo S Immuno sofort abzusetzen. Der Patient muss darüber informiert werden, dass bei ihm auch in Zukunft keine heparinhaltigen Arzneimittel mehr angewendet werden dürfen. Wegen der genannten gelegentlich auftretenden ungünstigen Wirkung des Heparins auf die Thrombozyten muss deren Zahl, insbesondere zu Beginn der Behandlung mit diesem Arzneimittel, engmaschig kontrolliert werden.
Zur Sicherheit vor übertragbaren Erregern, siehe Abschnitt 4.4
Nebenwirkungen, die von klinischen Studien und aus der klinischen Anwendung berichtet wurden, sind in der nachfolgenden Tabelle zusammengefasst.
Unbekannte Häufigkeiten basieren auf Spontanberichten aus der klinischen Anwendung mit Fibrinkle-bem von Baxter.
Die Nebenwirkungen und ihre Häufigkeiten werden wie folgt zusammengefasst:
Häufig: (>1/100 bis <1/10)
Gelegentlich; (>1/1.000 bis <1/100)
Selten: (>1/10.000 bis <1/1.000)
Nicht bekannt: (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
System-Organ-Klassen (SOC) |
bevorzugte MedDRA-Terms |
Häufigkeiten |
|
Erkrankungen des Immunsystems |
Überempfindlichkeit einschließlich anaphylaktischer Reaktionen, anaphylaktischer Schock und folgende Symptome: Angioödem, Parästhesien, Bradykardie, Tachykardie, Flush, Bronchospasmus, Atemnot, keuchende Atmung, Urtikaria, Juckreiz und Erythem. Anaphylaktische Reaktionen und anaphylaktischer Schock einschließlich Todesfälle |
Häufigkeit nicht bekannt |
|
Gefäßerkrankungen |
niedriger Blutdruck |
selten |
|
Arterielle Embolien, einschließlich zerebraler Arterienverschluss, Schlaganfälle+ |
Häufigkeit nicht bekannt | |
|
Erkrankungen des Gastrointestinaltraktes |
Übelkeit |
gelegentlich |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Verzögerte Wundheilung |
Häufigkeit nicht bekannt |
|
Untersuchungen |
erhöhter Wert an Fibrinspaltprodukten |
gelegentlich |
|
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen |
Schmerzen nach der Behandlung |
gelegentlich |
Bei der Anwendung von Fibrinklebern mit einem Sprühapplikator unter Verwendung von Druckgas ist das Auftreten lebensbedrohlicher Luft- oder Gasembolien berichtet worden, in einem Fall tödlich.
Als Symptome von Überempfindlichkeiten gegen Fibrinkleber/Hämostatika sind Reizungen am Verabreichungsort, Brustbeschwerden, Schüttelfrost, Kopfschmerzen, Lethargie, Unruhe und Erbrechen beobachtet worden.
4.9 Überdosierung
Es sind keine Fälle einer Überdosierung bekannt.
als Ergebnis einer intravaskulären Verabreichung in den oberen Sinus des Felsenbeins
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Lokale Hämostatika, ATC-Code: B02BC; Gewebekleber, ATC-Code: V03AK
Die Fibrinklebung mit obigen Arzneimitteln entspricht im Prinzip der letzten Phase der Blutgerinnung.
Fibrinogen wird durch Thrombin zu monomerem Fibrin umgesetzt. Dieses bildet durch End-zu End und Seit-zu Seit-Anlagerung aggregiertes Fibrin, das in 5 M Harnstoff löslich ist.
Gleichzeitig aktiviert Thrombin den Faktor XIII, der in ausreichenden Mengen in der Kleberproteinlösung vorhanden ist. Da in der verwendeten Thrombin-Lösung Kalziumchlorid enthalten ist, wird das entstehende
Fibrin anschließend durch den Faktor XIIIa in polymeres, harnstoffunlösliches Fibrin umgewandelt. Dabei werden kovalente Bindungen zwischen benachbarten y- und a-Ketten der Fibrinmonomere gebildet.
Die nach dem Wundverschluss einsetzende Wundheilung ist gekennzeichnet durch das Einsprossen von Fibroblasten in das Wundgebiet, wobei das Fibrin die Funktion einer Leitschiene übernimmt, sowie die Bildung von Kapillaren. Dieser Prozess stellt ein multifaktorielles Geschehen dar, bei dem Thrombin, Fibrin und Faktor XIII eine stimulierende Wirkung auf die Fibroblasten zeigen.
Als nächste Phase des Wundheilungsgeschehens setzt der Abbau des Fibrinnetzes durch Proteolyse und Phagozytose ein. In der Kleberproteinlösung sind geringe Mengen an Plasminogen enthalten, welches durch Kallikrein und verschiedene Gewebefaktoren zu Plasmin umgesetzt wird und somit die Fibrinolyse in Gang setzt.
Dieser Vorgang gleicht der bei jeder Wundheilung beobachteten Resorption körpereigenen Fibrins.
Ein zu rascher, fibrinolytischer Abbau des verfestigten Fibrinklebers wird jedoch durch die Zugabe von Aprotinin als Antifibrinolytikum gehemmt.
5.2 Pharmakokinetische Eigenschaften
TISSUCOL Duo S Immuno darf nur epiläsional angewendet werden. Intravasale Anwendung ist kontraindiziert. Deshalb wurden keine intravasalen Pharmakokinetikstudien am Menschen durchgeführt. TISSUCOL Duo S Immuno wird wie körpereigenes Fibrin durch Fibrinolyse und Phagozytose abgebaut.
TISSUCOL Duo S Immuno darf nur lokal angewendet werden und ist sofort verfügbar.
5.3 Präklinische Daten zur Sicherheit
Toxizitätsstudien mit einmaliger Verabreichung haben keine spezielle Gefährdung für den Menschen gezeigt, die über die in anderen Abschnitten der Fachinformation genannten Informationen hinausgeht. Aufgrund der Beschaffenheit sowie der besonderen Art der Anwendung wurden keine Studien zur Mutagenität und Kanzerogenität durchgeführt.
6.1 Liste der sonstigen Bestandteile
1 Fertigspritze Kleberproteinlösung enthält:
Natriumzitrat, Natriumchlorid, Glyzin, Humanalbumin, Plasminogen, Heparin, Triton, Kreatin, Wasser für Injektionszwecke
1 Fertigspritze Thrombinlösung enthält:
Natriumchlorid, Glyzin, Humanalbumin, Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Dieses Arzneimittel darf nicht mit anderen Medikamenten gemischt werden.
6.3 Dauer der Haltbarkeit
2 Jahre
Nach Ablauf des Verfalldatums dürfen die Präparate nicht mehr angewendet werden.
Nach dem Auftauen können die Präparate bis zu 48 Stunden steril bei Raumtemperatur aufbewahrt werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Tiefgekühlt lagern und transportieren (< -18°C). Die Kühlkette darf bis zur Anwendung nicht unterbrochen werden.
Einmal aufgetaute Präparate dürfen weder eingefroren noch im Kühlschrank gelagert werden (bei Kühlschranktemperatur geliert die Kleberproteinkomponente).
6.5 Art und Inhalt des Behältnisses
Es stehen folgende Gebrauchseinheiten zur Verfügung:
TISSUCOL Duo S 0,5 ml Immuno
mit: Kleberproteinlösung tiefgefroren 0,5 ml
Thrombinlösung tiefgefroren 0,5 ml
TISSUCOL Duo S1 ml Immuno
mit: Kleberproteinlösung tiefgefroren 1 ml
Thrombinlösung tiefgefroren1 ml
TISSUCOL Duo S 2 ml Immuno
mit: Kleberproteinlösung tiefgefroren 2 ml
Thrombinlösung tiefgefroren 2 ml
Jeder Gebrauchseinheit sind 2 Anschlussstücke und 4 Anwendungskanülen für das DUPLOJECT-System beigepackt.
Folgendes Zubehör zur Anwendung von TISSUCOL Duo S Immuno kann bezogen werden:
EASY SPRAY Druckregler
TISSOMAT4
Druckgassteuergerät mit Fußschalter, Manometer, Reduzierventil und Druckschlauch.
SPRAY SET
Steriler Einmalgerätesatz, bestehend aus einem Verbindungsschlauch mit Sterilfilter und zwei Sprühköpfen, zum Versprühen von TISSUCOL Duo S Immuno mittels DUPLOJECT und Sprühkopf auf große Wundflächen.
DUPLOJECT
Wird mit den TISSUCOL Duo S Immuno-Handelsformen mitgeliefert.
DUPLOCATH 180 Applikations-Katheter, lang
Einmalgerät zur Anwendung von TISSUCOL Duo S Immuno in schwer zugänglichen Bereichen des Operationsfeldes. Verwendbar auch in Kombination mit einem Endoskop, flexibel, röntgendicht. Länge: ca. 180 cm, 0 ca. 5 french (ca. 0,17 cm)
Der Applikations-Katheter 180, kann auf jede benötigte Länge gekürzt werden.
DUPLOCATH 25 Applikations-Katheter, kurz
Einmalgerät zur Anwendung von TISSUCOL Duo S Immuno in schwer zugänglichen Bereichen des Operationsfeldes. Verwendbar auch in Kombination mit einem Trokar.
Länge: ca. 25 cm, 0 ca. 5 french (ca. 0,17 cm)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Auftauen und Erwärmen von TISSUCOL Duo S Immuno:
Die beiden Fertigspritzen mit den Kleberkomponenten sind in die Spritzenhalterung DUPLOJECT eingelegt. Die gesamte Einheit wird unter aseptischen Bedingungen hermetisch in zwei sterilisierte Plastikumhüllungen eingesiegelt. Die innere Plastikumhüllung und deren Inhalt sind bei unbeschädigter äußerer Plastikumhüllung steril.
Zur Erleichterung des Mischens der beiden Lösungen sowie zur optimalen Verfestigung des Gemisches müssen die Kleberkomponenten auf 33-37 °C erwärmt werden. Die Temperatur von 37 °C darf jedoch keinesfalls überschritten werden.
Die effizienteste Methode die beiden Kleberkomponenten aufzutauen bzw. zu erwärmen ist die Verwendung eines sterilen, auf 33 bis 37 °C temperierten, Wasserbades, das jedoch die Temperatur von 37 °C nicht überschreiten darf. Um den vorgegebenen Temperaturbereich zu gewährleisten, sollte die Wassertemperatur mit Hilfe eines Thermometers überwacht und das Wasser gegebenenfalls gewechselt werden. Bei Verwendung eines sterilen Wasserbades sollte die DUPLOJECT-Spritzenhalterung mit den Fertigspritzen aus den Plastikumhüllungen entnommen werden.
Die Auftau- bzw. Erwärmzeiten im sterilen Wasserbad sind Tabelle 1 zu entnehmen.
|
Packungsgröße |
Auftau- bzw. Erwärmzeiten (Produkt ohne Plastikumhüllungen) |
|
0,5 ml |
3 Minuten |
|
1,0 ml |
3 Minuten |
|
2,0 ml |
7 Minuten |
Alternativ können die Kleberkomponenten in einem Inkubator bei 37 °C oder bei Raumtemperatur aufgetaut bzw. erwärmt werden. Beim Auftauen bei Raumtemperatur muss das Produkt kurz vor seiner Anwendung auf 33 bis 37 °C erwärmt werden, um ein optimales Mischen der beiden Lösungen zu ermöglichen.
Die Auftau- bzw. Erwärmzeiten im Inkubator bzw. bei Raumtemperatur sind Tabelle 2 zu entnehmen. Die Zeiten beziehen sich auf Produkt in den Plastikumhüllungen.
Tabelle 2: Auftau- bzw. Erwärmzeiten im Inkubator bzw. bei Raumtemperatur
|
Packungsgröße |
Auftau- bzw. Erwärmzeiten im Inkubator (Produkt in Plastikumhüllungen) |
Auftauzeit bei Raumtemperatur (Produkt in Plastikumhüllungen) |
Erwärmzeiten von Raumtemperatur auf 33-37 °C im Inkubator (Produkt in Plastikumhüllungen) |
|
0,5 ml |
45 Minuten |
45 Minuten |
20 Minuten |
|
1,0 ml |
50 Minuten |
60 Minuten |
25 Minuten |
|
2,0 ml |
85 Minuten |
110 Minuten |
35 Minuten |
Von einem Auftauen in der Hand ist abzusehen.
Die DUPLOJECT-Spritzenhalterung mit den Fertigspritzen sollte erst kurz vor Einsatz des Produktes aus den Plastikumhüllungen entnommen werden. Die Schutzkappen sollten erst kurz vor Anwendung des Produktes von den Spritzen entfernt werden.
Die Kleberprotein- und die Thrombinlösung sollte durchsichtig oder leicht opak sein. Lösungen, die Ablagerungen aufweisen, dürfen nicht verwendet werden.
Die aufgetaute Kleberproteinlösung sollte eine leicht visköse Flüssigkeit sein. Wenn die Lösung die Konsistenz eines verfestigten Gels aufweist, muss man davon ausgehen, dass sie denaturiert wurde (z.B. durch eine Unterbrechung der Kühlkette oder durch Überhitzung beim Erwärmen). In diesem Fall darf die Kleberproteinlösung nicht angewendet werden.
Hinweis:
TISSUCOL Duo S Immuno darf nicht in der Mikrowelle aufgetaut oder erwärmt werden.
Applikationsmethoden*
Die Applikation von TISSUCOL Duo S Immuno erfolgt mit dem DUPLOJECT-System, wobei sich die folgenden Applikationsmethoden unterscheiden lassen:
• Simultane Applikation mit DUPLOJECT-System und Applikationskanüle, siehe 6.6.1.
• Simultane Applikation mit DUPLOJECT-System und Applikations-Katheter, siehe 6.6.2.
• Sprühapplikation, siehe 6.6.3.
• Lokale Applikation mit Injektionsnadel, siehe 6.6.4.
• Applikation mit Trägermaterial, siehe 6.6.5.
Soweit Handschuhe und Instrumente mit der Kleberproteinlösung oder dem Gemisch in Berührung kommen, sollen sie vorher mit einer sterilen Kochsalzlösung angefeuchtet werden, um ein Haftenbleiben des Klebers zu vermeiden.
Die zu verklebenden Teile sind nach dem Auftragen des Gemisches rasch zu adaptieren und für mindestens 2 Minuten unter leichter Kompression zu halten, um eine ausreichende Polymerisation zu erreichen.
Speziell im Falle der Klebung von Flächen ist auf dünne Schichten des Gemisches zu achten.
Eine getrennte, sequenzielle Anwendung der beiden Komponenten von TISSUCOL Duo S Immuno sollte vermieden werden.
6.6.1 Simultane Applikation mit DUPLOJECT-System und Applikationskanüle
Das sterile DUPLOJECT-System besteht aus einer Halterung für die beiden Fertigspritzen und einem gemeinsamen Kolben, wodurch bei der Applikation gleiche Mengen der beiden Kleberkomponenten über ein gemeinsames Anschlussstück in einer Applikationskanüle durchmischt werden.
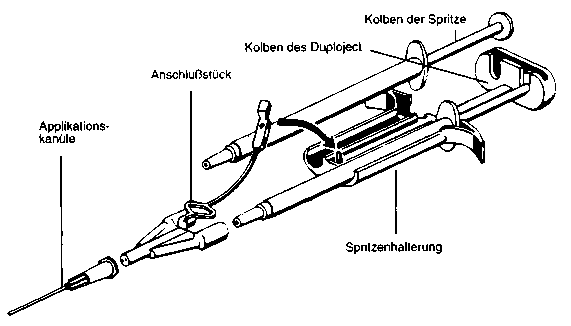
Arbeitsanleitung:
1. Die Verschlusskappen der beiden Spritzen entfernen.
2. Die Konusse beider Spritzen mit einem beigepackten Anschlussstücke verbinden. Dabei auf festen Halt achten. Anschlussstück mit Sicherungslasche an der Spritzenhalterung fixieren.
3. Eine der beigepackten Applikationskanülen auf das Anschlussstück stecken.
Die hier beschriebenen Applikationsmethoden lassen sich in unterschiedlicher Weise variieren, wie man der Literatur entnehmen kann.
Die in den Spritzen, im Anschlussstück und in der Kanüle befindliche Luft erst bei der Anwendung herausdrücken, da es sonst schon vorher zu einer Verklebung der Applikationskanüle kommen kann.
4. Bei der Klebung von Flächen: Das Gemisch auf eine Fläche der zu verklebenden Teile dünn, aber möglichst lückenlos auftragen.
Überschüssiges Produkt soll vom Verabreichungsort entfernt werden.
Wenn TISSUCOL Duo S Immuno mittels eines Sprühgerätes aufgetragen wird, stellen Sie bitte sicher, dass sich der Druck nur in dem vom Gerätehersteller empfohlenen Bereich befindet. Ein Druck von 1,4-1,7 bar sollte dabei nicht überschritten werden. Halten Sie den vom Gerätehersteller angegebenen Abstand vom Gewebe ein. Er sollte mindestens 10 bis 15 cm betragen. Beim Versprühen von TISSUCOL Duo S Immuno sollten wegen der Möglichkeit einer Gasembolie Blutdruck, Pulsschlag, Sauerstoffsättigung und endexpiratorischer CO2-Partialdruck überwacht werden.
Zur Beachtung:
Wird die Anwendung unterbrochen, so muss bei Wiederaufnahme der Klebung die gebrauchte Applikationskanüle durch eine neue ersetzt werden (3 Reservekanülen sind beigepackt). Die Applikationskanüle sollte aber erst unmittelbar vor der Weiterführung der Anwendung ausgetauscht werden, da es sonst zur Verklebung der Austrittsöffnung des Anschlussstückes kommen kann (in einem solchen Fall ist das beigepackte Reserveanschlussstück zu verwenden).
Wenn sehr kleine Volumina (1 bis 2 Tropfen) von TISSUCOL Duo S Immuno verabreicht werden, müssen die ersten Tropfen unmittelbar vor der Verabreichung aus der Applikationskanüle herausgedrückt und verworfen werden, um die Anwendung eines ausreichend gemischten Produktes sicherzustellen.
Es ist möglich, das Gemisch ohne Applikationskanüle direkt aus dem Anschlussstück aufzutragen. Während einer etwaigen Unterbrechung der Anwendung kann sich an der Austrittsöffnung ein Fibrin-clot bilden. Dieser lässt sich im Allgemeinen leicht entfernen. Sonst ist auch in diesem Falle das beigepackte Reserveanschlussstück zu benutzen.
6.6.2 Simultane Applikation mit DUPLOJECT-System und Applikations-Katheter
Zur Anwendung in schwer zugänglichen Bereichen des Operationsfeldes und zur endoskopischen Anwendung stehen Applikationskatheter zur Verfügung. Eine ausführliche Beschreibung dieser Anwendungsmethode ist den Gerätesätzen DUPLOCATH 25 bzw. DUPLOCATH 180 beigepackt.
6.6.3 Sprühapplikation
Diese Methode eignet sich besonders zum Besprühen größerer Flächen (z. B. bei Hauttransplantationen) und zur Stillung diffuser Blutungen.
Eine ausführliche Beschreibung dieser Anwendungsmethode ist dem Gerätesatz SPRAY SET beigepackt.
Wird TISSUCOL Duo S Immuno mithilfe eines Sprühgeräts aufgetragen, muss sichergestellt werden, dass der Druck und der Gewebeabstand innerhalb der folgenden, vom Hersteller empfohlenen Bereiche liegen:
|
Empfohlener Druck, Gewebeabstand und Sprühgeräte für die Applikation von TISSUCOL Duo S Immuno | |||||
|
Art der Chirurgie |
Zu verwendendes Sprühset |
Zu verwendende Applikationshilfe |
Zu verwendender Druckregler |
Empfohlener Abstand vom Zielgewebe |
Empfohlener Sprühdruck |
|
Offene Wunde |
Duploject Spray Set |
n. z. |
Tissomat |
10-15 cm |
1,5-2,0 bar (21,5-28,5 psi) |
|
Tissucol Spray Set |
n. z. |
EasySpray |
10-15 cm |
1,5-2,0 bar (21,5-28,5 psi) | |
|
Laparoskopie/ minimal invasive Eingriffe |
n. z. |
Duplospray MIS Applikator 20 cm |
Duplospray MIS Regulator Duplospray MIS Regulator NIST B11 |
2-5 cm |
1,2-1,5 bar (18-22 psi) |
|
Duplospray MIS Applikator 30 cm |
Duplospray MIS Regulator Duplospray MIS Regulator NIST B11 | ||||
|
Duplospray MIS Applikator 40 cm |
Duplospray MIS Regulator Duplospray MIS Regulator NIST B11 | ||||
|
Austauschbare Spitze |
Duplospray MIS Regulator Duplospray MIS Regulator NIST B11 | ||||
Beim Aufsprühen von TISSUCOL Diio S Immiino sollen Änderungen von Blutdruck, Puls, Sauerstoffsättigung und endexspiratorischem CO2 überwacht werden, da die Möglichkeit einer Luft- oder Gasembolie besteht (siehe Abschnitte 4.2 und 4.4).
6.6.4 Lokale Applikation mit Injektionsnadel
Die Blutungsstelle wird mit TISSUCOL Duo S Immuno umspritzt. Es hat sich bewährt, je nach Stärke der Blutung und Größe der Blutungsstelle 2 ml bis 4 ml TISSUCOL Duo S Immuno auf mehrere Depots zu verteilen. Die den Injektionsgeräten beigepackten Gebrauchsanweisungen müssen beachtet werden.
6.6.5 Applikation mit Trägermaterial
Bei diffusen, kapillären Blutungen empfiehlt es sich, Kleberprotein-und Thrombinlösung auf Trägermaterialien wie Kollagenvlies aufzutragen, um zu vermeiden, dass die Kleberkomponenten vor der Verfestigung fortgeschwemmt werden. Nach dem Auftragen des Gemisches (bzw. der Kleberprotein-und der Thrombinlösung) legt man das Trägermaterial sofort auf die Wundfläche. Dabei sind gleiche Mengen der beiden Komponenten zu verwenden.
Nicht verbrauchte Lösungen müssen fachgerecht entsorgt werden.
7. INHABER DER ZULASSUNG
Baxter Deutschland GmbH Edisonstraße 4 85716 Unterschleißheim Tel.: 089/31701-0
E-Mail-Adresse: info_de@baxter.com
8. ZULASSUNGSNUMMER(N)
7990.00.00
7990.01.00
7990.02.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
9. November 1987
10. September 1992
10. STAND DER INFORMATION
März 2013
11. SONSTIGE HINWEISE
Herkunftsländer der zur Produktion verwendeten Plasmen
Deutschland, Finnland, Norwegen, Österreich, Schweden, Schweiz, Tschechien und Vereinigte Staaten von Amerika.
12. VERSCHREIBUNGSSTATUS/ APOTHEKENPFLICHT
Verschreibungspflichtig
Eine Einheit (I.E.) Blutgerinnungsfaktor XIII entspricht derjenigen Aktivität, die in 1 ml frischem Normalplasma enthalten ist.
30 Kallidinogenase-Inaktivator-Einheiten (KIE) entsprechen 1 Trypsin-Inhibitor-Einheit (FIP-E.).
Eine Internationale Einheit (I. E.) Thrombin wird definiert als jene Aktivität, die in 0,0853 mg des 1. Internationalen Standards von humanem Thrombin enthalten ist.
Der TISSOMAT ist aber zwar noch im Handel, wird von Baxter aber nicht mehr vertrieben.