Tissucol-Kit 2,0 Immuno
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
TISSUCOL-Kit 1,0 Immuno TISSUCOL-Kit 2,0 Immuno TISSUCOL-Kit 5,0 Immuno
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
TISSUCOL-Kit Immuno ist eine Kombinationspackung, die die Präparate TISSUCOL Immuno lyophilisiert, Aprotininlösung, Thrombin S lyophilisiert, Thrombin L lyophilisiert und Kalziumchloridlösung zur Herstellung eines Zweikomponentenklebers enthält. Diese Präparate weisen hinsichtlich ihrer wirksamen Bestandteile folgende Zusammensetzungen auf:
* Eine Einheit (I.E.) Blutgerinnungsfaktor XIII entspricht derjenigen Aktivität, die in 1 ml frischem Normalplasma enthalten ist.
** 30 Kallidinogenase-Inaktivator-Einheiten (KIE) entsprechen 1 Trypsin-Inhibitor-Einheit (FIP-E.). *** Eine Internationale Einheit (I.E.) Thrombin wird definiert als jene Aktivität, die in 0,0853 mg des 1. Internationalen Standards von humanem Thrombin enthalten ist.
TISSUCOL-Kit 1,0 Immuno
TISSUCOL 1,0 lyophilisiert Kleberproteinkonzentrat thermoinaktiviert 1 Durchstechflasche mit 126 - 198 mg Trockensubstanz enthält:
80 - 120 mg 70 - 110 mg 2 - 9 mg 10 - 50 I.E*
Humanplasmaproteinfraktion mit Fibrinogen
Plasmafibronectin Blutgerinnungsfaktor XIII
Aprotininlösung
1 Durchstechflasche mit 1,0 ml Lösung enthält:
Aprotinin (bovin) 3000 KIE**
Thrombin S lyophilisiert
1 Durchstechflasche mit 55 - 75 mg Trockensubstanz enthält:
Thrombin (human) 500 I.E.***
Thrombin L lyophilisiert
1 Durchstechflasche mit 55 - 75 mg Trockensubstanz enthält: 4 I.E.***
Thrombin (human)
Kalziumchloridlösung
1 Durchstechflasche mit 1,0 ml enthält:
Kalziumchlorid x 2H20 5,88 mg
TISSUCOL-Kit 2,0 Immuno
TISSUCOL 2,0 lyophilisiert Kleberproteinkonzentrat thermoinaktiviert 1 Durchstechflasche mit 252 - 396 mg Trockensubstanz enthält:
160 - 240 mg
Humanplasmaproteinfraktion
mit Fibrinogen
Plasmafibronectin Blutgerinnungsfaktor XIII
Aprotininlösung
1 Durchstechflasche mit 2,0 ml Lösung enthält:
Aprotinin (bovin) entsprechend 3000 KIE pro ml
Thrombin S lyophilisiert
1 Durchstechflasche mit 110 - 150 mg Trockensubstanz enthält: Thrombin (human)
Thrombin L lyophilisiert
1 Durchstechflasche mit 110 - 150 mg Trockensubstanz enthält: Thrombin (human)
Kalziumchloridlösung 1 Durchstechflasche mit 2,0 ml enthält:
Kalziumchlorid x 2H20
140 - 220 mg 4 -18 mg 20 - 100 I.E.*
6000 KIE**
1000 I.E.***
8 I.E.***
11,76 mg
TISSUCOL-Kit 5, 0 Immuno
TISSUCOL 5,0 lyophilisiert Kleberproteinkonzentrat thermoinaktiviert 1 Durchstechflasche mit 630 - 990 mg Trockensubstanz enthält:
Humanplasmaproteinfraktion mit Fibrinogen
Plasmafibronectin Blutgerinnungsfaktor XIII
Aprotininlösung
1 Durchstechflasche mit 5,0 ml Lösung enthält:
Aprotinin (bovin) entsprechend 3000 KIE pro ml
Thrombin S lyophilisiert
1 Durchstechflasche mit 275 - 375 mg Trockensubstanz enthält: Thrombin (human)
Thrombin L lyophilisiert
1 Durchstechflasche mit 275 - 375 mg Trockensubstanz enthält: Thrombin (human)
Kalziumchloridlösung 1 Durchstechflasche mit 5,0 ml enthält:
Kalziumchlorid x 2H20
400 - 600 mg 350 - 550 mg 10 - 45 mg 50 - 250 I.E.*
15000 KIE**
2500 I.E.***
20 I.E.***
29,4 mg
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver und Lösungsmittel zur Herstellung eines Fibrinklebers. Das lyophilisierte Pulver ist hygroskopisch, weiß oder leicht gelb und von pulveriger oder körniger Konsistenz; die flüssigen Bestandteile sind klare, farblose Lösungen.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Die Präparate haben - gegebenenfalls in Kombination mit resorbierbarem Kollagenvlies oder anderen geeigneten Trägermaterialien - folgende Anwendungsgebiete:
Gewebeklebung
• bei insuffizienzgefährdeter chirurgischer Naht;
• zur gas- und flüssigkeitsdichten Absicherung einer chirurgischen Naht;
• zur Einsparung von Nähten in mechanisch wenig belasteten Bereichen, bzw. Ersatz von Nähten in mechanisch nicht belasteten Bereichen um eine Verkürzung der Operationszeit und eine ungestörte Wundheilung zu erzielen;
• bei aufgrund des Gewebezustandes, der topographischen Situation oder bei einem Implantat unsicherer oder undurchführbarer chirurgischer Naht;
• zur Abdichtung von Membrandefekten (mit und ohne Trägermaterial);
• zur Fixierung von Transplantaten und Implantaten.
Blutstillung
• bei Parenchymdefekten mit diffuser Blutung (größere Gefäße sind zu ligieren, Kollagenvlies als Trägermaterial wird empfohlen);
• bei flächenhaften Blutungen aus Mikrogefäßen mit dem Risiko großer postoperativer Blutverluste oder Hämatome (gegebenenfalls mit Kollagenvlies als Trägermaterial);
• bei Blutungen, die durch chirurgische Naht oder andere Maßnahmen nicht beherrschbar sind (gegebenenfalls Kunststoffpatches oder anderes stabiles Trägermaterial verwenden);
• bei hämorrhagischen Diathesen, wenn eine Korrektur des Hämostasedefektes nicht möglich ist oder Risiken der Substitutionstherapie vermieden werden sollen;
• zur Abdichtung poröser Gefäßprothesen.
Unterstützung der Wundheilung
• bei schlecht vaskularisiertem Empfängerbett für Hauttransplantate;
• bei Hautnekrosen nach Extravasation von Zytostatika;
• bei Hautulzerationen im Rahmen aggressiver Zytostatikatherapie;
• zur Auffüllung knöcherner Defekte, vor allem auch in Verbindung mit Spongiosa.
4.2 Dosierung und Art der Anwendung
TISSUCOL-Kit Immuno darf nur von erfahrenen Chirurgen angewendet werden, die in der Anwendung von TISSUCOL-Kit Immuno geschult wurden.
Dosierung
TISSUCOL-Kit Immuno dient zur Herstellung eines biologischen Zweikomponentenklebers, entsprechend dem folgenden Schema:
TISSUCOL-Lösung
TISSUCOL lyophilisiert Kleberproteinkonzentrat thermoinaktiviert
+
Aprotininlösung
*
+
TISSUCOL-Thrombinlösung
*
Thrombin S lyophilisiert oder Thrombin L lyophilisiert_
*
Thrombinlösung
+
*
Kalziumchloridlösung
verfestigter Fibrinkleber
*
(vollständige Resorption
Die als TISSUCOL-Lösung bezeichnete Komponente entsteht durch Auflösen von TISSUCOL lyophilisiert in Aprotininlösung. Die andere Komponente, die Thrombinlösung, wird durch Auflösen von Thrombin S lyophilisiert oder Thrombin L lyophilisiert in Kalziumchloridlösung hergestellt.
Bei der Applikation, für die mehrere Methoden zur Verfügung stehen, werden die beiden Komponenten vermischt, und es entsteht ein visköses Gemisch, das rasch zu einer weißen, elastischen Masse wird.
Das erforderliche Volumen an TISSUCOL-Kit Immuno-Lösung richtet sich nach der Größe der zu klebenden oder zu beschichtenden Oberfläche bzw. nach der Größe des auszufüllenden Defektes. Außerdem hängt es von der Applikationstechnik ab.
Bei der Klebung von Flächen kann als Anhaltspunkt dienen, dass 1,0 ml TISSUCOL -Lösung für eine Fläche von mindestens 10 cm2 ausreichen. Verwendet man zur Auftragung das DUPLOJECT System mit Sprühkopf (siehe Abschnitt 6.6), so lässt sich je nach Indikation eine Fläche von 25 - 100 cm2 beschichten.
Vor der Anwendung sollte die Wundoberfläche möglichst trocken sein.
Es empfiehlt sich, möglichst dünne Schichten der TISSUCOL-Thrombinlösung aufzutragen, um eine unerwünscht langsame Resorption des Fibrinklebers zu vermeiden.
Beim Einsatz zur Gewebeklebung wird empfohlen, dass die initiale Verabreichung sofort die ganze zu verklebende Fläche umfasst.
Die Anwendung kann falls notwendig wiederholt werden. Auf jeden Fall sollte aber eine Re-Applikation auf einer bestehenden, durchpolymerisierten TISSUCOL-Kit Immuno-Schicht vermieden werden, da TISSUCOL-Kit Immuno nicht auf einer durchpolymerisierten Schicht haftet.
Wahl der Aprotininkonzentration
Damit der verfestigte Fibrinkleber nicht zu schnell lysiert wird, enthält die TISSUCOL -Lösung den Fibrinolysehemmer Aprotinin.
Bei den weitaus meisten Anwendungsgebieten benutzt man die Aprotininlösung unverdünnt, also in einer Konzentration von 3000 KIE/ml. Bei der Klebung von Nervenanastomosen ist jedoch eine Konzentration von ca. 100 KIE/ml vorzuziehen, damit der Fibrinkleber schon in kurzer Zeit (etwa 2 Tage) resorbiert und das Entstehen von Fibrosen vermieden wird.
Eine Lösung mit der Konzentration von ca. 100 KIE/ml gewinnt man durch Verdünnen der im TISSUCOL-Kit Immuno vorhandenen Aprotininlösung (siehe Abschnitt 6.6).
Wahl der Thrombinkonzentration
Wie rasch die Verfestigung des Klebers einsetzt, hängt von der Thrombinkonzentration der zweiten Kleberkomponente ab. Während bei der Wahl von Thrombin L
(4 I.E. Thrombin/ml) die Verfestigung ca. 1 Minute nach Vereinigung der Kleberkomponenten beginnt, setzt bei Verwendung von Thrombin S (500 I.E. Thrombin/ml) die Verfestigung innerhalb von Sekunden ein. Deshalb ist Thrombin L für den Fall angezeigt, dass etwas Zeit - beispielsweise zur Adaption von Klebeflächen - benötigt wird. Soll sich die TISSUCOL-Thrombinlösung hingegen rasch verfestigen (z. B. um eine Blutstillung zu erzielen), so ist Thrombin S vorzuziehen.
Art der Anwendung
Zur epiläsionalen Anwendung
Um optimale Sicherheit bei der Anwendung von TISSUCOL-Kit Immuno zu gewährleisten, sollen die folgenden Empfehlungen befolgt werden:
Bei offener Chirurgie soll ein Druckregelgerät verwendet werden, dessen Maximaldruck höchstens 2,0 bar (28,5 psi) beträgt.
Bei minimal invasiven/laparoskopischen Eingriffen soll ein Druckregelgerät verwendet werden, dessen Maximaldruck höchstens 1,5 bar (22 psi) beträgt und das ausschließlich Kohlendioxidgas verwendet.
Vor dem Aufbringen von TISSUCOL-Kit Immuno muss die Wundoberfläche mittels Standardtechniken (z. B. intermittierende Anwendung von Kompressen, Tupfern, Anwendung von Saugern) getrocknet werden.
TISSUCOL-Kit Immuno darf nur gemäß den Anweisungen und unter Verwendung der Produkte und Geräte rekonstituiert bzw. verabreicht werden, die für dieses Produkt empfohlen werden (siehe Abschnitt 6.6).
Für die Sprühapplikation siehe Abschnitte 4.4 und 6.6 mit besonderen Empfehlungen zum erforderlichen Druck und Gewebeabstand je nach Art des Eingriffs und zur Länge der Applikationshilfen.
4.3 Gegenanzeigen
TISSUCOL-Kit Immuno darf nicht intravaskulär angewendet werden, insbesondere bei koronaren Bypass-Operationen ist höchste Vorsicht geboten, um jegliches Risiko der intravasalen Anwendung zu minimieren (siehe auch Kapitel 4.8 Nebenwirkungen).
TISSUCOL-Kit Immuno darf nicht in die Nasenschleimhaut injiziert werden.
Die alleinige Anwendung von TISSUCOL-Kit Immuno ist nicht angezeigt für die Behandlung von massiven arteriellen oder venösen Blutungen.
Bekannte Überempfindlichkeit gegen Rindereiweiß oder einen der Bestandteile von TISSUCOL-Kit Immuno, einschließlich Aprotinin.
Aktuelle oder aus der Anamnese bekannte allergisch bedingte Thrombozytopenie (Typ II) auf Heparin.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Nur zur epiläsionalen Anwendung.
Bei Patienten mit allergischer Diathese bzw. Arzneimittelüberempfindlichkeit sowie Patienten, die A-protinin bereits in der Vergangenheit erhalten haben, ist eine sorgfältige Nutzen-Risiko-Abwägung nötig. Es empfiehlt sich, vor der Gabe von Aprotinin Antihistaminika zu verabreichen.
TISSUCOL-Kit Immuno darf nicht intravaskulär angewendet werden, insbesondere bei koronaren Bypass-Operationen ist höchste Vorsicht geboten, um jegliches Risiko der intravasalen Anwendung zu minimieren (siehe auch Kapitel 4.8 Nebenwirkungen). Eine unabsichtliche, intravaskuläre Verabreichung von TISSUCOL-Kit Immuno kann zu lebensbedrohlichen, thromboembolischen Komplikationen oder disseminierter intravasaler Gerinnung führen.
Eine intravasale Injektion könnte darüber hinaus bei empfindlichen Patienten Wahrscheinlichkeit und Schwere von akuten Überempfindlichkeitsreaktionen erhöhen.
Bei der Injektion in die Submucosa kann es in Einzelfällen zu einer Schädigung des Gewebes mit der Folge einer Hämatombildung kommen. Eine akute Pankreatitis kann bei Patienten mit einem intramuralen Hämatom der Duodenalwand beobachtet werden.
Abdominale Schmerzen, Übelkeit und Erbrechen innerhalb von 1 bis 3 Tagen nach der endoskopischen Blutstillung durch Injektion können Anzeichen für ein intramurales Hämatom sein.
Wenn Fibrinkleber in abgeschlossene Hohlräume eingebracht werden, sollte das Risiko von Komplikationen aufgrund einer Kompression in Betracht gezogen werden.
Vor einer Sprühanwendung von TISSUCOL-Kit Immuno mit Instrumenten anderer Hersteller wird gewarnt. Der EASYSPRAY-Druckregler und das SPRAY SET sind bei Baxter Deutschland GmbH, Unterschleißheim erhältlich.
Beim Sprühen von Fibrinkleber kommt Druckgas zur Anwendung. Die Druckgasanwendung birgt das Risiko einer Gasembolie, eines Gasemphysems oder einer Gewebs- bzw. Organruptur in sich, die lebensbedrohlich sein können.
TISSUCOL-Kit Immuno soll nur als dünne Schicht aufgetragen werden. Eine zu dicke Schicht kann die Wirksamkeit des Produkts und die Wundheilung negativ beeinflussen.
Bei der Verwendung von Sprühgeräten mit Druckgasreglern zur Verabreichung von Fibrinklebern sind lebensbedrohliche/tödliche Luft- oder Gasembolien aufgetreten. Dieses Ereignis scheint mit der Verwendung von Spray-Sets mit höherem als dem empfohlenen Druck und/oder mit einem zu geringen Abstand zur Gewebeoberfläche zusammenzuhängen. Das Risiko scheint höher zu sein, wenn Fibrinkleber mit Luft aufgesprüht werden, als beim Sprühen mit CO2 und ist daher beim Aufsprühen von TISSUCOL-Kit Immuno auf offene Operationswunden nicht auszuschließen.
Wird TISSUCOL-Kit Immuno mittels Sprühapplikation aufgetragen, muss sichergestellt werden, dass ein Druck verwendet wird, der im vom Hersteller des Sprühgeräts empfohlenen Druckbereich liegt (siehe Tabelle 6.6 für Drücke und Abstände).
TISSUCOL-Kit Immuno soll nur per Sprühapplikation verabreicht werden, wenn der Sprühabstand exakt beurteilt werden kann. Nicht näher als im empfohlenen Abstand aufsprühen.
Beim Aufsprühen von TISSUCOL-Kit Immuno sollen Änderungen von Blutdruck, Puls, Sauerstoffsättigung und endexspiratorischem CO2 überwacht werden, da die Möglichkeit einer Luftoder Gasembolie besteht (siehe auch Abschnitt 4.2).
Der EASYSPRAY-Druckregler und das SPRAY SET dürfen deshalb in umschlossenen Körperhöhlen nicht eingesetzt werden. Das Sprühen darf ausschließlich unter Sicht, bei einem Mindestabstand von 10 cm erfolgen. Für die Anwendung von TISSUCOL-Kit Immuno in der minimal invasiven Chirurgie wird der DuploSpray MIS Regulator mit den entsprechenden Applikatoren empfohlen. Für weitere Informationen ist die Gebrauchsanweisung des Duplospray MIS Geräts heranzuziehen.
Bei der Sprühapplikation müssen Gebiete, auf die kein Kleber gesprüht werden soll, abgedeckt werden. Nur einsehbare Gebiete sollten besprüht werden.
Kleberproteinlösung und/oder Thrombinlösung, die bei der Anwendung auf Gewebe außerhalb des zu klebenden Bereichs gelangt sind, sollten nach Möglichkeit entfernt werden.
Wie bei allen proteinhaltigen Präparaten sind allergische Überempfindlichkeitsreaktionen möglich. Anzeichen von Überempfindlichkeitsreaktionen können Nesselsucht, generalisierte Urtikaria, Engegefühl in der Brust, Stenoseatmung, Hypotonie und Anaphylaxie einschließen. Wenn diese Symptome auftreten, muss die Anwendung sofort abgebrochen werden. Bereits appliziertes Produkt sollte von der Operationsstelle entfernt werden.
Es müssen die derzeit gültigen Standardmaßnahmen für eine Notfallbehandlung angewandt werden.
Bei einem Schock muss die geeignete medizinische Schockbehandlung eingeleitet werden.
TISSUCOL-Kit Immuno enthält Rindereiweiß (Aprotinin). Auch bei strikt lokaler Anwendung besteht das Risiko einer anaphylaktischen Reaktion, die auf das Aprotinin zurückzuführen ist. Das Risiko scheint bei Patienten mit einer vorangegangenen Exposition erhöht zu sein, selbst wenn es zuvor gut vertragen wurde. Deshalb sollte jede Verwendung von Aprotinin oder aprotininhaltigen Produkten in der Krankenakte vermerkt werden.
Standardmaßnahmen zur Verhinderung von Infektionen, die durch aus menschlichem Blut oder Plasma hergestellten Arzneimitteln übertragen werden können, schließen die Auswahl der Spender, die Testung der Einzelspenden und der Plasmapools auf spezifische Infektionsmarker und die Durchführung effektiver Herstellungsschritte zur Inaktivierung/Abtrennung von Viren mit ein. Trotzdem sind bei der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln Infektionskrankheiten durch Übertragung von Erregern - auch bislang unbekannter Natur - nicht völlig auszuschließen.
Diese Maßnahmen werden für umhüllte Viren wie z. B. HIV, HBV und HCV für wirksam erachtet. Diese Maßnahmen können bei nicht-umhüllten Viren, wie z. B. HAV und Parvovirus B19, eingeschränkt wirksam sein. Parvovirus B19-Infektionen können bei Schwangeren (fötale Infektion) und Personen mit Immundefekten oder gesteigerter Erythropoese (z. B. hämolytische Anämie) zu schweren Erkrankungen führen.
Wird ein aus menschlichem Plasma hergestelltes TISSUCOL-Kit regelmäßig/wiederholt verabreicht, müssen geeignete Impfungen (Hepatitis A und B) in Betracht gezogen werden.
Sicherheit und Wirksamkeit des Produktes an Kindern wurde nicht untersucht.
Es wird dringend empfohlen, jede Verabreichung von TISSUCOL-Kit mit Produktnamen und Chargennummer zu dokumentieren, um die Verbindung zwischen Patient und Produktcharge herzustellen.
Es wird auf die Dokumentationspflicht gemäß Transfusionsgesetz hingewiesen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Substanzen, die oxydierend wirken (z. B. Jod, H2O2), Proteine denaturieren (z. B. Alkohol) oder Schwermetalle enthalten (z. B. Thiomersal) beeinträchtigen die Wirksamkeit des Fibrinklebers. Wenn solche Substanzen, beispielsweise als Desinfektionsmittel, verwendet werden, so sind etwaige Reste vor Beginn der Klebung mit einem sterilen Tupfer möglichst vollständig zu entfernen.
Produkte die Oxidierte Cellulose enthalten, können die Wirksamkeit von TISSUCOL-Kit Immuno beeinflussen und sollten nicht als Trägermaterialien verwendet werden.
TISSUCOL-Kit Immuno kann auch bei voll heparinisierten Patienten (z. B. bei extrakorporalem Kreislauf) angewendet werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Es ist nicht bekannt, ob die Verabreichung von TISSUCOL-Kit Immuno während der Schwangerschaft und der Stillzeit negative Auswirkungen auf Mutter und Kind haben kann. Aus diesem Grund ist während der Schwangerschaft und Stillzeit eine strenge Indikationsstellung geboten.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nicht relevant.
4.8 Nebenwirkungen
Wie bei allen proteinhaltigen Arzneimitteln kann es bei wiederholter Anwendung von TISSUCOL-Kit zum Auftreten anaphylaktischer oder anaphylaktoider Reaktionen kommen. (siehe Abschnitt 4.4).
In seltenen Fällen können diese Reaktionen auch bei Patienten bei der Erstverabreichung von Apro-tinin oder TISSUCOL-Kit Immuno auftreten.
Selbst wenn eine zweite Verabreichung gut vertragen wird, kann eine darauf folgende systemische Gabe schwere anaphylaktische Reaktionen auslösen. Die Anzeichen von allergischen/anaphylaktischen Reaktionen können reichen von Bradykardie, Tachykardie, Blutdruckabfall, Flush, Bronchospasmus, keuchender Atmung, Atemnot, Übelkeit, Urtikaria, Angioödem, Juckreiz, Erythem und Parästhesie, bis hin zu schwerer Hypotension, anaphylaktischem Schock und Tod. Bei den ersten Anzeichen oder Symptomen einer Überempfindlichkeitsreaktion ist die Anwendung sofort abzubrechen, und es sind die gebräuchlichen Notfallmaßnahmen durchzuführen. Die therapeutischen Maßnahmen richten sich nach Art und Schweregrad der allergischen Reaktion.
Bei einem Schock ist die geeignete medizinische Schockbehandlung einzuleiten.
TISSUCOL-Kit Immuno darf nicht intravaskulär angewendet werden, da dies zu anaphylaktischen und/oder thromboembolischen Komplikationen oder disseminierter intravasaler Gerinnung führen kann, die lebensbedrohlich sein können.
Speziell bei koronaren Bypass-Operationen sollte TISSCOL-Kit Immuno mit Vorsicht angewendet werden, um jegliches Risiko der intravasalen Anwendung zu minimieren. In zwei retrospektiven, nicht-randomisierten Studien der koronaren Bypass-Chirurgie zeigten jene Patienten, die Fibrinkleber erhalten haben, ein statistisch höheres Mortalitätsrisiko. Obwohl diese Studien keinen kausalen Zusammenhang belegen, kann eine Verbindung zwischen dem erhöhten Risiko und dem Einsatz von TISSUCOL-Kit Immuno nicht ausgeschlossen werden. Daher sollte dieses Produkt mit besonderer Vorsicht angewandt werden, um eine unerwünschte, intravaskuläre Verabreichung zu vermeiden.
Aufgrund des Heparingehaltes von TISSUCOL-Kit Immuno können selten Antikörper-vermittelte schwere Thrombozytopenien (Typ II) mit Thrombozytenwerten deutlich unter 100.000/pl oder einem schnellen Abfall auf weniger als 50 % des Ausgangswertes beobachtet werden. Bei nicht Sensibilisierten beginnt der Thrombozytenabfall in der Regel 6-14 Tage nach Behandlungsbeginn, bei Sensibilisierten unter Umständen innerhalb von Stunden.
Die schwere Form der Thrombozytopenie kann verbunden sein mit arteriellen und venösen Thrombo-sen/Thrombembolien, Verbrauchskoagulopathie, evtl. Hautnekrosen an der Injektionsstelle, Petechien, Purpura und Meläna.
In solchen Fällen ist TISSUCOL-Kit Immuno sofort abzusetzen. Der Patient muss darüber informiert werden, dass bei ihm auch in Zukunft keine heparinhaltigen Arzneimittel mehr angewendet werden dürfen.
Wegen der genannten gelegentlich auftretenden ungünstigen Wirkung des Heparins auf die Thrombozyten muss deren Zahl, insbesondere zu Beginn der Behandlung mit diesem Arzneimittel, engmaschig kontrolliert werden.
Zur Sicherheit vor übertragbaren Erregern, siehe Abschnitt 4.4.
Nebenwirkungen, die von klinischen Studien und aus der klinischen Anwendung berichtet wurden, sind in der nachfolgenden Tabelle zusammengefasst.
Unbekannte Häufigkeiten basieren auf Spontanberichten aus der klinischen Anwendung mit Fibirnkle-bern von Baxter.
Die Nebenwirkungen und ihre Häufigkeit werden wie folgt zusammengefasst:
Häufig: (>1/100 bis <1/10)
Gelegentlich; (>1/1.000 bis <1/100) selten: (>1/10.000 bis <1/1.000)
Nicht bekannt: (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Erkrankungen des Immunsystems |
Überempfindlichkeit einschließlich anaphylaktischer Reaktionen, anaphylaktischer Schock und folgende Symptome: Angioödem, Parästhesien, Bradykardie, Tachykardie, Flush, Bronchospasmus, Atemnot, keuchende Atmung, Urtikaria, Juckreiz und Erythem. Anaphylaktische Reaktionen und anaphylaktischer Schock einschließlich Todesfälle. |
Häufigkeit nicht bekannt |
|
Gefäßerkrankungen |
niedriger Blutdruck |
Selten |
|
Arterielle Embolien, einschließlich zerebraler Arterienverschluss, Schlag-anfälle+ |
Häufigkeit nicht bekannt | |
|
Erkrankungen des Gastrointestinaltraktes |
Übelkeit |
gelegentlich |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Verzögerte Wundheilung |
Häufigkeit nicht bekannt |
|
Untersuchungen |
erhöhter Wert an Fibrinspaltprodukten |
gelegentlich |
|
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen |
Schmerzen nach der Behandlung |
gelegentlich |
+als Ergebnis einer intravaskulären Verabreichung in den oberen Sinus des Felsenbeins
Bei der Anwendung von Fibrinklebern mit einem Sprühapplikator unter Verwendung von Druckgas ist das Auftreten lebensbedrohlicher Luft- oder Gasembolien berichtet worden, in einem Fall tödlich.
Als Symptome von Überempfindlichkeiten gegen Fibrinkleber/Hämostatika sind Reizungen am Verabreichungsort, Brustbeschwerden, Schüttelfrost, Kopfschmerzen, Lethargie, Unruhe und Erbrechen beobachtet worden.
4.9 Überdosierung
Es sind keine Fälle einer Überdosierung bekannt.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Lokale Hämostatika, ATC-Code: B02BC; Gewebekleber, ATC-Code: V03AK
Die Fibrinklebung mit obigen Arzneimitteln entspricht im Prinzip der letzten Phase der Blutgerinnung.
Fibrinogen wird durch Thrombin zu monomerem Fibrin umgesetzt. Dieses bildet durch End-zu End-und Seit-zu Seit-Anlagerung aggregiertes Fibrin S, das in 5 M Harnstoff löslich ist.
Gleichzeitig aktiviert Thrombin den Faktor XIII, der in ausreichenden Mengen in der Kleberproteinlösung vorhanden ist. Da in der verwendeten Thrombin-Lösung Kalziumchlorid enthalten ist, wird das entstehende FibrinS anschließend durch den Faktor XIIIa in polymeres harnstoffunlösliches FibrinS umgewandelt. Dabei werden kovalente Bindungen zwischen benachbarten y- und a-Ketten der Fibrinmonomere gebildet.
Die nach dem Wundverschluss einsetzende Wundheilung ist gekennzeichnet durch das Einsprossen
von Fibroblasten in das Wundgebiet, wobei das Fibrin die Funktion einer Leitschiene übernimmt, sowie die Bildung von Kapillaren. Dieser Prozess stellt ein multi-faktorielles Geschehen dar, bei dem Thrombin, Fibrin und Faktor XIII eine stimulierende Wirkung auf die Fibroblasten zeigen.
Als nächste Phase des Wundheilungsgeschehens setzt der Abbau des Fibrinnetzes durch Proteolyse und Phagozytose ein. In der Kleberproteinlösung sind geringe Mengen an Plasminogen enthalten, welches durch Kallikrein und verschiedene Gewebefaktoren zu Plasmin umgesetzt wird und somit die Fibrinolyse in Gang setzt.
Dieser Vorgang gleicht der bei jeder Wundheilung beobachteten Resorption körpereigenen Fibrins.
Ein zu rascher fibrinolytischer Abbau des verfestigten Fibrinklebers wird jedoch durch die Zugabe von Aprotinin als Antifibrinolytikum gehemmt.
5.2 Pharmakokinetische Eigenschaften
TISSUCOL-Kit Immuno darf nur epiläsional angewendet werden. Intravasale Anwendung ist kontraindiziert. Deshalb wurden keine intravasalen Pharmakokinetikstudien am Menschen durchgeführt.
TISSUCOL-Kit wird wie körpereigenes Fibrin durch Fibrinolyse und Phagozytose abgebaut.
TISSUCOL-Kit Immuno darf nur lokal angewendet werden und ist sofort verfügbar.
5.3 Präklinische Daten zur Sicherheit
Toxizitätsstudien mit einmaliger Verabreichung haben keine spezielle Gefährdung für den Menschen gezeigt, die über die in anderen Abschnitten der Fachinformation genannten Informationen hinausgeht. Aufgrund der Beschaffenheit sowie der besonderen Art der Anwendung wurden keine Studien zur Mu-tagenität und Kanzerogenität durchgeführt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
1 Durchstechflasche mit TISSUCOL lyophilisiert enthält: Natriumchlorid, Natriumzitrat, Aprotinin, Glyzin, Heparin, Triton, Humanalbumin, Plasminogen
1 Durchstechflasche mit Aprotininlösung enthält: Natriumchlorid, Wasser für Injektionszwecke, Benzylalkohol
1 Durchstcchflaschc mit Thrombin S lyophilisiert enthält: Natriumchlorid, Glyzin, Humanalbumin 1 Durchstcchflaschc mit Thrombin L lyophilisiert enthält: Natriumchlorid, Glyzin, Humanalbumin
1 Durchstechflasche mit Kalziumchloridlösung enthält: Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Dieses Arzneimittel darf nicht mit anderen Medikamenten gemischt werden.
6.3 Dauer der Haltbarkeit
2 Jahre
Nach Ablauf des Verfalldatums dürfen die Präparate nicht mehr angewendet werden. Nach Auflösung sind die beiden Kleberkomponenten innerhalb von 4 Stunden zu verwenden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (2°C bis 8°C).
6.5 Art und Inhalt des Behältnisses
Von TISSUCOL-Kit Immuno stehen folgende Gebrauchseinheiten zur Verfügung: TISSUCOL-Kit 1,0 Immuno TISSUCOL-Kit 2,0 Immuno TISSUCOL-Kit 5,0 Immuno
Kombinationspackungen zur Herstellung von 1,0 ml, 2,0 ml und 5,0 ml TISSUCOL -Lösung.
Jede Kombinationspackung ist mit einem Gerätesatz zur Herstellung und Applikation der Kleberkomponenten und dem Applikationssystem DUPLOJECT ausgestattet.
Bei Baxter Deutschland GmbH, Unterschleißheim kann folgendes Zubehör bezogen werden:
DUPLOCATH 25
Kombiniertes Wärme- und Rührgerät zur Auflösung des lyophilisierten TISSUCOL Immuno Druckregler
Druckgassteuergerät mit Fußschalter, Manometer, Reduzierventil und Druckschlauch.
Steriler Einmalgerätesatz, bestehend aus einem Verbindungsschlauch mit Sterilfilter und zwei Sprühköpfen, zum Versprühen von TISSUCOL-Kit Immuno mittels DUPLOJECT und Sprühkopf auf große Wundflächen.
Wird mit den TISSUCOL-Kit Immuno -Handelsformen mitgeliefert.
Applikations-Katheter, lang
Einmalgerät zur Anwendung von TISSUCOL-Kit Immuno in schwer zugänglichen Bereichen des Operationsfeldes. Verwendbar auch in Kombination mit einem Endoskop, flexibel, röntgendicht.
Länge: ca. 180 cm, 0 ca. 5 french (ca. 0,17 cm)
Der Applikations-Katheter 180 kann auf jede benötigte Länge gekürzt werden.
Applikations-Katheter, kurz
Einmalgerät zur Anwendung von TISSUCOL-Kit Immun in schwer zugänglichen Bereichen des Operationsfeldes. Verwendbar auch in Kombination mit einem Trokar.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Die Gummistopfen der Präparateflaschen sind - wie allgemein üblich - vor dem Durchstechen zu desinfizieren. Im Übrigen ist der gesamte im TISSUCOL-Kit Immuno vorhandene Gerätesatz sterilisiert, so dass die Voraussetzungen für ein steriles Arbeiten - auch bei der Herstellung der Kleberkomponenten gegeben sind.
Verdünnen der Aprotininlösung beim Kleben von Nervenanastomosen
Wie unter 4.2 im Abschnitt Dosierung und Art der Anwendung erläutert, muss die Aprotininlösung beim Kleben von Nervenanastomosen auf ca. 100 KIE/ml verdünnt werden. Zu diesem Zweck gibt man 0,2 ml unverdünnte Aprotininlösung in 5 ml Wasser für Injektionszwecke (Aqua ad iniectabilia). Dabei bedient man sich einer blau markierten 2 ml-Spritze bzw. 5 ml-Spritze.
Nach dem Überführen der unverdünnten Aprotininlösung in das Wasser für Injektionszwecke schwenkt man die Wasserflasche mehrmals um, damit eine gleichmäßige Verteilung des Aprotinins eintritt. Die verdünnte Aprotininlösung ist dann sofort weiter zu verwenden.
Wo im Folgenden von Aprotininlösung die Rede ist, kann es sich um das verdünnte oder das unverdünnte Präparat handeln.
Herstellung der TISSUCOL-Lösung (1. Kleberkomponente)
Das Auflösen von TISSUCOL lyophilisiert kann auf zwei Wegen erfolgen:
• mit Hilfe des kombinierten Wärme- und Rührgerätes FIBRINOTHERM,
• unter Verwendung eines auf 37 °C temperierten Wasserbades.
Zur Erleichterung des Lösevorganges bei Verwendung des FIBRINOTHERM enthält die Flasche mit TISSUCOL lyophilisiert einen Rührpropeller.
Auflösen mit dem FIBRINOTHERM
FIBRINOTHERM ermöglicht die schnelle Auflösung von TISSUCOL lyophilisiert bei einer konstanten Temperatur von 37 °C mit Hilfe des in der TISSUCOL-Flasche vorhandenen Rührpropellers.
Folgendes Vorgehen wird empfohlen:
1. Die Schalter für Wärmevorrichtung und Magnetrührer einschalten.
2. Aprotininlösung in die Flasche mit dem lyophilisierten TISSUCOL überführen. Dazu ist eine blau markierte Spritze zu verwenden, gegebenenfalls nach Kanülenwechsel jene, die zur Herstellung der verdünnten Aprotininlösung benutzt wurde. Das lyophilisierte TISSUCOL ist durch leichtes Schwenken möglichst vollkommen zu benetzen.
Die TISSUCOL-Flasche ist unter Verwendung des passenden Adapterringes in die größte Bohrung zu stellen (Magnetrührer).
3. Den Lösungsvorgang überprüfen. Bis zur ersten Kontrolle wartet man zweckmäßigerweise etwa 6 Minuten. Die Auflösung von TISSUCOL ist dann abgeschlossen, wenn beim Betrachten der Lösung im durchscheinenden Licht keine ungelösten Partikel erkennbar sind. Andernfalls muss der Lösungsvorgang verlängert werden.
4. Nach dem Auflösen wird die TISSUCOL-Lösung mit einer blau markierten Spritze der TISSUCOL-Flasche entnommen. Eine Kanüle, die durch den Gummistopfen der TISSUCOL -Flasche gesteckt wird, gleicht das Vakuum in der Flasche aus und erleichtert auf diese Weise das Aufziehen der TISSUCOL-Lösung. Gleichzeitig mit dem Vakuum-Ausgleich fällt der Schaum zusammen.
Sollte die TISSUCOL-Lösung nach dem Auflösen nicht unmittelbar verwendet werden, so belässt man sie bei abgeschaltetem Rührwerk und der Temperatur von 37 °C in der TISSUCOL-Flasche (maximal 4 Stunden). Vor dem Aufziehen in die blau markierte Spritze ist das Rührwerk dann noch einmal kurz einzuschalten, um die Homogenität der Lösung zu gewährleisten.
Auflösen unter Verwendung eines Wasserbades
1. Sowohl die Flasche mit TISSUCOL lyophilisiert als auch die Flasche mit Aprotininlösung sind in ein auf 37 °C vorgewärmtes Wasserbad zu stellen und dort 10 bis 15 Minuten zu belassen. (Nicht über 40 °C erwärmen! Die Einhaltung der Temperatur ist ohne Thermostat praktisch nicht möglich.)
2. Anschließend wird die Aprotininlösung in die Flasche mit dem lyophilisierten TISSUCOL überführt. Dazu ist eine blau markierte Spritze zu verwenden.
3. Danach stellt man die TISSUCOL-Flasche für eine Minute wieder in das Wasserbad mit 37 °C.
4. Anschließend folgt ein kurzes, kräftiges Schwenken der TISSUCOL-Flasche, wobei jedoch zu viel Schaumbildung zu vermeiden ist. Daraufhin wird die Flasche für 10 bis 15 Minuten erneut in das Wasserbad mit 37 °C gestellt.
5. Danach ist zu prüfen, ob die Auflösung des lyophilisierten TISSUCOL abgeschlossen ist. Das ist dann der Fall, wenn beim Betrachten der Lösung im durchscheinenden Licht keine ungelösten Partikel erkennbar sind. Andernfalls muss der Lösungsvorgang für einige Minuten verlängert werden.
6. Nach dem Auflösen wird die TISSUCOL-Lösung mit einer blau markierten Spritze der TISSUCOL-Flasche entnommen (Eine Kanüle, die durch den Gummistopfen der TISSUCOL-Flasche gesteckt wird, gleicht das Vakuum in der Flasche aus und erleichtert auf diese Weise das Aufziehen der TISSUCOL-Lösung).
Sollte die TISSUCOL-Lösung nach dem Auflösen nicht unmittelbar verwendet werden, so belässt man sie in der TISSUCOL-Flasche bei 37 °C (maximal 4 Stunden). Vor dem Aufziehen in die blau markierte Spritze ist die TISSUCOL-Flasche dann, unter Vermeidung von Schaumbildung kurz zu schwenken, um die Homogenität der Lösung zu gewährleisten.
Herstellung der Thrombinlösung (2. Kleberkomponente)
Nach der Wahl der geeigneten Thrombinkonzentration wird der gesamte Inhalt der Durchstechflasche mit Kalziumchloridlösung in die Flasche mit Thrombin S lyophilisiert bzw. Thrombin L lyophilisiert überführt. Dazu benutzt man eine der schwarz markierten Spritzen.
Spritzen bzw. Kanülen, die zur Auflösung von Thrombin S lyophilisiert oder Thrombin L lyophilisiert verwendet wurden, dürfen auf keinen Fall zum Verdünnen der Aprotininlösung oder zum Auflösen des lyophilisierten TISSUCOL verwendet werden, da dadurch eine vorzeitige Verfestigung des Fibrinklebers ausgelöst wird.
Nach kurzem Schwenken ist die Trockensubstanz gelöst. Die Lösung wird dann in eine Bohrung des auf 37 °C vorgewärmten FIBRINOTHERM bzw. in das entsprechende Wasserbad gestellt. Sie ist nach etwa 6 bis 8 Minuten verwendbar. Gebraucht man die Lösung nicht sofort, wird sie bei 37 °C belassen (maximal 4 Stunden). Man entnimmt die Thrombinlösung vor Gebrauch mit der zweiten schwarz markierten Spritze.
Applikationsmethoden2
Die Applikation von TISSUCOL-Kit Immuno erfolgt mit dem DUPLOJECT-System, wobei sich die folgenden Applikationsmethoden unterscheiden lassen:
• Simultane Applikation mit DUPLOJECT-System und Applikationskanüle, siehe 6.6.1.
• Simultane Applikation mit DUPLOJECT-System und Applikations-Katheter, siehe 6.6.2.
• Sprühapplikation, siehe 6.6.3.
• Lokale Applikation mit Injektionsnadel, siehe 6.6.4.
• Applikation mit Trägermaterial, siehe 6.6.5.
Soweit Handschuhe und Instrumente mit der Kleberproteinlösung oder dem Gemisch in Berührung kommen, sollen sie vorher mit einer sterilen Kochsalzlösung angefeuchtet werden, um ein Haftenbleiben des Klebers zu vermeiden.
Die zu verklebenden Teile sind nach dem Auftragen des Gemisches rasch zu adaptieren und für mindestens 2 Minuten unter leichter Kompression zu halten, um eine ausreichende Polymerisation zu erreichen.
Speziell im Falle der Klebung von Flächen ist auf dünne Schichten des Gemisches zu achten.
Eine getrennte, sequenzielle Anwendung der beiden Komponenten von TISSUCOL-Kit Immuno sollte vermieden werden.
6.6.1 Simultane Applikation mit DUPLOJECT-System und Applikationskanüle
Das sterile DUPLOJECT-System besteht aus einer Halterung für die beiden Fertigspritzen und einem gemeinsamen Kolben, wodurch bei der Applikation gleiche Mengen der beiden Kleberkomponenten über ein gemeinsames Anschlussstück in einer Applikationskanüle durchmischt werden.
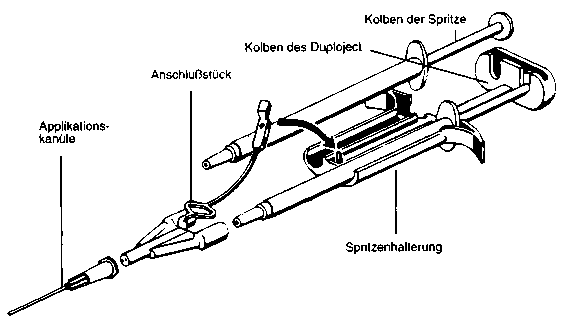
Arbeitsanleitung:
1. Die Verschlusskappen der beiden Spritzen entfernen.
2. Die Konusse beider Spritzen mit einem der beigepackten Anschlussstücke verbinden. Dabei auf festen Halt achten. Anschlussstück mit Sicherungslasche an der Spritzenhalterung fixieren.
3. Eine der beigepackten Applikationskanülen auf das Anschlussstück stecken.
Die in den Spritzen, im Anschlussstück und in der Kanüle befindliche Luft erst bei der Applikation herausdrücken, da es sonst schon vorher zu einer Verklebung der Applikationskanüle kommen kann.
4. Bei der Klebung von Flächen: Das Gemisch auf eine Fläche der zu verklebenden Teile dünn, aber möglichst lückenlos auftragen.
Überschüssiges Produkt soll vom Verabreichungsort entfernt werden.
Wenn TISSUCOL-Kit Immuno mittels eines Sprühgerätes aufgetragen wird, stellen Sie bitte sicher, dass sich der Druck nur in dem vom Gerätehersteller empfohlenen Bereich befindet. Ein Druck von 1,4-1,7 bar sollte dabei nicht überschritten werden. Halten Sie den vom Gerätehersteller angegebenen Abstand vom Gewebe ein. Er sollte mindestens 10-15 cm betragen. Beim Versprühen von TISSUCOL-Kit Immuno sollten wegen der Möglichkeit einer Gasembolie Blutdruck, Pulsschlag, Sauerstoffsättigung und endexpiratorischer CO2-Partialdruck überwacht werden.
Zur Beachtung:
Wird die Anwendung unterbrochen, so muss bei Wiederaufnahme der Klebung die gebrauchte Applikationskanüle durch eine neue ersetzt werden (3 Reservekanülen sind beigepackt). Die Applikationskanüle sollte aber erst unmittelbar vor der Weiterführung der Anwendung ausgetauscht werden, da es sonst zur Verklebung der Austrittsöffnung des Anschlussstückes kommen kann (in einem solchen Fall ist das beigepackte Reserve-anschluss-Stück zu verwenden).
Wenn sehr kleine Volumina (1 bis 2 Tropfen) von TISSUCOL-Kit Immuno verabreicht werden, müssen die ersten Tropfen unmittelbar vor der Verabreichung aus der Applikationskanüle herausgedrückt und verworfen werden, um die Anwendung eines ausreichend gemischten Produktes sicherzustellen.
Es ist möglich, das Gemisch ohne Applikationskanüle direkt aus dem Anschlussstück aufzutragen. Während einer etwaigen Unterbrechung der Anwendung kann sich an der Austrittsöffnung ein Fibrin-clot bilden. Dieser lässt sich im Allgemeinen leicht entfernen. Sonst ist auch in diesem Falle das beigepackte Reserveanschluss-Stück zu benutzen.
6.6.2 Simultane Applikation mit DUPLOJECT-System und Applikations-Katheter
Zur Anwendung in schwer zugänglichen Bereichen des Operationsfeldes und zur endoskopischen Anwendung stehen Applikations-Katheter zur Verfügung. Eine ausführliche Beschreibung dieser Anwendungsmethode ist den Gerätesätzen DUPLOCATH 25 bzw. DUPLOCATH 180 beigepackt.
6.6.3 Sprühapplikation
Diese Methode eignet sich besonders zum Besprühen größerer Flächen (z. B. bei Hauttransplantationen) und zur Stillung diffuser Blutungen.
Eine ausführliche Beschreibung dieser Anwendungsmethode ist dem Gerätesatz SPRAY SET beigepackt.
Wird TISSUCOL-Kit Immuno mithilfe eines Sprühgeräts aufgetragen, muss sichergestellt werden, dass der Druck und der Gewebeabstand innerhalb der folgenden, vom Hersteller empfohlenen Bereiche liegen:
|
Empfohlener Druck, Gewebeabstand und Sprühgeräte für die Applikation von TISSUCOL Duo S Immuno | |||||
|
Art der Chirurgie |
Zu verwendendes Sprühset |
Zu verwendende Applikationshilfe |
Zu verwendender Druckregler |
Empfohlener Abstand vom Zielgewebe |
Empfohlener Sprühdruck |
|
Offene Wunde |
Duploject Spray Set |
n. z. |
Tissomat |
10-15 cm |
1,5-2,0 bar (21,5-28,5 psi) |
|
Tissucol Spray Set |
n. z. |
EasySpray |
10-15 cm |
1,5-2,0 bar (21,5-28,5 psi) | |
|
Laparoskopie/ minimal invasive Eingriffe |
n. z. |
Duplospray MIS Applikator 20 cm |
Duplospray MIS Regulator |
2-5 cm |
1,2-1,5 bar (18-22 psi) |
|
Duplospray MIS Regulator NIST B11 | |||||
|
Duplospray MIS Applikator 30 cm |
Duplospray MIS Regulator | ||||
|
Duplospray MIS Regulator NIST B11 | |||||
|
Duplospray MIS Applikator 40 cm |
Duplospray MIS Regulator | ||||
|
Duplospray MIS Regulator NIST B11 | |||||
|
Austauschbare Spitze |
Duplospray MIS Regulator | ||||
|
Duplospray MIS Regulator NIST B11 | |||||
Beim Aufsprühen von TISSUCOL-Kit Immuno sollen Änderungen von Blutdruck, Puls, Sauerstoffsättigung und endexspiratorischem CO2 überwacht werden, da die Möglichkeit einer Luftoder Gasembolie besteht (siehe Abschnitte 4.2 und 4.4).
6.6.4 Lokale Applikation mit Injektionsnadel
Die Blutungsstelle wird mit TISSUCOL-Kit Immuno umspritzt. Es hat sich bewährt, je nach Stärke der Blutung und Größe der Blutungsstelle 2 ml bis 4 ml TISSUCOL-Kit Immuno auf mehrere Depots zu verteilen. Die den Injektionsgeräten beigepackten Gebrauchsanweisungen müssen beachtet werden.
6.6.5 Applikation mit Trägermaterial
Bei diffusen, kapillären Blutungen empfiehlt es sich, Kleberprotein- und Thrombinlösung auf Trägermaterialien wie Kollagenvlies aufzutragen, um zu vermeiden, dass die Kleberkomponenten vor der Verfestigung fortgeschwemmt werden. Nach dem Auftragen des Gemisches (bzw. der Kleberprotein-und der Thrombinlösung) legt man das Trägermaterial sofort auf die Wundfläche. Dabei sind gleiche Mengen der beiden Komponenten zu verwenden.
Nicht verbrauchte Lösungen müssen fachgerecht entsorgt werden.
7. INHABER DER ZULASSUNG
Baxter Deutschland GmbH
Edisonstraße 4
85716 Unterschleißheim
Tel.: 089/31701-0
E-Mail-Adresse: info_de@baxter.com
8. ZULASSUNGSNUMMER(N)
2717.01.00
2717.02.00
2717.03.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
27. Dezember 1982
DATUM Verlängerung der Zulassung
28. September 1992
10. STAND DER INFORMATION
März 2013
11. SONSTIGE HINWEISE
Herkunftsländer der zur Produktion verwendeten Plasmen
Deutschland, Finnland, Norwegen, Österreich, Schweden, Schweiz,Tschechien und Vereinigte Staaten von Amerika.
12. VERSCHREIBUNGSSTATUS / APOTHEKENPFLICHT
Verschreibungspflichtig
Der TISSOMAT ist aber zwar noch im Handel, wird von Baxter aber nicht mehr vertrieben,
Die hier beschriebenen Applikationsmethoden lassen sich in unterschiedlicher Weise variieren, wie man der Literatur entnehmen kann.