Trospium 15 Mg Filmtabletten Pfleger
Seite 1
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SmPC)
PFLEGER
Trospium 15 mg Filmtabletten Pfleger
1. Bezeichnung des Arzneimittels
Trospium 15 mg Filmtabletten Pfleger
2. Qualitative und quantitative Zusammensetzung
1 Filmtablette enthält 15 mg Trospiumchlorid.
Sonstiger Bestandteil mit bekannter Wirkung: 1 Filmtablette enthält 100 mg LactoseMonohydrat.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. Darreichungsform
Filmtablette
Weiße, runde, bikonvexe Filmtablette mit einer Spezial-Bruchkerbe „SNAP-TAB" auf einer Seite und der Prägung „0" auf der anderen Seite. Die Tablette kann in gleiche Dosen geteilt werden.
4. Klinische Angaben
4.1 Anwendungsgebiete
Zur Behandlung der Detrusor-Instabilität oder der Detrusor-Hyperreflexie mit den Symptomen Pollakisurie, imperativer Harndrang und Dranginkontinenz.
4.2 Dosierung und Art der Anwendung
Die empfohlene Tagesdosierung beträgt 45 mg Trospiumchlorid. Nach Abwägung von individueller Wirksamkeit und Verträglichkeit kann die Tagesdosierung vom behandelnden Arzt auf 30 mg gesenkt werden. Die Dosierung erfolgt wie in nachfolgender Tabelle vorgegeben.
|
Tagesdosis |
Dosierung/Tag |
entsprechend Einzeldosis |
|
45 mg |
3-mal täglich 1 Filmtablette |
15 mg Trospiumchlorid |
|
(empfohlene |
oder | |
|
Tagesdosis) |
morgens 2 Filmtabletten und |
30 mg Trospiumchlorid |
|
abends 1 Filmtablette |
15 mg Trospiumchlorid | |
|
30 mg |
2-mal täglich 1 Filmtablette |
15 mg Trospiumchlorid |
Patienten mit eingeschränkter Nierenfunktion
Bei stark eingeschränkter Nierenfunktion (Kreatinin-Clearance zwischen 10 und 30 ml/min/1,73m2) sollte eine Tagesdosis von 20 mg nicht überschritten werden.
Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit leichter bis mäßiger Beeinträchtigung der Leberfunktion (Child-Pugh 5 -6 bzw. 7 - 9) erscheint eine Dosisanpassung nicht notwendig (siehe Abschnitt 5.2 Pharmakokinetische Eigenschaften).
Studien für Patienten mit schwerer Leberfunktionsstörung (Child-Pugh > 10; class C) wurden nicht durchgeführt, so dass in diesen Fällen eine Behandlung nicht empfohlen wird.
Anwendung bei Kindern:
Die Behandlung von Kindern unter 12 Jahren wird nicht empfohlen, da keine Daten vorliegen.
Art und Dauer der Anwendung
Die Filmtabletten können wie in der Abbildung dargestellt in zwei Teile geteilt werden. Dazu die Tablette auf eine harte Unterlage legen und mit dem Finger Druck auf die Bruchkerbe ausüben (kurz und kräftig drücken), so dass die Tablette in zwei gleiche Teile geteilt werden kann.
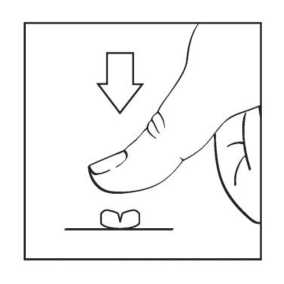
Die Filmtabletten oder deren Teilstücke sollten mit einer ausreichenden Menge an Flüssigkeit vor einer Mahlzeit auf nüchternen Magen eingenommen werden.
Die Notwendigkeit der Weiterbehandlung sollte in regelmäßigen Abständen von 3 - 6 Monaten überprüft werden.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen den Wirkstoff T rospiumchlorid oder einen der in Abschnitt 6.1. genannten sonstigen Bestandteile
- Harnverhaltung
- Engwinkelglaukom
- Tachyarrhythmie
- Myasthenia gravis
- schwerer chronisch entzündlicher Darmerkrankung (Colitis ulcerosa und Morbus Crohn)
- toxischem Megakolon
- dialysepflichtiger Niereninsuffizienz (Kreatinin-Clearance < 10 ml/min/1,73m2).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Trospiumchlorid sollte bei Patienten
- mit obstruktiven Zuständen des Gastrointestinaltraktes (z.B. Pylorusstenose)
- mit Behinderung des Harnabflusses mit dem Risiko der Restharnbildung
- mit autonomer Neuropathie
- mit einer Hiatushernie mit Refluxösophagitis
bei denen eine schnelle Herzschlagfolge nicht erwünscht ist, z.B. jenen mit Hyperthyreose, koronarer Herzkrankheit und Herzinsuffizienz
nur mit Vorsicht angewendet werden.
Da keine Daten zur Verwendung von Trospiumchlorid bei schweren Leberfunktionsstörungen vorliegen, wird von der Anwendung bei diesen Patienten abgeraten. Bei Patienten mit leichter bis mäßiger Beeinträchtigung der Leberfunktion ist Vorsicht geboten.
Trospiumchlorid wird hauptsächlich über die Nieren ausgeschieden. Bei Patienten mit starker Einschränkung der Nierenfunktion wurden beträchtliche Erhöhungen der Plasmaspiegel beobachtet. Deshalb sollte in dieser Patientengruppe, aber auch bei leichter bis mäßiger Einschränkung der Nierenfunktion mit Vorsicht behandelt werden.
Vor Beginn einer Therapie sollten organische Ursachen für Pollakisurie und Drangsymptomatik, wie Herz- oder Nierenkrankheiten, Polydipsie, sowie Infektionen und Tumoren der Harnorgane ausgeschlossen werden.
Patienten mit der seltenen hereditären Galaktose-Intoleranz, Lactase-Mangel oder Glucose-Galaktose-Malabsorption sollten Trospium 15 mg Filmtabletten Pfleger nicht einnehmen.
Kinder
Trospium 15 mg Tabletten Pfleger werden für Kinder unter 12 Jahren nicht empfohlen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Mögliche Wechselwirkungen sind
- Verstärkung der anticholinergen Wirkung von Amantadin, trizyklischen Antidepressiva, Chinidin, Antihistaminika und Disopyramid sowie
- Verstärkung der tachykarden Wirkung von Beta-Sympathomimetika.
- Abschwächung der Wirkung von Prokinetika (z.B. Metoclopramid, Cisaprid).
Da Trospiumchlorid die gastrointestinale Motilität und Sekretion beeinflussen kann, kann die Möglichkeit nicht ausgeschlossen werden, dass die Resorption anderer, gleichzeitig eingenommener Medikamente verändert wird.
Bei gleichzeitiger Einnahme von Medikamenten, die Stoffe wie Guar, Colestyramin und Colestipol enthalten, kann nicht ausgeschlossen werden, dass die Resorption von Trospiumchlorid verringert wird. Deshalb wird die gleichzeitige Anwendung von Medikamenten, die diese Stoffe enthalten, nicht empfohlen.
Untersuchungen zu stoffwechselbedingten Wechselwirkungen mit Trospiumchlorid wurden in vitro mit Cytochrom-P-450 Enzymen, die am Medikamentenstoffwechsel beteiligt sind, durchgeführt (P450 1A2, 2A6, 2C9, 2C19, 2D6, 2E1, 3A4). Dabei wurde kein Einfluss von Trospiumchlorid auf deren metabolische Aktivität festgestellt. Da Trospiumchlorid nur zu einem geringen Teil verstoffwechselt wird und eine Esterhydrolyse den einzigen relevanten Stoffwechselweg darstellt, werden keine stoffwechselbedingten Wechselwirkungen erwartet.
Zudem ergaben sich weder aus klinischen Studien noch aus der Arzneimittelüberwachung Erkenntnisse, welche auf klinisch relevante Wechselwirkungen schließen lassen.
4.6 Fertilität, Schwangerschaft und Stillzeit
In tierexperimentellen Untersuchungen wurden keine Hinweise darauf gefunden, dass Trospiumchlorid schädliche Effekte auf die Schwangerschaft, die embryonale und fötale Entwicklung, die Geburt oder die nachgeburtliche Entwicklung ausüben könnte.
Dennoch sollte Trospium 15 mg Filmtabletten Pfleger in der Schwangerschaft und Stillzeit nur unter strenger Indikationsstellung angewandt werden, da keine Erfahrungen über die Anwendung beim Menschen während der Schwangerschaft und Stillzeit vorliegen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Durch Störungen der Akkommodation kann es zu einer Beeinträchtigung der Fähigkeit zur aktiven Teilnahme am Straßenverkehr und zur Bedienung von Maschinen
4.8 Nebenwirkungen
Die bei der Behandlung mit Trospiumchlorid beobachteten Nebenwirkungen werden vorwiegend durch die typischen anticholinergen Wirkungen verursacht wie Mundtrockenheit, Dyspepsie und Verstopfung.
In einer kontrollierten klinischen Studie zu Trospiumchlorid 30 mg Filmtabletten wurden mit einer Häufigkeit von > 1 % als unerwünschte Ereignisse Mundtrockenheit (4,1%), Bauchschmerzen (2,4%), Verstopfung (2,1%), Übelkeit (1,2 %), Schwindel (1,2 %) und Kopfschmerz (1,1 %) festgestellt mit einem zumindest möglichen Kausalzusammenhang.
Die nach der Markteinführung der Trospiumchlorid-haltigen Arzneimittel festgestellten Nebenwirkungen sind entsprechend den Häufigkeitsgruppen und Systemorganklassen in nachfolgender Tabelle ausgewiesen.
|
System organklasse |
Sehr häufig (> 1/10) |
Häufig (> 1/100 bis < 1/10) |
Gelegentlich (> 1/1.000 bis < 1/100) |
Selten (> 1/10.000 bis < 1/1.000) |
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) |
|
Erkrankungen des Immunsystems |
Anaphylaxie |
StevensJohnsonSyndrom (SJS), toxischepidermale Nekrolyse (TEN) | |||
|
Augen erkrankungen |
Störung der Akkommodation (besonders bei Patienten, die hyperop und nicht ausreichend korrigiert sind) | ||||
|
Herz erkrankungen |
Tachykardie |
Tachy- arrhythmie | |||
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Dyspnoe | ||||
|
Erkrankungen des Gastrointestinal trakts |
Mundtrockenheit |
Dyspepsie, Verstopfung, Bauch schmerzen, Übelkeit |
Diarrhö, Flatulenz | ||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Ausschlag |
Angioödem | |||
|
Erkrankungen der Nieren und Harnwege |
Störungen der Harnentleerung (z.B. Restharnbildung) |
Harn verhaltung | |||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungs ort |
Schwäche, Brustschmerzen | ||||
|
Untersuchungen |
Milder bis mäßiger Anstieg der Trans-aminasen |
4.9 Überdosierung
Als höchste Einzeldosis wurden gesunden Probanden 360 mg Trospiumchlorid oral verabreicht. Hierbei traten Mundtrockenheit, Tachykardie und Miktionsbeschwerden verstärkt als Nebenwirkungen auf. Fälle schwerwiegender Überdosierung oder Vergiftung mit Trospiumchlorid sind bisher nicht bekannt geworden.
Als Zeichen einer Überdosierung sind verstärkte anticholinerge Symptome wie Sehstörungen, Tachykardie, Mundtrockenheit und Hautrötung zu erwarten.
Bei Vorliegen einer Vergiftung sollten folgende Maßnahmen ergriffen werden:
- Magenspülung und Verminderung der Resorption (z. B. Aktivkohle)
- Lokale Gabe von Pilocarpin bei Glaukomkranken
- Katheterisierung bei Harnverhalt
- Gabe eines Parasympathomimetikums bei schweren Symptomen (z. B. Neostigmin)
- Gabe von Betablockern bei ungenügendem Ansprechen, ausgeprägter Tachykardie und/oder Kreislaufinstabilität (z. B. initial 1 mg Propranolol i.v. unter EKG- und Blutdruckkontrolle).
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Spasmolytikum, Urologikum ATC- Code: GO4B D09
Trospiumchlorid, ein quartäres Ammoniumderivat des Nortropanols, gehört zur Stoffgruppe der Parasympatholytika oder Anticholinergika. Der Wirkstoff konkurriert konzentrationsabhängig und kompetitiv mit der körpereigenen Überträgersubstanz Acetylcholin um postsynaptische Bindungsstellen.
Trospiumchlorid besitzt eine hohe Affinität zu den M1- und den M3-Rezeptoren und eine vergleichsweise etwas geringere Affinität zu den M2-Rezeptoren und bindet vernachlässigbar gering an nicotinische Rezeptoren.
Für die anticholinerge Wirkung von Trospiumchlorid ist vor allem der über die Muskarin-Rezeptoren vermittelte relaxierende Effekt an glattmuskulären Geweben und Organen wesentlich.
Trospiumchlorid vermindert den Tonus der glatten Muskeln im Bereich des MagenDarm- und des Urogenitaltraktes. Es hemmt die Bronchial-, Speichel- und Schweißsekretion und lähmt die Akkommodation. Zentrale Effekte wurden bislang nicht beobachtet.
5.2 Pharmakokinetische Eigenschaften
Nach oraler Applikation von Trospiumchlorid-Tabletten werden nach 4 - 6 Stunden maximale Blutspiegelwerte erreicht. Die Eliminationshalbwertzeit ist sehr variabel und beträgt bei oraler Verabreichung im Mittel 5 - 18 Stunden. Es tritt keine Akkumulation auf. Die Plasmaproteinbindung beträgt 50 - 80 %. Im Dosisbereich von 20 bis 60 mg als Einzeldosis sind die Plasmaspiegel proportional zur verabreichten Dosis. Die überwiegende Menge des systemisch verfügbaren Trospiumchlorids wird unverändert, ein geringerer Teil (ca. 10 %) als Spiroalkohol, dem durch Hydrolyse der Esterbindung entstehenden Metaboliten, renal ausgeschieden.
Besondere Patientengruppen
Pharmakokinetische Daten ergaben keine wesentlichen Unterschiede bei älteren Patienten, sowie keine Geschlechtsunterschiede.
In einer Studie bei Patienten mit schwerer Einschränkung der Nierenfunktion (Kreatinin-Clearance 8 -32 ml/min) war die durchschnittliche AUC 4-fach und die Cmax 2-fach erhöht. Die Halbwertzeit war gegenüber gesunden Personen 2-fach verlängert. Es sind keine Studien bei Patienten mit geringerem Grad der Einschränkung der Nierenfunktion bekannt.
Ergebnisse einer Pharmakokinetik-Studie an Patienten mit leichter bis mäßiger Beeinträchtigung der Leberfunktion lassen keine Notwendigkeit einer Dosisanpassung bei dieser Patientengruppe erkennen.
5.3. Präklinische Daten zur Sicherheit
Toxikologische Eigenschaften
a) Mutagenes und tumorerzeugendes Potenzial
Trospiumchlorid zeigte in vitro und in vivo keine mutagenen Wirkungen.
Langzeitkanzerogenitätsstudien an Ratten und Mäusen ergaben keine Hinweise auf ein tumorerzeugendes Potenzial.
b) Reproduktionsstoxizität
Embryotoxizitätsstudien an Ratten und Kaninchen haben keine Hinweise auf teratogene oder andere embryotoxische Wirkungen ergeben. Entwicklung der Feten, Geburtsvorgang, postnatale Entwicklung der Nachkommen sowie Fertilität bei Ratten wurden nicht beeinträchtigt.
Trospiumchlorid passiert bei der Ratte die Plazenta und geht in die Muttermilch über. Erfahrungen über die Anwendung beim Menschen während der Schwangerschaft und Stillzeit liegen nicht vor.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Carboxymethylstärke-Natrium (Typ A) (Ph.Eur.), Hypromellose, Lactose-Monohydrat, Maisstärke, mikrokristalline Cellulose, Povidon K25, hochdisperses Siliciumdioxid, Stearinsäure (Ph.Eur.), Titandioxid (E171).
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
5 Jahre.
6.4. Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5. Art und Inhalt des Behältnisses
PVC/Aluminium-Blisterpackung mit 30 Filmtabletten , 50 Filmtabletten und 100 Filmtabletten . Klinikpackung mit 10 x 30, 10 x 50 und 10 x 100 Filmtabletten.
6.6. Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
Dr. R. Pfleger Chemische Fabrik GmbH D-96045 Bamberg Telefon: (0951) 6043-0 Telefax: (0951) 6043-29
8. Zulassungsnummer
7772.00.00
9. Datum der Verlängerung der Zulassung
01.04.2003
10. Stand der Information
August 2014
11. Verkaufsabgrenzung
Verschreibungspflichtig