Tuberkulin Ppd Rt 23 Ssi (10 T.e./ 0,1 Ml)
Page 1 of7

STATENS
SERUM
INSTITUT
Tuberculin PPD RT 23 SSI
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
Tuberkulin PPD RT23 SSI 2 T.E./0,1 ml, Injektionslösung Tuberkulin PPD RT23 SSI 10 T.E./0,1 ml, Injektionslösung Tuberkulin PPD RT 23
Lesen Sie die gesamte Packungsbeilage vor dem Hauttest sorgfältig durch.
• Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
• Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
• Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter.
• Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker.
Diese Packungsbeilage beinhaltet:
1. Was ist Tuberkulin PPD RT23 SSI und wofür wird es angewendet?
2. Was müssen Sie vor dem Hauttest beachten?
3. Wie wird der Hauttest durchgeführt?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Tuberkulin PPD RT23 SSI aufzubewahren?
6. Weitere Informationen
1 WAS IST TUBERKULIN PPD RT23 SSI UND WOFÜR WIRD ES ANGEWENDET?
Tuberkulin PPD RT23 SSI wird als Hauttest angewendet, um im Rahmen einer Diagnose
festzustellen, ob Sie jemals mit einem Bakterium infiziert waren, das Tuberkulose verursacht.
Dieses Arzneimittel ist ein Diagnostikum.

Tuberculin PPD RT 23 SSI_
2 WAS MÜSSEN SIE VOR DEM HAUTTEST BEACHTEN?
Der Hauttest darf nicht durchgeführt werden
• Wenn Sie gegen Tuberkulin PPD RT23 SSI oder einen der sonstigen Bestandteile von Tuberkulin PPD RT23 SSI allergisch sind.
• Wenn Sie eine schwere lokale Reaktion gegen Tuberkulin-Präparate entwickelt haben.
Bei Anwendung mit anderen Arzneimitteln
Tuberkulin PPD RT23 SSI kann gefahrlos gleichzeitig mit einem Impfstoff angewendet werden. Allerdings könnte sich die Wirksamkeit einer Impfung mit Impfstoffen gegen Masern, Mumps und Röteln verringern. Diese verringerte Wirksamkeit könnte dazu führen, dass falsch-negative Reaktionen erhalten werden. Eine vorangegangene BCG-Impfung kann eine falsch-positive Reaktion ergeben.
Bitte informieren Sie Ihren Arzt, wenn Sie andere Arzneimittel einnehmen/anwenden bzw. vor kurzem eingenommen/angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
Schwangerschaft und Stillzeit
Informieren Sie Ihren Arzt, wenn Sie schwanger sind oder stillen.
Der Hauttest kann während der Schwangerschaft oder in der Stillzeit durchgeführt werden.
Verkehrstüchtigkeit und das Bedienen von Maschinen
Tuberkulin PPD RT23 SSI hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Wichtige Informationen über bestimmte sonstige Bestandteile von Tuberkulin PPD RT23 SSI
Dieses Arzneimittel enthält weniger als 1 mmol Kalium (39 mg) und weniger als 1 mmol Natrium (23 mg) pro Dosis und ist somit im Wesentlichen „kalium- und natriumfrei“.
3 WIE WIRD DER HAUTTEST DURCHGEFÜHRT?
Tuberkulin PPD RT23 SSI wird vom Arzt oder einer medizinischen Fachkraft in die obere Hautschicht im Unterarm injiziert.
Die Dosierung beträgt bei Kindern und Erwachsenen 0,1 ml.
Nach der Injektion bildet sich eine Papel mit einem Durchmesser von 8-10 mm, die etwa 10 Minuten lang zu sehen ist. An der Injektionsstelle kann es zu Rötungen und Verhärtungen kommen. Nach 48-72 Stunden wird das Ergebnis des Hauttests von Ihrem Arzt oder einer medizinischen Fachkraft untersucht. Falls sich Verhärtungen gebildet haben, sollten diese anschließend wieder

STATENS
SERUM
INSTITUT
Tuberculin PPD RT 23 SSI
verschwinden. Wenn Sie weitere Fragen zur Anwendung des Arzneimittels haben, fragen Sie Ihren Arzt.
Ausführliche Informationen zur Art der Anwendung und Auswertung des Hauttests finden Sie im Abschnitt „Die folgenden Informationen sind nur für Ärzte bzw. medizinisches Fachpersonal bestimmt“.
4 WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Wie alle Arzneimittel kann Tuberkulin PPD RT23 SSI Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
In sehr seltenen Fällen (bei weniger als 1 von 10.000) können schwerwiegende allergische Reaktionen (Anaphylaxie) auftreten, wie Schwellung der Lippen, des Gesichts und des Rachens, Atmungsbeschwerden und Nesselsucht (Urtikaria). Informieren Sie bitte unverzüglich Ihren Arzt, wenn Sie eine dieser Nebenwirkungen bemerken.
Weitere Nebenwirkungen sind u. a.:
Häufige Nebenwirkungen (können bei weniger als 1 von 10 Patienten auftreten):
Schmerzen, Juckreiz und Reizungen an der Injektionsstelle.
Gelegentliche Nebenwirkungen (können bei weniger als 1 von 100 Patienten auftreten):
Fieber und Vergrößerung der Lymphknoten.
Seltene Nebenwirkungen (können bei weniger als 1 von 1.000 Patienten auftreten):
Hautnekrose, die in der Regel nach einigen Tagen wieder verschwindet, und Blasenbildung (Vesikulation).
Häufigkeit nicht bekannt (auf Grundlage der verfügbaren Daten nicht abschätzbar): Kopfschmerzen und Nesselsucht (Urtikaria).
Informieren Sie bitte Ihren Arzt oder Apotheker, wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind.
5 WIE IST TUBERKULIN PPD RT23 SSI AUFZUBEWAHREN?
• Arzneimittel für Kinder unzugänglich aufbewahren.
• Tuberkulin PPR RT23 SSI darf nach dem auf dem Umkarton (Verwendbar bis) angegebenen Verfalldatum nicht mehr angewendet werden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Im Kühlschrank lagern (2 °C-8 °C).

STATENS
SERUM
INSTITUT
Tuberculin PPD RT 23 SSI
• In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
• Tuberkulin PPD RT23 SSI sollte sofort nach dem Öffnen angewendet werden. Erfolgt keine sofortige Anwendung, liegen die Dauer und Bedingungen der Aufbewahrung in der Verantwortung des Anwenders und betragen normalerweise nicht mehr als 24 Stunden bei
2 °C-8 °C.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Tuberkulin PPD RT23 SSI enthält kein Lebendmaterial.
6 WEITERE INFORMATIONEN
Was Tuberkulin PPD RT23 SSI enthält
• Der Wirkstoff ist Tuberkulin PPD RT23.
1 Dosis (0,1 ml) Tuberkulin PPD RT23 SSI 2 T.E. enthält 0,04 Mikrogramm Tuberkulin PPD RT23.
1 Dosis (0,1 ml) Tuberkulin PPD RT23 SSI 10 T.E. enthält 0,2 Mikrogramm Tuberkulin PPD RT23.
• Die sonstigen Bestandteile sind: Dinatriumphosphatdihydrat, Kaliumdihydrogenphosphat, Natriumchlorid, Kaliumhydroxychinolinsulfat, Polysorbat 80 und Wasser für Injektionszwecke.
Wie Tuberkulin PPD RT23 SSI aussieht und Inhalt der Packung
Tuberkulin PPD RT23 SSI ist eine Injektionslösung (Injektionszubereitung).
Es ist eine klare, farblose bis blassgelbe Lösung.
Tuberkulin PPD RT23 SSI wird in zwei Wirkstärken in den Verkehr gebracht: 2 T.E. und 10 T.E. Packungsgrößen:
Durchstechflaschen mit Tuberkulin PPD RT23 SSI 2 T.E. mit 1,5 ml oder 5 ml in Packungsgrößen zu 1 oder 10 Stück.
Durchstechflaschen mit Tuberkulin PPD RT23 SSI 10 T.E. mit1,5 ml in Packungsgrößen zu 1 oder 10 Stück.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.

Tuberculin PPD RT 23 SSI_
Pharmazeutischer Unternehmer und Hersteller
Statens Serum Institut Artillerivej 5 DK-2300 Kopenhagen S Dänemark
Tel.-Nr.: +45 3268 3268 Fax-Nr.: +45 3268 3973 E-Mail: serum@ssi.dk
Diese Gebrauchsinformation wurde zuletzt genehmigt im 04/2011

STATENS
SERUM
INSTITUT
Tuberculin PPD RT 23 SSI
Die folgenden Informationen sind nur für Ärzte bzw. medizinisches Fachpersonal bestimmt:
Art der Anwendung
Im Folgenden ist die Anwendung von Tuberkulin PPD RT23 SSI ausführlich beschrieben:
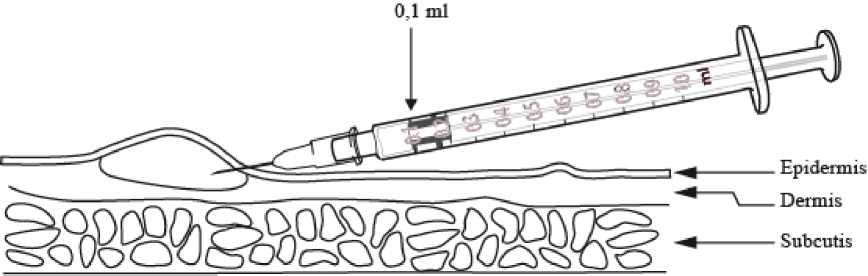
• 0,1 ml werden mit einer graduierten 1-ml-Spritze verabreicht, die mit einer kurzen angeschrägten Nadel (25G oder 26G) versehen ist.
• Die Injektion muss intradermal in das mittlere Drittel des Unterarms verabreicht werden. Bei Anwendung in der Nähe des Hand- oder des Ellenbogengelenks könnte die Reaktion abgeschwächt werden.
• Die Haut wird leicht gespannt und die Nadel beinahe parallel zur Hautoberfläche gehalten, wobei die angeschrägte Seite nach oben zeigt. Die Spitze der Nadel wird in die Oberflächenschicht der Dermis eingeführt.
• Die Nadel muss während des Einführens durch die Epidermis hindurch zu sehen sein. Die 0,1 ml werden langsam injiziert, woraufhin sich eine Papel mit einem Durchmesser von 8-10 mm bildet. Diese Papel verschwindet nach etwa 10 Minuten wieder.
• Wenn sich keine Papel bildet, war die Injektion zu tief, und der Hauttest muss am anderen Arm oder am selben Arm mindestens 4 cm entfernt von der ersten Injektionsstelle wiederholt werden.
Bezüglich der Anwendung des Mendel-Mantoux-Tests sollten die nationalen Empfehlungen herangezogen werden.
Auswertung der Reaktion
Die Reaktion auf einen Hauttest äußert sich als flache, unebene, leicht erhabene Verhärtung, die von einer Rötung umgeben ist. Die Verhärtung sollte 48-72 Stunden nach der Injektion untersucht werden, anschließend sollte sie wieder abklingen. Es wird nur die Verhärtung untersucht.
Der Durchmesser der Verhärtung wird in Millimetern quer entlang der Längsachse des Unterarms

STATENS
SERUM
INSTITUT
Tuberculin PPD RT 23 SSI
mit einem durchsichtigen, biegsamen Kunststofflineal gemessen.
Empfehlungen zur Auswertung des Mendel-Mantoux-Tests sind Tabelle 1 zu entnehmen.
|
Durchmesser der Verhärtung in Millimetern | ||
|
Negativ |
Positiv |
Stark positiv |
|
0-5 mm |
6-14 mm |
+15 mm |
Tabelle 1: Normale Auswertung des Hauttestergebnisses.
Je nach den nationalen Empfehlungen und individuellen und epidemiologischen Faktoren kann die Auswertung auch auf andere Weise erfolgen.
Auswertung
Eine positive Reaktion weist auf eine Immunreaktion aus mindestens einem der folgenden Gründe hin:
• Infektion mit Mycobacterium tuberculosis-Komplex, einschließlich M. tuberculosis, M. bovis, M. africanum, M. microtii oder M. tuberculosis subsp. caprae.
• Infektion mit nicht tuberkulösen Mykobakterien.
• Vorangegangene BCG-Impfung (BCG-geimpfte Personen werden in der Regel nach 48 Wochen Tuberkulin-positiv).
Bei Reaktionsstellen mit einem Durchmesser über 15 mm können eine vorangegangene BCG-Impfung oder ein Kontakt mit Mykobakterien in der Umwelt als Ursache wahrscheinlich ausgeschlossen werden.