Turimycin 150Mg
1
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Turimycin® 150 mg Hartkapseln
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Eine Hartkapsel enthält 162,86 mg Clindamycinhydrochlorid (entsprechend 150 mg Clindamycin).
Sonstiger Bestandteil mit bekannter Wirkung: Eine Hartkapsel enthält 118,4 mg Lactose als LactoseMonohydrat.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Hartkapsel
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Akute und chronische bakterielle Infektionen durch Clindamycin-empfindliche Erreger wie
- Infektionen der Knochen und Gelenke
- Infektionen des Hals-Nasen-Ohren-Bereichs
- Infektionen des Zahn- und Kieferbereichs
- Infektionen der tiefen Atemwege
- Infektionen des Becken- und Bauchraumes
- Infektionen der weiblichen Geschlechtsorgane
- Infektionen der Haut und Weichteile
- Scharlach.
Bei schweren Krankheitsbildern sollte einleitend eine intravenöse Behandlung mit Clindamycinhaltigen Arzneimitteln vorgenommen werden (Infusion).
4.2 Dosierung und Art der Anwendung
Dosierung
Jugendliche und Erwachsene
In Abhängigkeit von Ort und Schweregrad der Infektion nehmen Erwachsene und Jugendliche über 14 Jahre täglich 4 bis 12 Kapseln ein (entsprechend 0,6 bis 1,8 g Clindamycin).
Die Tagesdosis wird auf 4 Gaben verteilt.
Für die höheren Dosierungen stehen auch Arzneimittel mit einem höheren Wirkstoffgehalt zur Verfügung.
Kinder
In Abhängigkeit von Ort und Schweregrad der Infektion erhalten Kinder im Alter über 4 Wochen bis 14 Jahre täglich 8 bis 25 mg Clindamycin pro Kilogramm Körpergewicht.
Dies entspricht beispielhaft den folgenden Dosierungen:
Körper- Kapselanzahl Milligramm
gewicht pro Tag Clindamycin
|
20 kg |
3 Kapseln |
450 mg |
|
30 kg |
4 bis 5 Kapseln |
600 bis 750 mg |
|
40 kg |
4 bis 6 Kapseln |
600 bis 900 mg |
|
50 kg |
4 bis 8 Kapseln |
600 bis 1200 mg |
Die Tagesdosis wird auf 3 bis 4 Gaben verteilt. In der Regel sind 4 Gaben zu bevorzugen.
Für niedrigere Dosierungen stehen Arzneimittel mit einem geringeren Wirkstoffgehalt zur Verfügung.
Lebererkrankungen
Bei Patienten mit mittelschweren bis schweren Lebererkrankungen verlängert sich die Eliminationshalbwertzeit von Clindamycin. Eine Dosisreduktion ist in der Regel nicht erforderlich, wenn Turimycin 150 mg alle acht Stunden gegeben wird. Es sollte aber bei Patienten mit schwerer Leberinsuffizienz eine Überwachung der Plasmaspiegel von Clindamycin erfolgen. Entsprechend den Ergebnissen dieser Maßnahme kann eine Dosisverminderung notwendig werden oder eine Verlängerung des Dosierungsintervalles.
Nierenerkrankungen
Bei Nierenerkrankungen ist die Eliminationshalbwertzeit verlängert; eine Dosisreduktion ist aber bei leichter bis mäßig schwerer Einschränkung der Nierenfunktion nicht erforderlich. Es sollte jedoch bei Patienten mit schwerer Niereninsuffizienz oder Anurie eine Überwachung der Plasmaspiegel erfolgen. Entsprechend den Ergebnissen dieser Maßnahme kann eine Dosisverminderung oder alternativ ein verlängertes Dosierungsintervall von 8 oder sogar von 12 Stunden erforderlich sein.
Hämodialyse
Clindamycin ist nicht hämodialysierbar. Es ist daher vor oder nach einer Dialyse keine zusätzliche Dosis erforderlich.
Art der Anwendung
Turimycin 150 mg wird mit ausreichend Flüssigkeit eingenommen.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder Lincomycin (es besteht eine Parallergie) oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Es ist Vorsicht geboten bei
- eingeschränkter Leberfunktion
- Störungen der neuromuskulären Übertragung (Myasthenia gravis, Parkinson-Krankheit)
- Magen-Darm-Erkrankungen in der Vorgeschichte (z. B. frühere Entzündungen des Dickdarms).
Turimycin 150 mg sollte nicht bei akuten Infektionen der Atemwege angewendet werden, wenn diese durch Viren verursacht sind.
Turimycin 150 mg eignet sich nicht zur Meningitistherapie, da die im Liquor cerebrospinalis erreichbaren Antibiotikakonzentrationen zu gering sind.
Bei Langzeittherapie (Behandlung länger als 3 Wochen) sollten in regelmäßigen Abständen das Blutbild sowie die Leber- und Nierenfunktion kontrolliert werden.
Langfristige und wiederholte Anwendung von Turimycin 150 mg kann zu einer Superinfektion bzw. Kolonisation mit resistenten Keimen oder Sprosspilzen der Haut und Schleimhäute führen.
Eine Clindamycin-Behandlung ist u. U. eine mögliche Behandlungsalternative bei Penicillin-Allergie (Penicillin-Überempfindlichkeit). Eine Kreuzallergie zwischen Clindamycin und Penicillin ist nicht bekannt und aufgrund der Strukturunterschiede der Substanzen auch nicht zu erwarten. Es gibt jedoch in Einzelfällen Informationen über Anaphylaxie (Überempfindlichkeit) auch gegen Clindamycin bei Personen mit bereits bestehender Penicillin-Allergie. Dies sollte bei einer Clindamycin-Behandlung von Patienten mit Penicillin-Allergie beachtet werden.
Sehr selten treten schwere akute allergische Reaktionen auf, wie z. B. anaphylaktischer Schock. Hier muss die Behandlung mit Turimycin 150 mg sofort abgebrochen werden und die üblichen entsprechenden Notfallmaßnahmen (z. B. Antihistaminika, Corticosteroide, Sympathomimetika und ggf. Beatmung) müssen eingeleitet werden.
Sehr selten tritt eine pseudomembranöse Enterokolitis auf. Hier ist eine Beendigung der Therapie in Abhängigkeit von der Indikation zu erwägen und gegebenenfalls sofort eine angemessene Behandlung einzuleiten (z. B. Einnahme von speziellen Antibiotika/Chemotherapeutika, deren Wirksamkeit klinisch erwiesen ist). Arzneimittel, die die Peristaltik hemmen, sind kontraindiziert.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorbtion sollten Turimycin 150 mg nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Turimycin 150 mg sollte möglichst nicht mit Erythromycin und anderen Makroliden kombiniert werden, da hinsichtlich der antibakteriellen Wirkung in vitro ein antagonistischer Effekt beobachtet wurde.
Es besteht eine Kreuzresistenz der Erreger gegenüber Clindamycin und Lincomycin.
Turimycin 150 mg kann aufgrund seiner neuromuskulär-blockierenden Eigenschaften die Wirkung von Muskelrelaxanzien verstärken (z. B. Ether, Tubocurarin, Pancuroniumhalogenid). Hierdurch können bei Operationen unerwartete, lebensbedrohliche Zwischenfälle auftreten.
Die Sicherheit der empfängnisverhütenden Wirkung von oralen Kontrazeptiva ("Anti-Baby-Pille") ist bei gleichzeitiger Anwendung von Turimycin 150 mg in Frage gestellt. Daher sollten während der Behandlung mit Turimycin 150 mg andere empfängnisverhütende Maßnahmen zusätzlich angewendet werden.
Bei Patienten, die Clindamycin zusammen mit Vitamin-K-Antagonisten (z. B. Warfarin, Acenocoumarol, Fluindion) erhielten, wurden erhöhte Blutgerinnungswerte (PT/INR) und/oder Blutungen berichtet.
Die Blutgerinnungswerte sollten daher bei Patienten, die mit Vitamin-K-Antagonisten behandelt werden, engmaschig kontrolliert werden.
4.6 Schwangerschaft und Stillzeit
Bei einer Anwendung in Schwangerschaft und Stillzeit müssen Nutzen und Risiko sorgfältig gegeneinander abgewogen werden. Beobachtungen am Menschen haben bisher keinen Hinweis auf fruchtschädigende Einflüsse ergeben.
Beim gestillten Säugling sind Sensibilisierungen, Durchfälle und Sprosspilzbesiedlung der Schleimhäute nicht auszuschließen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nicht zutreffend.
4.8 Nebenwirkungen
|
Systemorgan klassen (MedDRA) |
Sehr häufig (> 1/10) |
Häufig (>1/100, <1/10) |
Gelegentlich (>1/1.000, <1/100) |
Selten (>1/10.000, <1/1.000) |
Sehr selten (<1/10.000) |
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) |
|
Erkrankungen des Blutes und des Lymphsystem s |
'Thrombozyto penie, Leukopenie, Eosinophilie, Neutropenie, Granulozytope nie | |||||
|
Erkrankungen des Gastrointestin altrakts |
2weiche Stühle und Durchfälle, manchmal verbunden mit Übelkeit, Erbrechen, Bauchschm erzen |
3pseudomem branöse Enterokolitis |
Ösophagitis, Mundschleimh autentzündung | |||
|
Leber- und Gallenerkrank ungen |
leichte, vorübergeh ende Erhöhung der Serumtrans aminasen |
vorübergehe nde Hepatitis mit cholestatisch er Gelbsucht | ||||
|
Erkankungen der Haut und des Unterhautzell gewebes |
Allergien in Form von masernähnlich em Exanthem sowie Pruritus und Urtikaria |
4Schwellungen (Quincke-Ödem, Gelenkschwellu ngen); 4Arzneimittelfie ber sowie Erythema exsudativum multiforme (z. B. StevensJohnsonSyndrom) und |
Reversible Auswirkungen auf das Blutbild, die toxischer und allergischer Art sein können.
|
Lyell-Syndrom; Juckreiz sowie desquamatöse und bullöse Hautentzündung | ||||||
|
Skelettmuskul atur-, Bindegewebs- und Knochenerkra nkungen |
neuromuskulär -blockierende Wirkung |
Polyarthritis | ||||
|
Erkrankungen der Geschlechtsor gane und der Brustdrüse |
Scheidenkatarrh | |||||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichun gsort |
3,4anaphylakt ischer Schock |
1
2
3
4
Treten häufig bis sehr häufig auf. Sie sind meist leichter Natur und klingen oft während der Behandlung, ansonsten nach Absetzen, ab. Diese Nebenwirkungen sind applikations- und dosisabhängig.
siehe auch Abschnitt „4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung“ Die Reaktionen treten teilweise schon nach Erstanwendung auf.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung anzuzeigen:
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn
Website: http://www.bfarm.de 4.9 Überdosierung
Es wurden keine Fälle von Überdosierung berichtet. Gegebenenfalls ist eine Magenspülung angezeigt. Hämodialyse und Peritonealdialyse sind nicht wirksam. Ein spezifisches Antidot ist nicht bekannt.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe:
Clindamycin ist ein halbsynthetisches Pyranosid. Pyranoside zeigen keine Verwandtschaft mit anderen bekannten Antibiotika.
ATC-Code: J01FF01
Wirkungsweise
Der Wirkungsmechanismus von Clindamycin beruht auf der Hemmung der Proteinbiosynthese durch Bindung an die 50S-Untereinheit des bakteriellen Ribosoms. Hieraus resultiert zumeist eine bakteriostatische Wirkung.
Beziehung zwischen Pharmakokinetik und Pharmakodynamik
Die Wirksamkeit hängt im Wesentlichen von der Zeitdauer ab, während der der Wirkstoffspiegel oberhalb der minimalen Hemmkonzentration (MHK) des Erregers liegt.
Resistenzmechanismen
Eine Resistenz gegenüber Clindamycin kann auf folgenden Mechanismen beruhen:
Die Resistenz bei Staphylokokken und Streptokokken beruht zumeist auf einem vermehrten Einbau von Methylgruppen in die 23S rRNS (sog. konstitutive MLSB-Resistenz), wodurch sich die Bindungsaffinität von Clindamycin zum Ribosom stark vermindert.
Die Mehrzahl der Methicillin-resistenten S. aureus (MRSA) zeigen den konstitutiven MLSB-Phänotyp und sind daher Clindamycin-resistent. Infektionen durch Makrolid-resistente Staphylokokken sollten auch bei nachgewiesener In-vitro-Empfindlichkeit nicht mit Clindamycin behandelt werden, da die Gefahr besteht, dass unter der Therapie Mutanten mit konstitutiver MLSB-Resistenz selektiert werden.
Bei Stämmen mit konstitutiver MLSB-Resistenz besteht eine vollständige Kreuzresistenz von Clindamycin mit Lincomycin, Makroliden (z. B. Azithromycin, Clarithromycin, Erythromycin, Roxithromycin, Spiramycin) sowie Streptogramin B.
Grenzwerte
Die Testung von Clindamycin erfolgt unter Benutzung der üblichen Verdünnungsreihe. Folgende minimale Hemmkonzentrationen für sensible und resistente Keime wurden festgelegt:
EUCAST (European Committee on Antimicrobial Susceptibility Testing) Grenzwerte
|
Erreger |
Sensibel |
Resistent |
|
Staphylococcus spp. |
< 0,25 mg/l |
> 0,5 mg/l |
|
Streptococcus spp. (Gruppen A, B, C, G) |
< 0,5 mg/l |
> 0,5 mg/l |
|
Streptococcus pneumoniae |
< 0,5 mg/l |
> 0,5 mg/l |
|
Streptokokken der „Viridans“-Gruppe |
< 0,5 mg/l |
> 0,5 mg/l |
|
Gram-negative Anaerobier |
< 4 mg/l |
> 4 mg/l |
|
Gram-positive Anaerobier |
< 4 mg/l |
> 4 mg/l |
Prävalenz der erworbenen Resistenz in Deutschland
Die Prävalenz der erworbenen Resistenz einzelner Spezies kann örtlich und im Verlauf der Zeit variieren. Deshalb sind - insbesondere für die adäquate Behandlung schwerer Infektionen - lokale Informationen über die Resistenzsituation erforderlich. Falls auf Grund der lokalen Resistenzsituation die Wirksamkeit von Clindamycin in Frage gestellt ist, sollte eine Therapieberatung durch Experten angestrebt werden. Insbesondere bei schwerwiegenden Infektionen oder bei Therapieversagen ist eine mikrobiologische Diagnose mit dem Nachweis des Erregers und dessen Empfindlichkeit gegenüber Clindamycin anzustreben.
Prävalenz der erworbenen Resistenz in Deutschland auf der Basis von Daten der letzten 5 Jahre aus nationalen Resistenzüberwachungsprojekten und -studien (Stand: Dezember 2013):
Üblicherweise empfindliche Spezies_
Aerobe Gram-positive Mikroorganismen
Actinomyces israelii°_
Staphylococcus aureus (Methicillin-sensibel)
Streptococcus pyogenes_
Streptokokken der „Viridans“-Gruppe ° A_
Anaerobe Mikroorganismen_
Bacteroides spp. ° (außer B. ^fragilis)_
Clostridium perfringens °_
Fusobacterium spp. °_
Peptoniphilus spp. °_
Peptostreptococcus spp. °_
Prevotella spp. °_
Propionibacterium spp. °_
Veillonella spp. °_
Andere Mikroorganismen_
Chlamydia trachomatis °_
Chlamydophila pneumoniae °_
Gardnerella vaginalis °_
Mycoplasma hominis °_
Spezies, bei denen erworbene Resistenzen ein Problem bei der Anwendung darstellen
können_
Aerobe Gram-positive Mikroorganismen_
Staphylococcus aureus_
Staphylococcus aureus (Methicillin-resistent) +_
Staphylococcus epidermidis +_
Staphylococcus haemolyticus_
Staphylococcus hominis_
Staphylococcus agalactiae_
Streptococcus pneumoniae_
Aerobe Gram-negative Mikroorganismen_
Moraxella catarrhalis $_
Anaerobe Mikroorganismen_
Bacteroides ^ fragilis °_
Von Natur aus resistente Spezies_
Aerobe Gram-positive Mikroorganismen_
Enterococcus spp._
Listeria monocytogenes_
Aerobe Gram-negative Mikroorganismen_
Escherichia coli_
Haemophilus influenzae_
Klebsiella spp._
Pseudomonas aeruginosa_
Anaerobe Mikroorganismen_
Clostridium difficile_
Andere Mikroorganismen_
Mycoplasma pneumoniae_
Ureaplasma urealyticum_
O
$
+
A
Bei Veröffentlichung der Tabellen lagen keine aktuellen Daten vor. In der Primärliteratur, Standardwerken und Therapieempfehlungen wird von einer Empfindlichkeit ausgegangen. Die natürliche Empfindlichkeit der meisten Isolate liegt im intermediären Bereich.
In mindestens einer Region liegt die Resistenzrate bei über 50%.
Sammelbezeichnung für eine heterogene Gruppe von Streptokokken-Spezies. Resistenzrate kann in Abhängigkeit von der vorliegenden Streptokokken-Spezies variieren.
Es muss zwischen den verwendeten Clindamycin-Derivaten nur bis zum Zeitpunkt der Resorption und Spaltung der Ester unterschieden werden. Danach ist im Organismus Clindamycin als freie Base (Wirkform) vorhanden. Die Ester sind als Prodrugs anzusehen.
Clindamycinhydrochlorid wird nach oraler Gabe rasch und nahezu vollständig aus dem Magen-DarmTrakt resorbiert. Durch gleichzeitige Nahrungsaufnahme wird die Resorption geringfügig verzögert. Maximale Serumkonzentrationen werden bei Nüchterngabe nach ca. 45 bis 60 Minuten, bei Einnahme nach einer Mahlzeit nach ca. 2 Stunden erreicht. Sie liegen nach einer einmaligen oralen Gabe von 150 mg bzw. 300 mg Clindamycin bei 1,9 bis 3,9 pg/ml bzw. 2,8 bis 3,4 pg/ml (nüchtern).
Die Bindung des Clindamycins an Plasmaproteine ist konzentrationsabhängig und liegt im therapeutischen Bereich zwischen 60 und 94 %.
Clindamycin ist gut gewebegängig, passiert die Plazentaschranke und geht in die Muttermilch über. Die Diffusion in den Liquorraum ist auch bei entzündeten Meningen unzureichend. Hohe Konzentrationen werden im Knochengewebe erreicht.
Clindamycin wird überwiegend in der Leber abgebaut. Einige Metaboliten sind mikrobiologisch wirksam. Medikamente, die als Enzyminduktoren in der Leber wirken, verkürzen die mittlere Verweildauer des Clindamycins im Körper.
Die Elimination von Clindamycin erfolgt zu etwa 2/3 mit den Fäzes und zu 1/3 mit dem Urin.
Die Serumhalbwertzeit von Clindamycin beträgt ca. 3 Stunden bei Erwachsenen und ca. 2 Stunden bei Kindern. Bei eingeschränkter Nierenfunktion und mittlerer bis schwerer Leberinsuffizienz ist die Halbwertzeit verlängert.
Clindamycin ist nicht dialysierbar.
Bioverfügbarkeit
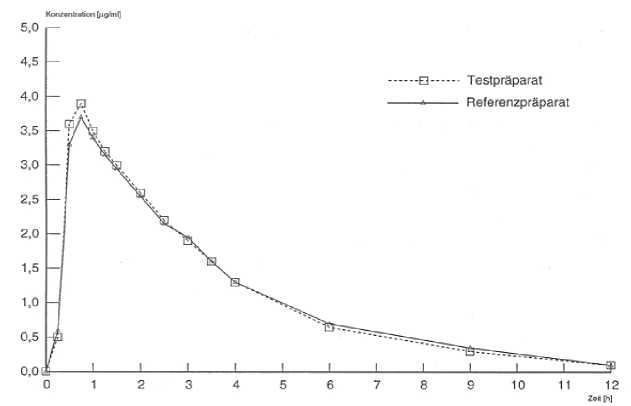
Eine im Jahr 1997 durchgeführte Bioverfügbarkeitsuntersuchung an 20 Probanden ergab bei einer Dosierung von 300 mg Clindamycin im Vergleich zum Referenzpräparat:
Applikationsbedingungen: nüchtern
Testpräparat Referenzpräparat
maximale Plasmakonzentration 4,16 ± 1,44 4,06 ± 1,16
(Cmax[pg/ml])
Zeitpunkt der maximalen Plasmakon- 0,78 ± 0,28 0,78 ± 0,34
zentration (tmax[h])
Fläche unter der Kon-
zentrations-Zeit-Kurve 13,37 ± 5,13 13,83 ± 4,67
(AUC0-4pg/ml x h])
Angabe der Werte als Mittelwerte und Streubreite.
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem KonzentrationsZeit-Diagramm:
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
Untersuchungen zur akuten Toxizität von Clindamycin und dessen Salzen an verschiedenen Tierspezies haben LD50-Werte im Bereich von 1800 bis 2620 mg/kg Körpergewicht (KG) nach oraler Gabe und zwischen 245 und 820 mg/kg KG nach intravenöser Gabe ergeben. Das Vergiftungsbild zeigte eine stark verminderte Aktivität der Tiere sowie Konvulsionen.
Chronische Toxizität
Die wiederholte Gabe von Clindamycinphosphat über 6 Tage an Ratten (subkutane Applikation) und an Hunde (intravenöse und intramuskuläre Applikation) verursachte keine systemischen toxischen Effekte.
Nach Applikation von Clindamycinphosphat über 1 Monat an Ratten (s.c.) und Hunde (i.m. und i.v.) konnten ebenfalls keine substanzbedingten Einflüsse auf die Körpergewichtsentwicklung, auf klinisch-chemische und hämatologische Parameter sowie auf die Organhistopathologie festgestellt werden.
Bei Hunden wurden nach intramuskulärer Gabe von 30 bis 90 mg/kg KG täglich Erhöhungen der SGOT und SGPT sowie ein leichter dosisabhängiger Anstieg des relativen Lebergewichts ohne Hinweis auf morphologische Veränderungen festgestellt.
Lokale Reaktionen um die Injektionsstelle (Entzündungen, Hämorrhagien und Gewebeschäden) wurden bei intramuskulärer und subkutaner Applikation beobachtet, wobei die Konzentration der applizierten Lösung die maximal therapeutisch zulässige Konzentration weit überstieg.
Mutagenes und tumorerzeugendes Potenzial
In-vitro- und In-vivo-Untersuchungen zur Mutagenität von Clindamycin ergaben keine Hinweise auf ein mutagenes Potenzial.
Langzeituntersuchungen am Tier auf ein tumorerzeugendes Potenzial von Clindamycin wurden nicht durchgeführt.
Reproduktionstoxizität
Untersuchungen mit Clindamycin an Ratten und Mäusen ergaben keine Hinweise auf Fertilitätsstörungen oder embryo-fetotoxische Eigenschaften.
Eine größere Studie an Schwangeren, bei der auch ca. 650 im ersten Trimester der Schwangerschaft exponierte Neugeborene untersucht wurden, zeigte keine erhöhten Fehlbildungsraten.
Clindamycin wurde im Nabelschnurblut mit ca. 50 % der matemalen Serumkonzentration gemessen. Es ist davon auszugehen, dass im Fetus therapeutische Konzentrationen erreicht werden können.
Der Übergang in die Muttermilch ist nachgewiesen; die Konzentrationen betrugen bis zu 4 ^g/ml nach maternalen Dosen von 600 mg und bis zu 2 ^g/ml nach Dosen von 300 mg.
Bis auf einen einzelnen Fallbericht sind bisher keine Anzeichen für unerwünschte Wirkungen auf gestillte Säuglinge bekannt geworden.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Kapselinhalt:
Lactose-Monohydrat
Maisstärke
Talkum
Magnesiumstearat (Ph.Eur.)
Kapselhülle:
Gelatine
Farbstoffe: Titandioxid (E171), Indigocarmin (E132), Eisenoxid gelb (E172), Eisenoxid schwarz (E172).
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
4 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Keine besonderen Vorsichtsmaßnahmen für die Aufbewahrung.
6.5 Art und Inhalt des Behältnisses
Packungen mit 12 Hartkapseln Packungen mit 30 Hartkapseln
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
mibe GmbH Arzneimittel Münchener Straße 15 06796 Brehna
Tel.: 034954/247-0 Fax: 034954/247-100
8. ZULASSUNGSNUMMER
42245.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
21. September 1998/14. Oktober 2003
10. STAND DER INFORMATION
07.2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig