Urapidil 100 Mg I.v. Carino
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels)
1. BEZEICHNUNG DES ARZNEIMITTELS
URAPIDIL 25 mg i.v. Carino Injektionslösung URAPIDIL 50 mg i.v. Carino Injektionslösung URAPIDIL 100 mg i.v. Carino Injektionslösung
Wirkstoff: Urapidil
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Ampulle mit 5 ml enthält 25 mg Urapidil 1 Ampulle mit 10 ml enthält 50 mg Urapidil 1 Ampulle mit 20 ml enthält 100 mg Urapidil
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM Injektionslösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
URAPIDIL i.v. Carino wird verwendet zur Behandlung von:
- hypertensiven Notfällen (z.B. krisenhafter Blutdruckanstieg)
- schweren bzw. schwersten Formen der Bluthochdruckkrankheit
- therapieresistentem Bluthochdruck
- zur kontrollierten Blutdrucksenkung bei Patienten mit Bluthochdruck während und/oder nach Operationen.
4.2 Dosierung, Art und Dauer der Anwendung
URAPIDIL i.v. Carino wird intravenös als Injektion oder Infusion am liegenden Patienten verabreicht. Sowohl ein- oder mehrmalige Injektion als auch intravenöse Langzeitinfusionen sind möglich. Injektionen lassen sich mit anschließender Langzeitinfusion kombinieren. Überlappend mit der parenteralen Akuttherapie ist der Übergang auf eine Dauertherapie mit einem oral zu verabreichenden Blutdrucksenker möglich.
Toxikologisch abgesichert ist eine Behandlungsdauer von 7 Tagen, die im Allgemeinen bei parenteraler antihypertensiver Therapie auch nicht überschritten wird. Eine parenterale Wiederholungsbehandlung bei erneut auftretendem Blutdruckanstieg ist möglich.
Hypertensiver Notfall, schwere und schwerste Formen der Hypertonie und therapieresistente Hypertonie
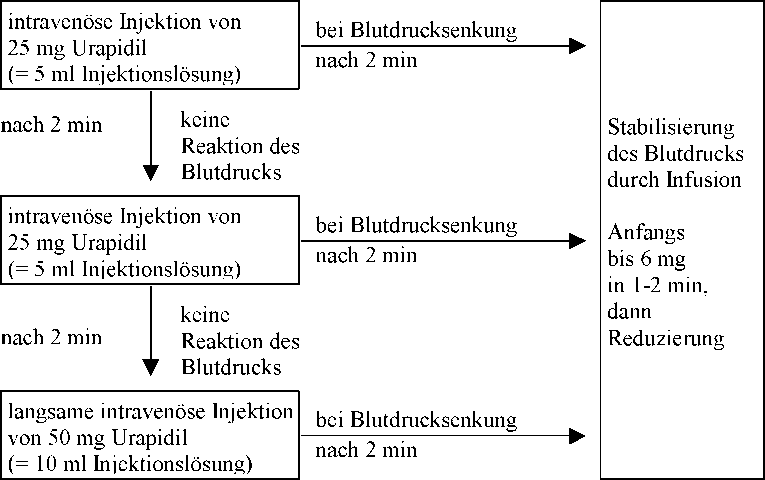
1) Intravenöse Injektion:
Als Injektion werden 10 - 50 mg Urapidil langsam - unter laufender Blutdruckkontrolle - intravenös verabreicht.
Innerhalb von 5 min nach der Injektion ist eine blutdrucksenkende Wirkung zu erwarten.
Abhängig vom Blutdruckverhalten kann die Injektion von URAPIDIL i.v. Carino wiederholt werden.
2) Intravenöse Dauertropfinfusion oder kontinuierliche Infusion _per Perfusor:
Die Dauertropfinfusionslösung zur Aufrechterhaltung des durch die Injektion erreichten Blutdruckniveaus wird folgendermaßen hergestellt:
Zu 500 ml einer kompatiblen Infusionslösung, z.B. physiologischer Kochsalzlösung, 5- oder 10%iger Glucoselösung, gibt man im Allgemeinen 250 mg Urapidil.
Bei Verwendung eines Perfusors zur Gabe der Erhaltungsdosis werden 20 ml Injektionslösung (= 100 mg Urapidil) in einer Perfusor-Spritze aufgezogen und bis zu einem Volumen von 50 ml mit einer kompatiblen Infusionslösung (siehe oben) verdünnt.
Die kompatible Höchstmenge beträgt 4 mg Urapidil pro ml Infusionslösung. Applikationsgeschwindigkeit:
Die Tropfgeschwindigkeit richtet sich nach dem individuellen Blutdruckverhalten.
Initiale Richtgeschwindigkeit:
2 mg/min
Erhaltungsdosis:
Im Mittel 9 mg/h, bezogen auf 250 mg Urapidil zusätzlich zu 500 ml Infusionslösung entspricht 1 mg = 44 Tropfen = 2,2 ml.
Dosierungsschema:
Kontrollierte Blutdrucksenkung bei Blutdruckanstiegen während und/oder nach Operationen
Zur Aufrechterhaltung des durch die Injektion erreichten Blutdruckniveaus kommen kontinuierliche Infusion per Perfusor oder Dauertropfinfusion zur Anwendung.
Ältere Patienten
Bei älteren Patienten müssen blutdrucksenkende Mittel mit entsprechender Vorsicht und zu Beginn in kleineren Dosen verabreicht werden, da bei diesen Patienten die Empfindlichkeit gegenüber derartigen Präparaten oftmals verändert ist.
Patienten mit Nieren- und/oder Leberfunktionsstörungen
Bei Patienten mit Nieren- und/oder Leberfunktionsstörungen kann eine Dosisverringerung erforderlich sein.
Kinder
Es gibt keine Erfahrungen bei Kindern (siehe Abschnitt 4.4).
4.3 Gegenanzeigen
URAPIDIL i.v. Carino darf nicht angewendet werden bei:
- Überempfindlichkeit gegen Urapidil oder einen der sonstigen Bestandteile des Arzneimittels
- Aortenisthmusstenose und arteriovenösem Shunt (hämodynamisch nicht wirksamer Dialyse-Shunt ausgenommen).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Besondere Vorsicht bei der Anwendung von URAPIDIL i.v. Carino ist erforderlich bei:
- Herzinsuffizienz, deren Ursache in einer mechanischen Funktionsbehinderung liegt, wie z. B. Aortenklappen- oder Mitralklappenstenose, bei Lungenembolie oder bei durch Perikarderkrankungen bedingter Einschränkung der Herzaktion
- Kindern, da keine Untersuchungen hierzu vorliegen
- Patienten mit Leberfunktionsstörungen
- Patienten mit mäßiger bis schwerer Nierenfunktionsstörung
- älteren Patienten
- Patienten, die gleichzeitig Cimetidin erhalten (siehe Abschnitt 4.5).
Vorsicht ist geboten, falls URAPIDIL i.v. Carino nicht als erstes blutdrucksenkendes Medikament gegeben wird. In diesem Fall ist ausreichend lange auf den Wirkungseintritt des/der zuvor gegebenen blutdrucksenkenden Mittel(s) zu warten. Die Dosierung von URAPIDIL i.v. Carino ist entsprechend niedriger zu wählen. Zu rascher Blutdruckabfall kann zu Bradykardie oder Herzstillstand führen.
URAPIDIL i.v. Carino enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro Ampulle.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Blutdrucksenkende Arzneimittel
Die blutdrucksenkende Wirkung von URAPIDIL i.v. Carino kann durch gleichzeitig verabreichte Alpha-Rezeptorenblocker, wie u.a. jene, die für urologische Erkrankungen gegeben werden, und durch andere blutdrucksenkende Arzneimittel sowie bei Zuständen mit Volumenmangel (Durchfall, Erbrechen) und durch Alkohol verstärkt werden.
Baclofen
Die Kombination von Urapidil mit Baclofen ist nur mit Vorsicht in Erwägung zu ziehen, da Baclofen die blutdrucksenkende Wirkung steigern kann.
Cimetidin
Bei gleichzeitiger Gabe von Cimetidin ist mit einer Erhöhung der Urapidil-Serumspiegelmaxima um 15 % zu rechnen. Daher sollte eine Dosisreduktion erwogen werden.
Die folgende gleichzeitige Verabreichung bedarf besonderer Vorsicht:
- Imipramin und Neuroleptika: blutdrucksenkende Wirkung und Risiko von orthostatischer Hypotonie
- Kortikoide: Reduktion der blutdrucksenkenden Wirkung durch Wasser-Natrium-Retention
ACE-Hemmer
Da noch keine ausreichenden Erfahrungen in der Kombinationsbehandlung mit ACE-Hemmern vorliegen, wird diese derzeit nicht empfohlen.
4.6 Schwangerschaft und Stillzeit
URAPIDIL i.v. Carino soll während der Schwangerschaft nur bei zwingender Indikation verabreicht werden, da bisher keine Erfahrungen über die Sicherheit einer Anwendung im ersten und zweiten Trimester und nur unzureichende Erfahrungen mit dem Einsatz im dritten Trimester vorliegen. Tierexperimentelle Studien haben keine Anhaltspunkte für eine Keimschädigung ergeben. URAPIDIL i.v. Carino darf in der Stillzeit nicht verabreicht werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Durch individuell auftretende unterschiedliche Reaktionen kann das Reaktionsvermögen so weit verändert sein, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr, zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Maße bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenhang mit Alkohol.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (<1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Die folgenden unerwünschten Wirkungen wurden nach Gabe von Urapidil berichtet:
Erkrankungen des Blutes und des Lymphsystems
|
Sehr selten: |
Thrombozytopenie |
|
Psychiatrische Erkrankungen Sehr selten: |
Unruhe |
|
Erkrankungen des Nervensystems Häufig: |
Schwindel, Kopfschmerzen |
|
Herzerkrankungen Gelegentlich: |
Herzklopfen, Tachykardie oder Bradykardie, Druckgefühl hinter dem Brustbein, Atemnot, Herzrhythmusstörungen |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums | |
|
Selten: |
verstopfte Nase |
|
Erkrankungen des Gastrointestinaltrakts | |
|
Häufig: |
Übelkeit |
|
Gelegentlich: |
Erbrechen |
|
Erkrankungen der Haut und des Unterzellgewebes | |
|
Gelegentlich: |
Schweißausbruch |
|
Selten: |
allergische Erscheinungen (Juckreiz, Hautrötung, Exantheme) |
|
Erkrankungen der Geschlechtsorgane und Brustdrüse | |
|
Selten: |
Priapismus |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |
|
Gelegentlich: |
Müdigkeit |
|
Sehr selten: |
Asthenie |
|
Untersuchungen Gelegentlich: |
unregelmäßige Herzschlagfolge |
|
Sehr selten: |
Verminderung der Thrombozytenzahl |
In der Mehrzahl der Fälle sind die oben aufgeführten Nebenwirkungen auf eine zu rasche Blutdrucksenkung zurückzuführen; erfahrungsgemäß verschwinden sie jedoch innerhalb von Minuten, auch während der Langzeitinfusion, so dass in Abhängigkeit vom Schweregrad der Nebenwirkung über die Unterbrechung der Behandlung entschieden werden muss.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de, anzuzeigen.
4.9 Überdosierung
Als Folge einer Überdosierung können verstärkt Nebenwirkungen auftreten wie z.B.
- seitens des Kreislaufs: Schwindel, Orthostasesyndrom und Kollaps
- seitens des Zentralnervensystems: Müdigkeit und verminderte Reaktionsfähigkeit (siehe Abschnitt 4.8).
Therapie bei Überdosierung:
Eine übermäßige Blutdrucksenkung kann durch Hochlagern der Beine und Volumensubstitution gebessert werden. Falls diese Maßnahmen nicht ausreichen, können gefäßverengende Präparate langsam und unter Blutdruckkontrolle i.v. injiziert werden. In ganz seltenen Fällen ist die Gabe von Katecholaminen (z.B. Adrenalin, 0,5 - 1,0 mg auf 10 ml mit isotonischer Natriumchloridlösung verdünnt) notwendig.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antihypertonikum, ATC-Code: C02CA06
Urapidil führt zu einer Senkung des systolischen und diastolischen Blutdrucks durch Verminderung des peripheren Widerstandes. Die Herzfrequenz bleibt weitgehend konstant oder steigt nur geringfügig reflektorisch an.
Das Herzzeitvolumen wird nicht verändert; ein infolge erhöhter Nachlast vermindertes Herzzeitvolumen kann ansteigen.
Wirkungsmechanismus:
Urapidil hat zentrale und periphere Angriffspunkte. Peripher blockiert Urapidil vorwiegend postsynaptische Alpha-1-Rezeptoren und hemmt somit den vasokonstriktorischen Angriff der Katecholamine.
Zentral moduliert Urapidil die Aktivität der Kreislaufregulationszentren; dadurch wird eine reflektorische Zunahme des Sympathikotonus verhindert oder der Sympathikotonus gesenkt.
5.2 Pharmakokinetische Eigenschaften
Nach intravenöser Applikation von 25 mg Urapidil wird ein biphasischer Verlauf (initiale Verteilungsphase, terminale Eliminationsphase) der Konzentration im Blut gemessen. Die Verteilungsphase hat eine Halbwertszeit von ca. 35 min. Das Verteilungsvolumen beträgt 0,8 (0,6 -1,2) l/kg.
Die Metabolisierung von Urapidil erfolgt vorwiegend in der Leber. Der Hauptmetabolit ist ein am Phenylkern in 4-Stellung hydroxiliertes Urapidil, welches keine nennenswerte antihypertensive
Wirkung hat. Der Metabolit O-demethyliertes Urapidil verfügt etwa über die gleiche biologische Aktivität wie Urapidil, entsteht aber nur in geringem Umfang.
Die Elimination von Urapidil sowie seiner Metaboliten erfolgt beim Menschen zu 50 - 70 % renal, davon ca. 15 % der applizierten Dosis als pharmakologisch aktives Urapidil; der Rest wird als Metaboliten, primär als nicht blutdrucksenkendes para-hydroxyliertes Urapidil fäkal ausgeschieden. Für die Halbwertszeit der Elimination aus dem Serum wurden 2,7 (1,8 - 3,9) h nach intravenöser Bolusinjektion gemessen.
Die Plasma-Eiweißbindung von Urapidil (Humanserum) beträgt in vitro 80 %. Diese relativ geringe Plasma-Eiweißbindung von Urapidil könnte erklären, dass bisher keine Interaktionen zwischen Urapidil und stark an Plasma-Eiweiß gebundenen Medikamenten bekannt sind.
Bei fortgeschrittener Leber- und/oder Niereninsuffizienz sowie bei älteren Patienten sind das Verteilungsvolumen und die Clearance von Urapidil reduziert, die Eliminationshalbwertszeit ist verlängert.
Die Substanz penetriert die Blut-Hirn-Schranke und ist placentagängig.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Reproduktionstoxizität, Genotoxizität und zum kanzerogenen Potential lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Propylenglykol, Natriumdihydrogenphosphat-Dihydrat, Dinatriumhydrogenphosphat, Wasser für Injektionszwecke, zur pH-Einstellung: Salzsäure 36 % und Natriumhydroxid
6.2 Inkompatibilitäten
URAPIDIL i.v. Carino soll nicht mit alkalischen Injektions- und Infusionslösungen gemischt werden, da es aufgrund der sauren Eigenschaften der Injektionslösungen zu einer Trübung oder Ausflockung kommen kann.
6.3 Dauer der Haltbarkeit
Die Dauer der Haltbarkeit beträgt 3 Jahre.
Dieses Arzneimittel soll nach Ablauf des Verfalldatums nicht mehr angewendet werden.
Die chemische und physikalische Stabilität der gebrauchsfertigen Zubereitung wurde für 24 Stunden bei 25 °C nachgewiesen. Aus mikrobiologischer Sicht sollte die gebrauchsfertige Zubereitung sofort verwendet werden. Wenn die gebrauchsfertige Zubereitung nicht sofort verwendet wird, ist der Anwender für die Dauer und die Bedingungen der Aufbewahrung verantwortlich.
Für eine angebrochene Ampulle ist die Haltbarkeit für 24 Stunden bei einer Aufbewahrung von 2-8°C nachgewiesen.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses OPC-Glas-Ampullen (Klarglas Typ I gemäß Ph.Eur.).
Packungsgrößen
URAPIDIL 25 mg i.v. Carino: Packung mit 5 Ampullen zu je 5 ml (= 25 mg Urapidil),
Packung mit 50 (10 x 5) Ampullen zu je 5 ml (= 25 mg Urapidil). URAPIDIL 50 mg i.v. Carino: Packung mit 5 Ampullen zu je 10 ml (= 50 mg Urapidil),
Packung mit 50 (10 x 5) Ampullen zu je 10 ml (= 50 mg Urapidil). URAPIDIL 100 mg i.v. Carino: Packung mit 5 Ampullen zu je 20 ml (= 100 mg Urapidil),
Packung mit 50 (10 x 5) Ampullen zu je 20 ml (= 100 mg Urapidil).
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
CARINOPHARM GmbH Bahnhofstraße 18 31008 Elze
Telefon: 0180 2 1234-01*
Telefax: 0180 2 1234-02*
* 0,06 € pro Anruf aus dem deutschen Festnetz; Mobilfunkhöchstpreise: 0,42 € pro Minute
8. ZULASSUNGSNUMMERN
URAPIDIL 25 mg i.v. Carino: 64904.00.00
URAPIDIL 50 mg i.v. Carino: 64906.00.00
URAPIDIL 100 mg i.v. Carino: 71477.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
URAPIDIL 25 mg i.v. Carino: 21.03.2007/27.02.2013
URAPIDIL 50 mg i.v. Carino: 21.03.2007/27.02.2013
URAPIDIL 100 mg i.v. Carino: 07.08.2009/14.04.2014
10. STAND DER INFORMATION
07/2014
11. VERSCHREIBUNGSSTATUS / ABGABEPFLICHT
Verschreibungspflichtig