Urapidil-Carinopharm I.v. 25 Mg
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
Urapidil-Pharmore i.v. 25 mg, Injektionslösung
Wirkstoff: Urapidil
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker.
Diese Packungsbeilage beinhaltet:
1. Was ist Urapidil-Pharmore i.v. 25 mg und wofür wird es angewendet?
2. Was müssen Sie vor der Anwendung von Urapidil-Pharmore i.v. 25 mg beachten?
3. Wie ist Urapidil-Pharmore i.v. 25 mg anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Urapidil-Pharmore i.v. 25 mg aufzubewahren?
6. Weitere Informationen
1. WAS IST Urapidil-Pharmore i.v. 25 mg UND WOFÜR WIRD ES ANGEWENDET?
Urapidil-Pharmore i.v. 25 mg ist ein Arzneimittel zur Blutdrucksenkung (Alpha-Rezeptorantagonist /
Synthetisches Antihypertonikum).
Urapidil-Pharmore i.v. 25 mg wird angewendet bei:
- hypertensiven Notfällen (z.B. krisenhaftem Blutdruckanstieg)
- schweren bzw. schwersten Formen der Bluthochdruckkrankheit
- nicht therapierbarem Bluthochdruck
- zur kontrollierten Blutdrucksenkung bei Patienten mit Bluthochdruck während und/oder nach Operationen.
2. WAS MÜSSEN SIE VOR DER ANWENDUNG VON Urapidil-Pharmore i.v. 25 mg BEACHTEN?
Urapidil Pharmore i.v. 25 mg darf nicht angewendet werden,
- wenn Sie überempfindlich (allergisch) gegen Urapidil oder einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels sind, bei einer Verengung der Hauptschlagader (Aortenisthmusstenose) und bei einer krankhaften Verbindung zwischen einer Arterie und einer Vene (arteriovenösem Shunt (hämodynamisch nicht wirksamer Dialyse-Shunt ausgenommen)).
Besondere Vorsicht bei der Anwendung von Urapidil-Pharmore i.v. 25 mg ist erforderlich,
- bei Herzmuskelschwäche (Herzinsuffizienz), deren Ursache in einer mechanischen Funktionsbehinderung liegt, wie z.B. Herzklappenverengungen (Aortenklappen- oder Mitralklappenstenose), bei Lungenembolie oder bei durch Herzbeutelerkrankungen (Perikarderkrankungen) bedingter Einschränkung der Herzaktion
- bei Kindern, da keine Untersuchungen hierzu vorliegen
- bei Patienten mit Leberfunktionsstörungen
- bei Patienten mit mäßiger bis schwerer Nierenfunktionsstörung
- bei älteren Patienten
- bei Patienten, die gleichzeitig Cimetidin (Arzneimittel zur Verminderung der Magensäure) erhalten (siehe Abschnitt: „Bei Anwendung von Urapidil-Pharmore i.v. 25 mg mit anderen Arzneimitteln“).
In diesen Fällen, wenden Sie sich bitte an Ihren Arzt.
Falls Urapidil-Pharmore i.v. 25 mg als zusätzliches blutdrucksenkendes Medikament gegeben wird:
- Es sollte ausreichend lange auf den Wirkungseintritt des/der zuvor gegebenen blutdrucksenkenden Mittel(s) gewartet werden. Ihr Arzt wird die Dosierung von Urapidil-Pharmore i.v. 25 mg entsprechend niedriger wählen. Zu rascher Blutdruckabfall kann zu Verlangsamung der Herztätigkeit (Bradykardie) oder Herzstillstand führen.
Die blutdrucksenkende Wirkung von Urapidil-Pharmore i.v. 25 mg kann durch folgende Einflüsse verstärkt werden:
- durch Volumenmangelzustände, die durch Durchfall oder Erbrechen hervorgerufen werden können
- durch eine gleichzeitige Anwendung unter Alkoholeinfluss.
Bei Anwendung von Urapidil-Pharmore i.v. 25 mg mit anderen Arzneimitteln
Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen oder anwenden bzw. vor kurzem eingenommen oder angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
Blutdrucksenkende Arzneimittel
Die blutdrucksenkende Wirkung von Urapidil-Pharmore i.v. 25 mg kann durch gleichzeitig verabreichte Alpha-Rezeptorenblocker (bestimmte blutdrucksenkende Arzneimittelgruppe und zur Behandlung von Erkrankungen des Harntraktes) und durch andere blutdrucksenkende Arzneimittel verstärkt werden.
Baclofen (zur Behandlung von Muskelkrämpfen)
Die Kombination von Urapidil mit Baclofen ist nur mit Vorsicht in Erwägung zu ziehen, da Baclofen die blutdrucksenkende Wirkung steigern kann.
Cimetidin (Arzneimittel zur Verminderung der Magensäure)
Bei gleichzeitiger Gabe von Cimetidin ist mit einer Erhöhung der Urapidil-Konzentration im Blut um 15 % zu rechnen.
Die folgende gleichzeitige Verabreichung bedarf besonderer Vorsicht:
- Imipramin und Neuroleptika ( zur Behandlung von Depressionen)
- Kortikoide (entzündungshemmende Arzneimittel)
ACE-Hemmer (Arzneimittel gegen Bluthochdruck und Herzerkrankungen)
Da noch keine ausreichenden Erfahrungen in der Kombinationsbehandlung mit ACE-Hemmern vorliegen, wird diese derzeit nicht empfohlen.
Schwangerschaft und Stillzeit
Urapidil-Pharmore i.v. 25 mg soll während der Schwangerschaft nur bei zwingender Indikation verabreicht werden, da bisher keine Erfahrungen über die Sicherheit einer Anwendung im ersten und zweiten Trimester und nur unzureichende Erfahrungen mit dem Einsatz im dritten Trimester vorliegen. Tierexperimentelle Studien haben keine Anhaltspunkte für eine Keimschädigung ergeben..
Urapidil-Pharmore i.v. 25 mg darf in der Stillzeit nicht verabreicht werden.
Verkehrstüchtigkeit und das Bedienen von Maschinen
Sie dürfen sich nicht an das Steuer eines Fahrzeuges setzen und keine Werkzeuge oder Maschinen bedienen, weil das Reaktionsvermögen beeinträchtigt werden kann. Dies gilt in verstärktem Maße bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenhang mit Alkohol.
Wichtige Informationen über bestimmte sonstige Bestandteile von Urapidil-Pharmore i.v. 25 mg
Urapidil-Pharmore i.v. 25 mg enthält weniger als 1 mmol (23 mg) Natrium pro Ampulle, d.h. es ist nahezu natriumfrei.
3. WIE IST Urapidil-Pharmore i.v. 25 mg ANZUWENDEN?
Die Anwendung von Urapidil-Pharmore i.v. 25 mg erfolgt durch Ihren Arzt. Ihr Arzt bestimmt die für Sie geeignete Dosierung und erforderliche Behandlungsdauer.
Urapidil-Pharmore i.v. 25 mg sollte immer genau nach dessen Anweisungen angewendet werden. Bitte fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht ganz sicher sind.
Urapidil-Pharmore i.v. 25 mg wird intravenös als Injektion oder Infusion am liegenden Patienten verabreicht. Sowohl ein- oder mehrmalige Injektionen als auch intravenöse Langzeitinfusionen sind möglich. Injektionen lassen sich mit anschließender Langzeitinfusion kombinieren. Überlappend mit dieser Injektion bzw. Infusion während der Akuttherapie ist der Übergang auf eine Dauertherapie mit einem Blutdrucksenker zum Einnehmen in Form von Tabletten, Kapseln oder Ähnlichem möglich. Unbedenklich ist eine Behandlungsdauer von 7 Tagen, die im Allgemeinen bei Anwendung unter Umgehung des Magen-Darm-Trakts (parenteraler) blutdrucksenkender (antihypertensiver) Therapie auch nicht überschritten wird. Eine parenterale Wiederholungsbehandlung bei erneut auftretendem Blutdruckanstieg ist möglich.
Wie oft und in welchen Mengen sollte Urapidil-Pharmore i.v. 25 mg angewendet werden?
Bei krisenhaft stark ansteigendem Bluthochdruck (Hypertensiver Notfall), schwere und schwerste Formen des Bluthochdrucks (der Hypertonie) und therapieresistente Hypertonie
1) Intravenöse Injektion:
Als Injektion werden 10 - 50 mg Urapidil langsam - unter laufender Blutdruckkontrolle - intravenös verabreicht.
Innerhalb von 5 min nach der Injektion ist eine blutdrucksenkende Wirkung zu erwarten.
Abhängig vom Blutdruckverhalten kann die Injektion von Urapidil-Pharmore i.v. 25 mg wiederholt werden.
2) Intravenöse Dauertropfinfusion oder kontinuierliche Infusion per Perfusor(Dosierpumpe zur fortwährenden intravenösen Verabreichung von Medikamenten):
Die Dauertropfinfusionslösung zur Aufrechterhaltung des durch die Injektion erreichten Blutdruckniveaus wird folgendermaßen hergestellt:
Zu 500 ml einer kompatiblen Infusionslösung, z.B. physiologischer Kochsalzlösung, 5- oder 10%iger Glucoselösung, gibt man im Allgemeinen 250 mg Urapidil (10 Ampullen Urapidil-Pharmore i.v. 25 mg).
Bei Verwendung eines Perfusors zur Gabe der Erhaltungsdosis werden 20 ml Injektionslösung (= 100 mg Urapidil) in einer Perfusor-Spritze aufgezogen und bis zu einem Volumen von 50 ml mit einer kompatiblen Infusionslösung (siehe oben) verdünnt.
Die kompatible Höchstmenge beträgt 4 mg Urapidil pro ml Infusionslösung.
Anwendungshinweis:
Urapidil-Pharmore i.v. 25 mg soll nicht mit alkalischen Injektions- und Infusionslösungen gemischt werden, da es aufgrund der sauren Eigenschaften der Injektionslösungen zu einer Trübung oder Ausflockung kommen kann.
Applikationsgeschwindigkeit:
Die Tropfgeschwindigkeit richtet sich nach dem individuellen Blutdruckverhalten.
Initiale Richtgeschwindigkeit:
2 mg/min
Erhaltungsdosis:
Im Mittel 9 mg/h, bezogen auf 250 mg Urapidil zusätzlich zu 500 ml Infusionslösung entspricht 1 mg = 44 Tropfen = 2,2 ml.
Dosierungsschema:
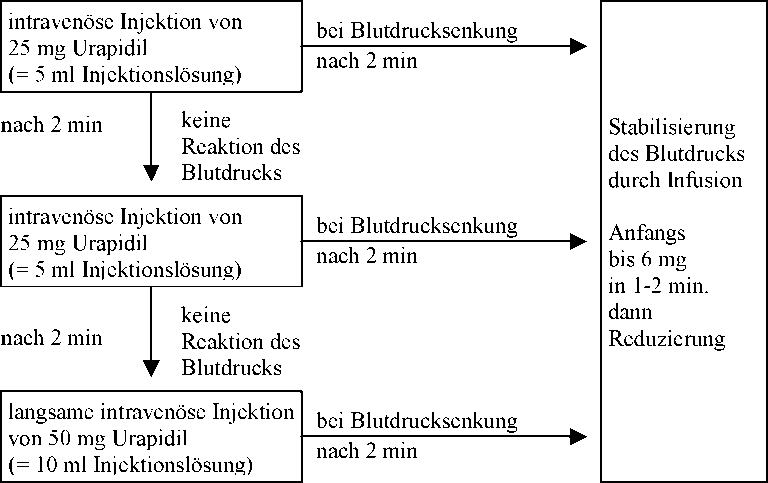
Kontrollierte Blutdrucksenkung bei Blutdruckanstiegen während und/oder nach Operationen
Zur Aufrechterhaltung des durch die Injektion erreichten Blutdruckniveaus kommen kontinuierliche Infusion per Perfusor oder Dauertropfinfusion zur Anwendung.
Ältere Patienten
Bei älteren Patienten müssen blutdrucksenkende Mittel mit entsprechender Vorsicht und zu Beginn in kleineren Dosen verabreicht werden, da bei diesen Patienten die Empfindlichkeit gegenüber derartigen Präparaten oftmals verändert ist.
Patienten mit Nieren- und/oder Leberfunktionsstörungen
Bei Patienten mit Nieren- und/oder Leberfunktionsstörungen kann eine Dosisverringerung von Urapidil-Pharmore i.v. 25 mg erforderlich sein.
Kinder
Die für dieses Präparat in Frage kommenden Anwendungsgebiete (Indikationen) sind in der Kinderheilkunde äußerst selten. Erfahrungen liegen nicht vor.
Wenn eine größere Menge von Urapidil-Pharmore i.v. 25 mg angewendet wurde, als vorgesehen
Als Folge einer Überdosierung können verstärkt Nebenwirkungen auftreten wie z.B.
- seitens des Kreislaufs: Schwindel, Ohrensausen, Schwarzwerden vor den Augen (Orthostasesyndrom) und Kollaps
- seitens des Zentralnervensystems: Müdigkeit und verminderte Reaktionsfähigkeit (siehe auch Abschnitt 4. “Welche Nebenwirkungen sind möglich?”).
Therapie bei Überdosierung:
Eine übermäßige Blutdrucksenkung kann durch Hochlagern der Beine und Infusion von kreislaufstabilisierenden Lösungen (Volumensubstitution) gebessert werden. Falls diese Maßnahmen nicht ausreichen, können gefäßverengende Präparate langsam und unter Blutdruckkontrolle intravenös injiziert werden. In ganz seltenen Fällen ist die Gabe von Katecholaminen (z.B. Adrenalin, 0,5 - 1,0 mg auf 10 ml mit isotonischer Natriumchloridlösung verdünnt) notwendig.
Wenn Sie weitere Fragen zur Anwendung des Arzneimittels haben, fragen Sie Ihren Arzt oder Apotheker.
4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Informieren Sie bitte Ihren Arzt oder Apotheker, wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt:
|
Sehr häufig: |
mehr als 1 Behandelter von 10 |
|
Häufig: |
1 bis 10 Behandelte 100 |
|
Gelegentlich: |
1 bis 10 Behandelte von 1.000 |
|
Selten: |
1 bis 10 Behandelte von10.000 |
|
Sehr selten: |
weniger als 1 Behandelter von 10.000 |
|
Nicht bekannt: |
Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar |
Die folgenden Nebenwirkungen wurden nach Anwendung von Urapidil berichtet: Erkrankungen des Blutes und des Lymphsystems:
Sehr selten: Störung in der Blutgerinnung (Verminderung der
Thrombozytenzahl)
Psychiatrische Erkrankungen
Sehr selten: Unruhe
Erkrankungen des Nervensystems
Häufig: Schwindel, Kopfschmerzen
Herzerkrankungen
Gelegentlich: Herzklopfen, Beschleunigung oder Verlangsamung der
Herzschlagfolge (Tachykardie oder Bradykardie), Druckgefühl hinter dem Brustbein, Atemnot, unregelmäßige Herzschlagfolge (Herzrhythmusstörungen)
Erkrankungen der Atemwege, des Brustraums und Mediastinums Selten: verstopfte Nase
Erkrankungen des Magen-Darm-Trakts (Gastrointestinaltrakts)
Häufig: Übelkeit
Gelegentlich: Erbrechen
Erkrankungen der Haut und des Unterhautzellgewebes Gelegentlich: Schweißausbruch
Selten: allergische Erscheinungen (Juckreiz, Hautrötung,
Exantheme)
Erkrankungen der Geschlechtsorgane und Brustdrüse
Selten:
Dauererektion (Priapismus)
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Gelegentlich: Müdigkeit
Sehr selten: Schwächegefühl
In der Mehrzahl der Fälle sind die oben aufgeführten Nebenwirkungen auf eine zu rasche Blutdrucksenkung zurückzuführen. Erfahrungsgemäß verschwinden sie jedoch innerhalb von Minuten, auch während der Langzeitinfusion. In Abhängigkeit vom Schweregrad der Nebenwirkung muss über die Unterbrechung der Behandlung entschieden werden.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem
Bundesinstitut für Arzneimitte und Medizinprodukte,
Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. WIE IST Urapidil-Pharmore i.v. 25 mg AUFZUBEWAHREN?
Arzneimittel für Kinder unzugänglich aufbewahren.
Sie dürfen das Arzneimittel nach dem auf dem Etikett und dem Umkarton angegebenen Verfalldatum nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Aufbewahrungsbedingungen:
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Hinweis auf Haltbarkeit nach Anbruch oder Zubereitung
Die chemische und physikalische Stabilität der gebrauchsfertigen Zubereitung wurde für 24 Stunden bei 25 °C nachgewiesen. Aus mikrobiologischer Sicht sollte die gebrauchsfertige Zubereitung sofort verwendet werden. Wenn die gebrauchsfertige Zubereitung nicht sofort verwendet wird, ist der Anwender für die Dauer und die Bedingungen der Aufbewahrung verantwortlich.
Für eine angebrochene Ampulle ist die Haltbarkeit für 24 Stunden bei einer Aufbewahrung von 2-8°C nachgewiesen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
6. WEITERE INFORMATIONEN Was Urapidil-Pharmore i.v. 25 mg enthält
Der Wirkstoff ist Urapidil. 5 ml Injektionslösung enthalten 25 mg Urapidil.
- Die sonstigen Bestandteile sind Propylenglykol, Natriumdihydrogenphosphat-Dihydrat,
Dinatriumhydrogenphosphat, Wasser für Injektionszwecke, zur pH-Einstellung: Salzsäure 36 % und Natriumhydroxid.
Wie Urapidil-Pharmore i.v. 25 mg aussieht und Inhalt der Packung
Urapidil-Pharmore i.v. 25 mg Injektionslösung ist ist eine klare, farblose Lösung, abgefüllt in OPC-Glas-Ampullen (Klarglas Typ I gemäß Ph.Eur.).
Urapidil-Pharmore i.v. 25 mg ist in folgenden Packungsgrößen erhältlich:
Packung mit 5 Ampullen zu je 5 ml (= 25 mg Urapidil),
Packung mit 50 (10 x 5) Ampullen zu je 5 ml (= 25 mg Urapidil).
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Pharmazeutischer Unternehmer
Pharmore GmbH Gildestr. 75 49479 Ibbenbüren
Hersteller
HELM AG Nordkanalstr. 28 20097 Hamburg