Vagifem
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
Vagifem 25 Mikrogramm Vaginaltabletten
Estradiol
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt
4.
Was in dieser Packungsbeilage steht:
1. Was ist Vagifem und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Vagifem beachten?
3. Wie ist Vagifem anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Vagifem aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist Vagifem und wofür wird es angewendet?
Vagifem enthält Estradiol.
• Estradiol ist ein weibliches Sexualhormon
• Es gehört zu den Estrogenen
• Es ist mit dem Estradiol, das in den weiblichen Eierstöcken produziert wird, identisch.
Vagifem gehört zu der Gruppe von Arzneimitteln, die zur lokalen Hormonersatztherapie (HRT) angewendet werden.
Es wird angewendet, um Wechseljahresbeschwerden in der Scheide wie z. B. Trockenheit oder Reizerscheinungen zu lindern. In der medizinischen Fachsprache wird diese Erkrankung als vaginale Atrophie bezeichnet. Sie wird verursacht durch einen Abfall des Spiegels an weiblichem Geschlechtshormon (Estrogen), der normalerweise nach der letzten natürlichen Periodenblutung (Menopause) auftritt. Vagifem wird bei Frauen nach der letzten natürlichen Periodenblutung (der Menopause) angewendet.
Vagifem ersetzt das Estrogen, das normalerweise in den Eierstöcken der Frau produziert wird. Es wird in die Vagina eingeführt, auf diese Weise wird das Hormon dort freigesetzt, wo es benötigt wird. Dadurch werden vaginale Beschwerden gelindert.
Bei Frauen, die älter als 65 Jahre sind, sind die therapeutischen Erfahrungen begrenzt.
2. Was sollten Sie vor der Anwendung von Vagifem beachten?
Krankengeschichte und regelmäßige Kontrolluntersuchungen
Eine Hormonersatzbehandlung ist mit Risiken verbunden, welche vor der Entscheidung, die Behandlung zu beginnen bzw. fortzusetzen, beachtet werden müssen.
Bevor Sie eine Hormonersatzbehandlung beginnen (oder wieder aufnehmen), wird Ihr Arzt Ihre eigene Krankengeschichte und die Ihrer Familie erfassen. Ihr Arzt wird über die Notwendigkeit einer körperlichen Untersuchung entscheiden. Dies kann, falls erforderlich, eine Untersuchung der Brüste und/oder eine Unterleibsuntersuchung umfassen.
Gehen Sie bitte regelmäßig, wie von Ihrem Arzt empfohlen, zur Vorsorgeuntersuchung Ihrer Brüste. Vagifem darf nicht angewendet werden,
wenn nachfolgend genannte Punkte auf Sie zutreffen. Wenn Sie sich nicht sicher sind, ob dies der Fall ist, sprechen Sie mit Ihrem Arzt, bevor Sie Vagifem anwenden.
Sie dürfen Vagifem nicht anwenden, wenn
• Sie überempfindlich (allergisch) gegen Estradiol oder einen der in Abschnitt 6 genannten sonstigen Bestandteile dieses Arzneimittels sind
• Sie an Brustkrebs erkrankt sind oder früher einmal erkrankt waren bzw. ein entsprechender Verdacht besteht
• Sie an einer Form von Krebs leiden oder früher einmal gelitten haben, dessen Wachstum von Estrogen abhängig ist, z. B. Krebs der Gebärmutterschleimhaut oder ein entsprechender Verdacht besteht
• vaginale Blutungen unklarer Ursache auftreten
• eine unbehandelte übermäßige Verdickung der Gebärmutterschleimhaut
(Endometriumhyperplasie) vorliegt, die nicht behandelt wird
• sich bei Ihnen ein Blutgerinnsel in einer Vene (Thrombose) gebildet hat bzw. früher einmal gebildet hatte, z. B. in den Beinen (Thrombose in den tiefen Venen) oder in der Lunge (Lungenembolie)
• Sie unter einer Blutgerinnungsstörung leiden (z. B. Protein-C-, Protein-S- oder AntithrombinMangel)
• Sie eine Krankheit haben bzw. früher einmal hatten, die durch Blutgerinnsel in den Arterien verursacht wird, z. B. Herzinfarkt, Schlaganfall oder anfallsartig auftretende Brustschmerzen mit Brustenge (Angina pectoris)
• Sie eine Lebererkrankung haben oder früher einmal hatten und sich die Leberfunktionswerte noch nicht wieder normalisiert haben
• Sie unter einer seltenen erblich bedingten Blutkrankheit leiden, der so genannten Porphyrie
Wenn eine der oben genannten Krankheiten während der Anwendung von Vagifem erstmalig auftritt, beenden Sie bitte sofort die Behandlung und suchen Sie unverzüglich Ihren Arzt auf.
Warnhinweise und Vorsichtsmaßnahmen
Sprechen Sie mit Ihrem Arzt, wenn Sie jemals von einem der nachfolgend aufgeführten gesundheitlichen Problemen betroffen waren. In diesem Fall sollten Sie Ihren Arzt häufiger zur Durchführung von Kontrolluntersuchungen aufsuchen. Vagifem wird, im Gegensatz zu systemisch verabreichtem Estrogen, lokal in der Vagina angewendet, und die Aufnahme in das Blut ist sehr gering. Es ist daher sehr unwahrscheinlich, dass die unten aufgeführten Erkrankungen wiederkehren oder sich während der Behandlung mit Vagifem verschlechtern.
• Asthma
• Epilepsie
• Zuckerkrankheit (Diabetes)
• Gallensteine
• Bluthochdruck
• Migräne oder starke Kopfschmerzen
• Lebererkrankung, z. B. ein gutartiger Lebertumor
• Wachstum von Gebärmutterschleimhaut außerhalb der Gebärmutter (Endometriose) oder früher aufgetretenes übermäßiges Wachstum der Gebärmutterschleimhaut (Endometriumhyperplasie)
• Erkrankung, die das Trommelfell und das Gehör beeinträchtigt (Otosklerose)
• Erkrankung des Immunsystems, die viele Organfunktionen des Körpers beeinträchtigt (systemischer Lupus erythematodes, SLE)
• erhöhtes Risiko für estrogenabhängigen Krebs (z. B. wenn Ihre Mutter, Schwester oder Großmutter Brustkrebs hatten)
• erhöhtes Risiko für die Bildung von Blutgerinnseln (siehe „Venöse Blutgerinnsel (Thrombosen)“)
• Gutartige Geschwülste in der Gebärmutter (Myome)
• Sehr hohe Blutfettwerte (Triglyceride)
• Flüssigkeitseinlagerung infolge von Herz- oder Nierenerkrankungen.
Sie müssen die Behandlung sofort abbrechen und einen Arzt aufsuchen
wenn während der Anwendung der Hormonersatzbehandlung eine der folgenden Krankheiten bzw. Situationen auftritt:
• Migräneartige Kopfschmerzen, die erstmalig auftreten
• Gelbfärbung Ihrer Haut oder des Weißen Ihrer Augen (Gelbsucht). Dies kann auf eine Lebererkrankung hinweisen.
• Deutliche Erhöhung Ihres Blutdrucks (Beschwerden können Kopfschmerzen, Müdgkeit und Schwindel sein)
• Krankheiten, die im Abschnitt „Vagifem darf nicht angewendet werden“ erwähnt sind
• wenn Sie schwanger werden
• wenn Sie Anzeichen für Blutgerinnsel bemerken, z. B.
- schmerzhafte Schwellung und Rötung der Beine
- plötzliche Brustschmerzen
- Atemnot
Weitere Information hierzu finden Sie unter „Venöse Blutgerinnsel (Thrombosen)“
Die folgenden Risiken treffen für HRT-Arzneimittel zu, die im Blut zirkulieren. Es ist nicht bekannt, ob diese Risiken auf lokal verabreichte Therapien wie Vagifem zutreffen.
Hormonersatzbehandlung und Krebs
Übermäßige Verdickung der Gebärmutterschleimhaut (Endometriumhyperplasie) und Krebs der Gebärmutterschleimhaut (Endometriumkarzinom)
Während einer Estrogen-Monotherapie erhöht sich das Risiko für Krebs der Gebärmutterschleimhaut (Endometrium).
Es ist nicht sicher, ob eine Langzeitbehandlung (länger als ein Jahr) oder wiederholte Anwendung von vaginal verabreichten Estrogenprodukten ein ähnliches Risiko haben.
Es konnte nachgewiesen werden, dass Vagifem zu Beginn der Behandlung zu einem sehr geringen Anteil systemisch resorbiert wird, weshalb die zusätzliche Gabe von Gestagen hier nicht empfohlen wird.
Falls Sie Durchbruch- oder Schmierblutungen haben, ist dies normalerweise kein Grund, beunruhigt zu sein, aber Sie sollten sich einen Termin bei Ihrem Arzt geben lassen. Dies könnte ein Anzeichen dafür sein, dass Ihr Endometrium dicker geworden ist.
Brustkrebs
Es gibt Hinweise auf ein erhöhtes Brustkrebsrisiko bei kombinierter Hormonersatzbehandlung mit Estrogen und Gestagen und möglicherweise auch bei alleiniger Anwendung von Estrogen. Das zusätzliche Risiko hängt von der Dauer der Hormonersatzbehandlung ab und zeigt sich innerhalb weniger Jahre. Nach Beendigung der Behandlung kehrt das Risiko jedoch innerhalb weniger Jahre (meist 5 Jahre) wieder zurück auf den Stand bei Nichtanwenderinnen. Bei Frauen, deren Gebärmutter entfernt wurde und die eine Hormonersatzbehandlung mit Estrogen-Monopräparaten 5 Jahre lang anwenden, wurde kein oder nur ein geringfügig erhöhtes Brustkrebsrisiko nachgewiesen.
Zum Vergleich
Bei Frauen im Alter von 50 bis 79 Jahren, die keine Hormonersatzbehandlung anwenden, werden durchschnittlich 9 bis 17 Brustkrebsfälle pro 1.000 Frauen innerhalb eines Zeitraums von 5 Jahren diagnostiziert. Bei Frauen im Alter von 50 bis 79 Jahren, die eine kombinierte Hormonersatzbehandlung mit Estrogen und Gestagen über 5 Jahre anwenden, beträgt die Anzahl 13 bis 23 Fälle pro 1.000 Frauen (d. h. 4 bis 6 zusätzliche Fälle).
Untersuchen Sie regelmäßig Ihre Brüste. Suchen Sie Ihren Arzt auf, wenn Sie Veränderungen Ihrer Brüste bemerken, z. B.
• Einziehungen (Dellenbildung) in der Haut
• Veränderungen der Brustwarzen
• Knoten, die Sie sehen oder fühlen können
Eierstockkrebs
Eierstockkrebs ist selten. Ein leicht erhöhtes Risiko, Eierstockkrebs zu entwickeln, wurde für Frauen berichtet, die über einen Zeitraum von mindestens 5 bis 10 Jahren eine Hormonersatzbehandlung angewendet haben.
Zum Vergleich
Bei Frauen im Alter zwischen 50 und 69 Jahren, die keine Hormonersatzbehandlung anwenden, werden über einen 5-Jahres-Zeitraum durchschnittlich 2 Fälle von Eierstockkrebs pro 1.000 Frauen diagnostiziert. Bei Frauen, die eine Hormonersatzbehandlung 5 Jahre lang anwenden, treten etwa 2 bis 3 Fälle pro 1.000 Anwenderinnen auf (d. h. bis zu 1 zusätzlicher Fall).
Herz-/Kreislauf-Wirkungen einer Hormonersatzbehandlung
Venöse Blutgerinnsel (Thrombosen)
Das Risiko, dass sich Blutgerinnsel in den Venen (Thrombosen) bilden, ist bei Frauen, die eine Hormonersatzbehandlung anwenden, gegenüber Nichtanwenderinnen um etwa das 1,3- bis 3fache erhöht. Ein erhöhtes Risiko besteht insbesondere während des ersten Anwendungsjahres.
Blutgerinnsel können ernsthafte Folgen haben. Wenn ein Blutgerinnsel zu den Lungen wandert, kann dies Brustenge, Atemnot oder einen Ohnmachtsanfall verursachen oder sogar zum Tod führen.
Eine höhere Wahrscheinlichkeit, dass sich ein Blutgerinnsel bildet, besteht für Sie mit zunehmendem Alter und wenn eine der nachfolgend genannten Bedingungen auf Sie zutrifft. Sprechen Sie bitte mit Ihrem Arzt, wenn auf Sie eine der folgenden Situationen zutrifft:
• wenn Sie wegen einer größeren Operation, Verletzung oder Krankheit längere Zeit nicht laufen können
• wenn Sie stark übergewichtig sind (BMI > 30 kg/m2)
• wenn Sie unter einer Gerinnungsstörung leiden, die eine medikamentöse Langzeitbehandlung zur Vorbeugung von Blutgerinnseln erfordert
• wenn jemals bei einem nahen Verwandten von Ihnen ein Blutgerinnsel im Bein, in der Lunge oder in einem anderen Organ aufgetreten ist
• wenn Sie unter einem systemischen Lupus erythematodes (SLE) leiden
• wenn Sie Krebs haben.
Bezüglich Anzeichen für Blutgerinnsel, siehe „Sie müssen die Behandlung sofort abbrechen und einen Arzt aufsuchen“.
Zum Vergleich
Betrachtet man Frauen in ihren 50ern, die keine Hormonersatzbehandlung anwenden, ist über einen 5-Jahres-Zeitraum durchschnittlich bei 4 bis 7 von 1.000 Frauen ein venöses Blutgerinnsel zu erwarten. Bei Frauen in ihren 50ern, die eine Hormonersatzbehandlung mit Estrogen und Gestagen über 5 Jahre angewendet haben, treten 9 bis 12 Thrombosefalle pro 1.000 Anwenderinnen auf (d. h. 5 zusätzliche Fälle).
Bei Frauen in ihren 50ern, deren Gebärmutter entfernt wurde und die eine Hormonersatzbehandlung nur mit Estrogen über 5 Jahre angewendet haben, treten 5 bis 8 Thrombosefälle pro 1.000 Anwenderinnen auf (d. h. 1 zusätzlicher Fall).
Herzkrankheit (Herzinfarkt)
Es liegen keine Hinweise darauf vor, dass eine Hormonersatzbehandlung einem Herzinfarkt vorbeugt. Bei Frauen, die älter als 60 Jahre sind und die eine kombinierte Hormonersatzbehandlung mit Estrogen und Gestagen anwenden, besteht im Vergleich zu Frauen, die keine Hormonersatzbehandlung anwenden, eine leicht erhöhte Wahrscheinlichkeit, eine Herzkrankheit zu entwickeln.
Das Risiko, eine Herzkrankheit zu entwickeln, ist bei Frauen, deren Gebärmutter entfernt wurde und die nur Estrogene anwenden, nicht erhöht.
Schlaganfall
Das Schlaganfallrisiko ist bei Anwenderinnen einer Hormonersatzbehandlung etwa 1,5fach höher als bei Nichtanwenderinnen. Die Anzahl der infolge der Anwendung einer Hormonersatzbehandlung zusätzlich auftretenden Schlaganfälle steigt mit zunehmendem Alter.
Zum Vergleich
Betrachtet man Frauen in ihren 50ern, die keine Hormonersatzbehandlung anwenden, sind über einen 5-Jahres-Zeitraum 8 Schlaganfälle pro 1.000 Frauen zu erwarten. Bei Frauen in ihren 50ern, die eine Hormonersatzbehandlung anwenden, sind es 11 Fälle pro 1.000 Anwenderinnen (d. h. 3 zusätzliche Fälle).
Sonstige Erkrankungszustände
Nach der Anwendung von hormonellen Substanzen, wie sie in Vagifem enthalten sind, wurden in seltenen Fällen gutartige, in noch selteneren Fällen bösartige Lebertumore, die in Einzelfällen zu lebensbedrohlichen Blutungen im Bauchraum führten, beobachtet.
Eine Hormonersatzbehandlung beugt keinen Gedächtnisstörungen vor.
Es gibt einige Hinweise auf ein erhöhtes Risiko für Gedächtnisstörungen bei Frauen, die zu Beginn der Anwendung einer Hormonersatzbehandlung älter als 65 Jahre waren. Fragen Sie hierzu Ihren Arzt um Rat.
Anwendung von Vagifem zusammen mit anderen Arzneimitteln
Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen bzw. vor kurzem eingenommen haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt. Es ist jedoch nicht wahrscheinlich, dass Vagifem die Wirkung anderer Arzneimittel beeinträchtigt. Dies liegt an der lokalen Anwendung von Vagifem in der Scheide und an der geringen Dosis des Estradiols.
Schwangerschaft und Stillzeit
Sie dürfen Vagifem in der Schwangerschaft nicht anwenden. Vagifem ist nur bei Frauen nach der Menopause vorgesehen. Wenn Sie während der Behandlung mit Vagifem schwanger werden, müssen Sie die Behandlung sofort abbrechen und Ihren Arzt aufsuchen.
Sie dürfen Vagifem in der Stillzeit nicht anwenden.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Es sind keine Auswirkungen bekannt.
3. Wie ist Vagifem anzuwenden?
Wenden Sie Vagifem immer genau nach Anweisung des Arztes an. Bitte fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht ganz sicher sind.
Anwendung dieses Arzneimittels
• Sie können mit der Behandlung mit Vagifem an jedem beliebigen Tag beginnen.
• Vagifem wird mit Hilfe des Applikators in die Scheide eingeführt.
Wenn sich Ihre Symptome durch die Behandlung nach dreimonatiger Anwendung nicht gebessert haben oder wenn Sie die Behandlung schlecht vertragen, sollten Sie Ihren Arzt aufsuchen.
Die ANWEISUNGEN FÜR DIE HANDHABUNG am Ende dieser Gebrauchsinformation zeigen Ihnen, wie Vagifem einzuführen ist. Lesen Sie diese Anweisungen sorgfältig durch, bevor Sie Vagifem anwenden.
Wie oft Sie Vagifem anwenden sollten
• Wenden Sie über die ersten zwei Wochen eine Vaginaltablette jeden Tag an
• Wenden Sie dann zweimal pro Woche eine Vaginaltablette an. Pausieren Sie zwischen den Anwendungen jeweils 3 bis 4 Tage.
Allgemeine Informationen zur Behandlung von Symptomen der Menopause
• Zur Linderung der Symptome der Menopause sollte die niedrigste wirksame Dosis angewendet und die Behandlung so kurz wie möglich gehalten werden.
• Die Behandlung sollte nur so lange fortgesetzt werden, wie der Nutzen die Risiken überwiegt. Sprechen Sie mit Ihrem Arzt darüber.
Wenn Sie eine größere Menge von Vagifem angewendet haben, als Sie sollten
• Wenn Sie eine größere Menge Vagifem angewendet haben, als Sie sollten, wenden Sie sich an Ihren Arzt oder Apotheker.
• Vagifem ist zur örtlichen Anwendung in der Scheide bestimmt. Die Dosierung von Estradiol ist so gering, dass eine beträchtliche Anzahl von Vaginaltabletten angewendet werden müsste, um die Dosierung zu erreichen, die normalerweise für die orale Therapie eingesetzt wird.
Wenn Sie die Anwendung von Vagifem vergessen haben
• Wenn Sie eine Vaginaltablette vergessen haben, wenden Sie das Arzneimittel an, sobald Sie dies bemerken.
• Wenden Sie nicht die doppelte Dosis an, wenn Sie die vorherige Anwendung vergessen haben. Wenn Sie die Anwendung von Vagifem abbrechen
Brechen Sie die Anwendung von Vagifem nicht ab, ohne dies vorher mit Ihrem Arzt zu besprechen. Ihr Arzt wird Ihnen die Auswirkungen des Abbruchs der Therapie erklären und auch andere Behandlungsmöglichkeiten mit Ihnen besprechen.
Wenn Sie weitere Fragen zur Anwendung des Arzneimittels haben, fragen Sie Ihren Arzt oder Apotheker.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann Vagifem Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Die Häufigkeit der möglichen Nebenwirkungen ist unten aufgelistet und wird entsprechend der folgenden Konvention definiert:
Sehr häufig (betrifft mehr als 1 von 10 Anwenderinnen)
Häufig (betrifft 1 bis 10 von 100 Anwenderinnen)
Gelegentlich (betrifft 1 bis 10 von 1.000 Anwenderinnen)
Selten (betrifft 1 bis 10 von 10.000 Anwenderinnen)
Sehr selten (betrifft weniger als 1 von 10.000 Anwenderinnen)
Nicht bekannt (Häufigkeiten auf Grundlage der verfügbaren Daten nicht abschätzbar)
Häufig (kann bei mehr als 1 von 100 Frauen auftreten)
• Kopfschmerzen
• Blähungen
• Übelkeit oder Erbrechen
• Verdauungsstörungen
• Bauchschmerzen, Unwohlsein
• Flüssigkeitsansammlungen in den Armen oder Beinen (Ödeme)
• Blutungen aus der Scheide, Ausfluss, Vaginalbeschwerden
• Pilzinfektion oder Entzündung in der Scheide
• Flüssigkeitsansammlungen in der Brust, Vergrößerung der Brust, Schmerzen in der Brust oder Empfindlichkeit der Brust
Sehr selten (kann bei weniger als 1 von 10.000 Frauen auftreten)
• Brustkrebs
• Krebs der Gebärmutterschleimhaut (Endometriumkarzinom)
• Endometriumhyperplasie (krankhaftes Wachstum der Gebärmutterschleimhaut)
• generalisierte Überempfindlichkeit (z. B. anaphylaktische Reaktion/Schock)
• Wassereinlagerung (Flüssigkeitsretention)
• Schlaflosigkeit
• Depressionen
• Verschlechterung von Migräne
• tiefe Venenthrombose
• Durchfall
• Nesselsucht
• Hautausschlag
• erythematöser Hautausschlag
• juckender Hautausschlag
• Juckreiz in der Scheide
• Reizungen in der Scheide
• Schmerzen in der Scheide
• schmerzhafter Scheidenkrampf (Vaginismus)
• Geschwüre in der Scheide
• Unwirksamkeit des Arzneimittels
• Gewichtszunahme
• Erhöhung des Estrogenspiegels im Blut (Blutuntersuchungen)
Die folgenden Nebenwirkungen können unter einer systemischen Estrogenbehandlung auftreten:
• Erkrankungen der Gallenblase
• verschiedene Hauterkrankungen
- Hautverfärbungen, insbesondere im Gesicht und am Hals, so genannte Schwangerschaftsflecken (Chloasma)
- schmerzhafte rötliche Hautknötchen (Erythema nodosum)
- Ausschlag mit Schießscheiben-artigen oder kreisförmigen rötlichen Flecken bzw. Entzündungen (Erythema multiforme).
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist Vagifem aufzubewahren?
Arzneimittel für Kinder unzugänglich aufbewahren.
Bewahren Sie Vagifem nicht über 25 °C auf! Nicht im Kühlschrank aufbewahren.
Sie dürfen Vagifem nach dem auf der Faltschachtel angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Das Arzneimittel darf nicht im Abwasser oder Haushaltsabfall entsorgt werden. Fragen Sie Ihren Apotheker wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr benötigen. Diese Maßnahme hilft die Umwelt zu schützen.
6. Inhalt der Packung und weitere Informationen Was Vagifem enthält:
• Der Wirkstoff ist 25 Mikrogramm Estradiol (als Estradiol-Hemihydrat). Jede Vaginaltablette enthält 25 pg Estradiol (als Estradiol-Hemidydrat).
• Die sonstigen Bestandteile sind: Hypromellose, Lactose-Monohydrat, Maisstärke und Magnesiumstearat (Ph.Eur.).
• Der Filmüberzug enthält: Hypromellose und Macrogol 6000.
Wie Vagifem aussieht und Inhalt der Packung:
Jede weiße Vaginaltablette ist in einem Applikator zum Einmalgebrauch erhältlich.
Die Vaginaltabletten tragen die Prägung NOVO 279 auf einer Seite.
Packungsgrößen
10, 12, 15, 18, 20 oder 30 Vaginaltabletten mit Applikatoren
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Pharmazeutischer Unternehmer:
Novo Nordisk Pharma GmbH Brucknerstraße 1 55127 Mainz Tel.: 06131/903-0 Fax: 06131/903-250
Hersteller:
Novo Nordisk A/S Novo Alle DK-2880 Bagsvaerd Dänemark
Diese Packungsbeilage wurde zuletzt überarbeitet im: 01/2014
ANWEISUNGEN FÜR DIE HANDHABUNG
Wie Vagifem anzuwenden ist
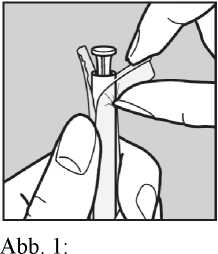
1. Reißen Sie eine Blisterpackung ab.
Öffnen Sie die Blisterpackung am Kolbenende wie in der Abbildung gezeigt.
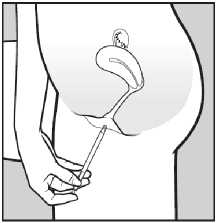
Abb. 2:
2. Führen Sie den Applikator vorsichtig in die Scheide ein, bis Sie einen leichten Widerstand spüren (8-10 cm).
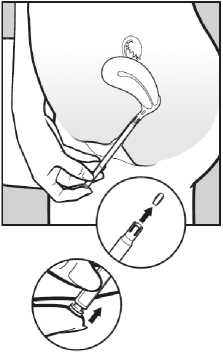
Abb. 3:
3. Um die Vaginaltablette freizusetzen, drücken Sie leicht auf den Druckknopf am Kolbenende, bis ein Klick spürbar wird. Die Vaginaltablette haftet sofort an der Scheidenwand an. Sie fällt nicht heraus, wenn Sie aufstehen oder laufen.
Abb. 4:
4. Der Applikator wird wieder herausgezogen und entsorgt.