Vanco-Cell 1000Mg
2012-03-25/B B, CW
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SPC)
1. Bezeichnung des Arzneimittels
VANCO-cell® 500 mg
Pulver zur Herstellung einer Infusionslösung oder einer Lösung zum Einnehmen VANCO-cell® 1000 mg
Pulver zur Herstellung einer Infusionslösung oder einer Lösung zum Einnehmen
2. Qualitative und quantitative Zusammensetzung
1 Durchstechflasche VANCO-cell® 500 mg mit 512,5 mg Pulver zur Herstellung einer Infusionslösung oder einer Lösung zum Einnehmen enthält 512,5 mg Vancomycinhydrochlorid* entsprechend 500 mg Vancomycin
1 Durchstechflasche VANCO-cell® 1000 mg mit 1025 mg Pulver zur Herstellung einer Infusionslösung oder einer Lösung zum Einnehmen enthält 1025 mg Vancomycinhydrochlorid* entsprechend 1000 mg Vancomycin
(* mit einer Wirksamkeit von mindestens 1050 I.E. je Milligramm Substanz, berechnet auf die wasserfreie Substanz)
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Pulver zur Herstellung einer Infusionslösung oder einer Lösung zum Einnehmen.
Fast weißes bis leicht rosa-farbenes Pulver.
4. Klinische Angaben
4.1 Anwendungsgebiete
Bei oraler Anwendung:
VANCO-cell® kann nach Auflösen eingenommen werden zur Behandlung bestimmter Darmentzündungen:
• antibiotikabedingter pseudomembranöser Enterokolitis (z.B. durch Clostridium difficile)
• Staphylokokken-Enterokolitis
Parenteral angewandt ist Vancomycin bei diesen Erkrankungen nicht wirksam.
Bei intravenöser Infusion:
Die parenterale Gabe ist auf schwere Infektionen, die durch gegen andere Antibiotika resistente Erreger verursacht sind, oder bei Patienten mit einer Allergie gegen Betalactam-Antibiotika zu begrenzen.
• Endokarditis
• Infektionen der Knochen (Osteitis, Osteomyelitis) und Gelenke
• Pneumonie
• Septikämie, Sepsis
• Weichteilinfektionen
Zur perioperativen Prophylaxe bei erhöhter Gefährdung des Patienten durch Infektionen mit grampositiven Erregern in der Herz- und Gefäßchirurgie sowie bei Knochen- und Gelenkoperationen.
Antibakterielles Spektrum und Resistenzen: siehe Abschnitt 5.1.
4.2 Dosierung und Art der Anwendung Intravenöse Infusion:
Patienten mit normaler Nierenfunktion:
• Jugendliche (ab 12 Jahre) und Erwachsene:
Die übliche intravenöse Dosis beträgt 500 mg alle 6 Stunden oder 1 g alle 12 Stunden.
• Ältere Patienten:
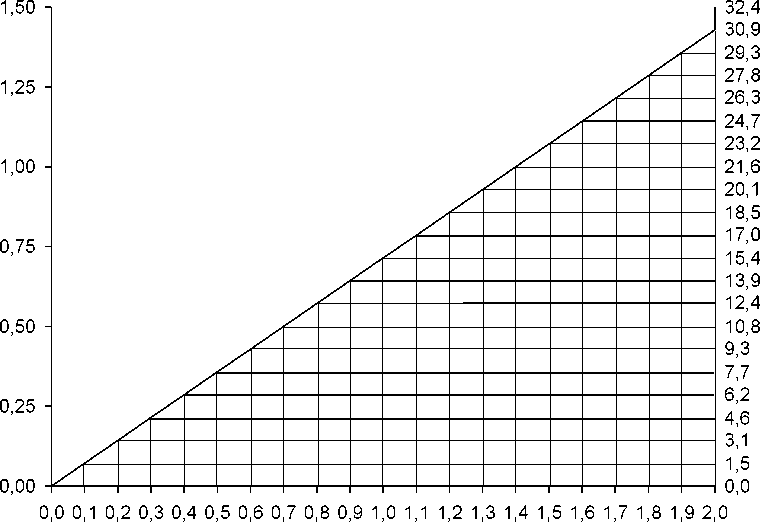
Die natürliche Abnahme der glomerulären Filtrationsrate mit zunehmendem Lebensalter kann zu erhöhten Vancomycin-Serumkonzentrationen führen, wenn die Dosis nicht angepasst wird (siehe „Nomogramm bei eingeschränkter Nierenfunktion“).
• Kinder (unter 12 Jahre):
Die übliche intravenöse Tagesdosis beträgt 40 mg/kg Körpergewicht meistens verteilt auf 4 Einzelgaben, d.h. 10 mg/kg Körpergewicht alle 6 Stunden.
• Säuglinge und Neugeborene:
Für junge Säuglinge und Neugeborene kann die Dosis geringer sein. Empfohlen wird eine Anfangsdosis von 15 mg/kg und Erhaltungsdosen von 10 mg/kg alle 12 Stunden in der ersten Lebenswoche und alle 8 Stunden bis zu einem Alter von einem Monat. Eine Überwachung der Serumkonzentrationen kann nötig sein.
• Perioperative Prophylaxe:
Erwachsene erhalten 1 g Vancomycin i.v. vor der Operation (bei Einleitung der Narkose) und je nach Länge und Art der Operation eine oder mehrere Gaben von 1 g Vancomycin i.v. postoperativ.
Kinder erhalten 20 mg Vancomycin/kg Körpergewicht i.v. zu den gleichen Zeitpunkten.
Patienten mit eingeschränkter Nierenfunktion:
Bei Patienten mit eingeschränkter Nierenfunktion muss die Dosis der
Ausscheidungsleistung angepasst werden. Dies ist - besonders bei schwerkranken Patienten mit wechselnder Nierenleistung - sinnvoll. Die Serumspiegel müssen regelmäßig bestimmt werden. Dabei gelten die folgenden Vorgaben: cmax: 30-40 mg/l; cmin: 5-10 mg/l; css (mittlerer Blutspiegel im steady state): 15 mg/l
Für viele Patienten mit Nierenfunktionsstörungen kann das folgende Nomogramm benutzt werden. Die Kreatinin-Clearance kann bestimmt bzw. näherungsweise ermittelt werden. Die Vancomycin-Gesamttagesdosis (in mg) beträgt ca. 15-mal die glomeruläre Filtrationsrate (in ml/min).
Die Initialdosis sollte immer mindestens 15 mg/kg betragen.
Nomogramm für Erwachsene mit eingeschränkter Nierenfunktion (nach Moellering et al., Ann. Intern. Med. (1981); 94:343)
E
1
LU
o
<
QL
<
LU
_l
o
o
2
o
o
z
<
>
CNI
O)
O)
OT
CO
O
Q
O
2
O
O
z
<
>
CREATININ CLEARANCE (ml/min/kg)
Das Nomogramm ist nicht anwendbar auf Patienten mit Anurie (mit praktisch nicht vorhandener Nierenfunktion). Diesen Patienten sollte eine Dosis von 15 mg/kg zum Erreichen therapeutischer Serumkonzentrationen gegeben werden. Die Erhaltungsdosen betragen 1,9 mg/kg pro 24 Stunden.
Dosierung bei Hämodialyse:
Bei Patienten ohne Nierenfunktion, auch mit regelmäßiger Hämodialyse, ist auch folgende Dosierung möglich:
Sättigungsdosis 1000 mg, Erhaltungsdosis 1000 mg alle 7 - 10 Tage.
Werden bei der Hämodialyse Polysulfonmembranen verwendet („high flux dialysis"), verkürzt sich die Halbwertszeit von Vancomycin. Bei Patienten, die regelmäßig hämodialysiert werden, kann eine zusätzliche Erhaltungsdosis erforderlich sein.
Wenn nur der Serumkreatininwert bekannt ist, lässt sich anhand der folgenden Formeln der Wert für die Kreatinin-Clearance näherungsweise errechnen:
(140 - Alter) x Gewicht (kg)
ClCr (Cockroft und Gault) =-------------------------------------------
A x Kreatinin im Serum (mg/dl)
A: für Männer 72 für Frauen 85
Der Serumkreatininwert muss einem stabilen Zustand der Nierenfunktion entsprechen. Bei folgenden Patientengruppen liegt der näherungsweise errechnete Wert meist über der tatsächlichen Kreatinin-Clearance: Bei Patienten mit abnehmender Nierenleistung (z.B. bei Schock, schwerem Herzversagen oder Oligurie), fettleibigen Patienten oder Patienten mit Lebererkrankungen, Ödem oder Aszites; geschwächte, mangelernährte oder inaktivierte Patienten. Wann immer möglich, sollte die Kreatinin-Clearance direkt bestimmt werden.
Parenteral darf Vancomycin nur als langsame i.v. Infusion (nicht mehr als 10 mg/min, Einzeldosen auch von weniger als 600 mg über mindestens 60 min) und in ausreichender Verdünnung (mindestens 100 ml pro 500 mg bzw. mindestens 200 ml pro 1 g) gegeben werden.
Patienten, bei denen die Flüssigkeitsaufnahme eingeschränkt werden muss, kann auch eine Lösung von 500 mg/50 ml bzw. 1 g/100 ml gegeben werden. Bei dieser höheren Konzentration kann das Risiko infusionsbedingter Erscheinungen erhöht sein.
Orale Gabe:
Erwachsene mit Enterokolitis nehmen üblicherweise 500 mg bis 2 g Vancomycin täglich in 3 oder 4 Teilgaben ein.
Kinder erhalten 40 mg/kg Körpergewicht pro Tag in 3 oder 4 Teilgaben.
Eine Tagesdosis von 2 g Vancomycin sollte nicht überschritten werden.
Dauer der Anwendung
Die Behandlungsdauer richtet sich nach der Schwere der Infektion sowie nach dem klinischen und bakteriologischen Verlauf.
Bei Enterokolitis sollte Vancomycin oral 7 - 10 Tage lang eingenommen werden.
4.3 Gegenanzeigen
Vancomycin darf nicht bei bekannter Überempfindlichkeit gegenüber dem Wirkstoff angewendet werden.
Bei akuter Anurie sowie bei Vorschädigung des Cochlearapparates darf Vancomycin nur bei vitaler Indikation infundiert werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Bei Patienten mit eingeschränkter Nierenfunktion sollte die Therapie sorgfältig überwacht werden.
Bei schweren und anhaltenden Durchfällen ist an eine pseudomembranöse Kolitis zu denken, die lebensbedrohlich sein kann (siehe Abschnitt 4.8). Deshalb ist in diesen Fällen eine Beendigung der Therapie mit VANCO-cell® in Abhängigkeit von der Indikation zu erwägen und ggf. sofort eine angemessene Behandlung einzuleiten (z.B. Einnahme von speziellen Antibiotika/Chemotherapeutika, deren Wirksamkeit klinisch erwiesen ist). Arzneimittel, die die Peristaltik hemmen, dürfen nicht eingenommen werden.
Therapeutische Blutspiegel sollten eine Stunde nach Ende der Infusion zwischen 30 und 40 mg/l liegen, die Talspiegel zwischen 5 und 10 mg/l. Eine regelmäßige, therapiebegleitende Kontrolle der Blutspiegel von Vancomycin ist angezeigt bei längerer Anwendungsdauer, insbesondere bei Patienten mit Nierenfunktionsstörungen oder Beeinträchtigung des Hörvermögens sowie bei gleichzeitiger Gabe ototoxischer bzw. nephrotoxischer Substanzen wie Aminoglykosiden. In diesen Fällen sollte die Nierenfunktion regelmäßig überwacht und die Dosierung der Nierenfunktionseinschränkung angepasst werden.
Bei Patienten mit eingeschränkter Hörfunktion, bei zusätzlicher Gabe ototoxischer Medikamente sowie bei Nierenfunktionsstörungen sind regelmäßige Kontrollen der Hörfunktion erforderlich.
Bei Patienten, die Vancomycin über längere Zeit erhalten oder gleichzeitig andere Medikamente erhalten, die eine Neutropenie oder Agranulozytose verursachen können, sollte die Leukozytenzahl regelmäßig überwacht werden.
Bei Auftreten von schweren akuten Überempfindlichkeitsreaktionen (z.B. Anaphylaxis) (siehe Abschnitt 4.8) muss die Behandlung mit VANCO-cell® sofort abgebrochen werden und die üblichen entsprechenden Notfallmaßnahmen eingeleitet werden.
Da während oder kurz nach rascher Infusion von Vancomycin anaphylaktoide Reaktionen auftreten können (siehe Abschnitt 4.8), muss unbedingt darauf geachtet werden, Vancomycin genügend zu verdünnen und über einen ausreichend langen Zeitraum zu infundieren (siehe Abschnitt 4.2).
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Achtung:
Bei Patienten mit einer entzündlichen Darminfektion können auch nach oraler Anwendung von Vancomycin klinisch bedeutsame Serumkonzentrationen auftreten, vor allem, wenn gleichzeitig eine Nierenfunktions-einschränkung besteht. Dann sind Wechselwirkungen wie nach intravenöser Infusion möglich.
Vancomycin / andere potentiell nieren- bzw. gehörschädigende Medikamente: Eine gleichzeitige oder aufeinanderfolgende Gabe von Vancomycin und anderen potentiell oto- oder nephrotoxischen Medikamenten kann die Oto-und/oder Nephrotoxizität verstärken. Besonders bei gleichzeitiger Gabe von Aminoglykosiden ist eine sorgfältige Überwachung notwendig. In diesen Fällen ist die Maximaldosis von Vancomycin auf 500 mg alle 8 Stunden zu begrenzen.
Vancomycin / Narkosemittel:
Es gibt Berichte, dass die Häufigkeit der im zeitlichen Zusammenhang mit der intravenösen Vancomycin-Infusion möglichen Nebenwirkungen (wie z.B. Hypotonie, Hautrötung, Erythem, Nesselsucht und Juckreiz; siehe Abschnitt 4.8) bei gleichzeitiger Gabe von Vancomycin und Narkosemitteln zunimmt.
Vancomycin / Muskelrelaxantien:
Wird Vancomycin unter oder unmittelbar nach Operationen verabreicht, kann bei gleichzeitiger Anwendung von Muskelrelaxantien (wie z.B. Succinylcholin) deren Wirkung (neuromuskuläre Blockade) verstärkt und verlängert sein.
4.6 Fertilität, Schwangerschaft und Stillzeit
Zu einer Anwendung von Vancomycin in der Schwangerschaft und Stillzeit beim Menschen liegen keine ausreichenden Erfahrungen vor, daher sollte VANCO-cell® Schwangeren nur nach einer eingehenden Nutzen-Risiko-Abwägung gegeben werden. Tierversuche haben keine Hinweise auf Missbildungen ergeben.
Vancomycin geht in die Muttermilch über und sollte daher in der Stillzeit nur bei Versagen anderer Antibiotika angewendet werden. Beim Säugling kann es zu Störungen der Darmflora mit Durchfällen, Sprosspilzbesiedlung und möglicherweise auch zu einer Sensibilisierung kommen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nicht zutreffend.
4.8 Nebenwirkungen
Achtung:
Bei Patienten mit einer entzündlichen Darminfektion können auch nach oraler Anwendung von Vancomycin klinisch bedeutsame Serumkonzentrationen auftreten, vor allem, wenn gleichzeitig eine Einschränkung der Nierenfunktion besteht. Dann sind Nebenwirkungen wie nach intravenöser Infusion möglich.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt: sehr häufig (>1/10), häufig (>1/100 bis <1/10), gelegentlich (>1/1.000 bis < 1/100), selten (>1/10.000 bis <1/1.000), sehr selten (<1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
|
Erkrankungen des Blutes und des Lymphsystems | |
|
Gelegentlich (>1/1.000, <1/100) |
Thrombozytopenie, Eosinophilie. Reversible Neutropenie, die gewöhnlich eine Woche nach Therapiebeginn oder später auftritt bzw. nach Infusion einer Gesamtdosis von über 25 g. Nach Absetzen von Vancomycin normalisiert sich das Blutbild meistens schnell (siehe Abschnitt 4.4). |
|
Sehr selten (<1/10.000) |
Reversible Agranulozytose, bei der ein ursächlicher Zusammenhang mit der Vancomycin-Behandlung jedoch nicht belegt wurde (siehe Abschnitt 4.4). |
|
Erkrankungen des Ohrs und des Labyrinths | |
|
Gelegentlich (>1/1.000, <1/100) |
Schwindel, Ohrenklingen. Vorübergehende oder bleibende Verschlechterung des Hörvermögens. Die davon betroffenen Patienten hatten sehr hohe Dosen von Vancomycin oder zusätzlich andere ototoxische Medikamente erhalten oder bei ihnen lag eine Nierenfunktionseinschränkung oder ein bereits beeinträchtigtes Hörvermögen vor. Bei diesen Patienten sind regelmäßige Kontrollen der Hörfunktion angebracht. |
|
Erkrankungen des Gastrointestinaltrakts | |
|
Häufig (>1/100, <1/10) |
Übelkeit |
|
Sehr selten (<1/10.000) |
Pseudomembranöse Enterokolitis nach intravenöser Verabreichung (siehe Abschnitt 4.4). |
|
Erkrankungen der Nieren und Harnwege | |
|
Häufig (>1/100, <1/10) |
Nierenschädigung, hauptsächlich erkennbar an erhöhten Serumkreatinin- oder Serumharnstoff-Konzentrationen, meist bei Patienten, die hohe Vancomycin-Dosen erhielten oder bei gleichzeitiger Gabe von Aminoglykosiden oder bereits bestehender Nierenfunktionseinschränkung. |
|
Sehr selten (<1/10.000) |
Entzündungen der Nieren (interstitielle Nephritis) und/oder akutes Nierenversagen. |
|
Nach Absetzen von Vancomycin normalisierten sich die Befunde meist. | |
|
Erkrankungen der Haut und des Unterhautgewebes | |
|
Häufig (>1/100, <1/10) |
Exantheme und Schleimhautentzündungen mit und ohne Juckreiz. |
|
Selten (>1/10.000, <1/1.000) |
Schwere Hauterscheinungen mit lebensbedrohlichen Allgemeinreaktionen (wie z.B. Ig-A lineare Dermatose, exfoliative Dermatitis, Stevens-Johnson-Syndrom, Lyell-Syndrom). |
|
Infektionen und parasitäre Erkrankungen | |
|
Die Einnahme von Vancomycin kann zur Überwucherung des Darmtraktes mit nicht empfindlichen Bakterien oder Pilzen führen. | |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |
|
Venenentzündungen können auftreten. Durch langsame Infusion | |
|
verdünnter Lösungen (250-500 mg/100 ml) und Wechsel der Infusionsstelle kann man sie vermindern. Versehentliche paravenöse oder intramuskuläre Injektionen führen zu Schmerzen, Gewebsreizungen und Nekrosen. | |
|
Erkrankungen des Immunsystems | |
|
Gelegentlich (>1/1.000, <1/100) |
Schwerwiegendere Überempfindlichkeitsreaktionen mit Symptomen wie z.B. Arzneimittelfieber, Eosinophilie, Schüttelfrost, Vaskulitis. Überempfindlichkeitsreaktionen aller Schweregrade - bis zum Schock -sind möglich (siehe Abschnitt 4.4). |
|
Sehr selten (<1/10.000) |
Starker und bis zu 10 Stunden anhaltender Tränenfluss |
|
Im Zusammenhang mit der intravenösen Infusion auftretende Reaktionen |
Anaphylaktoide Reaktionen einschließlich Blutdruckabfall, Atemnot, Nesselfieber oder Juckreiz während oder kurz nach rascher Infusion von Vancomycin. Hautrötung am Oberkörper („red neck“ bzw. „red man“), Schmerzen und Krämpfe der Brust- oder Rückenmuskulatur. Die Reaktionen klingen nach Absetzen der Infusion im Allgemeinen innerhalb von 20 Minuten bis zu einigen Stunden ab. Da diese Erscheinungen bei langsamer Infusion selten auftreten, muss unbedingt darauf geachtet werden, Vancomycin genügend zu verdünnen und über einen ausreichend langen Zeitraum zu infundieren (siehe Abschnitt 4.2). Wird Vancomycin schnell, z.B. innerhalb einiger Minuten injiziert, kann es zu starkem Blutdruckabfall einschließlich Schock und gelegentlich (>1/1.000, <1/100) zu Herzstillstand kommen. |
4.9 Überdosierung
Intoxikationen im strengen Sinne sind unbekannt. Bei bestimmten Risikokonstellationen (z.B. bei stark eingeschränkter Nierenfunktion) kann es zu hohen Serumkonzentrationen und zu ototoxischen und nephrotoxischen Effekten kommen.
• Ein spezifisches Antidot ist nicht bekannt.
• Hohe Serumkonzentrationen können durch Hämodialyse unter Verwendung von Polysulfonmembranen wirksam reduziert werden, ebenso mit dem Verfahren der Hämofiltration oder Hämoperfusion mit Polysulfon-Harzen.
• Im übrigen ist bei Überdosierung eine symptomatische Behandlung unter Aufrechterhaltung der Nierenfunktion erforderlich.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Vancomycin ist ein Antibiotikum aus der Gruppe der Glykopeptide.
ATC-Code: J01XA01
Wirkungsweise
Der Wirkungsmechanismus von Vancomycin beruht auf der Hemmung der Transglykosylierungsreaktion, so dass die für die Quervernetzung des Mureins benötigten Vorstufen (N-Acetylglucosamin, N-Acetylmuraminsäure) nicht mehr in die wachsende Zellwand eingebaut werden. Hieraus resultiert eine bakterizide Wirkung.
Beziehung zwischen Pharmakokinetik und Pharmakodynamik Die Wirksamkeit hängt im Wesentlichen von der Zeitdauer ab, während der der Wirkstoffspiegel oberhalb der minimalen Hemmkonzentration (MHK) des Erregers liegt.
Resistenzmechanismen
Eine Resistenz gegenüber Vancomycin kann auf folgenden Mechanismen beruhen:
• Veränderung der Zielstruktur: Diese Form der Resistenz ist in den letzten Jahren insbesondere bei der Spezies Enterococcus faecium aufgetreten. Die Veränderung beruht auf dem Austausch der endständigen D-Alanin-D-Alanin-Funktion der Aminosäureseitenkette einer Mureinvorstufe durch D-Ala-D-Lactat, so dass die Affinität zum Vancomycin stark vermindert ist. Die hierfür verantwortlichen Enzyme sind eine neu gebildete D-Lactat-Dehydrogenase bzw. Ligase.
• Die verminderte Empfindlichkeit oder Resistenz bei Staphylokokken gegenüber Vancomycin beruht auf der Überproduktion von Vorstufen des Mureins, an die Vancomycin gebunden wird.
Eine partielle Kreuzresistenz von Vancomycin besteht mit dem Glykopeptid-Antibiotikum Teicoplanin.
Grenzwerte
Die Testung von Vancomycin erfolgt unter Benutzung der üblichen Verdünnungsreihe. Folgende minimale Hemmkonzentrationen für sensible und resistente Keime wurden festgelegt:
EUCAST (European Committee on Antimicrobial Susceptibility Testing) Grenzwerte
|
Erreger |
Sensibel |
Resistent |
|
Staphylococcus aureus |
<2 mg/l |
>2 mg/l |
|
Koagulase negative Staphylokokken |
<4 mg/l |
>4 mg/l |
|
Enterococcus spp. |
<4 mg/l |
>4 mg/l |
|
Streptococcus spp. (Gruppen A, B, C, G) |
<2 mg/l |
>2 mg/l |
|
Streptococcus pneumoniae |
< 2 mg/l |
> 2 mg/l |
|
Streptokokken der „Viridans“-Gruppe |
< 2 mg/l |
> 2 mg/l |
|
Grampositive Anaerobier |
< 2 mg/l |
> 2 mg/l |
Prävalenz der erworbenen Resistenz in Deutschland
Die Prävalenz der erworbenen Resistenz einzelner Spezies kann örtlich und im Verlauf der Zeit variieren. Deshalb sind - insbesondere für die adäquate Behandlung schwerer Infektionen - lokale Informationen über die Resistenzsituation erforderlich. Falls auf Grund der lokalen Resistenzsituation die Wirksamkeit von Vancomycin in Frage gestellt ist, sollte eine Therapieberatung durch Experten angestrebt werden. Insbesondere bei schwerwiegenden Infektionen oder bei Therapieversagen ist eine mikrobiologische Diagnose mit dem Nachweis des Erregers und dessen Empfindlichkeit gegenüber Vancomycin anzustreben.
Prävalenz der erworbenen Resistenz in Deutschland auf der Basis von Daten der letzten 5 Jahre aus nationalen Resistenzüberwachungsprojekten und -studien (Stand: Dezember 2012):
Üblicherweise empfindliche Spezies_
Aerobe Gram-positive Mikroorganismen_
Corynebacterium jeikeium °_
Enterococcus faecalis_
Staphylococcus aureus (inkl. Methicillin-resistenter Stämme)_
Staphylococcus epidermidis_
Staphylococcus haemolyticus_
Staphylococcus hominis_
Streptococcus agalactiae_
Streptococcus dysgalactiae subsp. equisimilis °
(Streptokokken der Gruppen C & G)_
Streptococcus pneumoniae_
Streptococcus pyogenes_
Streptokokken der „Viridans“-Gruppe ° A_
Anaerobe Mikroorganismen_
Clostridium difficile °_
Peptoniphilus spp. °_
Peptostreptococcus spp. °_
Spezies, bei denen erworbene Resistenzen ein Problem bei der Anwendung darstellen
können_
Aerobe Gram-positive Mikroorganismen_
Enterococcus faecium_
Von Natur aus resistente Spezies_
Alle Gram-negativen Bakterien_
Andere Mikroorganismen_
Chlamydia spp._
Chlamydophila spp._
Legionella pneumophila_
Mycoplasma spp._
° Bei Veröffentlichung der Tabellen lagen keine aktuellen Daten vor. In der Primärliteratur, Standardwerken und Therapieempfehlungen wird von einer Empfindlichkeit ausgegangen.
A Sammelbezeichnung für eine heterogene Gruppe von Streptokokken-Spezies. Resistenzrate kann in Abhängigkeit von der vorliegenden Streptokokken-Spezies variieren.
5.2 Pharmakokinetische Eigenschaften
Vancomycin verteilt sich nach i.v. Gabe in fast allen Geweben. In Pleura-, Perikard-, Aszites- und Synovialflüssigkeit sowie im Herzmuskel und in den Herzklappen werden ähnlich hohe Konzentrationen wie im Blutplasma erreicht. Die Angaben über die Vancomycin-Konzentrationen im Knochen (Spongiosa, Compacta) variieren stark. Das scheinbare Verteilungsvolumen im „steady state" wird mit 0,43 (bis zu 0,9) l/kg angegeben. Bei nicht entzündeten Meningen passiert Vancomycin die Blut-Hirn-Schranke nur in geringem
Umfang.
Vancomycin wird zu 55% an Plasmaproteine gebunden. Es wird nur zu einem geringen Teil metabolisiert. Nach parenteraler Gabe wird es fast vollständig als mikrobiologisch aktive Substanz (ca. 75 - 90% innerhalb von 24 h) durch glomeruläre Filtration über die Nieren ausgeschieden. Die biliäre Ausscheidung ist unbedeutend (weniger als 5% einer Dosis).
Bei Patienten mit normaler Nierenfunktion beträgt die Halbwertszeit im Serum ca. 4 - 6 (5 - 11) h, bei Kindern 2,2 bis 3 Stunden. Bei eingeschränkter Nierenfunktion kann die Halbwertszeit von Vancomycin erheblich verlängert sein (bis auf 7,5 Tage); wegen der Ototoxizität von Vancomycin ist in solchen Fällen eine therapiebegleitende Überwachung der Plasmakonzentrationen angezeigt.
Die durchschnittlichen Plasmakonzentrationen nach der i.v. Infusion von 1 g Vancomycin über 60 Minuten betrugen am Ende der Infusion etwa 63 mg/l, nach 2 Stunden etwa 23 mg/l und nach 11 Stunden etwa 8 mg/l.
In einer Untersuchung von Boeckh, Lode et al. (Antimicrob. Agents Chemother. 32 (1988): 92 - 95) betrugen die durchschnittlichen Plasmakonzentrationen nach der i.v. Infusion von 500 mg Vancomycin über 60 Minuten etwa 32 mg/l am Ende der Infusion, nach 1 Stunde etwa 13 mg/l und nach 4 Stunden etwa 5,7 mg/l.
Die Clearance von Vancomycin aus dem Plasma korreliert annähernd mit der glomerulären Filtrationsrate.
Die gesamte systemische und renale Clearance von Vancomycin kann bei älteren Patienten vermindert sein.
Wie Untersuchungen an anephrischen Patienten gezeigt haben, scheint die metabolische Clearance sehr gering zu sein. Beim Menschen wurden bisher keine Vancomycin-Metabolite identifiziert.
Wird Vancomycin während einer Peritonealdialyse intraperitoneal gegeben, so gelangen während 6 Stunden ca. 60% in den systemischen Kreislauf. Nach i.p. Gabe von 30 mg/kg werden Serumspiegel von ca. 10 mg/l erreicht.
Bei oraler Gabe wird das hochpolare Vancomycin praktisch nicht resorbiert. Es erscheint nach oraler Zufuhr in aktiver Form im Stuhl und stellt deshalb für die pseudomembranöse Kolitis und Staphylokokken-Kolitis ein geeignetes Chemotherapeutikum dar.
Nach wiederholter oraler Gabe von Vancomycin können bei Patienten mit aktiver pseudomembranöser Enterokolitis gelegentlich messbare Serumspiegel auftreten.
Vancomycin passiert die Plazenta und tritt in die Muttermilch über. Zwei Stunden nach intravenöser Verabreichung von 50 mg/kg an trächtige Kaninchen am 13. Tag der Gestation betrugen die Konzentrationen im mütterlichen Plasma 20,0, im fetalen Plasma 3,7 und im Fruchtwasser 12,5 Einheiten/ml. In der Milch laktierender Katzen lagen die Konzentrationen nach i.m. Verabreichung von Vancomycin zwischen einem Drittel und zwei Drittel der mütterlichen Serumkonzentration.
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
Die LD50 betrug (in mg/kg KG):_
|
i.v. |
i.p. |
oral | |
|
Maus |
489 |
>5000 | |
|
Ratte |
319 |
2218 | |
|
Hund |
292 | ||
|
Meerschweinchen |
737 |
Ratten und Mäuse starben nach letalen Dosen unmittelbar nach Behandlung aufgrund toxischer Erscheinungen des Zentralnervensystems, Hunde mehrere Tage später an Nierenversagen.
Chronische Toxizität
Bei Ratten, die 35 Tage lang tägliche orale Dosen zwischen 375 und 3000 mg/kg KG erhielten, wurden ab 1500 mg/kg eine Retikulozytose und Lymphozytopenie, ab 750 mg/kg KG im Vergleich zur Kontrollgruppe verminderte Gewichte von Milz und Thymus beobachtet. In allen Dosisgruppen trat eine Reduktion von Gesamteiweiß, Glucose und Cholesterin im Serum und eine histologisch feststellbare Störung des Coecum-Mukosaepithels auf.
Intravenöse Dosen von 25 mg/kg bei Hunden und 50 mg/kg bei Affen, sowie i.m. Verabreichung von 50 mg/kg an Katzen führten lediglich zu lokalen Reaktionen an der Injektionsstelle. Höhere Dosen ab 50 mg/kg i.v. beim Hund und 350 mg/kg i.p. bei der Ratte erwiesen sich als nephrotoxisch.
Mutagenes und tumorerzeugendes Potential
Vancomycin wurde nur eingeschränkt bezüglich mutagener Wirkungen geprüft. Bisherige Tests zeigten negative Ergebnisse.
Langzeituntersuchungen am Tier auf ein tumorerzeugendes Potential liegen nicht vor.
Reproduktionstoxizität
In Teratogenitätsstudien wurden Ratten Dosierungen bis zu 200 mg/kg KG gegeben und Kaninchen bis zu 120 mg/kg KG. Dabei wurden keine teratogenen Effekte beobachtet.
Tierstudien zur Anwendung in der Peri-/ Postnatalperiode und zu Auswirkungen
auf die Fertilität liegen nicht vor.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Keine.
6.2 Inkompatibilitäten
Vancomycin-Lösungen haben einen niedrigen pH-Wert. Dies kann zu chemischer oder physikalischer Instabilität führen, wenn sie mit anderen Substanzen gemischt werden. Jede parenterale Lösung sollte daher vor der Anwendung auf Ausfällungen und Verfärbungen visuell überprüft werden. Trübungen traten auf, wenn Vancomycin-Lösungen mit Lösungen folgender Substanzen gemischt wurden:
Aminophyllin; Barbiturate; Benzylpenicilline; Chloramphenicolhydrogensuccinat; Chlorothiazid-Natrium; Dexamethason-21-dihydrogenphosphat-Dinatrium; Heparin-Natrium; Hydrocortison-21 -hydrogensuccinat; Methicillin-Natrium; Natriumhydrogencarbonat; Nitrofurantoin-Natrium; Novobiocin-Natrium; Phenytoin-Natrium; Sulfadiazin-Natrium; Sulfafurazoldiethanolamin.
6.3 Dauer der Haltbarkeit
3 Jahre.
Haltbarkeit der rekonstituierten Lösung:
Die chemische und physikalische Stabilität der in Wasser für Injektionszwecke rekonstituierten Lösung wurde bei Raumtemperatur und +2-+8°C für eine Lagerdauer von 48 Stunden nachgewiesen.
Haltbarkeit der zubereiteten Infusionslösung:
Die chemische und physikalische Stabilität der gebrauchsfertigen Lösung (mit 0,9%iger Natriumchloridlösung oder 5%iger Glucoselösung) wurde für 48 Stunden bei Raumtemperatur und +2-+8°C nachgewiesen. Vom mikrobiologischen Standpunkt aus sollte die zubereitete Infusionslösung sofort verbraucht werden. Falls dies nicht geschieht, liegt die Verantwortung für Lagerungsbedingungen und Lagerdauer beim Anwender. Normalerweise kann eine Lagerdauer von 24 Stunden bei +2-+8°C nur überschritten werden, wenn die Zubereitung der Infusionslösung unter kontrollierten und validierten aseptischen Bedingungen stattgefunden hat.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über +25°C lagern.
Die Durchstechflasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Nach Anbruch Rest verwerfen.
Lagerungsbedingungen des rekonstituierten/verdünnten Arzneimittels siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
Klare Durchstechflaschen (Type I Glas) mit Brombutylstopfen.
VANCO-cell® 500 mg:
Packungen mit:
1 Durchstechflasche 5 Durchstechflaschen 10 Durchstechflaschen Anstaltspackungen
VANCO-cell®1000 mg:
Packungen mit:
1 Durchstechflasche 5 Durchstechflaschen 10 Durchstechflaschen Anstaltspackungen
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Kompatibilität mit intravenösen Flüssigkeiten:
Zur Herstellung der Infusionslösung sind geeignet:
• Wasser für Injektionszwecke
• 5%ige Glucoselösung
• 0,9%ige Natriumchloridlösung
Vancomycin-Lösung ist, sofern nicht die chemisch-physikalische Verträglichkeit mit anderen Infusionslösungen erwiesen ist, grundsätzlich getrennt von diesen zu verabreichen.
Zubereitung der Infusionslösung:
Vor dem Gebrauch VANCO-cell® in Wasser für Injektionszwecke auflösen. Die rekonstituierte Lösung kann fast farblos bis leicht rosa gefärbt sein.
Weiteres Verdünnen entsprechend den nachfolgenden Anweisungen ist erforderlich. Die rekonstituierte Lösung muss mit kompatiblen Infusionslösungen weiter verdünnt werden. Die Vancomycin-Konzentration soll 2,5 - 5 mg/ml Infusionslösung nicht übersteigen.
VANCO-cell® 500 mg:
Der Inhalt einer Durchstechflasche wird in 10 ml Wasser für Injektionszwecke gelöst und mit anderen Infusionslösungen weiter auf 100 - 200 ml verdünnt.
VANCO-cell® 1000 mg:
Der Inhalt einer Durchstechflasche wird in 20 ml Wasser für Injektionszwecke gelöst und mit anderen Infusionslösungen weiter auf 200 - 400 ml verdünnt. Haltbarkeit der zubereiteten Lösungen siehe Abschnitt 6.3.
Zubereitung der Lösung zum Einnehmen:
Der Inhalt einer Durchstechflasche mit 500 mg Vancomycin kann in 30 ml, mit 1000 mg Vancomycin in 60 ml Wasser aufgelöst und dem Patienten in Teilmengen zu trinken gegeben oder über eine Magensonde zugeführt werden. Dieser Zubereitung kann man ein Geschmackskorrigens hinzufügen.
Kombinationstherapie
Im Falle einer Kombinationstherapie von Vancomycin mit anderen Antibiotika/Chemotherapeutika sollen die Präparate getrennt gegeben werden.
7. Inhaber der Zulassung
cell pharm GmbH Theodor-Heuss-Str. 52 61118 Bad Vilbel Telefon: 0 61 01 / 30 42-0 Telefax: 0 61 01 / 30 42-11
8. Zulassungsnummer(n)
VANCO-cell® 500 mg: 45184.00.00 VANCO-cell® 1000 mg: 45184.01.00
9. Datum der Erteilung der Zulassung / Verlängerung der Zulassung
20. April 1999 / 01. Juli 2004
10. Stand der Information
Februar 2013
11. Verkaufsabgrenzung
Verschreibungspflichtig
VANCO-cell® 500 mg/1000mg FI cell pharm 15