Vancomycin Hexal 0,5 G
FACHINFORMATION
1. BEZEICHNUNG DER ARZNEIMITTEL
Vancomycin HEXAL 0,5 g Pulver zur Herstellung einer Lösung zum Einnehmen oder zur
Herstellung einer Infusionslösung
Vancomycin HEXAL 1,0 g Pulver zur Herstellung einer Lösung zum Einnehmen oder zur
Herstellung einer Infusionslösung
Wirkstoff: Vancomycinhydrochlorid
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Vancomycin HEXAL 0,5 g
1 Durchstechflasche mit Pulver zur Herstellung einer Lösung zum Einnehmen oder zur Herstellung einer Infusionslösung enthält Vancomycinhydrochlorid*, entsprechend 500 mg Vancomycin.
*mit einer Wirksamkeit von mindestens 10501.E. je mg Substanz, berechnet auf die wasserfreie Substanz
Vancomycin HEXAL 1,0 g
1 Durchstechflasche mit Pulver zur Herstellung einer Lösung zum Einnehmen oder zur Herstellung einer Infusionslösung enthält Vancomycinhydrochlorid*, entsprechend 1000 mg Vancomycin.
*mit einer Wirksamkeit von mindestens 10501.E. je mg Substanz, berechnet auf die wasserfreie Substanz
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver zur Herstellung einer Lösung zum Einnehmen oder zur Herstellung einer Infusionslösung
Weißes, leicht bräunliches Pulver
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Bei oraler Anwendung
Vancomycin-Pulver kann nach Auflösen eingenommen werden zur Behandlung bestimmter Darmentzündungen:
- Antibiotika-bedingte pseudomembranöse Enterokolitis (z. B. durch Clostridium difficile)
- Staphylokokken-Enterokolitis.
Parenteral angewandt ist Vancomycin bei diesen Erkrankungen nicht wirksam.
Bei intravenöser Infusion
Die parenterale Gabe ist auf schwere Infektionen, die durch grampositive, Vancomycin-empfindliche und gegen andere Antibiotika resistente Bakterien verursacht sind, und auf Patienten mit einer Allergie gegen Betalaktam-Antibiotika zu begrenzen (siehe Abschnitt 5.1).
- Endokarditis
- Infektionen der Knochen (Osteitis, Osteomyelitis) und Gelenke
- Pneumonie
- Septikämie, Sepsis
- Weichteilinfektionen
Zur perioperativen Prophylaxe bei erhöhter Gefährdung des Patienten durch Infektionen mit grampositiven Erregern in der Herz- und Gefäßchirurgie sowie bei Knochen- und Gelenkoperationen.
Eine durch Enterokokken, Streptococcus viridans oder Streptococcus bovis verursachte Endocarditis sollte mit einer Kombination aus Vancomycin und einem Aminoglykosid behandelt werden.
Die offiziellen Richtlinien für die richtige Anwendung antibakterieller Wirkstoffe sollten beachtet werden.
4.2 Dosierung und Art der Anwendung
Orale Anwendung
Erwachsene mit Enterokolitis nehmen
üblicherweise 500 mg bis 2 g Vancomycin täglich in 3 oder 4 Teilgaben ein.
Kinder erhalten 40 mg/kg Körpergewicht pro Tag in 3 oder 4 Teilgaben. Eine Tagesdosis von 2 g Vancomycin sollte nicht überschritten werden.
Intravenöse Anwendung (Infusion)
Patienten mit normaler Nierenfunktion
Jugendliche ab 12 Jahre und Erwachsene
Die empfohlene intravenöse Tagesdosis beträgt 2000 mg verteilt auf Gaben von jeweils 500 mg alle 6 Stunden oder 1000 mg alle 12 Stunden.
Die übliche Dosierung bei einer bakteriellen Endokarditis beträgt 1000 mg Vancomycin i.v. alle 12 Stunden über 4 Wochen, entweder als Monotherapie oder in Kombination mit anderen Antibiotika, wie Gentamicin und Rifampicin, Gentamicin, Streptomycin. Eine Enterokokken-Endokarditis wird 6 Wochen lang mit Vancomycin in Kombination mit einem Aminoglykosid behandelt. Offizielle Richtlinien sind dabei zu beachten.
Ältere Patienten
Aufgrund der eingeschränkten Nierenfunktion kann eine Dosisreduzierung erforderlich sein, siehe nachstehend.
Kinder über 1 Monat bis 12 Jahre -
. Die übliche intravenöse Dosis beträgt 10 mg/kg Körpergewicht (KG) pro Gabe alle 6 Stunden (Tagesdosis: 40 mg/kg KG. Das infundierte Flüssigkeitsvolumen muss als Teil der Gesamtflüssigkeitsaufnahme des Kindes berücksichtigt werden.
Reife Neugeborene
Empfohlen werden die Dosierungen in Tabelle 1.
|
Tabelle 1: Dosierung Reife Neugeborene | |
|
Alter |
Dosierung |
|
0-7 Tage |
Anfangsdosis 15 mg/kg KG, gefolgt von Erhaltungsdosen von 10 mg/kg alle 12 Stunden |
|
7-30 Tage |
Anfangsdosis 15 mg/kg KG, gefolgt von Erhaltungsdosen von 10 mg/kg alle 8 Stunden |
Eine Überwachung der Serumkonzentrationen kann nötig sein (siehe Abschnitt 4.4).
Übergewichtige Patienten
Eine Anpassung der üblichen Tagesdosis kann erforderlich sein.
Perioperative Prophylaxe
Erwachsene erhalten 1000 mg Vancomycin i.v. vor der Operation (bei Einleitung der Narkose) und je nach Länge und Art der Operation eine oder mehrere Gaben von 1000 mg Vancomycin i.v. postoperativ.
Kinder erhalten 20 mg Vancomycin/kg KG i.v. zu den gleichen Zeitpunkten.
Patienten mit eingeschränkter Nierenfunktion
Dosisanpassungen sind erforderlich, um toxische Serumkonzentrationen zu verhindern. Bei Frühgeborenen und älteren Patienten kann aufgrund der eingeschränkten Nierenfunktion eine Dosisreduzierung erforderlich sein, die größer als erwartet ist. Bei diesen Patientengruppen ist eine regelmäßige Überwachung der Serumkonzentration angeraten, da insbesondere nach einer längeren Therapie eine Akkumulation beobachtet wurde.
Die Vancomycin-Serumkonzentration kann mithilfe von mikrobiologischen Assays, Radioimmunoassay, Fluoreszenz-Polarisations-Immunoassay, Fluoreszenz-Immunoassay oder Hochdruckflüssigkeitschromatographie bestimmt werden.
Das folgende Nomogramm (Abb. 1) auf der Grundlage der Kreatinin-Clearance dient als Leitlinie für die Dosisanpassung:
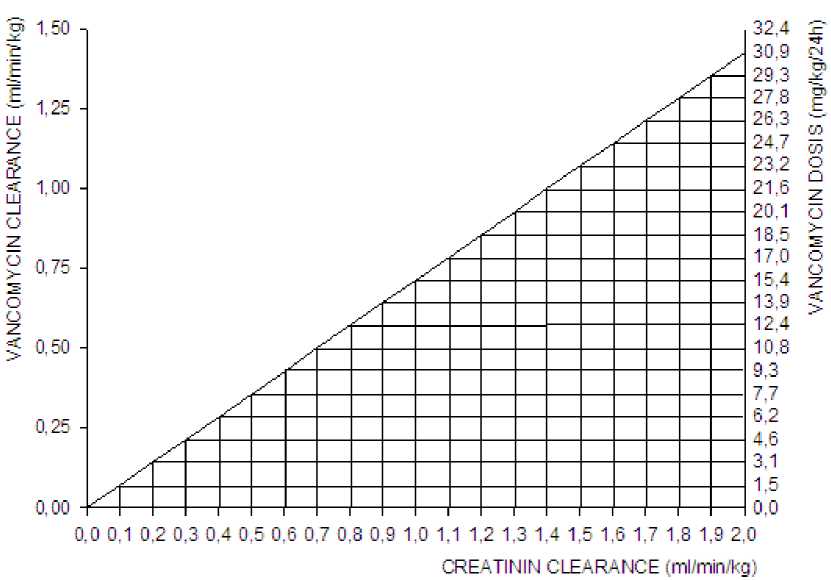
Abb. 1: Nomogramm der Dosierung von Vancomycin bei Patienten mit eingeschränkter Nierenfunktion Das Nomogramm ist nicht anwendbar auf Patienten mit Anurie (mit praktisch nicht vorhandener Nierenfunktion) unter Hämodialyse. Diesen Patienten sollte eine Ladungsdosis von 15 mg/kg KG zum schnellen Erreichen therapeutischer Serumkonzentrationen gegeben werden. Die Erhaltungsdosis beträgt 1,9 mg/kg KG/24 Std.
Bei erwachsenen Patienten mit stark eingeschränkter Nierenfunktion kann zur Vereinfachung statt der täglichen Dosis eine Erhaltungsdosis von 250 bis 1000 mg in Abständen von mehreren Tagen gegeben werden.
Bei Anurie ist eineDosis von 1000 mg alle 7-10 Tage empfohlen.
Wenn nur der Serumkreatininwert bekannt ist, lässt sich der Wert für die Kreatinin-Clearance anhand der folgenden Formel errechnen:
Männer: Körpergewicht (kg) x (140 - Alter (Jahre))
72 x Serum-Kreatinin (mg/100 ml)
Frauen: 0,85 x (obiger Wert für Männer)
Überwachung der Vancomycin-Serumkonzentrationen
Die Serumkonzentration von Vancomycin sollte am 2. Tag der Behandlung unmittelbar vor Verabreichung der nächsten Dosis und eine Stunde nach der Infusion überprüft werden. Therapeutische Vancomycin-Konzentrationen im Blut sollten eine Stunde nach Ende der Infusion zwischen 30 und 40 mg/l (maximal 50 mg/l) liegen, die Talspiegel (unmittelbar vor der nächsten Gabe) zwischen 5 und 10 mg/l.
Die Serumkonzentration sollte normalerweise zwei- bis dreimal pro Woche überprüft werden. Patienten mit eingeschränkter Leberfunktion:
Es liegen keine Hinweise vor, dass die Dosierung bei Patienten mit eingeschränkter Leberfunktion herabgesetzt werden muss.
Art der Anwendung Orale Gabe
Dem Patienten wird die Lösung zum Einnehmen in Teilmengen zu trinken gegeben oder über eine Magensonde zugeführt. Dieser Zubereitung kann man ein Geschmackskorrigens hinzufügen (siehe auch Abschnitt 6.6).
Intravenöse Infusion
Parenteral darf Vancomycin nur als langsame intravenöse Infusion (nicht mehr als 10 mg/min, - über mindestens 60 min) und in ausreichender Verdünnung (mindestens 100 ml pro 500 mg bzw. mindestens 200 ml pro 1000 mg) gegeben werden (siehe Abschnitte 4.4 und 4.8).
Patienten, bei denen die Flüssigkeitsaufnahme eingeschränkt werden muss, kann auch eine Lösung von 500 mg/ 50 ml bzw. von 1000 mg/100 ml gegeben werden. Bei dieser höheren Konzentration kann das Risiko infusionsbedingter Erscheinungen erhöht sein (Hinweise zur Zubereitung der Infusionslösung siehe Abschnitt 6.6). Infusionsbedingte Reaktionen können jedoch bei jeder Geschwindigkeit oder Konzentration auftreten. Die Dosis muss individuell entsprechend dem Gewicht, dem Alter und der Nierenfunktion angepasst werden. Die Vancomycin-Serumkonzentration kann überwacht werden, um die Dosisanpassung zu erleichtern.
Dauer der Anwendung
Die Behandlungsdauer richtet sich nach der Schwere der Infektion sowie nach dem klinischen und bakteriologischen Verlauf.
Bei Enterokolitis sollte Vancomycin oral 7-10 Tage lang eingenommen werden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff Vancomycin.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Bei rascher Bolusgabe, z. B. innerhalb weniger Minuten, kann es zu starkem Blutdruckabfall einschließlich Schock und gelegentlich zu Herzstillstand, histaminähnlichen Reaktionen sowie makulopapulösem oder erythematösem Hautausschlag („red man“ oder „red neck“) kommen. Um diese durch eine schnelle Infusion bedingten Erscheinungen zu vermeiden, darf Vancomycin nur ausreichend verdünnt über einen Zeitraum von nicht weniger als 60 Minuten infundiert werden. Die Reaktionen klingen nach Absetzen der Infusion im Allgemeinen prompt wieder ab (siehe Abschnitt 4.2 und Abschnitt 4.8).
Vancomycin ist potenziell oto- und nephrotoxisch und darf deswegen bei Patienten mit eingeschränkter Nierenfunktion nur mit Vorsicht gegeben werden. Die Dosis muss dabei der Nierenfunktionseinschränkung angepasst werden. Das Toxizitätsrisiko wird durch hohe Serumkonzentrationen und eine längere Anwendung wesentlich erhöht. Deswegen sollten die Blutwerte regelmäßig überwacht und Nierenfunktionstests durchgeführt werden.
Bei Patienten mit bekannten Gehörschäden sollte die Gabe von Vancomycin vermieden werden. Wenn Vancomycin für solche Patienten notwendig ist, sollte die Dosis durch regelmäßige Bestimmung der Serumkonzentration des Arzneimittels entsprechend festgelegt werden. Einer beginnenden Taubheit kann ein Tinnitus vorausgehen.
Das Risiko von Gehörschädigungen ist bei älteren Patienten größer. Erfahrungen mit anderen Antibiotika legen nahe, dass die Taubheit trotz Absetzen der Behandlung progredient ist.
Anwendung bei pädiatrischen Patienten
Bei Frühgeborenen und Neugeborenen kann es ratsam sein, die gewünschte Vancomycin-Serumkonzentration zu bestätigen.
Die gleichzeitige Gabe von Vancomycin und Narkosemitteln wurde bei Kindern mit Erythem und histaminähnlicher Hautrötung in Verbindung gebracht.
Anwendung bei älteren Patienten
Die natürliche Abnahme der glomerulären Filtrationsrate mit zunehmendem Lebensalter kann zu erhöhten Vancomycin-Serumkonzentrationen führen, wenn die Dosis nicht angepasst wird (siehe Abschnitt 4.2).
Vorsichtsmaßnahmen
Bei längerer Anwendungsdauer von Vancomycin ist insbesondere bei Patienten mit eingeschränkter Nierenfunktion oder mit Beeinträchtigung des Hörvermögens bzw. bei der gleichzeitigen Anwendung von nephro- oder ototoxischen Substanzen eine regelmäßige Überwachung des Blutspiegels angezeigt.
Die Dosierung muss auf der Grundlage der Serumkonzentration angepasst werden. Die Blutwerte müssen regelmäßig überwacht und Nierenfunktionstests durchgeführt werden.
Bei Patienten mit eingeschränkter Nierenfunktion und Personen nach dem 60. Lebensjahr müssen regelmäßig die Gehörfunktion überprüft und die Vancomycin-Serumkonzentration bestimmt werden. Bei allen mit Vancomycin behandelten Patienten sollten regelmäßig Blut-und Urinuntersuchungen sowie Nierenfunktionstests durchgeführt werden.
Vancomycin verursacht starke Gewebereizungen und darf wegen des Nekroserisikos an der Injektionsstelle nie intramuskulär, sondern immer nur intravenös angewendet werden. Bei zahlreichen mit Vancomycin behandelten Patienten treten zum Teil schwere Schmerzen an der Injektionsstelle und Thrombophlebitis auf.
Häufigkeit und Schweregrad einer Thrombophlebitis können durch die langsame Gabe des Arzneimittels als verdünnte Lösung (2,5 bis 5,0 g/l) und durch Änderung der Injektionsstelle auf ein Minimum begrenzt werden.
Eine längere Anwendung von Vancomycin kann zu einem übermäßigen Wachstum (Überwucherung) nicht empfindlicher Organismen führen. Die sorgfältige Beobachtung des Patienten ist hier von ausschlaggebender Bedeutung. Im Falle einer Superinfektion während der Therapie sind angemessene Maßnahmen zu ergreifen.
Es liegen einige wenige Berichte über eine durch C. difficile verursachte pseudomembranöse Kolitis bei Patienten unter der Behandlung mit Vancomycin i.v. vor.
Vancomycin sollte Patienten mit bekannter Überempfindlichkeit auf Teicoplanin nur mit Vorsicht verabreicht werden, da über allergische Kreuzreaktionen zwischen Vancomycin und Teicoplanin berichtet wurde.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei Patienten mit einer entzündlichen Darminfektion können auch nach oraler Anwendung von Vancomycin klinisch bedeutsame Serumkonzentrationen auftreten, vor allem, wenn gleichzeitig eine Nierenfunktionseinschränkung besteht. Dann sind Wechselwirkungen wie nach intravenöser Infusion möglich.
Die gleichzeitige Gabe von Vancomycin und Narkosemitteln wurde mit Erythem, histaminähnlicher Hautrötung und anaphylaktoiden Reaktionen in Verbindung gebracht.
Es liegen Berichte vor, dass die Häufigkeit von infusionsbedingten Reaktionen mit der gleichzeitigen Gabe von Narkosemittel zunimmt. Infusionsbedingte Reaktionen lassen sich auf ein Mindestmaß beschränken, wenn man die Vancomycin mindestens 60 Minuten vor Einleitung der Anästhesie infumdiert.
Die gleichzeitige oder sequenzielle, systemische oder topische Anwendung anderer potenziell ototoxischer, neurotoxischer oder nephrotoxischer Arzneimittel, wie Amphotericin B, Aminoglykoside, Bacitracin, Polymyxin B, Colistin, Viomycin oder Cisplatin, verlangt, wenn indiziert, eine engmaschige Überwachung.
Bei gleichzeitiger Anwendung von Vancomycin und Muskelrelaxanzien kann die Wirkung einer neuromuskulären Blockade verstärkt werden.
4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft
Bisher liegen keine oder nur sehr begrenzte Erfahrungen mit der Anwendung von Vancomycin bei Schwangeren vor. Reproduktionstoxizitätsstudien mit Tieren haben keine Hinweise auf Auswirkungen auf Schwangerschaft oder embryonale und fetale Entwicklung ergeben(siehe Abschnitt 5.3).
Vancomycin passiert jedoch die Plazenta, sodass ein potenzielles Risiko embryonaler und neonataler Ototoxizität und Nephrotoxizität nicht auszuschließen ist. Vancomycin sollte daher bei schwangeren Frauen nur unter strenger Indikationsstellung und nach sorgfältiger NutzenRisiko-Abwägung angewendet werden.
Stillzeit
Vancomycin geht in die Muttermilch über und sollte daher in der Stillzeit nur bei Versagen anderer Antibiotika angewendet werden. Vancomycin sollte stillenden Frauen nur mit Vorsicht gegeben werden, da es beim Säugling zu Störungen der Darmflora mit Durchfällen, Sprosspilzbesiedelung und möglicherweise auch zu einer Sensibilisierung kommen kann.
Dabei ist angesichts der Bedeutung des Arzneimittels für eine stillende Frau ein Abbruch des Stillens zu erwägen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Vancomycin HEXAL hat keinen oder vernachlässigbaren Einfluss auf die Verkehrstüchtigkeit und das Bedienen von Maschinen.
4.8 Nebenwirkungen
Bei der Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig Häufig Gelegentlich Selten Sehr selten Nicht bekannt
(> 1/10)
(> 1/100 bis < 1/10)
(> 1/1.000 bis < 1/100)
(> 1/10.000 bis < 1/1.000)
(< 1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Intravenöse Infusion
Die am häufigsten beobachteten Nebenwirkungen sind Phlebitis und pseudoallergische Reaktionen im Zusammenhang mit einer zu schnellen intravenösen Infusion von Vancomycin.
|
Organsystem |
Häufig |
Gelegentlich |
Selten |
Sehr selten |
|
Erkrankungen des Blutes und des Lymphsystems |
Thrombozytopenie, Neutropenie, Agranulozytose, Eosinophilie | |||
|
Erkrankungen des Immunsystems |
Anaphylaktische Reaktionen, Überempfindlic hkeitsreaktionen | |||
|
Augen erkrankungen |
vorübergehender, (bis zu 10 Stunden anhaltender) starker Tränenfluss |
|
Erkrankungen des Ohrs und des Labyrinths |
vorübergehende oder bleibende Verschlechterun g des Hörvermögens |
Tinnitus, Schwindel | ||
|
Herzerkrankung en |
Herzstillstand | |||
|
Gefäß erkrankungen |
Blutdruck abfall |
Vaskulitis | ||
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Atemnot, Stridor | |||
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit |
Pseudo membranöse Enterokolitis | ||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Exanthem und Schleim-hautentzündungen, Pruritus, Urtikaria |
Exfoliative Dermatitis, StevensJohnsonSyndrom, LyellSyndrom, lineare IgA-Dermatose | ||
|
Erkrankungen der Nieren und Harnwege |
Nierenschädig ung, manifestiert vor allem durch erhöhte Serumkreatinin Konzentratione n |
Interstitielle Nephritis, akutes Nierenversagen | ||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Phlebitis, Rötung von Oberkörper und Gesicht („red neck“, “red man“), |
, Arzneimittelfieber, Schüttelfrost, Schmerzen und Krämpfe in Brust- und Rückenmuskulatur (siehe Abschnitt 4.4) |
Infusionsbedingte Reaktionen
Während oder kurz nach einer schnellen Infusion können anaphylaktische Reaktionen wie Blutdruckabfall, Atemnot, Urtikaria oder Pruritus auftreten. Es kann auch zu Hautrötung am Oberkörper („red neck" bzw. „red man"), zu Schmerzen und Krämpfen der Brust- oder Rückenmuskulatur kommen.
Die Reaktionen klingen im Allgemeinen innerhalb von 20 Minuten bis 2 Stunden nach Absetzen der Infusion ab. Vancomycin ist langsam über mehr als 60 Minuten zu infundieren (siehe Abschnitt 4.4).
Die Verschlechterung des Hörvermögens kann vorübergehend oder bleibend sein. Sie kommt hauptsächlich bei Patienten nach einer Überdosierung, bei Patienten mit bereits beeinträchtigtem Hörvermögen und bei der gleichzeitigen Gabe anderer ototoxischer Arzneimittel wie Aminoglykoside vor.
Nebenwirkungen nach oraler Anwendung
Bei Patienten mit einer entzündlichen Darminfektion können auch nach oraler Anwendung von Vancomycin klinisch bedeutsame Serumkonzentrationen auftreten, vor allem, wenn gleichzeitig eine Einschränkung der Nierenfunktion besteht. Dann sind Nebenwirkungen wie nach intravenöser Infusion möglich.
Die Einnahme von Vancomycin kann zur Überwucherung mit nicht empfindlichen Bakterien oder Pilzen führen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Eine Supportivtherapie unter Aufrechterhaltung der glomerulären Filtration ist ratsam. Vancomycin wird mittels Hämodialyse oder Peritonealdialyse nur schlecht aus dem Blut entfernt. Hämoperfusion mit Amberlit-Harz XAD-4 ist laut Berichten nur begrenzt von Nutzen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe
Vancomycin ist ein Antibiotikum aus der Gruppe der Glykopeptide. ATC-Code
J01XA01
Wirkungsweise
Der Wirkungsmechanismus von Vancomycin beruht auf der Hemmung der
Transglykosylierungsreaktion, so dass die für die Quervernetzung des Mureins benötigten
Vorstufen (N-Acetylglucosamin, N-Acetylmuraminsäure) nicht mehr in die wachsende Zellwand
eingebaut werden. Hieraus resultiert eine bakterizide Wirkung.
Beziehung zwischen Pharmakokinetik und Pharmakodynamik
Die Wirksamkeit hängt im Wesentlichen von der Zeitdauer ab, während der der
Wirkstoffspiegel oberhalb der minimalen Hemmkonzentration (MHK) des Erregers liegt.
Resistenzmechanismen
Eine Resistenz gegenüber Vancomycin kann auf folgenden Mechanismen beruhen:
- Veränderung der Zielstruktur: Diese Form der Resistenz ist in den letzten Jahren insbesondere bei der Spezies Enterococcus faecium aufgetreten. Die Veränderung beruht auf dem Austausch der endständigen D-Alanin-D-Alanin-Funktion der Aminosäureseitenkette einer Mureinvorstufe durch D-Ala-D-Lactat, so dass die Affinität zum Vancomycin stark vermindert ist. Die hierfür verantwortlichen Enzyme sind eine neu gebildete D-Lactat-Dehydrogenase bzw. Ligase.
- Die verminderte Empfindlichkeit oder Resistenz bei Staphylokokken gegenüber Vancomycin beruht auf der Überproduktion von Vorstufen des Mureins, an die Vancomycin gebunden wird.
Eine partielle Kreuzresistenz von Vancomycin besteht mit dem Glykopeptid-Antibiotikum
Teicoplanin.
Grenzwerte
Die Testung von Vancomycin erfolgt unter Benutzung der üblichen Verdünnungsreihe.
Folgende minimale Hemmkonzentrationen für sensible und resistente Keime wurden festgelegt:
EUCAST (European Committee on Antimicrobial Susceptibility Testing) Grenzwerte
|
Erreger |
Sensibel |
Resistent |
|
Staphylococcus aureus |
< 2 mg/l |
> 2 mg/l |
|
Koagulase negative Staphylokokken |
< 4 mg/l |
> 4 mg/l |
|
Enterococcus spp. |
< 4 mg/l |
> 4 mg/l |
|
Streptococcus spp. (Gruppen A, B, C, G) |
< 2 mg/l |
> 2 mg/l |
|
Streptococcus pneumoniae |
< 2 mg/l |
> 2 mg/l |
|
Streptokokken der „Viridans“-Gruppe |
< 2 mg/l |
> 2 mg/l |
|
Grampositive Anaerobier |
< 2 mg/l |
> 2 mg/l |
Prävalenz der erworbenen Resistenz in Deutschland
Die Prävalenz der erworbenen Resistenz einzelner Spezies kann örtlich und im Verlauf der Zeit variieren. Deshalb sind - insbesondere für die adäquate Behandlung schwerer Infektionen -lokale Informationen über die Resistenzsituation erforderlich. Falls auf Grund der lokalen Resistenzsituation die Wirksamkeit von Vancomycin in Frage gestellt ist, sollte eine Therapieberatung durch Experten angestrebt werden. Insbesondere bei schwerwiegenden Infektionen oder bei Therapieversagen ist eine mikrobiologische Diagnose mit dem Nachweis des Erregers und dessen Empfindlichkeit gegenüber Vancomycin anzustreben.
Prävalenz der erworbenen Resistenz in Deutschland auf der Basis von Daten der letzten 5 Jahre aus nationalen Resistenzüberwachungsprojekten und -studien (Stand: Dezember 2012):
Aerobe Gram-positive Mikroorganismen
Corynebacterium jeikeium
O
Enterococcus ^ faecalis
Staphylococcus aureus (inkl. Methicillin-resistenter Stämme)
Staphylococcus epidermidis
Staphylococcus haemolyticus
Staphylococcus hominis
Streptococcus agalactiae
Streptococcus dysgalactiae subsp. equisimilis ° (Streptokokken der Gruppen C & G)_
Streptococcus pneumoniae
Streptococcus pyogenes
Streptokokken der „Viridans“-Gruppe ° A
Anaerobe Mikroorganismen
Clostridium difficile °
Peptoniphilus spp.
O
Peptostreptococcus spp.
O
Spezies, bei denen erworbene Resistenzen ein Problem bei der Anwendung darstellen können
Aerobe Gram-positive Mikroorganismen
Enterococcus faecium
Alle Gram-negativen Bakterien
Andere Mikroorganismen
Chlamydia spp.
Chlamydophila spp.
Legionella pneumophila
Mycoplasma spp.
° Bei Veröffentlichung der Tabellen lagen keine aktuellen Daten vor. In der Primärliteratur, Standardwerken und Therapieempfehlungen wird von einer Empfindlichkeit ausgegangen.
A Sammelbezeichnung für eine heterogene Gruppe von Streptokokken-Spezies. Resistenzrate kann in Abhängigkeit von der vorliegenden Streptokokken-Spezies variieren.
5.2 Pharmakokinetische Eigenschaften
Resorption
Bei oraler Gabe wird das hochpolare Vancomycin praktisch nicht resorbiert. Es erscheint nach oraler Zufuhr in aktiver Form im Stuhl und stellt deshalb für die pseudomembranöse Enterokolitis und Staphylokokken- Enterokolitis ein geeignetes Chemotherapeutikum dar. Nach wiederholter oraler Gabe von Vancomycin können bei Patienten mit aktiver pseudomembranöser Enterokolitis gelegentlich messbare Serumspiegel auftreten.
Verteilung
Vancomycin wird intravenös zur Behandlung von systemischen Infektionen gegeben.
Bei Patienten mit normaler Nierenfunktion ergibt die intravenöse Anwendung mehrerer Dosen von 1 g Vancomycin (15 mg/kg) über 60 Minuten ungefähre durchschnittliche Plasmakonzentrationen von 50-60 pg/ml, 20-25 pg/ml und 5-10 pg/ml unmittelbar, 2 Stunden bzw. 11 Stunden nach Ende der Infusion. Die intravenöse Anwendung mehrerer Dosen von 500 mg über 30 Minuten ergibt durchschnittliche Plasmakonzentrationen von etwa 40-50 mg/l, 19-20 mg/l und 10-11 mg/l unmittelbar, 2 Stunden bzw. 11 Stunden nach Ende der Infusion.
Die Plasmakonzentrationen nach mehreren Dosen sind denen einer Einzeldosis ähnlich.
Bei Serumkonzentrationen von 10 mg/l bis 100 mg/l bindet Vancomycin, gemessen mittels Ultrafiltration, zu etwa 30-55 % an Plasmaprotein.
Nach i .v.-Gabe von Vancomycinhydrochlorid werden Hemmkonzentrationen auch in Pleura-, Perikard-, Aszites- und Synovialflüssigkeit, im Urin und der Peritonealdialyseflüssigkeit sowie im Gewebe des Herzohrs gefunden.
Bei nicht entzündeten Meningen passiert Vancomycin die Blut-Hirn-Schranke nur in geringem Umfang..
Biotransformation
Vancomycin wird nur zu einem geringen Teil metabolisiert.
Elimination
Bei Patienten mit normaler Nierenfunktion beträgt die Halbwertzeit im Serum ca. 4-6 Stunden. In den ersten 24 Stunden werden rund 80 % der gegebenen Vancomycin-Dosis durch glomeruläre Filtration über den Urin ausgeschieden.
Bei eingeschränkter Nierenfunktion ist die Ausscheidung von Vancomycin verzögert. Bei anephrischen Patienten beträgt die mittlere Halbwertzeit 7,5 Tage. Wird Vancomycin während einer Peritonealdialyse intraperitoneal gegeben, so gelangen während 6 Stunden ca. 35-60 % in den systemischen Kreislauf. Nach intraperitonealer Injektion von 30 mg/kg werden Serumspiegel von ca. 8 mg/l erreicht. Vancomycin wird mittels Hämodialyse oder Peritonealdialyse zwar nicht wirksam eliminiert, es liegen jedoch Berichte über eine erhöhte Vancomycin-Clearance unter Hämoperfusion oder Hämofiltration vor. Die gesamte systemische und renale Clearance von Vancomycin kann bei älteren Patienten vermindert sein.
Vancomycin passiert die Plazenta und tritt in die Muttermilch über.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie und Toxizität bei wiederholter Gabe lassen die nicht klinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Begrenzte Daten über mutagene Effekte zeigen negative Ergebnisse, Langzeit-Tierstudien zum kanzerogenen Potenzial liegen nicht vor. In Teratogenitätsstudien mit Ratten und Kaninchen, die ausgehend von der Körperfläche (mg/m2) Dosierungen erhielten, die denen für Menschen entsprachen, wurden weder direkte noch indirekte teratogene Effekte beobachtet.
Tierstudien zur Anwendung in der perinatalen und postnatalen Phase und bezüglich der Auswirkungen auf die Fertilität liegen nicht vor.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Keine
6.2 Inkompatibilitäten
Vancomycin-Lösungen haben einen niedrigen pH-Wert. Dies kann beim Mischen mit anderen Substanzen zu chemischer oder physikalischer Instabilität der resultierenden Lösung führen. Das Mischen mit alkalischen Lösungen ist zu vermeiden.
Jede parenterale Lösung sollte daher vor der Anwendung auf Ausfällungen und Verfärbungen visuell überprüft werden.
Dieses Arzneimittel darf ausschließlich mit den in Abschnitt 6.6 genannten Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
Ungeöffnete Durchstechflasche:
2 Jahre
Haltbarkeit nach Öffnen des Behältnisses oder nach Herstellung der gebrauchsfertigen Zubereitung
Die chemische und physikalische Stabilität der rekonstituierten Lösung wurde für 24 Stunden bei 25 °C und für 96 Stunden bei 2-8 °C gezeigt. Die frisch zubereitete Lösung sollte wegen des Risikos einer mikrobiellen Kontamination alsbald verbraucht werden. Wenn die Lösung nicht sofort nach der Herstellung verbraucht wird, liegen die Lagerzeit und die Lagerbedingungen in der Verantwortung des Anwenders und sollten nicht länger als 24 Stunden bei 2-8 °C sein, wenn die Zubereitung nicht unter geprüften und validierten Bedingungen erfolgte.
Nach Anbruch Reste verwerfen.
Für die orale Anwendung kann die zubereitete Lösung 96 Std. im Kühlschrank aufbewahrt werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Ungeöffnete Durchstechflasche:
Nicht über 25 °C lagern.
Die Durchstechflasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen. Lagerungsbedingungen der rekonstituierten Lösung siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
Vancomycin HEXAL 0,5 g
Packungen mit 5 x 1 bzw. 10 x 1 Durchstechflasche aus farblosen Glas mit Stopfen und Flip-off-Kappe mit Pulver zur Herstellung einer Lösung zum Einnehmen oder zur Herstellung einer Infusionslösung
Das Volumen einer Durchstechflasche beträgt 10 ml.
Vancomycin HEXAL 1,0 g
Packungen mit 5 x 1 bzw. 10 x1 Durchstechflasche aus farblosen Glas mit Stopfen und Flip-off-Kappe mit Pulver zur Herstellung einer Lösung zum Einnehmen oder zur Herstellung einer Infusionslösung
Das Volumen einer Durchstechflasche beträgt 20 ml.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
6.6
Vor dem Gebrauch das Pulver in Wasser für Injektionszwecke auflösen. Weiteres Verdünnen entsprechend den nachfolgenden Anweisungen ist erforderlich. Die rekonstituierte Lösung muss mit kompatiblen Infusionslösungen weiter verdünnt werden. Die Vancomycin-Konzentration soll 2,5-5 mg/ml Infusionslösung nicht übersteigen.
Zubereitung der Infusionslösung
Vancomycin HEXAL 0,5 g
Der Inhalt einer Durchstechflasche wird in 10 ml Wasser für Injektionszwecke gelöst und mit anderen Infusionslösungen (Wasser für Injektionszwecke, 5 %ige Glucoselösung, physiologische Kochsalzlösung) weiter auf 100-200 ml verdünnt.
Vancomycin HEXAL 1,0 g
Der Inhalt einer Durchstechflasche wird in 20 ml Wasser für Injektionszwecke gelöst und mit anderen Infusionslösungen (Wasser für Injektionszwecke, 5 %ige Glucoselösung, physiologische Kochsalzlösung) weiter auf 200-400 ml verdünnt.
Durch die Rekostitution entsteht eine klare, farblose bis leicht gelbliche Lösung.
Zubereitung der Lösung zum Einnehmen
Der Inhalt einer Durchstechflasche mit 500 mg Vancomycin kann in 30 ml Wasser, der Inhalt einer Durchstechflasche mit 1 g Vancomycin kann in 60 ml Wasser aufgelöst werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNGEN
Hexal AG Industriestraße 25 83607 Holzkirchen Tel.: (08024) 908-0 Fax.: (08024)908-1290 E-Mail: medwiss@hexal.com
8. ZULASSUNGSNUMMERN
Vancomycin HEXAL 0,5 g: 45249.01.00
Vancomycin HEXAL 1,0 g: 45249.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNGEN/DATUM DER VERLÄNGERUNG DER ZULASSUNGEN
Datum der Erteilung der Zulassungen 07.02.2001
Datum der Verlängerung der Zulassungen 13.05.2009
10. STAND DER INFORMATION
September 2013
11.
VERKAUFSABGRENZUNG
V erschreibungspflichtig