Vancomycin Noridem 1000 Mg Pulver Für Ein Konzentrat Zur Herstellung Einer Infusionslösung
1. BEZEICHNUNG DES ARZNEIMITTELS
Vancomycin Noridem 1000 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jede Durchstechflasche enthält 1000 mg Vancomycin (entsprechend 1.050.000 I.E.) (als Vancomycinhydrochlorid).
Nach Rekonstitution mit 20 ml Wasser für Injektionszwecke enthält das entstandene Konzentrat zur Herstellung einer Infusionslösung 50 mg/ml Vancomycin.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver für ein Konzentrat zur Herstellung einer Infusionslösung Ein weißes, kristallines Pulver.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Intravenöses Vancomycin ist bei den nachfolgenden schweren Infektionen indiziert, die durch gram-positive Vancomycin-empfindliche Bakterien hervorgerufen werden, welche nicht mit anderen Antibiotika, wie Penicilline oder Cephalosporine, behandelt werden konnten oder auf diese nicht angesprochen haben oder gegen diese resistent sind.
■ Endokarditis
■ Knocheninfektionen (Osteitis, Osteomyelitis)
■ Pneumonie
■ Weichteilinfektionen
Eine durch Enterokokken, Streptococcus viridans oder Streptococcus bovis hervorgerufene Endokarditis sollte mit einer Kombination aus Vancomycin und einem Aminoglykosid behandelt werden.
Bei Patienten mit hohem Risiko für bakterielle Endokarditis kann Vancomycin zur perioperativen Prophylaxe gegen bakterielle Endokarditis eingesetzt werden, wenn sie sich großen chirurgischen Eingriffen (z.B. Herz- und Gefäßoperationen usw.) unterziehen müssen und kein geeignetes Betalactam-Antibiotikum bekommen können.
Die offiziellen Richtlinien für die richtige Anwendung von antibakteriellen Wirkstoffen sollten beachtet werden.
Vancomycin Noridem Pulver für ein Konzentrat zur Herstellung einer Infusionslösung muss intravenös verabreicht werden (als Infusion).
Jede intravenöse Dosis sollte in einer Geschwindigkeit, welche 10 mg/min nicht überschreiten sollte und über einen Zeitraum von mindestens 60 Minuten in Konzentrationen, welche 5 mg/ml (500 mg in mindestens 100 ml und 1 g in mindestens 200 ml verdünnt mit einem geeigneten Verdünnungsmittel ) nicht überschreiten, verabreicht werden. Bei einigen Patienten, bei denen eine Flüssigkeitsrestriktion erforderlich ist, können Lösungen bis zu 10 mg/ml (500 mg/50 ml oder 1000 mg/100 ml) verwendet werden. Die Verwendung von höheren Konzentrationen kann allerdings das Risiko infusionsbedingter Nebenwirkungen erhöhen (siehe Abschnitt 4.8).
Die Dosis sollte entsprechend Gewicht, Alter und Nierenfunktion individuell angepasst werden.
Die nachfolgenden Dosierschemata werden empfohlen:
Intravenöse Verabreichung
Patienten mit normaler Nierenfunktion
Erwachsene, Jugendliche und Kinder über 12 Jahren:
Die empfohlene intravenöse Tagesdosis beträgt 2 g, aufgeteilt auf Dosen von 500 mg alle 6 Stunden oder 1000 mg alle 12 Stunden.
Bei bakterieller Endokarditis ist das allgemein anerkannte Dosisregime 1000 mg Vancomycin intravenös alle 12 Stunden für 4 Wochen, entweder allein oder in Kombination mit anderen Antibiotika (Gentamicin plus Rifampin, Gentamicin, Streptomycin). Enterokkokken-Endokarditis wird über 6 Wochen mit Vancomycin in Kombination mit einem Aminoglykosid behandelt, entsprechend den nationalen Empfehlungen.
Perioperative Prophylaxe gegen bakterielle Endokarditis: Erwachsene erhalten vor dem chirurgischen Eingriff (vor der Narkoseeinleitung) intravenös 1000 mg Vancomycin und abhängig von Operationsdauer und -typ kann eine Dosis von 1000 mg Vancomycin i.v. 12 Stunden postoperativ verabreicht werden.
Kinder im Alter von einem Monat bis 12 Jahren:
Die empfohlene intravenöse Dosis beträgt 10 mg/kg alle 6 Stunden.
Kleinkinder und Säuglinge:
Die empfohlene Initialdosis beträgt 15 mg/kg, gefolgt von 10 mg/kg alle 12 Stunden in der ersten Lebenswoche und danach alle 8 Stunden bis zum Alter von 1 Monat. Eine sorgfältige Überwachung der Vancomycin-Serumkonzentration wird empfohlen (siehe unten).
Ältere Patienten:
Aufgrund der nachlassenden Nierenfunktion im Alter können bei älteren Patienten niedrigere Erhaltungsdosen erforderlich sein.
Adipöse Patienten:
Eine Änderung der üblichen Tagesdosis kann erforderlich sein.
Patienten mit beeinträchtigter Nierenfunktion
Bei Patienten mit beeinträchtigter Nierenfunktion muss die Dosis angepasst werden und das untenstehende Nomogramm kann als Orientierungshilfe dienen. Die sorgfältige Überwachung der Vancomycin-Serumkonzentration wird empfohlen (siehe unten).
|
DOSIERUNG VON VANCOMYCIN BEI PATIENTEN MIT NIERENINSUFFIZIENZ | |
|
Kreatinin-Clearance (ml/min) |
Vancomycin-Dosis (mg/24 Stunden) |
|
100 |
1.545 |
|
90 |
1.390 |
|
80 |
1.235 |
|
70 |
1.080 |
|
60 |
925 |
|
50 |
770 |
|
40 |
620 |
|
30 |
465 |
|
20 |
310 |
|
10 |
155 |
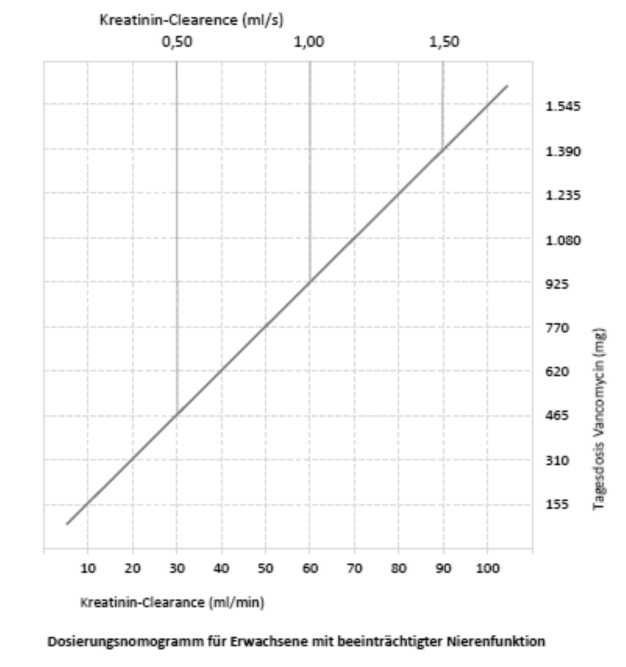
Bei Patienten mit leichter oder mittelschwerer Niereninsuffizienz darf die Initialdosis nicht weniger als 15 mg/kg betragen. Bei Patienten mit schwerer Niereninsuffizienz sollte vorzugsweise eine Erhaltungsdosis zwischen 250 mg und 1000 mg im Abstand von mehreren Tagen gegeben werden, anstatt niedrigere Tagesdosen zu verabreichen.
Patienten mit Anurie (mit so gut wie keiner Nierenfunktion) sollten eine Dosis von 15 mg/kg Körpergewicht bis zur Erreichung der therapeutischen Serumkonzentration erhalten. Die Erhaltungsdosen betragen 1,9 mg/kg Körpergewicht pro 24 Stunden. Zur Vereinfachung können erwachsene Patienten mit stark beeinträchtigter Nierenfunktion statt einer täglichen Dosis eine Erhaltungsdosis von 250 mg bis 1000 mg in Abständen von mehreren Tagen erhalten.
Dosierung im Fall einer Hämodialyse
Bei Patienten mit fehlender Nierenfunktion, selbst bei regelmäßiger Hämodialyse, ist folgende Dosierung ebenfalls möglich:
Sättigungsdosis 1000 mg, Erhaltungsdosis 1000 mg alle 7 bis 10 Tage.
Bei Verwendung von Polysulfon-Membranen für die Hämodialyse („High-Flux-Dialyse"), verkürzt sich die Halbwertszeit von Vancomycin. Bei Patienten mit regelmäßiger Hämodialyse kann eine zusätzliche Erhaltungsdosis erforderlich sein.
Patienten mit Leberinsuffizienz
Es bestehen keine Nachweise darüber, dass bei Patienten mit Leberinsuffizienz die Dosis reduziert werden muss.
Überwachung der Vancomycin-Serumkonzentrationen
Die Serumkonzentration von Vancomycin sollte am zweiten Behandlungstag direkt vor der nächsten Dosis und eine Stunde nach der Infusion überwacht werden. Die therapeutischen Vancomycin-Blutspiegel sollten eine Stunde nach Ende der Infusion zwischen 30 mg/l und 40 mg/l (max. 50 mg/l) liegen, die Talspiegel (kurz vor der nächsten Verabreichung) zwischen 5 mg/l und 10 mg/l. Die Konzentrationen sollten normalerweise zwei- oder dreimal wöchentlich überwacht werden.
Art der Anwendung
Parenteral darf Vancomycin nur als langsame intravenöse Infusion (nicht mehr als 10 mg/min - über mindestens 60 Minuten) in ausreichender Verdünnung (mindestens 100 ml pro 500 mg oder mindestens 200 ml pro 1000 mg) gegeben werden.
Patienten, bei denen Flüssigkeitsrestriktion erforderlich ist, können eine Lösung von 500 mg/50 ml oder 1000 mg/100 ml erhalten. Bei diesen höheren Konzentrationen kann das Risiko infusionsbedingter Nebenwirkungen erhöht sein.
Informationen über die Herstellung der Lösung siehe Abschnitt 6.6.
Dauer der Anwendung
Die Behandlungsdauer hängt von der Schwere der Infektion sowie vom klinischen und bakteriologischen Verlauf ab.
4.3 Gegenanzeigen
Überempfindlichkeit gegen Vancomycin.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Warnhinweise:
Bei akuter Anurie oder bei Schädigung des Cochleaapparates darf Vancomycin nur bei Vitalindikationen eingesetzt werden.
Bei schweren akuten Überempfindlichkeitsreaktionen (z.B. Anaphylaxie) muss die Behandlung mit Vancomycin sofort abgebrochen werden und die üblichen geeigneten Notfallmaßnahmen müssen eingeleitet werden (z.B. Antihistaminika, Kortikosteroide und, falls nötig, künstliche Beatmung).
Eine rasche Bolus Verabreichung ist verbunden mit Hypotonie, Schock und selten Herzstillstand (siehe Abschnitt 4.8) und es muss daher verdünnt über eine Zeitdauer von mindestens 60 Minuten mit einer Dosis nicht über 10 mg/min, verabreicht werden. Bei Abbruch der Infusion kommen diese Reaktionen in der Regel sofort zum Stillstand.
Nephrotoxizität: Vancomycin muss bei Patienten mit Niereninsuffizienz mit Vorsicht eingesetzt werden, da bei anhaltend hohen Blutkonzentrationen die Möglichkeit für toxische Wirkungen wesentlich höher ist. Bei der Behandlung dieser Patienten und solcher, die eine gleichzeitige Behandlung mit anderen nephrotoxischen Arzneimitteln erhalten (z.B. Aminoglykoside), müssen serielle Tests der Nierenfunktion durchgeführt und das geeignete Dosisregime eingehalten werden, um das Risiko einer Nephrotoxizität auf ein Minimum zu reduzieren (siehe Abschnitt 4.2).
Ototoxizität: Über Ototoxizität, die vorübergehend oder permanent sein kann (siehe Abschnitt 4.8), wurde bei Patienten mit vorbestehender Schwerhörigkeit berichtet, die überhöhte intravenöse Dosen erhielten oder die eine gleichzeitige Behandlung mit anderen ototoxischen Arzneimitteln, wie Aminoglykosiden, erhielten. Ein Tinnitus kann der Schwerhörigkeit vorangehen. Das Risiko eines Gehörschadens ist bei älteren Patienten höher. Um das Risiko einer Ototoxizität zu reduzieren, müssen die Blutspiegel regelmäßig bestimmt werden, und es wird eine regelmäßige Untersuchung der Gehörfunktion empfohlen. Eine Schwerhörigkeit kann trotz des Abbruchs der Behandlung fortschreiten.
Vancomycin darf aufgrund des Risikos einer Nekrose nur intravenös verabreicht werden (als Infusion). Das Risiko einer Venenreizung wird minimiert, wenn Vancomycin in Form einer verdünnten Infusion (2,5 g/l bis 5 g/l) verabreicht und die Injektionsstelle gewechselt wird.
Die Verabreichung von Vancomycin durch intraperitoneale Injektion während einer kontinuierlichen ambulanten Peritonealdialyse wurde mit dem chemischen Peritonitis Syndrom in Verbindung gebracht.
Vorsichtsmaßnahmen:
Eine Thrombophlebitis kann auftreten, deren Häufigkeit und Schwere durch eine langsame Verabreichung des verdünnten Arzneimittels (2,5 g/l bis 5 g/l) oder durch den regelmäßigen Wechsel der Injektionsstelle minimiert werden kann.
Die Häufigkeit von infusionsbedingten Reaktionen (Hypotonie, Flush, Erythem, Urtikaria und Juckreiz) nimmt bei gleichzeitiger Verabreichung von Anästhetika zu. Dies kann vermieden werden, wenn Vancomycin mehr als 60 Minuten vor Einleitung der Narkose infundiert wird.
Vancomycin muss bei Patienten mit einer Teicoplaninallergie mit Vorsicht verabreicht werden, da allergische Kreuzreaktionen zwischen Vancomycin und Teicoplanin festgestellt wurden.
Pseudomembranöse Colitis wurde bei fast allen antibakteriellen Substanzen, einschließlich Vancomycin, berichtet und kann leicht bis lebensbedrohlich verlaufen.
Daher ist es wichtig diese Diagnose bei Patienten, bei denen im Zuge einer Anwendung von Vancomycin Durchfälle auftreten, in Betracht zu ziehen. Antiperistaltika sind kontraindiziert.
Wie bei anderen Antibiotika kann eine länger dauernde Therapie mit Vancomycin zu einer Überwucherung von nicht-empfindlichen Bakterien und Pilzen führen. Eine sorgfältige Überwachung des Patienten ist wichtig. Wenn während der Behandlung eine Superinfektion auftritt, müssen geeignete Maßnahmen ergriffen werden.
Fälle von reversibler Neutropenie wurden beschrieben (siehe Abschnitt 4.8). Bei Patienten, die Vancomycin als Langzeittherapie erhalten oder zusätzlich mit einem Arzneimittel, das eine Neutropenie hervorrufen kann, behandelt werden, sollte regelmäßig ein Blutbild durchgeführt werden.
Eine Anästhetika-induzierte Myokarddepression kann durch Vancomycin verstärkt werden. Während der Anästhesie muss die Dosis unter enger Überwachung der Herzfunktion gut verdünnt und langsam verabreicht werden. Ein Positionswechsel sollte bis zur Vollendung der Infusion verschoben werden, um die posturale Anpassung zu ermöglichen.
Anwendung bei älteren Patienten:
Aufgrund seiner Ototoxizität und Nephrotoxizität sollte Vancomycin bei Patienten mit
Niereninsuffizienz oder vorangegangenem Gehörverlust mit Vorsicht eingesetzt werden. Ältere Patienten sind besonders gefährdet: Die Dosen sollten auf Grundlage der Serumspiegel titriert werden. Die Blutspiegel sollten überwacht und Nierenfunktionstests regelmäßig durchgeführt werden. Ältere Patienten sind besonders für einen Gehörschaden anfälliger und es sollten daher aufeinander folgende Tests der Gehörfunktion durchgeführt werden, wenn sie über 60 Jahre alt sind. Eine begleitende oder sequentielle Anwendung anderer neurotoxischer Substanzen sollte vermieden werden.
Anwendung bei Säuglingen und Kindern:
Vancomycin sollte bei frühgeborenen Säuglingen und Kindern, aufgrund ihrer renalen Unreife und des möglichen Anstiegs der Serumkonzentration von Vancomycin, mit besonderer Vorsicht angewendet werden. Die Vancomycinkonzentrationen im Blut sollten daher sorgfältig überwacht werden. Der gleichzeitige Einsatz von Vancomycin und Anästhetika bei Kindern wurde mit Erythemen und anaphylaktoiden Reaktionen in Verbindung gebracht. Falls die Verabreichung von Vancomycin als Operationsprophylaxe erforderlich ist, empfiehlt es sich, das Anästhetikum erst nach Beendigung der Vancomycin-Infusion zu verabreichen (siehe Abschnitt 4.8).
Eine regelmäßige Überwachung der Vancomycin-Blutspiegel ist bei Langzeittherapie indiziert, insbesondere bei Patienten mit Nierenfunktionsstörungen oder beeinträchtigtem Hörvermögen sowie bei gleichzeitiger Anwendung von nephrotoxischen bzw. ototoxischen Substanzen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Andere potentiell nephrotoxische oder ototoxische Arzneimittel Die gleichzeitige oder aufeinanderfolgende Gabe von Vancomycin und anderen potentiell neurotoxischen oder/und nephrotoxischen Wirkstoffen, insbesondere Gentamicin, Amphotericin B, Streptomycin, Neomycin, Kanamycin, Amikacin, Tobramycin, Viomycin, Bacitracin, Polymyxin B, Colistin und Cisplatin, kann die Nephrotoxizität und/oder Ototoxizität von Vancomycin verstärken und erfordert daher die sorgfältige Überwachung des Patienten.
Aufgrund der synergistischen Wirkung (z.B. mit Gentamicin) muss in diesen Fällen die Höchstdosis von Vancomycin auf 500 mg alle 8 Stunden begrenzt werden.
Anästhetika
Die gleichzeitige Anwendung von Vancomycin und Anästhetika wurde mit dem Auftreten von Erythemen, histamin-artigen Flush-Reaktionen und anaphylaktoiden Reaktionen in Zusammenhang gebracht. Dies kann durch die Verabreichung von Vancomycin über 60 Minuten vor der Narkoseeinleitung reduziert werden.
Muskelrelaxantien
Wenn Vancomycin während oder direkt nach einer Operation verabreicht wird, kann die Wirkung (neuromuskuläre Blockade) von aktuell eingesetzten Muskelrelaxantien (wie Succinylcholin) verstärkt oder verlängert werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft:
Es liegen keine ausreichenden Erfahrungen zur Sicherheit der Anwendung von Vancomycin während der Schwangerschaft beim Menschen vor. Studien zur Reproduktionstoxizität bei Tieren deuten nicht darauf hin, dass die Entwicklung des Embryos, Föten oder die Schwangerschaft beeinflusst wird (siehe Abschnitt 5.3).
Vancomycin passiert jedoch die Plazenta, so dass ein potentielles Risiko embryonaler und neonataler Ototoxizität und Nephrotoxizität nicht ausgeschlossen werden kann. Vancomycin darf daher in der Schwangerschaft nur bei eindeutiger Notwendigkeit und nach einer sorgfältigen Risiko-NutzenAbwägung angewendet werden.
Stillzeit:
Vancomycin wird mit der Muttermilch ausgeschieden und darf daher während der Stillzeit nur verabreicht werden, wenn andere Antibiotika versagt haben. Vancomycin muss aufgrund von potentiellen Nebenwirkungen für den Säugling (Störungen der Darmflora mit Diarrhö, Kolonisierung durch hefeartige Pilze und möglicherweise Sensibilisierung) stillenden Müttern nur mit Vorsicht verabreicht werden.
Angesichts der Bedeutung dieses Arzneimittels für die stillende Mutter sollte die Entscheidung in Betracht gezogen werden, das Stillen zu beenden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Vancomycin hat keinen oder vernachlässigbaren Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Die häufigsten Nebenwirkungen sind Phlebitis und pseudo-allergische Reaktionen im Zusammenhang mit einer zu schnellen intravenösen Anwendung (als Infusionen) von Vancomycin.
Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Die nachfolgend aufgeführten Nebenwirkungen werden anhand des MedDRA-Übereinkommens und der Organklassensystemdatenbasis definiert. sehr häufig (>1/10); häufig (>1/100, < 1/10); gelegentlich (>1/1.000, < 1/100); selten (>1/10.000, < 1/1.000); sehr selten (< 1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Erkrankungen des Blut- und Lymphsystems:
Selten (> 1/10.000, <1/1.000):
Trombozytopenie, Neutropenie, Agranulozytose, Eosinophilie.
Erkrankungen des Immunsystems:
Selten (> 1/10.000, <1/1.000):
anaphylaktische Reaktionen, Überempfindlichkeitsreaktionen.
Erkrankungen des Ohrs und des Labyrinths:
Gelegentlich (> 1/1.000, <1/100): transienter oder permanenter Gehörverlust.
Selten (> 1/10.000, <1/1.000):
Tinnitus, Schwindel
Herzerkrankungen
Sehr selten (< 1/10.000):
Herzstillstand
Gefäßerkrankungen:
Häufig (>1/100, <1/10):
Blutdruckabfall, Thrombophlebitis
Selten (> 1/10.000, <1/1.000):
Vaskulitis
Erkrankungen der Atemwege, des Brustraums und Mediastinums:
Häufig (>1/100, <1/10):
Dyspnoe, Stridor
Erkrankungen des Gastrointestinaltrakts:
Selten (> 1/10.000, <1/1.000):
Übelkeit
Sehr selten (< 1/10.000): pseudomembranöse Enterokolitis
Erkrankungen der Haut und des Unterhautzellgewebes:
Häufig (>1/100, <1/10):
Exantheme und Mukositis, Pruritus, Urtikaria
Sehr selten (< 1/10.000):
exfoliative Dermatitis, Stevens-Johnson-Syndrom, Lyell-Syndrom, Vasculitis, bullöse Dermatitis mit IgA-Ablagerung
Erkrankungen der Nieren und Harnwege:
Häufig (> 1/100, <1/10):
Niereninsuffizienz, primär durch eine Erhöhung des Serumkreatinins oder der Harnstoffserumkonzentrationen manifestiert.
Selten (> 10.000, <1/1.000):
interstitielle Nephritis, akutes Nierenversagen
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Häufig (> 1/100, <1/10):
Rötung von Oberkörper und Gesicht. Schmerzen und Krämpfe von Brust- und
Rückenmuskeln.
Selten (> 10.000, <1/1.000):
Arzneimittelfieber, Schüttelfrost.
Während oder kurz nach einer schnellen Infusion können anaphylaktische Reaktionen auftreten. Die Reaktionen klingen im Allgemeinen binnen 20 Minuten bis 2 Stunden nach Beendigung der Verabreichung ab.
Ototoxizität wurde vor allem bei Patienten berichtet, die hohe Dosen erhalten hatten oder die gleichzeitig mit anderen ototoxischen Arzneimitteln behandelt wurden, oder eine bereits bestehende Beeinträchtigung der Nierenfunktion oder des Gehörs aufwiesen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des NutzenRisiko-Verhältnisses des Arzneimittels.
Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Bei Überdosierung wurde über Toxizität berichtet.
Die intravenöse Verabreichung von 500 mg an ein 2-jähriges Kind führte zu einer tödlichen Intoxikation.
Die Verabreichung von insgesamt 56 g über 10 Tage an einen Erwachsenen führte zu einer tödlichen Intoxikation. Bei bestimmten Risikokonstellationen (z.B. bei schwerer Nierenfunktionsstörung) können hohe Serumkonzentrationen und oto- sowie nephrotoxische Wirkungen auftreten.
Maßnahmen im Fall einer Überdosierung
• Ein spezifisches Antidot ist nicht bekannt.
• Hohe Konzentrationen können durch Hämodialyse unter Verwendung von Polysulfonmembranen oder Hämofiltration oder Hämoperfusion unter Verwendung von Polysulfon-Harzen wirksam reduziert werden.
• Zusätzlich ist im Fall einer Überdosierung eine symptomatische Behandlung unter Aufrechterhaltung der Nierenfunktion erforderlich.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
ATC-Klassifikation
Pharmakotherapeutische Gruppe: Glycopeptid-Antibiotika
ATC-Code: J01XA01
Wirkmechanismus
Vancomycin ist ein Glykopeptid-Antibiotikum. Vancomycin hat eine bakterizide Wirkung auf wuchernde Keime, indem es die Biosynthese der Zellwand blockiert.
Zusätzlich beeinträchtigt es die Permeabilität der bakteriellen Zellmembran und der RNS-Synthese.
Beziehung zwischen Pharmakokinetik und Pharmakodynamik Die Wirkung von Vancomycin wird als zeitabhängig angesehen, d.h. die antimikrobielle Wirksamkeit hängt von der Zeitdauer ab, in der der Wirkstoffspiegel über die minimale Hemmkonzentration (MHK) des Zielkeims liegt.
Resistenzmechanismus:
Die erworbene Resistenz gegenüber Glykopeptiden basiert auf dem Erwerb verschiedener van-Genkomplexe und der Änderung der D-Alanyl-D-Alanin Endgruppe zu D-Alanyl-D-Lactat oder D-Alanyl-D-Serin, die Vancomycin schlecht binden, weil eine entscheidende Wasserstoffbindungsstelle fehlt. Diese Resistenzform wird insbesondere bei Enterococcus faecium beobachtet.
Die eingeschränkte Empfindlichkeit oder Resistenz von Staphylococcus gegenüber Vancomycin sind noch nicht genau bekannt. Mehrere genetische Faktoren und mehrfache Mutationen sind dafür erforderlich.
Über eine Kreuzresistenz mit Teicoplanin wurde berichtet.
Empfindlichkeit:
Vancomycin ist wirksam gegen Gram-positive Bakterien. Gram-negative Bakterien sind resistent.
Folgende MHK-Breakpoints trennen sensible von resistenten Keimen: Empfehlungen des EUCAST (European Committee on Antimicrobial Susceptibility Testing)
|
Empfindlichkeit |
Resistent | |
|
Staphylococcus spp. |
< 2 mg/l |
>2 mg/l |
|
Enterococcus spp. |
< 4 mg/l |
> 4 mg/l |
|
Streptococcus spp |
< 2 mg/l |
> 2 mg/l |
|
Streptococcus pneumoniae |
< 2 mg/l |
> 2 mg/l |
|
Gram-positive Anaerobier |
< 2 mg/l |
< 2 mg/l |
|
Nicht speziesspezifisch1 |
< 2 mg/l |
> 4 mg/l |
Streptococcus pneumoniae
Spezies, bei denen die erworbene Resistenz ein Problem darstellen kann
Enterococcus faecium Streptococcus bovis Streptococcus viridans
Primär resistente Spezies
Gram-negative Bakterien Chlamydia spp.
Mycobacteria Mycoplasma spp.
Rickettsia spp.
5.2 Pharmakokinetische Eigenschaften
Vancomycin wird von einem intakten Gastrointestinaltrakt nicht signifikant resorbiert.
Verteilung: Nach intravenöser Verabreichung verteilt sich Vancomycin fast im gesamten Gewebe und diffundiert in die pleurale, perikardiale, aszitische und synoviale Flüssigkeit, sowie in den Herzmuskel und die Herzklappen. Vergleichbar hohe Konzentrationen werden im Blutplasma erreicht. Daten über die Konzentrationen von Vancomycin in den Knochen (spongiosa, compacta) variieren stark. Das sichtbare Verteilungsvolumen im Steady-State wird mit 0,43 (bis 0,9) l/kg angegeben. In nicht entzündeten Hirnhäuten passiert Vancomycin nur geringfügig die Blut-Hirn-Schranke. Vancomycin ist an Plasmaproteine zu 30 bis 55 % oder sogar höher gebunden.
Elimination: Vancomycin wird nur in geringem Ausmaß metabolisiert. Nach parenteraler Verabreichung wird es über glomeruläre Filtration über die Nieren fast komplett als mikrobiologisch wirksame Substanz (ca. 75 % bis 90 % in 24 Stunden) ausgeschieden. Die biliäre Ausscheidung ist nicht signifikant (unter 5 % je Dosis).
Bei Patienten mit normaler Nierenfunktion liegt die Halbwertzeit im Serum bei ca. 4 bis 6 (5 bis 11) Stunden, bei Kindern bei 2,2 bis 3 Stunden. Bei beeinträchtigter Nierenfunktion kann sich die Halbwertzeit von Vancomycin verlängern (bis zu 7,5 Tagen). Aufgrund der Ototoxizität von Vancomycin ist in solchen Fällen eine Therapie unterstützende Überwachung der Plasmakonzentrationen indiziert.
Durchschnittliche Plasmakonzentrationen nach einer intravenösen Infusion von 1000 mg Vancomycin über 60 Minuten liegen bei ca. 63 mg/l nach Beendigung der Infusion, ca. 23 mg/l nach 2 Stunden und ca. 8 mg/l nach 11 Stunden.
Die Plasma-Clearance von Vancomycin korreliert fast mit der glomerulären Filtrationsrate.
Die systemische und renale Gesamt-Clearance von Vancomycin kann bei älteren Patienten reduziert sein.
Wie Studien bei anephrischen Patienten gezeigt haben, scheint die metabolische Clearance sehr niedrig zu sein.
Bei Menschen wurden bisher keine Vancomycin-Metaboliten nachgewiesen.
Falls Vancomycin während einer peritonealen Dialyse über den intraperitonealen Weg verabreicht wird, erreichen ca. 60 % die systemische Zirkulation innerhalb von 6 Stunden. Nach einer intraperitonealen Verabreichung von 30 mg/kg KG, werden Serumspiegel von ca. 10 mg/l erreicht.
Vancomycin diffundiert leicht über die Plazenta und wird im Nabelschnurblut verteilt.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie und Reproduktionstoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Limitierte Daten zu mutagenen Wirkungen zeigen negative Ergebnisse, Langzeitstudien bei Tieren zum karzinogenen Potenzial sind nicht verfügbar. In Teratogenitätsstudien, wo Ratten und Kaninchen auf der Basis ihrer Körperfläche (mg/m2) annährend so hohe Dosen wie Menschen erhielten, konnte keine direkte oder indirekte teratogene Wirkung beobachtet werden.
Tierstudien zur Anwendung in der perinatalen/postnatalen Periode und zu den Auswirkungen auf die Fertilität sind nicht verfügbar.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Salzsäure (zur pH-Einstellung)
6.2 Inkompatibilitäten
Die Vancomycin-Lösung hat einen niedrigen pH-Wert, wodurch eine chemische oder physikalische Instabilität verursacht werden kann, wenn sie mit anderen Substanzen gemischt wird. Das Mischen mit alkalischen Lösungen ist zu vermeiden. Jede parenterale Lösung muss vor Gebrauch auf Ausfällungen und Verfärbungen optisch überprüft werden.
Es hat sich gezeigt, dass Mischungen von Vancomycin- und Beta-Laktam-Antibiotika-Lösungen physikalisch inkompatibel sind. Die Wahrscheinlichkeit einer Präzipitation erhöht sich bei höheren Vancomycin-Konzentrationen. Es empfiehlt sich die intravenösen Schläuche zwischen den Verabreichungen dieser Antibiotika angemessen auszuspülen. Es empfiehlt sich außerdem Vancomycin-Lösungen auf 5 mg/ml oder weniger zu verdünnen.
Obwohl intravitreale Injektion keine zulässige Vancomycin-Verabreichungsweg darstellt, wurde, unter Verwendung von unterschiedlichen Injektionsspritzen und Nadeln, Präzipitation nach einer intravitrealen Injektion von Vancomycin und Ceftazidim gegen Endophthalmitis berichtet. Die Präzipitate lösten sich nach und nach bis zur vollständigen Klarheit des Glaskörpers über 2 Monate und unter Verbesserung der Sehschärfe auf.
Dieses Arzneimittel darf, außer mit den unter Abschnitt 6.6 aufgeführten, nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
Pulver, verkaufsfertig abgepackt 1000 mg Durchstechflasche: 1 Jahr
Nach Rekonstitution/Verdünnung
Aus mikrobiologischer Sicht sollte das Produkt sofort verwendet werden. Wenn es nicht sofort verwendet wird, unterliegen Aufbewahrungsdauer und -bedingungen vor der Verwendung der Verantwortung des Anwenders. Die chemische und physikalische Stabilität der gebrauchsfertigen Lösung wurde für 24 Stunden bei 2-8 oC nachgewiesen.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Pulver:
Nicht über 25°C lagern. Die Durchstechflasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Nach Rekonstitution/Verdünnung
Bezüglich Lagerungsbedingungen des rekonstituierten/verdünnten Arzneimittels, siehe Abschnitt 6.3.
Parenterale Arzneimittel sollten vor der Verabreichung visuell auf Partikel und Verfärbungen geprüft werden, wann immer die Lösung oder das Behältnis dies zulassen.
6.5 Art und Inhalt des Behältnisses
Farblose Glas-Durchstechflaschen (Typ I) mit 30,5 ml, verschlossen mit Gummistopfen (Typ I) und versiegelt mit Aluminiumdeckeln und einem roten Plastik-Flip-off-Deckel.
Packungsgrößen: 1, 5, 10 und 20
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Vor der Verabreichung muss das Pulver rekonstituiert und das sich daraus ergebende Konzentrat dann verdünnt werden.
Zubereitung des rekonstituierten Konzentrats
Zum Zeitpunkt der Anwendung wird der Inhalt jeder 1000 mg Durchstechflasche in 20 ml sterilem Wasser für Injektionszwecke aufgelöst. Ein Milliliter der rekonstituierten Lösung enthält 50 mg Vancomycin.
Lagerungsbedingungen für das rekonstituierte Arzneimittel siehe Abschnitt 6.3.
Zubereitung der gebrauchsfertig verdünnten Infusionslösung
Die rekonstituierten Lösungen mit 50 mg/ml Vancomycin müssen, abhängig von der Art der Anwendung, weiter verdünnt werden.
Geeignete Verdünnungsmittel sind:
Glucose 5 % Injektionslösung (50 mg/ml) oder Natriumchlorid 0,9 % Injektionslösung (9 mg/ml).
Intermittierende Infusion:
Die Vancomycin - Konzentration in der Infusionslösung darf 5 mg/ml nicht überschreiten.
Die gewünschte Dosis ist als langsame intravenöse Infusion mit einer Geschwindigkeit von maximal 10 mg/Minute für mindestens 60 Minuten oder noch länger zu verabreichen.
Wird Vancomycin über einen kürzeren Zeitraum oder in höheren Konzentrationen verabreicht, kann es zu einer induzierten ausgeprägten Hypotonie, zusätzlich zu einer Thrombophlebitis, kommen. Eine schnelle Verabreichung kann auch zu Rötung und einem vorübergehenden Ausschlag über Nacken und Schultern führen.
Kontinuierliche Infusion:
Diese sollte nur eingesetzt werden, wenn eine Behandlung mit einer intermittierenden Infusion nicht möglich ist. Verdünnen Sie 1000 mg bis 2000 mg gelöstes Vancomycin mit einer ausreichenden Menge des oben angegebenen geeigneten Verdünnungsmittels und verabreichen Sie dieses in Form einer Tropfinfusion, sodass der Patient die verschriebene Tagesdosis innerhalb von 24 Stunden erhält.
Lagerungsbedingungen für das verdünnte Arzneimittel siehe Abschnitt 6.3.
Vor der Verabreichung müssen die rekonstituierten und verdünnten Lösungen auf Partikel und Verfärbungen optisch überprüft werden. Nur klare und farblose Lösungen, die frei von Partikeln sind, dürfen verwendet werden.
Entsorgung
Die Durchstechflaschen sind nur zum einmaligen Gebrauch bestimmt. Nicht verwendetes Arzneimittel ist zu verwerfen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
Noridem Enterprises Ltd. Evagorou & Makariou Mitsi Building 3^Suit. 115,
1065 Nikosia Zypern
Mitvertrieb:
DEMO Pharmaceuticals GmbH Airport Business Center Am Söldnermoos 17 D-85399 Hallbergmoos Tel: 0811/555455-0
8. ZULASSUNGSNUMMER
73936.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
07.01.2014
10. STAND DER INFORMATION
Februar 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Nicht speziesspezifische Breakpoints wurden hauptsächlich auf der Basis von PK/PD-Daten bestimmt und sind unabhängig von den MHK-Verteilungen einzelner Arten. Sie sind nur bei den Arten anzuwenden, denen keine speziesspezifischen Breakpoints zugeteilt wurden, und nicht bei denjenigen Arten, für die eine Sensibilitätstestung nicht empfohlen wird.
Die Prävalenz der erworbenen Resistenz einzelner Arten kann geografisch und im Verlauf der Zeit unterschiedlich sein, und Informationen über die lokale Resistenzsituation sind wünschenswert, insbesondere wenn schwere Infektionen behandelt werden.
Nach Bedarf sollte fachmännischer Rat eingeholt werden, wenn die lokale Prävalenz der Resistenz derart ist, dass der Nutzen des Arzneimittels bei zumindest einigen Infektionsarten zweifelhaft ist.
Klassen
Üblicherweise empfindliche Spezies Gram-positiv
Enterococcus faecalis.
Staphylococcus aureus Staphylococcus Koagulase -negativ Staphylococcus epidermidis Streptococcus spp.