Verahexal Khk 120 Mg Retard
Wortlaut der für die Fachinformation vorgesehenen Angaben
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
VeraHEXAL® 40 mg Filmtabletten VeraHEXAL® 80 mg Filmtabletten VeraHEXAL® 120 mg Filmtabletten
VeraHEXAL® 120 mg retard
®
VeraHEXAL® 180 mg retard
VeraHEXAL® 240 mg retard
®
VeraHEXAL® KHK 120 mg retard VeraHEXAL® RR 240 mg retard
Hartkapseln, retardiert Hartkapseln, retardiert Hartkapseln, retardiert Retardtabletten
Retardtabletten
Verapamilhydrochlorid
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
VeraHEXAL 40
1 Filmtablette enthält 40 mg Verapamilhydrochlorid.
Sonstige Bestandteile mit bekannter Wirkung: Lactose-Monohydrat.
VeraHEXAL 80
1 Filmtablette enthält 80 mg Verapamilhydrochlorid.
Sonstige Bestandteile mit bekannter Wirkung: Lactose-Monohydrat.
VeraHEXAL 120
1 Filmtablette enthält 120 mg Verapamilhydrochlorid.
Sonstige Bestandteile mit bekannter Wirkung: Lactose-Monohydrat.
VeraHEXAL 120 mg retard
1 retardierte Hartkapsel enthält 120 mg Verapamilhydrochlorid. Sonstige Bestandteile mit bekannter Wirkung: Sucrose.
VeraHEXAL 180 mg retard
1 retardierte Hartkapsel enthält 180 mg Verapamilhydrochlorid. Sonstige Bestandteile mit bekannter Wirkung: Sucrose.
VeraHEXAL 240 mg retard
1 retardierte Hartkapsel enthält 240 mg Verapamilhydrochlorid. Sonstige Bestandteile mit bekannter Wirkung: Sucrose.
VeraHEXAL KHK 120 mg retard 1 Retardtablette enthält 120 mg Verapamilhydrochlorid.
Sonstige Bestandteile mit bekannter Wirkung: Lactose-Monohydrat.
VeraHEXAL RR 240 mg retard
1 Retardtablette enthält 240 mg Verapamilhydrochlorid.
Sonstige Bestandteile mit bekannter Wirkung: Lactose-Monohydrat.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1
3. DARREICHUNGSFORM
VeraHEXAL 40/-80/-120 Filmtablette
VeraHEXAL 40 ist eine weiße, runde, beidseitig gewölbte Filmtablette.
VeraHEXAL 80 ist eine weiße, runde, beidseitig gewölbte Filmtablette mit einseitiger Bruchkerbe.
Die Filmtablette kann in gleiche Dosen geteilt werden.
VeraHEXAL 120 ist eine weiße, runde, beidseitig gewölbte Filmtablette mit einseitiger Bruchkerbe.
Die Bruchkerbe dient nur zum Teilen der Filmtablette für ein erleichtertes Schlucken und nicht zum Teilen in gleiche Dosen.
VeraHEXAL 120 mg retard/-180 mg retard/ - 240 mg retard Hartkapsel, retardiert
VeraHEXAL 120 mg retard ist eine Kapsel mit zwei rosa-farbenen Kapsel-Hälften, in der weiße bis gelbliche Pellets enthalten sind.
VeraHEXAL 180 mg retard ist eine Kapsel mit einer transparenten und einer rot-braunen Kapsel-Hälfte, in der weiße bis gelbliche Pellets enthalten sind.
VeraHEXAL 240 mg retard ist eine Kapsel mit zwei rot-braunen Kapsel-Hälften, in der weiße bis gelbliche Pellets enthalten sind.
VeraHEXAL KHK 120 mg retard/ - RR 240 mg retard Retardtablette
VeraHEXAL KHK 120 mg retard ist eine beige- bis ocker-farbene, runde Retardtablette mit einseitiger Bruchkerbe.
Die Bruchkerbe dient nur zum Teilen der Retardtablette für ein erleichtertes Schlucken und nicht zum Teilen in gleiche Dosen.
VeraHEXAL RR 240 mg retard ist eine grüne, längliche, beidseitig leicht gewölbte Retardtablette mit beidseitiger Bruchkerbe.
Die Retardtablette kann in gleiche Dosen geteilt werden.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
• Symptomatische koronare Herzkrankheit:
- chronisch stabile Angina pectoris (Belastungsangina)
- instabile Angina pectoris (Crescendoangina, Ruheangina)
- vasospastische Angina pectoris (Prinzmetal-Angina, Variant-Angina)
- Angina pectoris bei Zustand nach Myokardinfarkt bei Patienten ohne Herzinsuffizienz, wenn Betarezeptorenblocker nicht angezeigt sind.
• Störungen der Herzschlagfolge bei:
- paroxysmaler supraventrikulärer Tachykardie
- Vorhofflimmern/Vorhofflattern mit schneller AV-Überleitung (außer bei WPW-Syndrom, siehe unter Abschnitt 4.3).
• Hypertonie.
4.2 Dosierung und Art der Anwendung
Verapamilhydrochlorid, der Wirkstoff von VeraHEXAL, ist individuell, dem Schweregrad der Erkrankung angepasst, zu dosieren. Nach langjähriger klinischer Erfahrung liegt die durchschnittliche Dosis bei fast allen Indikationen zwischen 240 mg und 360 mg pro Tag.
Eine Tagesdosis von 480 mg sollte als Dauertherapie nicht überschritten werden; eine kurzfristige Erhöhung ist möglich.
Soweit nicht anders verordnet gelten folgende Dosierungsrichtlinien:
|
DOSIERUNG |
VeraHEXAL 40 VeraHEXAL 80 VeraHEXAL 120 Filmtabletten |
VeraHEXAL 120 mg retard VeraHEXAL 180 mg retard Hartkapseln, retardiert VeraHEXAL KHK 120 mg retard Retardtablette |
VeraHEXAL 240 mg retard Hartkapseln, retardiert VeraHEXAL RR 240 mg retard Retardtablette |
|
Erwachsene und Jugendliche über 50 kg Körpergewicht | |||
|
Koronare Herzkrankheit |
Empfohlene Dosierung: 1,2 (120)-240-480 mg Verapamilhydrochlorid pro Tag in 3-4 Einzeldosen |
Empfohlene Dosierung: 3 240-480 mg Verapamilhydrochlorid pro Tag in 2 Einzeldosen | |
|
Hypertonie |
Empfohlene Dosierung: 1,2 (120)-240-360 mg Verapamilhydrochlorid pro Tag in 3 Einzeldosen |
Empfohlene Dosierung: 240-480 mg Verapamilhydrochlorid pro Tag in 2 Einzeldosen |
Empfohlene Dosierung: 240-480 mg Verapamilhydrochlorid pro Tag in 1-2 Einzeldosen (1 Einzeldosis morgens; bei unzureichender Wirksamkeit zusätzlich 1 Einzeldosis abends) |
|
Paroxysmale, supraventrikuläre Tachykardie, Vorhofflimmern/ Vorhofflattern |
Empfohlene Dosierung: 1,2 (120)-240-480 mg Verapamilhydrochlorid pro Tag in 3-4 Einzeldosen |
Empfohlene Dosierung: 3 240-480 mg Verapamilhydrochlorid pro Tag in 2 Einzeldosen | |
|
Kinder (Nur bei Störungen der Herzschlagfolge) | |||
|
Ältere Vorschulkinder bis 6 Jahre |
Empfohlene Dosierung: 80-120 mg Verapamilhydrochlorid pro Tag in 2-3 Einzeldosen | ||
|
Schulkinder 6-14 Jahre |
Empfohlene Dosierung: 4 80-360 mg Verapamilhydrochlorid pro Tag in 2-4 Einzeldosen | ||
1 Die Anwendung von VeraHEXAL 40 ist angezeigt bei Patienten, bei denen eine ausreichende Wirksamkeit bereits nach niedrigen Dosen erwartet werden kann (z. B. bei Patienten mit Leberfunktionsstörungen oder älteren Patienten).
2 VeraHEXAL 120 wird angewendet, sofern mit niedrigeren Dosen (z. B. 240 mg Verapamilhydrochlorid pro
Tag) keine ausreichende Wirkung erzielt wurde.
3 Vera HEXAL 240 retard/ - RR 240 retard wird angewendet, sofern mit niedrigeren Dosen (z. B. 240 mg Verapamilhydrochlorid pro Tag) keine ausreichende Wirkung erzielt wurde.
4 VeraHEXAL 80/ -120 wird bei Schulkindern angewendet, sofern mit niedrigeren Dosen (z. B. 80-120 mg Verapamilhydrochlorid pro Tag) keine ausreichende Wirkung erzielt wurde.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Verapamil Retardtabletten bei Kindern und Jugendlichen ist
nicht erwiesen. Es liegen keine Daten vor.
Für alle Darreichungsformen:
Eingeschränkte Leberfunktion
Bei Patienten mit eingeschränkter Leberfunktion wird, in Abhängigkeit vom Schweregrad, wegen eines verlangsamten Arzneimittelabbaus die Wirkung von Verapamilhydrochlorid verstärkt und verlängert. Deshalb sollte in derartigen Fällen die Dosierung mit besonderer Sorgfalt eingestellt und mit niedrigen Dosen begonnen werden (z. B. bei Patienten mit Leberfunktionsstörungen zunächst 2- bis 3-mal täglich 40 mg Verapamilhydrochlorid, entsprechend 80-120 mg Verapamilhydrochlorid pro Tag).
Die Einnahme erfolgt ungelutscht und unzerkaut mit ausreichend Flüssigkeit (z. B. 1 Glas Wasser, kein Grapefruitsaft!) am besten zu oder kurz nach den Mahlzeiten.
Art und Dauer der Anwendung VeraHEXAL nicht im Liegen einnehmen.
Verapamilhydrochlorid darf bei Patienten mit Angina pectoris nach Myokardinfarkt erst 7 Tage nach dem akuten Infarktereignis eingesetzt werden.
Die Dauer der Anwendung ist nicht begrenzt.
Nach einer längeren Therapie sollte VeraHEXAL grundsätzlich nicht plötzlich, sondern ausschleichend abgesetzt werden.
4.3 Gegenanzeigen
VeraHEXAL darf nicht eingenommen werden bei:
- Überempfindlichkeit (Allergie) gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile von VeraHEXAL
- Herz-Kreislauf-Schock
- akutem Myokardinfarkt mit Komplikationen (Bradykardie, Hypotonie, Linksherzinsuffizienz)
- ausgeprägten Reizleitungsstörungen (wie z. B. SA- bzw. AV-Block II. und III. Grades)
- Sinusknotensyndrom
- manifester Herzinsuffizienz
- Vorhofflimmern/flattern und gleichzeitigem Vorliegen eines WPW-Syndroms (erhöhtes Risiko, eine Kammertachykardie auszulösen)
Die gleichzeitige intravenöse Applikation von Betarezeptorenblockern darf bei Patienten während der Behandlung mit VeraHEXAL nicht erfolgen (Ausnahme Intensivmedizin) (siehe auch Abschnitt 4.5).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Eine besonders sorgfältige Überwachung ist erforderlich bei:
- AV-Block I. Grades
- Hypotonie (weniger als 90 mmHg systolisch)
- Bradykardie (Puls unter 50 Schlägen pro Minute)
- stark eingeschränkter Leberfunktion (siehe Abschnitt 4.2)
- Erkrankungen mit beeinträchtigter neuromuskulärer Transmission (Myasthenia gravis, Lambert-Eaton-Syndrom, fortgeschrittene Duchenne-Muskeldystrophie)
Obwohl in Vergleichsstudien zuverlässig gezeigt wurde, dass die beeinträchtigte Nierenfunktion bei Patienten mit terminalem Nierenversagen keinen Einfluss auf die Pharmakokinetik von Verapamil hat, legen einzelne Fallberichte nahe, dass Verapamil bei Patienten mit beeinträchtigter Nierenfunktion nur mit Vorsicht und unter sorgfältiger Überwachung
angewendet werden sollte. Verapamil kann nicht mittels Hämodialyse entfernt werden.
Arzneimittelwechselwirkungen:
Verapamil ist Substrat und Inhibitor des Cytochroms P450 3A4. Bei gleichzeitiger Gabe von Simvastatin, welches über Cytochrom P450 3A4 metabolisiert wird, kann Verapamil die Blutspiegel von Simvastatin erhöhen und dadurch kann das Risiko muskulärer Toxizität erhöht werden. Die Simvastatindosis sollte entsprechend angepasst werden (siehe Produktinformation des Herstellers, siehe auch Abschnitt 4.5).
Zusätzlich für VeraHEXAL 40/- 80/- 120/- KHK 120 mg retard/- RR 240 mg retard Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten VeraHEXAL 40/- 80/- 120/- KHK 120 mg retard und RR 240 mg retard nicht einnehmen.
Zusätzlich für VeraHEXAL 120 mg retard/- 180 mg retard/- 240 mg retard Patienten mit der seltenen hereditären Fructose-Intoleranz, Glucose-Galactose-Malabsorption oder Saccharase-Isomaltase-Mangel sollten VeraHEXAL 120 mg retard/- 180 mg retard und - 240 mg retard nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Folgende Wechselwirkungen dieser Arzneimittel müssen beachtet werden:
Antiarrhythmika (z. B. Flecainid, Disopyramid), Betarezeptorenblocker (z. B. Metoprolol, Propranolol), Inhalationsanästhetika
Gegenseitige Verstärkung der kardiovaskulären Wirkungen (höhergradige AV-Blockierung, höhergradige Senkung der Herzfrequenz, Auftreten einer Herzinsuffizienz, verstärkte Blutdrucksenkung).
Die gleichzeitige intravenöse Applikation von Betarezeptorenblockern darf bei Patienten während der Behandlung mit VeraHEXAL nicht erfolgen (Ausnahme Intensivmedizin) (siehe auch Abschnitt 4.3).
Antihypertensiva, Diuretika, Vasodilatatoren Verstärkung des antihypertensiven Effekts.
Digoxin, Digitoxin
Erhöhung der Digoxin- bzw. Digitoxin-Plasmaspiegel aufgrund verminderter renaler Ausscheidung (vorsorglich auf Symptome einer Digoxin- bzw. Digitoxin-Überdosierung achten und, falls notwendig, Reduktion der Glykosiddosis, evtl. nach Bestimmung der Digoxin- bzw. Digitoxin-Plasmaspiegel).
Chinidin
Verstärkter Blutdruckabfall ist möglich; bei Patienten mit hypertropher obstruktiver Kardiomyopathie kann das Auftreten eines Lungenödems möglich sein; Erhöhung des ChinidinPlasmaspiegels.
Carbamazepin
Carbamazepin-Wirkung wird verstärkt, Zunahme der neurotoxischen Nebenwirkung.
Lithium
Wirkungsabschwächung von Lithium, Erhöhung der Neurotoxizität.
Muskelrelaxantien
Mögliche Wirkungsverstärkung durch Verapamilhydrochlorid.
Acetylsalicylsäure
Verstärkte Blutungsneigung.
Doxorubicin
Bei gleichzeitiger Anwendung von Doxorubicin und Verapamil oral werden die Bioverfügbarkeit und der maximale Plasmaspiegel von Doxorubicin bei Patienten mit kleinzelligem Lungenkarzinom erhöht. Bei Patienten in fortgeschrittenem Tumorstadium wurden keine signifikanten Änderungen der Pharmakokinetik von Doxorubicin bei gleichzeitiger intravenöser Applikation von Verapamil beobachtet.
Ethanol
Verzögerung des Ethanolabbaus und Erhöhung der Ethanolplasmaspiegel, somit Verstärkung der Alkoholwirkung durch Verapamil.
Wechselwirkungen aufgrund von Cytochrom P450 Isoenzym 3A4
Verapamilhydrochlorid wird in der Leber hauptsächlich durch das Cytochrom P450 Isoenzym 3A4 metabolisiert und inhibiert dieses Enzym.
Darüber hinaus inhibiert Verapamil das P-Glycoprotein (P-gp).
In diesem Zusammenhang müssen folgende Wechselwirkungen beachtet werden:
Andere Inhibitoren des Cytochrom-P450-Isoenzyms 3A4 wie z. B. Azol-Fungistatika (z. B. Clotrimazol, Ketoconazol oder Itraconazol), Proteaseinhibitoren (z. B. Ritonavir oder Indinavir), Makrolide (z. B. Erythromycin, Clarithromycin, Telithromycin), Cimetidin, Serotonin-Rezeptorenantagonisten (z. B. Almotriptan), Antidepressiva (z. B. Imipramin), Antidiabetika (z. B. Glibenclamid), Benzodiazepine und andere Anxiolytika (z. B. Buspiron):
Erhöhung des Verapamilhydrochlorid-Plasmaspiegels und/oder der Plasmaspiegel dieser Arzneimittel durch (gegenseitige) Beeinflussung des Abbaus.
Induktoren des Cytochrom P450 Isoenzyms 3A4 wie z. B. Phenytoin, Rifampicin, Phenobarbital, Carbamazepin, Urikosurika (z. B. Sulfinpyrazon), Hypericum perforatum (Johanniskrautextrakt):Senkung des Verapamilhydrochlorid-Plasmaspiegels und Abschwächung der Wirkung von Verapamilhydrochlorid.
Substrate des Cytochrom-P450-Isoenzyms 3A4, z. B. Antiarrhythmika (z. B. Amiodaron oder Chinidin), CSE-Hemmer (z. B. Simvastatin, Lovastatin oder Atorvastatin), Midazolam, Ciclosporin, Everolimus, Sirolimus, Tacrolimus, Theophyllin, Prazosin, Terazosin:
Erhöhung der Plasmaspiegel dieser Arzneimittel.
Colchicin
Colchicin ist Substrat sowohl des Cytochrom P450 Isoenzyms CYP3A4 als auch des Efflux-Transporters, P-Glycoprotein (P-gp). Verapamil hemmt CYP3A4 und P-gp. Bei gleichzeitiger Anwendung von Verapamil und Colchicin kann die Inhibierung von CYP3A4 und/oder P-gp durch Verapamil zu erhöhten Plasmaspiegeln von Colchicin führen. Die gleichzeitige Anwendung von Verapamil und Colchicin wird nicht empfohlen.
CSE-Hemmer (Statine):
- Allgemein
Bei Patienten, die Verapamil einnehmen, sollte die Behandlung mit einem CSE-Hemmer (z. B. Simvastatin, Atorvastatin oder Lovastatin) mit der geringsten möglichen Dosis begonnen und hochtitriert werden. Wird eine Behandlung mit Verapamil zu einer bestehenden Therapie mit CSE-Hemmern (z. B. Simvastatin, Atorvastatin oder Lovastatin) hinzugefügt, sollte an eine Reduktion der Statin-Dosis gedacht werden, wobei gegen die Serum-Cholesterin-Konzentration zurück zu titrieren ist.
- Simvastatin
Bei gleichzeitiger Anwendung von Verapamil und Simvastatin in höheren Dosen ist das Risiko einer Myopathie/Rhabdomyolyse erhöht. Die Simvastatindosis sollte entsprechend angepasst
werden (siehe Produktinformation des Herstellers, vgl auch Abschnitt 4.4).
- Fluvastatin, Provastatin und Rosuvastatin
Fluvastatin, Provastatin und Rosuvastatin werden nicht über das Cytochrom-P450-Isoenzym 3A4 metabolisiert. Eine Wechselwirkung mit Verapamil ist weniger wahrscheinlich.
- Atorvastatin
Bei gleichzeitiger Anwendung von Verapamil und Atorvastatin erhöht sich die Bioverfügbarkeit von Verapamil.
Hinweis:
Während der Anwendung von VeraHEXAL sollten grapefruithaltige Speisen und Getränke gemieden werden. Grapefruit kann den Plasmaspiegel von Verapamilhydrochlorid erhöhen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Verapamilhydrochlorid ist plazentagängig. Die Plasmakonzentration im Nabelvenenblut beträgt 20-92 % der Plasmakonzentration des mütterlichen Blutes. Es liegen keine ausreichenden Erfahrungen mit der Anwendung von Verapamilhydrochlorid während der Schwangerschaft vor. Daten über eine begrenzte Anzahl von oral behandelten Schwangeren lassen jedoch nicht auf teratogene Wirkungen von Verapamilhydrochlorid schließen. Tierexperimentelle Studien haben Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3).
Daher soll Verapamilhydrochlorid im ersten und zweiten Trimenon der Schwangerschaft nicht eingenommen werden. Eine Einnahme im dritten Trimenon der Schwangerschaft darf nur bei zwingender Indikation, unter Berücksichtigung des Risikos für Mutter und Kind, erfolgen.
Stillzeit
Verapamil geht in die Muttermilch über (Milchkonzentration ca. 23 % der mütterlichen Plasmakonzentration).
Begrenzte Humandaten nach oraler Einnahme haben gezeigt, dass der Säugling nur eine geringe Wirkstoffmenge aufnimmt (0,1 bis 1 % der mütterlichen Dosis) und daher die Einnahme von Verapamil mit dem Stillen möglicherweise vereinbar ist.
Wegen der Gefahr schwerwiegender Nebenwirkungen beim Säugling sollte Verapamil während der Stillzeit jedoch nur dann verwendet werden, wenn dies für das Wohlergehen der Mutter unbedingt notwendig ist.
Es gibt Anhaltspunkte dafür, dass Verapamilhydrochlorid in Einzelfällen Hyperprolaktinämie und Galaktorrhoe verursachen kann.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Die Behandlung mit VeraHEXAL bedarf der regelmäßigen ärztlichen Kontrolle. Durch individuell auftretende unterschiedliche Reaktionen kann das Reaktionsvermögen soweit verändert sein, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr, zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Maße bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Unter der Therapie mit VeraHEXAL können die nachfolgend genannten Nebenwirkungen auftreten.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig: > 1/10
Häufig: > 1/100 bis < 1/10
Gelegentlich: > 1/1.000 bis < 1/100
Selten: > 1/10.000 bis < 1/1.000
Sehr selten: < 1/10.000
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Stoffwechsel- und Ernährungsstörungen Gelegentlich: Verminderung der Glukosetoleranz.
Psychiatrische Erkankungen Häufig: Müdigkeit, Nervosität.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen, Schwindel- bzw. Benommenheitsgefühl, Parästhesien,
Neuropathie und Tremor.
Sehr selten: Extrapyramidale Symptome (Parkinson-Syndrom, Choreoathetose, dystone
Syndrome): bilden sich nach bisherigen Erfahrungen nach Absetzen von VeraHEXAL zurück.
Bei gleichzeitiger Anwendung von Verapamil und Colchicin (Wirkstoff zur Gichtbehandlung) wurde in einem Einzelfall über Lähmungen (Paralyse) und zwar Schwäche in Armen und Beinen (Tetraparese) berichtet. Die gleichzeitige Anwendung von Verapamil und Colchicin wird nicht empfohlen.
Herzerkrankungen
Häufig: Entstehung einer Herzinsuffizienz bzw. Verschlimmerung einer
vorbestehenden Herzinsuffizienz, übermäßiger Blutdruckabfall und/oder orthostatische Regulationsstörungen, Sinusbradykardie, AV-Block I. Grades, Knöchelödeme, Flush, Hautrötung und Wärmegefühl.
Gelegentlich: Palpitationen, Tachykardie, AV-Block II. oder III. Grades.
Sehr selten: Sinusstillstand mit Asystolie.
Erkrankungen der Atemwege, des Brustraumes und Mediastinums Gelegentlich: Bronchospasmus.
Erkrankungen des Ohrs und des Labyrinths Gelegentlich: Schwindel (Vertigo), Tinnitus.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Übelkeit, Brechreiz, Völlegefühl, Obstipation.
Gelegentlich: Abdominale Beschwerden, Erbrechen.
Sehr selten: Ileus, Gingivahyperplasie (Gingivitis, Blutung): bildet sich nach Absetzen
von VeraHEXAL zurück.
Leber- und Gallenerkrankungen
Gelegentlich: Wahrscheinlich allergisch bedingte Hepatitis mit reversibler Erhöhung der
leberspezifischen Enzyme.
Erkrankungen
Häufig:
Selten:
Sehr selten:
der Haut und des Unterhautzellgewebes
Allergische Reaktionen, wie Erythem, Pruritus, Urtikaria, makulopapulöse Exantheme, Erythromelalgie.
Purpura.
Angioneurotisches Ödem, Stevens-Johnson-Syndrom, Erythema multiforme, Photodermatitis, Haarausfall.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Selten: Gelenkschmerzen, Muskelschmerzen, Muskelschwäche.
Sehr selten: Verschlimmerung einer Myasthenia gravis, eines Lambert-Eaton
Syndroms und einer fortgeschrittenen Duchenne-Muskeldystrophie.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich: Impotenz.
Selten: Gynäkomastie unter Langzeitbehandlung bei älteren Patienten: bildet sich
nach bisherigen Erfahrungen nach Absetzen von VeraHEXAL zurück.
Sehr selten: Erhöhung der Prolaktinspiegel, Galaktorrhoe.
Hinweis
Bei Patienten mit Herzschrittmacher kann eine Erhöhung der Pacing- und Sensingschwelle unter Verapamilhydrochlorid nicht ausgeschlossen werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer
Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-
Verhältnissses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden
Verdachtsfall einer Nebenwirkung über das
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger Allee 3
D-53175 Bonn
Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome einer Überdosierung
Die Intoxikationssymptome nach Vergiftungen mit Verapamilhydrochlorid verlaufen in Abhängigkeit von der zugeführten Menge, dem Zeitpunkt der Entgiftungsmaßnahmen und der kontraktilen Funktionsfähigkeit des Myokards (Altersabhängigkeit).
Folgende Symptome werden bei einer schweren Vergiftung mit Verapamil beobachtet: schwerer Blutdruckabfall, Herzinsuffizienz, bradykarde oder tachykarde
Herzrhythmusstörungen (z. B. junktionaler Rhythmus mit AV-Dissoziation und höhergradigem AV-Block), die zum Herz-Kreislauf-Schock und Herzstillstand führen können.
Bewusstseinstrübung bis zum Koma, Hyperglykämie, Hypokaliämie, metabolische Azidose, Hypoxie, kardiogener Schock mit Lungenödem, Beeinträchtigung der Nierenfunktion und Konvulsionen. Über Todesfälle wurde gelegentlich berichtet.
Therapiemaßnahmen bei Überdosierung
Therapeutisch stehen die Giftelimination und die Wiederherstellung stabiler Herz-KreislaufVerhältnisse im Vordergrund.
Die Therapiemaßnahmen richten sich nach Zeitpunkt und Art der Verabreichung sowie nach Art und Schwere der Vergiftungssymptome.
Bei Vergiftungen mit größeren Mengen von Retardpräparaten ist zu beachten, dass eine Wirkstofffreisetzung und Resorption im Darm noch länger als 48 Stunden nach der Einnahme erfolgen kann.
Eine Magenspülung ist nach oraler Intoxikation mit Verapamilhydrochlorid anzuraten, auch noch später als 12 Stunden nach der Einnahme, falls keine Magen-Darm-Motilität (Darmgeräusche) nachweisbar ist. Bei Verdacht auf Vergiftung mit Retardpräparaten sind umfangreiche Eliminationsmaßnahmen indiziert, wie induziertes Erbrechen, Absaugen von Magen- und Dünndarminhalt unter endoskopischer Kontrolle, Darmspülung, Abführen, hohe Einläufe.
Eine Hämodialyse ist wegen fehlender Dialysierbarkeit von Verapamilhydrochlorid nicht sinnvoll, eine Hämofiltration und evtl. eine Plasmapherese (hohe Plasmaeiweißbindung der Calcium-Antagonisten) wird jedoch empfohlen.
Übliche intensivmedizinische Wiederbelebungsmaßnahmen, wie extrathorakale Herzmassage, Beatmung, Defibrillation bzw. Schrittmachertherapie.
Spezifische Maßnahmen
Beseitigung von kardiodepressorischen Effekten, von Hypotonie und Bradykardie.
Bradykarde Herzrhythmusstörungen werden symptomatisch mit Atropin und/oder BetaSympathomimetika (Isoprenalin, Orciprenalin) behandelt, bei bedrohlichen bradykarden Herzrhythmusstörungen ist eine temporäre Schrittmachertherapie erforderlich.
Als spezifisches Antidot gilt Calcium, z. B. 10-20 ml einer 10 %igen Calciumgluconatlösung intravenös (2,25 bis 4,5 mmol), erforderlichenfalls wiederholt oder als Dauertropfinfusion (z. B. 5 mmol/Stunde).
Die Hypotonie, als Folge von kardiogenem Schock und arterieller Vasodilatation, wird mit Dopamin (bis 25 pg je kg Körpergewicht je Minute), Dobutamin (bis 15 pg je kg Körpergewicht je Minute), Epinephrin bzw. Norepinephrin behandelt. Die Dosierung dieser Medikamente orientiert sich allein an der gezielten Wirkung. Der Serum-Calcium-Spiegel sollte hochnormal bis leicht erhöht gehalten werden. In der Frühphase wird aufgrund der arteriellen Vasodilatation zusätzlich Flüssigkeit substituiert (Ringer- oder Natriumchloridlösung).
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Calciumantagonist
ATC-Code: C08DA01
Verapamilhydrochlorid gehört zu der Gruppe der Calciumantagonisten. Diese Substanzen haben eine hemmende Wirkung auf den Calciumeinstrom durch Muskelzellmembranen.
Verapamilhydrochlorid wirkt auch als Calciumantagonist an der glatten Muskulatur, insbesondere im Bereich der Gefäße und des Magen-Darm-Traktes. Der Effekt auf die glatte Gefäßmuskulatur äußert sich in einer Vasodilatation.
Verapamilhydrochlorid hat als Calciumantagonist auch einen deutlichen Effekt auf das Myokard. Die Wirkung auf den AV-Knoten äußert sich in einer Verlängerung der Überleitungszeit. Im Bereich des Arbeitsmyokards kann es zu einem negativ inotropen Effekt kommen.
Beim Menschen verursacht Verapamilhydrochlorid infolge der Vasodilatation eine Abnahme des totalen peripheren Widerstandes. Es kommt zu keiner reflektorischen Zunahme des Herzminutenvolumens. Dementsprechend sinkt der Blutdruck.
5.2 Pharmakokinetische Eigenschaften
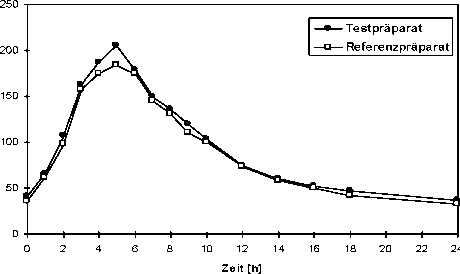
Nach oraler Gabe wird Verapamilhydrochlorid rasch zu 80-90 % aus dem Dünndarm resorbiert. Die biologische Verfügbarkeit beträgt wegen eines ausgeprägten “First-pass-Metabolismus” nur ca. 20 %. Bei oraler Gabe von nicht retardiertem Verapamilhydrochlorid werden nach 1-2 Stunden maximale Plasmaspiegel erreicht. Verapamilhydrochlorid wird zu etwa 90 % an Plasmaproteine gebunden.
Die Substanz wird in hohem Maße zu einer Vielzahl von Metaboliten verstoffwechselt, von denen nur das Norverapamil eine geringe Wirksamkeit besitzt, die im Vergleich zur Muttersubstanz bei 20 % liegt. Die Eliminationshalbwertzeit von Verapamilhydrochlorid liegt bei 3-7 Stunden. Bei Patienten mit eingeschränkter Leberfunktion ist mit einer verzögerten Elimination zu rechnen. Verapamilhydrochlorid wird zu etwa 70 % mit dem Urin, überwiegend als Metabolite ausgeschieden, der unveränderte Anteil liegt bei 3-4 %. Folglich wird die Pharmakokinetik von Verapamilhydrochlorid durch renale Insuffizienz nicht beeinflusst. Mit den Fäzes werden etwa 16 % der verabreichten Dosis eliminiert.
5.3 Präklinische Daten zur Sicherheit
In-vitro- und In-vivo-Untersuchungen erbrachten keine Hinweise auf mutagene Wirkungen von Verapamilhydrochlorid.
Eine Langzeitstudie an der Ratte ergab keine Hinweise auf ein tumorerzeugendes Potenzial von Verapamilhydrochlorid.
Embryotoxizitätsstudien an Kaninchen und Ratte haben bis zu Tagesdosen von 15 mg/kg bzw. 60 mg/kg keine Hinweise auf ein teratogenes Potenzial ergeben. Bei der Ratte traten jedoch im maternal-toxischen Bereich Embryoletalität und Wachstumsretardierungen auf.
6. PHARMAZEUTISCHE ANGABEN
6.1. Liste der sonstigen Bestandteile
VeraHEXAL 40/- 80/- 120 Mikrokristalline Cellulose Carboxymethylstärke-Natrium (Typ A) (Ph.Eur.)
Hypromellose Lactose-Monohydrat Magnesiumstearat (Ph.Eur.)
Maisstärke Povidon (K 25) hochdisperses Siliciumdioxid Titandioxid (E 171)
Zusätzlich für VeraHEXAL 40/- 80
Hyprolose
Macrogol 6000
Zusätzlich für VeraHEXAL 120 Macrogol 4000
VeraHEXAL 120 mg retard/- 180 mg retard/- 240 mg retard
Ethylcellulose
Gelatine
Magnesiumstearat (Ph.Eur.)
Maisstärke
Poly(methacrylsäure, ethylacrylat)
Povidon (K 30)
Sucrose Talkum Triethylcitrat Gereinigtes Wasser Eisen(III)-oxid (E 172)
Titandioxid (E 171)
VeraHEXAL KHK 120 mg retard/- RR 240 mg retard
Mikrokristalline Cellulose
Hypromellose
Lactose-Monohydrat
Macrogol 4000
Magnesiumstearat (Ph.Eur.)
Natriumalginat Povidon (K 25)
Hochdisperses Siliciumdioxid
Zusätzlich für VeraHEXAL KHK 120 mg retard Eisen(III)-hydroxid-oxid (E 172)
Titandioxid (E 171)
Zusätzlich für VeraHEXAL RR 240 mg retard Chinolingelb (E 104)
Indigocarmin (E 132)
Titandioxid (E 171)
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
VeraHEXAL 40/- 80/- 120 5 Jahre
VeraHEXAL 120 mg retard/- 180 mg retard/- 240 mg retard 3 Jahre
VeraHEXAL KHK 120 mg retard/- RR 240 mg retard 24 Monate
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
VeraHEXAL 80
Für dieses Arzneimittel ist keine besondere Lagerungsbedingung erforderlich.
VeraHEXAL 40/- 120/- 120 mg retard/- 180 mg retard/- 240 mg retard/- KHK 120 mg retard/- RR 240 mg retard Nicht über 30 °C lagern.
VeraHEXAL KHK 120 mg retard/- RR 240 mg retard Nicht über 25 °C lagern.
VeraHEXAL 40/- 80/- 120
Packungen mit 30, 50 und 100 Filmtabletten
VeraHEXAL 120 mg retard/- 180 mg retard/- 240 mg retard Packungen mit 30, 50 und 100 Hartkapseln, retardiert
VeraHEXAL KHK 120 mg retard/- RR 240 mg retard Packungen mit 30, 50 und 100 Retardtabletten
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
INHABER DER ZULASSUNGEN
HEXAL AG Industriestraße 25 83607 Holzkirchen Telefon: (08024) 908-0 Telefax: (08024) 908-1290 e-mail: medwiss@hexal.com
ZULASSUNGSNUMMERN
VeraHEXAL 40:
VeraHEXAL 80:
VeraHEXAL 120:
VeraHEXAL 120 mg retard: VeraHEXAL 180 mg retard: VeraHEXAL 240 mg retard: VeraHEXAL KHK 120 mg retard: VeraHEXAL RR 240 mg retard:
26214.00. 00
7676.00. 00
7676.01.00
7721.00. 01
7721.01.01
7721.02.01 33952.01.00
33952.00. 00
DATUM DER ERTEILUNG DER ZULASSUNGEN / VERLÄNGERUNG DER ZULASSUNGEN
|
VeraHEXAL 40: |
29.04.2003 |
|
VeraHEXAL 80: |
09.05.2003 |
|
VeraHEXAL 120: |
09.05.2003 |
|
VeraHEXAL 120 mg retard: |
29.04.2003 |
|
VeraHEXAL 180 mg retard: |
09.12.2003 |
|
VeraHEXAL 240 mg retard: |
29.04.2003 |
|
VeraHEXAL KHK 120 mg retard: |
06.05.2003 |
|
VeraHEXAL RR 240 mg retard: |
29.04.2003 |
|
STAND DER INFORMATION |
März 2015
11. VERKAUFSABGRENZUNG
V erschreibungspflichtig
at
Konzentration [ng/ml]
350
0
o>
o
.2
S
0
o
rat
24
Zeit [h]
12