Verrumal
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Verrumal®
Lösung zur Anwendung auf der Haut Fluorouracil, Salicylsäure
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
100 g Lösung enthalten:
Fluorouracil 0,5 g; Salicylsäure 10,0 g.
Sonstiger Bestandteil mit bekannter Wirkung: Dimethylsulfoxid 8,0 g Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Lösung zur Anwendung auf der Haut.
Verrumal ist eine klare, farblose Lösung.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Vulgäre Warzen (Sonderform: Dornwarzen, an druckbelasteten Stellen der Fußsohle), plane juvenile Warzen der Extremitäten.
4.2 Dosierung und Art der Anwendung
Dosierung
Im Allgemeinen wird Verrumal zwei- bis dreimal täglich auf jede Warze aufgetragen.
Die durchschnittliche Anwendungsdauer beträgt sechs Wochen. Auf eine tägliche, konsequente Anwendung ist zu achten.
Nach erfolgreicher Therapie sollte noch ca. eine Woche lang weiterbehandelt werden.
Kinder
Verrumal darf nicht bei Säuglingen angewendet werden.
Art der Anwendung
Zur Anwendung auf der Haut.
Verrumal darf nur auf die Warze und nicht auf die gesunde Haut der Warzenumgebung gelangen; gegebenenfalls ist die umgebende Haut mit einer Paste oder Salbe abzudecken. Es empfiehlt sich, den Pinsel vor Betupfen am Flaschenhals abzustreifen. Bei sehr kleinen Warzen
sollte man statt des Pinsels zum exakten Auftragen einen Zahnstocher oder etwas Ähnliches verwenden.
Vor jedem neuen Auftragen von Verrumal sollte der vorhandene Lackfilm durch einfaches Abziehen entfernt werden.
Bei periungualen und besonders bei subungualen Warzen ist darauf zu achten, dass die Nagelmatrix nicht geschädigt wird und Verrumal nicht in das Nagelbett gelangt.
Die zu behandelnde Fläche soll nicht größer als 25 cm2 sein.
Erfahrungsgemäß ist es in vielen Fällen, z. B. bei stark prominenten vulgären Warzen und bei Fußsohlenwarzen günstig, wenn das unter der Verrumal-Behandlung abgestorbene Gewebe vom Arzt abgetragen wird.
4.3 Gegenanzeigen
Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Verrumal darf nicht angewendet werden in der Stillzeit, bei einer bestehenden Schwangerschaft und auch nicht von Frauen, bei denen eine Schwangerschaft nicht mit Sicherheit ausgeschlossen werden kann.
Verrumal darf bei Säuglingen und bei Patienten mit Niereninsuffizienz nicht angewendet werden.
Verrumal darf nicht zusammen mit Brivudin, Sorivudin und Analoga angewendet werden. Brivudin, Sorivudin und Analoga sind potente Hemmstoffe des Fluorouracil-abbauenden Enzyms Dihydropyrimidindehydrogenase (DPD) (siehe auch Abschnitt 4.4 und 4.5).
Verrumal ist nicht zur Anwendung auf großen Hautflächen bestimmt (Hautfläche nicht größer als 25 cm2).
Verrumal darf nicht mit den Augen und den Schleimhäuten in Berührung gebracht werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Das Enzym Dihydropyrimidindehydrogenase (DPD) spielt eine wichtige Rolle für den Abbau von Fluorouracil. Inhibierung, Defizienz oder eine erniedrigte Aktivität dieses Enzyms kann zu einer Akkumulation von Fluorouracil führen.
Gegebenenfalls ist die Bestimmung der DPD-Enzymaktivität vor Beginn der Behandlung mit Fluoropyrimidinen indiziert. Patienten, die Phenytoin gleichzeitig mit Fluorouracil einnehmen, sollten regelmäßig auf einen erhöhten Phenytoin-Plasma-Spiegel untersucht werden.
Feuergefährlich!
Salicylsäure und der sonstige wirksame Bestandteil Dimethylsulfoxid können zu Hautreizungen führen.
Sind Hautareale mit dünner Epidermis von Warzen befallen, so ist Verrumal weniger häufig aufzutragen und der Therapieverlauf öfter zu kontrollieren, da es durch die stark hornschichterweichende Wirkung der im Verrumal enthaltenen Salicylsäure zu Narbenbildung kommen kann.
Bei Warzen mit sehr starker Verhornungstendenz ist es manchmal angebracht, mit Salicylsäure-Pflaster vorzubehandeln.
Bei Patienten mit Sensibilitätsstörungen (z.B. bei Diabetes mellitus) ist eine engmaschige ärztliche Kontrolle erforderlich.
Nach jedem Gebrauch ist das Fläschchen gut zu schließen, da das Präparat sonst schnell eintrocknet und nicht mehr ordnungsgemäß angewendet werden kann.
Es ist darauf zu achten, dass Verrumal Lösung beim Auftragen nicht mit Textilien und nicht mit Acryl (z. B. Acrylbadewannen) in Berührung kommt, da die Lösung vor der Lackfilmbildung nicht entfernbare Flecken hervorrufen kann.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Das Enzym Dihydropyrimidindehydrogenase (DPD) spielt eine wichtige Rolle für den Abbau von Fluorouracil. Die Nukleosidanaloga, wie z.B. Brivudin und Sorivudin, können zu einer drastischen Erhöhung der Plasmakonzentration von Fluorouracil oder anderen Fluoropyrimidinen und damit einhergehender Zunahme der Toxizität führen.
Aus diesem Grund sollte zwischen der Anwendung von Fluorouracil und Brivudin, Sorivudin und Analoga ein Zeitabstand von mindestens 4 Wochen eingehalten werden.
Im Falle einer versehentlichen Verabreichung von Nucleosidanaloga wie Brivudin und Sorivudin an Patienten, die mit Fluorouracil behandelt werden, sollten wirkungsvolle Maßnahmen zur Verringerung der Fluorouracil-Toxizität ergriffen werden. Gegebenenfalls ist eine Einweisung ins Krankenhaus angezeigt. Alle Maßnahmen zur Verhütung systemischer Infektionen und einer Dehydration sollten eingeleitet werden.
Bei gleichzeitiger Gabe von Phenytoin und Fluorouracil wurde über eine Erhöhung des Plasmaspiegels von Phenytoin berichtet, die zu Symptomen einer Phenytoin-Intoxikation führten (siehe 4.4).
Resorbierte Salicylsäure kann interagieren mit Methotrexat und Sulfonylharnstoffen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Verrumal ist während der Schwangerschaft und der Stillzeit kontraindiziert (siehe Abschnitt 4.3).
4.7 Auswirkung auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Verrumal hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: Sehr häufig (>1/10)
Häufig (>1/100 bis <1/10)
Gelegentlich (>1/1.000 bis <1/100)
Selten (>1/10.000 bis <1/1.000)
Sehr selten (<1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Systemorgan klasse |
Sehr häufig |
häufig |
gelegentlich |
selten |
Sehr selten |
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) |
|
Erkrankungen des Nervensystems |
Kopf schmerzen | |||||
|
Augenerkrank ungen |
T rockenes Auge, Juckreiz, erhöhter Tränenfluss | |||||
|
Erkrankungen der Haut und des Unterhautzell gewebes |
Hautab schuppung | |||||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
an dem Verabreichungsort auftretende/r: Erytheme, Entzündungen, Reizungen (inklusive Brennen), Schmerzen, Juckreiz |
an dem Verabreichungsort auftretende: Blutungen, Hauterosionen, Verkrustungen |
an dem Verabreichungsort auftretende/s Dermatitis, Ödem, Ulcus |
In seltenen Fällen kann ein starkes Brennen zum Absetzen der Therapie führen.
Durch die starke hornschichterweichende Wirkung kann es insbesondere in der Umgebung der Warze zu weißlichen Verfärbungen und Abschilferungen der Haut kommen.
Aufgrund des Gehaltes an Salicylsäure können bei Anwendung dieses Arzneimittels bei entsprechend veranlagten Patienten leichte Reizerscheinungen wie Dermatitiden und kontaktallergische Reaktionen auftreten, die sich durch Juckreiz, Rötung, Bläschen auch über das Kontaktareal hinaus (so genannte Streureaktionen) manifestieren können.
4.9 Überdosierung
Beim Auftragen von Verrumal auf eine 25 cm2 große Hautfläche wird eine Menge von 0,2 g Verrumal und damit 1 mg Fluorouracil (FU) appliziert. 1 mg FU entspricht bei einem 60 kg schweren Menschen einer Dosis von 0,017 mg/kg Körpergewicht. Systemische Intoxikationen treten bei intravenösen Gaben von 15 mg/kg Körpergewicht auf und sind somit aufgrund dieses tausendfachen Sicherheitsabstandes ausgeschlossen. Zudem erhöht sich der Sicherheitsabstand noch erheblich, da eine perkutane Resorption von FU aus Verrumal in keinem nennenswerten Maße stattfindet (siehe auch Abschnitt 5.2).
Da nach perkutaner Resorption der Salicylsäure kaum Serumspiegel über 5 mg/dl erreicht werden (siehe auch Abschnitt 5.2), sind auch Salicylat-Intoxikationen bei bestimmungsgemäßer Anwendung von Verrumal praktisch ausgeschlossen.
Frühsymptome einer Salicylat-Intoxikation können erst bei Serumspiegeln über 30 mg/ dl auftreten. Sie äußern sich in Ohrensausen, Tinnitus mit Schwerhörigkeit, Epistaxis, Übelkeit, Erbrechen, Reizbarkeit sowie Trockenheitsgefühl der Schleimhäute.
Bei bestimmungsgemäßer Anwendung auf der Haut sind also für beide Wirkstoffe systemische Intoxikationen unwahrscheinlich (s.o.). Eine deutliche Überschreitung der empfohlenen Anwendungshäufigkeit erhöht jedoch Häufigkeit und Schweregrad lokaler Reaktionen an der Anwendungsstelle.
Kinder
Kleine Kinder haben ein anderes Verhältnis zwischen Körperoberfläche und Körpermasse als Erwachsene. Daher erhöht eine signifikante Überschreitung der maximal empfohlenen Behandlungsfläche oder der Behandlungsfrequenz das Risiko einer Salicylsäurevergiftung besonders bei kleinen Kindern.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Warzenmittel und Keratolytika ATC-Code: D11AF
Der Wirkstoff Fluorouracil (FU) gehört zu den als Antimetaboliten wirkenden Zytostatika.
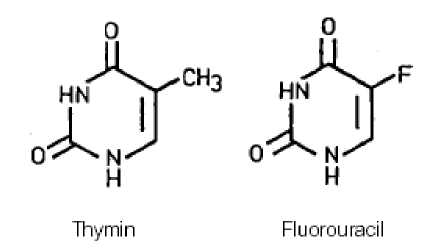
Aufgrund seiner strukturellen Ähnlichkeit mit dem in Nukleinsäuren vorkommenden Thymin (5-Methyluracil) verhindert FU dessen Bildung und Verwertung und hemmt auf diese Weise sowohl die DNA- als auch die RNA-Synthese. Infolgedessen wird das Wachstum der Warzenviren gehemmt, und es kommt zur Wachstumshemmung insbesondere solcher Zellen, welche sich — wie bei den Warzen — in einem forcierten Wachstumsstadium befinden und deshalb FU in vermehrtem Maße aufnehmen.
5.2 Pharmakokinetische Eigenschaften
In einer Resorptionsstudie am Schwein konnte nach kutaner Applikation — auch großer Mengen Verrumal — kein Fluorouracil im Serum nachgewiesen werden, d. h. der Wirkstoff wurde nicht in mit üblichen analytischen Methoden (HPLC) erfassbarer Menge resorbiert.
Nach neueren Untersuchungen liegt die Resorptionsrate von Fluorouracil beim Menschen nach Anwendung von Verrumal deutlich unter 0,1 %.
Verrumal bildet nach dem Auftragen auf die Haut einen festen, nach dem Verdunsten des Lösungsmittels weiß erscheinenden Film. Hierdurch wird eine okklusive Wirkung erreicht, so dass die Penetration des Wirkstoffs in die tieferen Schichten der Warzen gefördert wird.
Salicylsäure wurde wegen ihrer keratolytischen Eigenschaften zugesetzt, damit die gerade bei Warzen schwierige Penetration des Wirkstoffs begünstigt wird. Gleiches wird durch den Lösungsvermittler für den Wirkstoff FU, Dimethylsulfoxid, erreicht.
Die keratolytische Wirkung der Salicylsäure beruht auf einer direkten Einwirkung auf die interzellulären Kittsubstanzen bzw. Desmosomen, die den Verhornungsvorgang fördern.
Aus tierexperimentellen und humanpharmakokinetischen Untersuchungen geht hervor, dass Salicylsäure in Abhängigkeit von der Grundlage und penetrationsbeeinflussenden Faktoren wie z. B. dem Hautzustand rasch penetriert.
Die Metabolisierung von Salicylsäure erfolgt durch Konjugation mit Glycin zu Salicylursäure, mit Glucuronsäure an der phenolischen OH-Gruppe zu Etherglucuronid und an der COOH-Gruppe zu Esterglucuronid bzw. durch Hydroxylierung zu Gentisinsäure bzw. Dihydroxybenzoesäure.
Die Halbwertzeit der Salicylsäure liegt im normalen Dosisbereich zwischen 2 und 3 Stunden und kann bei hoher Dosierung infolge begrenzter Kapazität der Leber, Salicylsäure zu konjugieren, auf 15 bis 30 Stunden ansteigen.
Bei einer topischen Salicylsäure-Anwendung sind im Allgemeinen (bei Beachtung der Kontraindikationen!) keine toxischen Nebenwirkungen zu erwarten, da kaum Serumspiegel über 5 mg/dl erreicht werden. Frühsymptome einer Salicylat-Intoxikation können erst bei Serumwerten über 30 mg/dl auftreten.
5.3 Präklinische Daten zur Sicherheit
Von Salicylsäure sind bisher keine mutagenen, kanzerogenen und teratogenen Wirkungen bekannt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Ethanol
Ethylacetat
Pyroxylin
Poly(butylmethacrylat-comethylmethacrylat) (80:20)
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
Nach Anbruch: 6 Monate
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
Verrumal darf nur kurzzeitig unter 10 °C gelagert werden.
Feuergefährlich!
6.5 Art und Inhalt des Behältnisses
Flasche mit 14 ml
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Almirall Hermal GmbH Scholtzstraße 3 21465 Reinbek Telefon: (0 40) 7 27 04-0 Telefax: (0 40) 7 22 92 96 info@almirall.de www.almirall.de
8. ZULASSUNGSNUMMER
244.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
01. November 1978 / 24. November 2003
10. STAND DER INFORMATION
11.2013
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Seite 7 von 7