Viatim
Sanofi Pasteur MSD GmbH
Gebrauchsinformation: Information für Anwender ViATIM
Suspension und Lösung zur Herstellung einer Injektionssuspension in einer Fertigspritze
Inaktivierter Hepatitis A-Adsorbat- und Typhus-Polysaccharid-Impfstoff
Für Kinder ab 16 Jahren und Erwachsene
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit diesem Impfstoff geimpft werden, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
- Dieser Impfstoff wurde Ihnen persönlich verschrieben. Geben Sie ihn nicht an Dritte weiter.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich bitte an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
1. Was ist ViATIM und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von ViATIM beachten?
3. Wie ist ViATIM anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist ViATIM aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist ViATIM und wofür wird es angewendet?
ViATIM ist ein Impfstoff. Impfstoffe werden zum Schutz vor Infektionskrankheiten angewendet. Dieser Impfstoff schützt Personen ab einem Alter von 16 Jahren gleichzeitig vor einer Typhus- und Hepatitis A-Erkrankung.
Typhus ist eine Infektionskrankheit und kann durch Nahrungsmittel und Getränke übertragen werden, die das krankheitsauslösende Bakterium (bezeichnet als Salmonella enterica, Subtyp typhi) enthalten. Typhus ist eine schwere Infektionskrankheit, die zum Tode führen kann, wenn sie nicht sofort behandelt wird.
Eine Hepatitis A-Erkrankung wird durch ein Virus verursacht, das die Leber angreift. Dieses kann durch Nahrungsmittel oder Getränke übertragen werden, die das Virus enthalten. Zu den Beschwerden gehören Gelbsucht und allgemeines Unwohlsein.
Wenn Sie mit ViATIM geimpft werden, bauen die natürlichen Abwehrmechanismen des Körpers einen Schutz vor einer Typhus- und Hepatitis A-Erkrankung auf.
Bitte beachten Sie auch die aktuellen STIKO-Empfehlungen (Ständige Impfkommission am Robert Koch-Institut, aktuell abrufbar über www.stiko.de).
2. Was sollten Sie vor der Anwendung von ViATIM beachten?
Um sicher zu sein, dass Sie mit ViATIM geimpft werden können, sollten Sie Ihren Arzt, das medizinische Fachpersonal oder Ihren Apotheker darüber informieren, wenn einer der unten aufgeführten Punkte auf Sie zutrifft. Wenn Sie etwas nicht verstehen, bitten Sie diese um weitere Erklärungen.
ViATIM darf nicht verabreicht werden,
- wenn Sie allergisch gegen die Wirkstoffe oder einen der in Abschnitt 6 genannten sonstigen Bestandteile dieses Impfstoffs sind
- wenn Sie allergisch gegen Neomycin sind (Neomycin ist ein Antibiotikum, das während der Herstellung verwendet wird und das noch in Restmengen im Impfstoff enthalten sein kann.)
- wenn Sie an einer akuten fieberhaften Erkrankung leiden. In diesem Fall sollte die Impfung verschoben werden, bis Sie wieder gesund sind
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt, Apotheker oder dem medizinischen Fachpersonal, bevor Sie mit ViATIM geimpft werden.
- Wenn Ihr Immunsystem geschwächt ist: Ihr Immunsystem kann durch eine Behandlung mit kortikoidhaltigen Arzneimitteln, Chemotherapie oder Strahlentherapie zur Krebsbehandlung geschwächt sein. Ihr Arzt rät möglicherweise zu einer Verschiebung der Impfung, bis die Behandlung abgeschlossen ist.
- Wenn Ihr Immunsystem durch eine HIV-Infektion geschwächt ist: Sie können mit ViATIM geimpft werden, jedoch schützt der Impfstoff Sie möglicherweise nicht so gut wie Personen mit einem gesunden Immunsystem.
- Dieser Impfstoff schützt nicht gegen andere Viren, die zu einer Infektion der Leber führen können (wie beispielsweise Hepatitis B-, C- oder E-Viren). Wenn Sie zum Zeitpunkt der Impfung mit ViATIM bereits mit dem Hepatitis A-Virus infiziert sind, kann die Impfung Sie möglicherweise nicht vollständig schützen.
- Dieser Impfstoff schützt nur vor einer Erkrankung, die durch das Typhus-Bakterium verursacht wird, und nicht vor Erkrankungen durch andere Salmonellen-Bakterien.
- Dieser Impfstoff kann die Krankheiten, vor denen er schützt, nicht verursachen.
- Wie bei allen Impfstoffen sind möglicherweise nicht alle Personen, die mit ViATIM geimpft werden, vor Hepatitis A und Typhus geschützt.
Eine Ohnmacht kann (besonders bei Jugendlichen) nach oder bereits vor Injektion mit einer Nadel auftreten. Bitte informieren Sie deshalb Ihren Arzt oder das medizinische Fachpersonal, wenn Sie bzw. Ihr Kind bei einer früheren Injektion schon einmal ohnmächtig geworden sind.
Anwendung von ViATIM zusammen mit anderen Arzneimitteln oder Impfstoffen
Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel anwenden, kürzlich andere Arzneimittel angewendet haben oder beabsichtigen, andere Arzneimittel anzuwenden.
ViATIM enthält keine lebenden Bakterien oder Viren und kann daher gleichzeitig mit anderen Impfstoffen an unterschiedlichen Körperstellen (beispielsweise dem anderen Arm oder Bein) verabreicht werden. ViATIM darf nicht mit anderen Impfstoffen in derselben Spritze gemischt werden.
Ob ViATIM auch schützt, wenn es gleichzeitig mit Immunglobulinen (Antikörper aus Blutspenden) verabreicht wird, ist nicht untersucht worden. Wenn Sie eine Injektion mit Immunglobulinen benötigen, kann diese gleichzeitig mit oder einige Wochen nach der Verabreichung von ViATIM gegeben werden. Es kann jedoch sein, dass Ihr Körper in diesem Fall nicht so viele Antikörper gegen das Hepatitis A-Virus produziert wie sonst. Es ist aber sehr wahrscheinlich, dass Sie dennoch vor einer Infektion geschützt sind.
Schwangerschaft, Stillzeit und Zeugungs-/Gebärfähigkeit
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen schwanger zu werden, fragen Sie vor der Verabreichung dieses Impfstoffs Ihren Arzt oder Apotheker um Rat. Auch wenn ViATIM vermutlich keine schädigenden Auswirkungen auf das ungeborene Kind hat, wird Ihr Arzt entscheiden, ob Sie jetzt oder erst nach der Geburt des Kindes geimpft werden sollen.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Dieser Impfstoff hat einen geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Gelegentlich wurde nach Gabe von ViATIM über Schwindel berichtet (bei weniger als 1 von 100, aber mehr als 1 von 1.000 Geimpften), daher sollten Sie beim Steuern von Fahrzeugen oder beim Bedienen von Maschinen besonders vorsichtig sein.
ViATIM enthält Phenylalanin und Natrium
Dieses Produkt enthält Phenylalanin und kann schädlich sein, wenn Sie eine Phenylketonurie haben. Dieser Impfstoff enthält weniger als 1 Millimol Natrium (23 Milligramm) pro Dosis, d. h., er ist nahezu “natriumfrei”.
3. Wie ist ViATIM anzuwenden?
Die Impfung sollte von Ärzten oder medizinischem Fachpersonal verabreicht werden, die im Umgang mit Impfstoffen geschult sind und die über die notwendige Ausstattung verfügen, um seltene schwere allergische Reaktionen nach der Verabreichung zu behandeln.
Dosierung
Die empfohlene Dosis für Personen ab einem Alter von 16 Jahren ist ein Milliliter. Bereits nach einer Dosis des Impfstoffs wird ein Impfschutz erreicht.
Dieser Impfstoff schützt bereits etwa 14 Tage nach Gabe der ersten Dosis vor Hepatitis A. Zum Aufbau eines Langzeitschutzes vor einer Hepatitis A-Erkrankung ist die Gabe einer zweiten Dosis (Auffrischimpfung) eines inaktivierten Hepatitis A-Impfstoffs erforderlich. Nach Gabe dieser Auffrischimpfung sind Sie mehr als 10 Jahre vor Hepatitis A geschützt. Diese Auffrischimpfung sollte innerhalb von 36 Monaten, vorzugsweise innerhalb von 6 bis 12 Monaten nach der ersten Dosis verabreicht werden.
Wenn Sie vor 6 bis 36 Monaten bereits eine erste Dosis eines inaktivierten Hepatitis A-Impfstoffs erhalten haben, kann dieser Impfstoff verabreicht werden, um einen Langzeitschutz vor Hepatitis A aufzubauen. Voraussetzung hierfür ist, dass Sie auch einen Schutz vor Typhus benötigen. Wenn die erste Hepatitis A-Impfung jedoch in Form eines kombinierten Hepatitis A- und Typhus-Impfstoffs verabreicht wurde, sollte die zweite Dosis eines Kombinationsimpfstoffs 36 Monate nach der ersten Dosis verabreicht werden.
Dieser Impfstoff schützt etwa 14 Tage nach der Verabreichung vor Typhus. Der Impfschutz hält ungefähr 3 Jahre an. Wenn nach 3 Jahren weiterhin das Risiko einer Ansteckung mit Typhus besteht, sollten Sie sich erneut mit gereinigtem Typhus Vi-Polysaccharid-Impfstoff impfen lassen.
Die Flüssigkeiten in den beiden Kammern der Fertigspritze werden unmittelbar vor der Impfung gemischt. Nach dem Mischen wird der Arzt oder das medizinische Fachpersonal die Spritze schütteln und sich vergewissern, dass der Impfstoff eine weißlich-trübe Flüssigkeit ist und keine Fremdkörper enthält.
Art der Anwendung
Dieser Impfstoff wird langsam in einen Muskel (intramuskulär (i.m.)) an der Außenseite des Oberarms verabreicht. Der Impfstoff sollte nicht unter die Haut (subkutan) oder in ein Blutgefäß (intravasal) verabreicht werden. Dieser Impfstoff darf nicht in die Gesäßmuskulatur verabreicht werden.
Wenn Sie an Hämophilie (d. h. einer Krankheit, bei der Sie leicht Blutergüsse bekommen oder schnell bluten) oder anderen Erkrankungen leiden, bei denen eine Verabreichung in den Muskel vermieden werden sollte, kann der Impfstoff unter die Haut verabreicht werden.
Wenn Sie eine größere Menge von ViATIM angewendet haben, als Sie sollten:
In seltenen Fällen wurde eine höhere Dosis verabreicht als empfohlen. Das Nebenwirkungsprofil war vergleichbar mit dem in Abschnitt 4 beschriebenen Nebenwirkungsprofil.
Wenn Sie weitere Fragen zur Anwendung dieses Impfstoffs haben, fragen Sie bitte Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch ViATIM Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Schwerwiegende allergische Reaktionen unbekannter Häufigkeit (Häufigkeit kann aufgrund der verfügbaren Daten nicht abgeschätzt werden):
- Schwere allergische Reaktion (Anaphylaxie), die eines oder mehrere der folgenden Symptome beinhaltet:
• Nesselsucht/Hautausschläge
• Schwellung von Gesicht und/oder Hals, Atembeschwerden, Blaufärbung der Zunge oder Lippen
• Niedriger Blutdruck, schnelle Herzfrequenz und schwacher Puls, kalte Haut, Schwindel und möglicherweise Kollaps
Wenn diese Anzeichen oder Beschwerden auftreten, entwickeln sie sich in der Regel sehr schnell nach der Verabreichung, während sich die geimpfte Person noch in der Arztpraxis oder im Krankenhaus aufhält. Sollten die genannten Beschwerden nach Verlassen der Arztpraxis oder der Klinik, in der die Impfung verabreicht wurde, auftreten, müssen Sie SOFORT einen Arzt aufsuchen.
- Serumkrankheit:
• Gelenkschmerzen, Hautausschläge, vergrößerte Lymphknoten und allgemeines Unwohlsein
Falls diese Beschwerden auftreten, entwickeln sie sich in der Regel 2 bis 4 Wochen nach der Injektion. Sollten die genannten Beschwerden auftreten, müssen Sie so schnell wie möglich einen Arzt aufsuchen.
Sehr häufige Nebenwirkungen (kann mehr als 1 von 10 Geimpften betreffen)
- Schmerz an der Einstichstelle, der in manchen Fällen länger als 3 Tage anhält. Starker Schmerz kann bei weniger als 1 von 10 Geimpften (häufig) auftreten.
- Rötung, Schwellung und Verhärtung an der Verabreichungsstelle. Starke Schwellung und Verhärtung können bei weniger als 1 von 10 Geimpften (häufig) auftreten.
- Kopfschmerz
- Abgeschlagenheit
- Allgemeines Unwohlsein
- Muskelschmerzen
Häufige Nebenwirkungen (kann bis zu 1 von 10 Geimpften betreffen)
- Übelkeit
- Durchfall
- Gelenkschmerzen
- Fieber (hohe Temperatur)
Gelegentliche Nebenwirkungen (kann bis zu 1 von 100 Geimpften betreffen)
- Juckreiz
- Ausschläge
- Schwindel
Sehr seltene Nebenwirkungen (kann bis zu 1 von 10.000 Geimpften betreffen)
- Knötchenbildung an der Verabreichungsstelle
Nebenwirkungen nicht bekannter Häufigkeit (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
- Verschlimmerung von Asthma bei Personen, die bereits an Asthma leiden
- Ohnmachtsanfall als Reaktion auf die Injektion
- Taubheitsgefühl der Haut oder Hautkribbeln
- Ausschlag erhaben und juckend
- Erbrechen und Bauchschmerzen
- Veränderte Leberwerte
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das
medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage
angegeben sind. Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Impfstoffe und
biomedizinische Arzneimittel
Paul-Ehrlich-Institut
Paul-Ehrlich-Str. 51-59
63225 Langen
Tel: +49 6103 77 0
Fax: +49 6103 77 1234
Website: www.pei.de
anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist ViATIM aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen diesen Arzneimittel nach dem auf der Faltschachtel nach "Verwendbar bis:" angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats.
Im Kühlschrank lagern (2 °C - 8 °C). Nicht einfrieren! In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Dieser Impfstoff darf nicht verwendet werden, wenn sich Fremdpartikel darin befinden.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr benötigen. Sie tragen damit zum Schutz der Umwelt bei.
6. Inhalt der Packung und weitere Informationen Was ViATIM enthält
Die Wirkstoffe für 1 Dosis (1,0 Milliliter) des gemischten Impfstoffs sind:
- Inaktiviertes Hepatitis A-Virus, Stamm GBM1, 2 160 Antigen-Einheiten
1 gezüchtet in humanen diploiden MRC-5 Zellen
2 adsorbiert an hydratisiertes Aluminiumhydroxid (enthält 0,3 Milligramm Aluminium) Aluminiumhydroxid ist in diesem Impfstoff als Adsorbens enthalten. Adsorbentien sind Substanzen, die in bestimmten Impfstoffen verwendet werden, um die schützenden Effekte des Impfstoffs zu beschleunigen, zu verstärken und/oder zu verlängern.
- Salmonella typhi (Stamm Ty 2) Vi-Kapselpolysaccharid 25 Mikrogramm
Die sonstigen Bestandteile sind: Natriumchlorid, Dinatriumhydrogenphosphat-Dihydrat, Natriumdihydrogenphosphat-Dihydrat, Phenoxyethanol, Formaldehyd, Medium 199 Hanks ohne Phenolrot (bestehend aus Aminosäuren, einschließlich Phenylalanin (siehe Abschnitt 2), Mineralsalzen, Vitaminen und anderen Bestandteilen) ergänzt mit Polysorbat 80, Wasser für Injektionszwecke, Salzsäure oder Natriumhydroxid zur Einstellung des pH-Wertes.
Wie ViATIM aussieht und Inhalt der Packung
Der Impfstoff besteht aus einer Suspension sowie einer Lösung zur Herstellung einer Injektionssuspension in einer Doppelkammer-Fertigspritze (0,5 Milliliter des inaktivierten Hepatitis A-Virus befinden sich in der einen Kammer und 0,5 Milliliter des gereinigten Typhus-PolysaccharidAntigens in der anderen). Der inaktivierte Hepatitis A-Impfstoff ist eine weißlich-trübe Suspension; der Typhus-Polysaccharid-Impfstoff ist eine klare, farblose Lösung.
ViATIM ist in Packungsgrößen mit 1x1 oder 10x1 Doppelkammer-Fertigspritze mit oder ohne Kanüle zugelassen.
Nicht alle zugelassenen Packungsgrößen und Handelsformen müssen erhältlich sein.
Pharmazeutischer Unternehmer und Hersteller
Pharmazeutischer Unternehmer Sanofi Pasteur MSD GmbH Paul-Ehrlich-Str. 1 69181 Leimen
Hersteller
Sanofi Pasteur S.A.,
Parc Industriel D’Incarville, 27100 Val de Reuil, Frankreich
Sanofi Pasteur S.A.,
Campus Merieux, oder
1541 avenue Marcel Merieux,
69280 Marcy l’Etoile,
Frankreich
Dieses Arzneimittel ist in den Mitgliedstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:
|
Mitgliedstaat |
Bezeichnung |
|
Dänemark, Deutschland, Finnland, Griechenland, Irland, Island, Luxemburg, Niederlande, Norwegen, Österreich, Portugal, Schweden, Vereinigtes Königreich |
ViATIM |
|
Belgien |
VACCIN COMBINE TYPHOIDIQUE POLYOSIDIQUE VI PURIFIE ET HEPATITE A |
Frankreich, Spanien
TYAVAX
Diese Packungsbeilage wurde zuletzt überarbeitet im Februar 2015.
Die folgenden Informationen sind für Ärzte bzw. medizinisches Fachpersonal bestimmt:
Anweisungen für die Handhabung der Doppelkammer-Fertigspritze
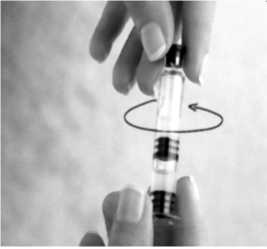
Entfernen Sie durch Drehen in Pfeilrichtung den Gummistopfen.
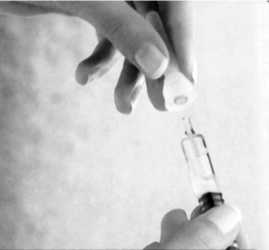
Bringen Sie eine Kanüle inklusive Kanülenschutz auf der Spritze an.
3.)
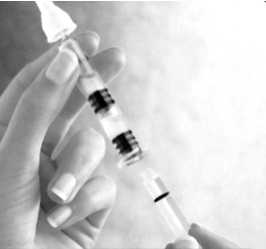
Schrauben Sie den Spritzenkolben in den Stopper.
4.)
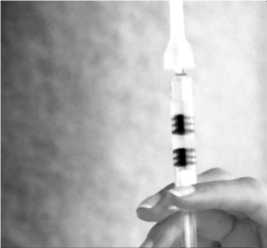
Mischen Sie die Impfstoffkomponenten, indem Sie den Kolben langsam nach oben drücken, wobei Sie die Spritze senkrecht halten.
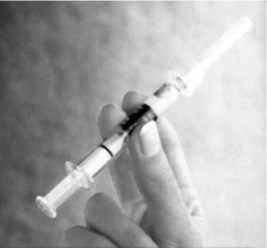
Schütteln Sie die Spritze, bis Sie eine homogene Suspension erhalten.
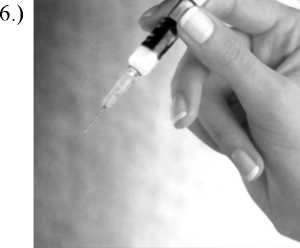
Entfernen Sie den Kanülenschutz.
Sonstige Hinweise
Gemäß § 22 Infektionsschutzgesetz müssen alle Schutzimpfungen vom Impfarzt mit dem Impfdatum, Handelsnamen, der Chargen-Bezeichnung, der Angabe der Krankheit, gegen die geimpft wurde, sowie Name, Anschrift und Unterschrift des impfenden Arztes in einen Impfausweis eingetragen werden.
Häufig unterbleiben indizierte Impfungen, weil bestimmte Umstände irrtümlicherweise als Kontraindikationen angesehen werden. Einzelheiten hierzu und weitere Informationen finden Sie in den jeweils aktuellen Empfehlungen der Ständigen Impfkommission (STIKO) am Robert KochInstitut, aktuell abrufbar über www.stiko.de.
9/9