Vistabel 4 Allergan-Einheiten/0,1 Ml Pulver Zur Herstellung Einer Injektionslösung
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS (FACHINFORMATION)
BEZEICHNUNG DES ARZNEIMITTELS
1.
VISTABEL 4 Allergan-Einheiten/0,1 ml Pulver zur Herstellung einer Injektionslösung Clostridium botulinum Toxin Typ A
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Clostridium botulinum Toxin Typ A 4 Allergan-Einheiten pro 0,1 ml rekonstituierte Lösung.
Allergan-Einheiten sind nicht auf andere Botulinumtoxin Präparate übertragbar. Durchstechflasche mit 50 Einheiten.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver zur Herstellung einer Injektionslösung. Weißes Pulver.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
VISTABEL ist indiziert für die vorübergehende Verbesserung des Aussehens, wenn die Ausprägung der folgenden Gesichtsfalten eine erhebliche psychologische Belastung für erwachsene Patienten darstellt:
• Moderate bis starke vertikale Falten zwischen den Augenbrauen sichtbar bei maximalem Stirnrunzeln (Glabellafalten)
• Moderate bis starke seitliche Kanthalfalten (Krähenfüße) sichtbar bei maximalem Lächeln
• Kombinierte Behandlung von moderaten bis starken Krähenfüßenfalten sichtbar bei maximalem Lächeln und Glabellafalten sichtbar bei maximalem Stirnrunzeln.
4.2 Dosierung und Art der Anwendung
Dosierung
Untenstehend sind spezifische Empfehlungen für jede Indikation aufgeführt.
Botulinumtoxin-Einheiten sind nicht von einem Präparat auf andere übertragbar. Die in Allergan-Einheiten empfohlenen Dosierungen unterscheiden sich von denen anderer Botulinumtoxin-Präparate.
Es liegen nur begrenzte klinische Daten aus Phase 3-Studien mit VISTABEL bei Patienten vor, die über 65 Jahre alt sind (siehe Abschnitt 5.1). Die Anwendung bei älteren Patienten erfordert keine besondere Dosisanpassung.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von VISTABEL bei der Behandlung von Glabellafalten sichtbar bei maximalem Stirnrunzeln oder Krähenfüßen sichtbar bei maximalem Lächeln bei Personen unter 18 Jahren wurde nicht untersucht. Der Einsatz von VISTABEL bei Personen unter 18 Jahren wird nicht empfohlen (siehe Abschnitt 4.4).
Art der Anwendung
VISTABEL darf nur von Ärzten mit der geeigneten Qualifikation und Erfahrung mit dieser Behandlung und dem Gebrauch der erforderlichen Ausstattung verabreicht werden.
VISTABEL darf nach der Rekonstitution nur für eine Behandlung pro Patient verwendet werden. Nicht verwendete Produktreste müssen gemäß Abschnitt 6.6 entsorgt werden. Für die Rekonstitution des Produkts und die Verabreichung sind besondere Vorsichtsmaßnahmen zu treffen, ebenso wie für die Inaktivierung und Beseitigung der restlichen nicht verwendeten Lösung (siehe Abschnitte 4.4 und 6.6).
Das empfohlene Injektionsvolumen pro Injektionsstelle im Muskel beträgt 0,1 ml. Siehe auch Verdünnungstabelle in Abschnitt 6.6.
Für Hinweise zum Gebrauch, zur Handhabung und Entsorgung der Durchstechflaschen siehe Abschnitt 6.6.
Es sollte darauf geachtet werden sicherzustellen, dass VISTABEL nicht in ein Blutgefäß injiziert wird, wenn die Injektion in die vertikalen Falten zwischen den Augenbrauen sichtbar bei maximalem Stirnrunzeln (auch Glabellafalten genannt) oder in die seitlichen Kanthalfalten sichtbar bei maximalem Lächeln (auch Krähenfüße genannt) erfolgt, siehe Abschnitt 4.4.
Anleitungen _für die Anwendung bei Glabellafalten sichtbar bei maximalem Stirnrunzeln:
Rekonstituiertes VISTABEL (50 Einheiten/1,25 ml) wird mit einer sterilen 30-Gauge-Nadel injiziert. Es werden jeweils 0,1 ml (4 Einheiten) in jede der 5 Injektionsstellen verabreicht (siehe Abbildung 1): Zwei Injektionen in jeden M. corrugator und eine Injektion in den M. procerus, dies entspricht einer Gesamtdosis von 20 Einheiten.
Vor und während der Injektion muss mit Daumen oder Zeigefinger fest unter den Augenhöhlenrand gedrückt werden, um eine Diffusion der Lösung in dieses Gebiet zu verhindern. Die Nadel muss während der Injektion superior und medial ausgerichtet bleiben. Um das Risiko einer Ptosis des Augenlids zu reduzieren, sollte die maximale Dosierung von 4 Einheiten für jede Injektion als auch die Anzahl der Injektionsstellen nicht überschritten werden. Zusätzlich müssen Injektionen in der Nähe des M. levator palpebrae superioris vermieden werden, insbesondere bei Patienten mit größeren Brauendepressorkomplexen (Depressor supercilii). Injektionen in den M. corrugator dürfen nur im Mittelteil des Muskels im Abstand von mindestens 1 cm über dem Augenbrauenbogen erfolgen.
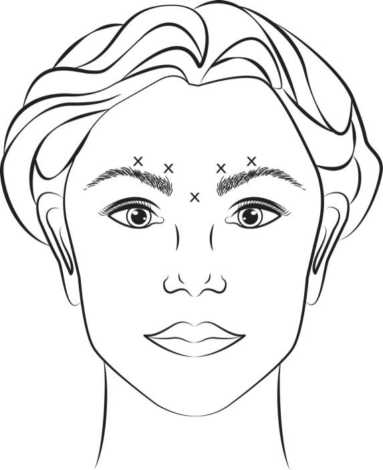
Eine Reduktion der Ausprägung der Glabellafalten sichtbar bei maximalem Stimrunzeln tritt im Allgemeinen innerhalb einer Woche nach Behandlung ein. Die Wirkung hält bis zu 4 Monate nach der Injektion an.
Die Behandlungsintervalle sollten nicht häufiger als alle 3 Monate sein. Wenn die Behandlung fehlschlägt oder die Wirkung bei Wiederholungsinjektionen nachlässt, sollten alternative Behandlungsmethoden herangezogen werden.
Anleitunsen _für die Anwendung bei Krähenfüßen sichtbar bei maximalem Lächeln:
Rekonstituiertes VISTABEL (50 Einheiten/1,25 ml) wird mit einer sterilen 30-Gauge-Nadel injiziert. Es werden jeweils 0,1 ml (4 Einheiten) in jede der 3 Injektionsstellen pro Seite in den seitlichen M. orbicularis oculi verabreicht (insgesamt 6 Injektionsstellen), dies entspricht einer Gesamtdosis von 24 Einheiten bei einem Gesamtvolumen von 0,6 ml (12 Einheiten pro Seite).
Um das Risiko einer Ptosis des Augenlids zu reduzieren, sollte die maximale Dosierung von 4 Einheiten für jede Injektion als auch die Anzahl der Injektionsstellen nicht überschritten werden. Zusätzlich sollten Injektionen auf der Schläfenseite neben dem Augenhöhlenrand erfolgen, um dadurch einen sicheren Abstand zum Lidhebermuskel einzuhalten.
Injektionen sollten mit der Schräge der Nadelspitze nach oben und vom Auge weg verabreicht werden. Die erste Injektion (A) sollte auf der Schläfenseite ungefähr 1,5 bis 2,0 cm vom lateralen Augenwinkel und knapp schläfenwärts des Augenhöhlenrandes erfolgen. Wenn sich die Falten im Bereich der Krähenfüße über und unter dem lateralen Augenwinkel befinden, injizieren Sie wie in Abbildung 2 gezeigt wird. Wenn sich die Falten im Bereich der Krähenfüße hingegen in erster Linie unterhalb des lateralen Augenwinkels befinden, injizieren Sie wie in Abbildung 3 gezeigt wird.
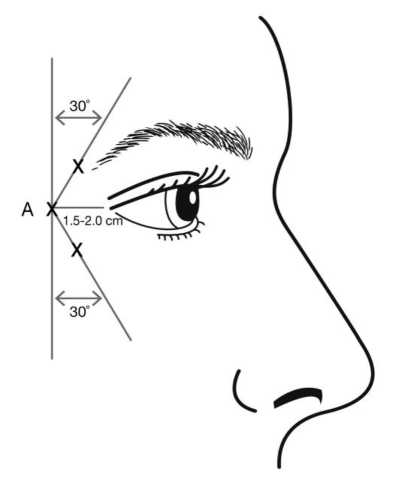
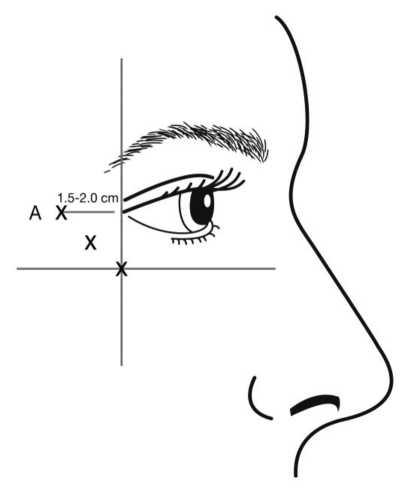
Bei einer gleichzeitigen Behandlung von Glabellafalten sichtbar bei maximalem Stimrunzeln beträgt die Dosis für Krähenfüße sichtbar bei maximalem Lächeln 24 Einheiten und für Glabellafalten 20 Einheiten (siehe Anweisungen zur Anwendung bei Glabellafalten und Abbildung 1), was eine Gesamtdosis von 44 Einheiten und ein Gesamtvolumen von 1,1 ml ergibt.
Eine Reduktion der Ausprägung der Krähenfüße sichtbar bei maximalem Lächeln trat nach Bewertung des Prüfarztes innerhalb einer Behandlungswoche auf. Die Wirkung hielt für eine mittlere Dauer (Median) von 4 Monaten nach der Injektion an.
Behandlungsintervalle sollten nicht kürzer als alle 3 Monate sein.
Allgemeine Informationen
Sollte nach durchgeführter Erstapplikation auch nach einem Monat kein signifikanter therapeutischer Effekt eintreten, sind folgende Maßnahmen durchzuführen:
• Analyse der Gründe für das Therapieversagen, z.B. falsche Muskeln, in die injiziert wurde, Injektionsverfahren, Bildung Toxin-neutralisierender Antikörper, unzureichende Dosierung
• Überprüfung der Behandlung mit Botulinumtoxin Typ A als angemessene Therapieform.
Wenn nach der ersten Behandlungssitzung keine Nebenwirkungen auftreten, kann eine Wiederholungsbehandlung vorgenommen werden; es sollten mindestens drei Monate zwischen den beiden Behandlungen liegen.
Bei unzureichender Dosierung bei Glabellafalten sichtbar bei maximalem Stirnrunzeln kann eine Wiederholungsbehandlung vorgenommen werden, indem die Dosis auf eine Gesamtdosis von bis zu 40 oder 50 Einheiten unter Berücksichtigung der Analyse des vorausgegangenen Therapieversagens angepasst wird.
Die Sicherheit und Wirksamkeit von VISTABEL nach wiederholten Injektionen nach mehr als 12 Monaten ist nicht untersucht worden.
4.3 Gegenanzeigen
VISTABEL darf nicht angewendet werden:
- bei Personen, bei denen eine Überempfindlichkeit gegen Botulinumtoxin Typ A oder einen der sonstigen Bestandteile bekannt ist
- bei Myasthenia gravis oder Lambert-Eaton-Syndrom
- bei Infektionen an den vorgesehenen Injektionsstellen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Besondere Vorsicht ist bei der Aufbereitung des Produkts und der Verabreichung sowie bei der Inaktivierung und Beseitigung der restlichen nicht verwendeten Lösung (siehe Abschnitte 4.2 und 6.6) erforderlich.
Dieses Arzneimittel enthält weniger als 1 mmol (23 mg) Natrium pro Dosiereinheit, d.h., es ist nahezu „natriumfrei“.
Bevor der Arzt VISTABEL anwendet, muss er sich mit der Anatomie des Patienten sowie irgendwelchen aufgrund chirurgischer Eingriffe entstandenen anatomischen Veränderungen vertraut machen. Injektionen in verletzliche anatomische Strukturen sind zu vermeiden.
Die empfohlenen Dosierungen und die Häufigkeit der Dosierung sind nicht zu überschreiten.
Sehr selten kann nach der Injektion von Botulinumtoxin eine anaphylaktische Reaktion auftreten. Deshalb sollten Epinephrin (Adrenalin) und andere antianaphylaktische Maßnahmen verfügbar sein.
Patienten mit nicht erkannten neuromuskulären Störungen können ein erhöhtes Risiko klinisch signifikanter systemischer Auswirkungen aufweisen, einschließlich schwerer Dysphagie und respiratorischer Störungen durch typische Dosen von Botulinumtoxin Typ A. In einigen dieser Fälle dauerte die Dysphagie mehrere Monate lang an und erforderte den Einsatz einer Magensonde (siehe Abschnitt 4.3).
Bei Patienten mit amyotropher Lateralsklerose oder peripheren neuromuskulären Dysfunktionen sollte VISTABEL ebenfalls nur mit Vorsicht angewendet werden.
Nebenwirkungen, die möglicherweise mit der Ausbreitung des Toxins an vom Applikationsort entfernte Stellen in Zusammenhang stehen (siehe Abschnitt 4.8), wurden mit Botulinumtoxin sehr selten berichtet. Bei Patienten, die mit therapeutischen Dosen behandelt werden, kann eine übersteigerte Muskelschwäche auftreten. Probleme beim Schlucken und mit der Atmung sind als schwerwiegend einzustufen und können zum Tode führen. Die Injektion von VISTABEL wird bei Patienten mit einer Vorgeschichte von Dysphagie und Aspiration nicht empfohlen.
Die Patienten oder das Pflegepersonal sollten darauf hingewiesen werden, dass sofort der Arzt zu verständigen ist, wenn Schluck-, Sprech- oder Atemstörungen auftreten.
Zu hohe Dosen oder zu häufige Injektionen können das Risiko einer Antikörperbildung erhöhen. Antikörperbildung kann auch bei anderen Indikationen zu einem Therapieversagen mit Botulinumtoxin Typ A führen.
Wie bei jedem Injektionsverfahren zu erwarten, stehen auch hier lokale Schmerzen, Entzündung, Parästhesien, Hypoästhesie, Schmerzempfindlichkeit, Schwellungen/Ödeme, Erytheme, lokale Infektionen, Blutungen und/oder Hämatome mit der Injektion in Zusammenhang. Schmerzen und/oder Angstzustände bezüglich der Injektion führten zu vasovagalen Reaktionen, einschließlich vorübergehender Hypotonie und Synkope.
VISTABEL sollte nur mit Vorsicht angewendet werden bei Entzündung der vorgesehenen Injektionsstelle(n) oder bei ausgeprägter Schwäche oder Atrophie des zu injizierenden Muskels.
Es sollte darauf geachtet werden sicherzustellen, dass VISTABEL nicht in ein Blutgefäß injiziert wird, wenn die Injektion in die Glabellafalten sichtbar bei maximalem Stirnrunzeln oder in die Krähenfüße sichtbar bei maximalem Lächeln erfolgt, siehe Abschnitt 4.2.
Es besteht das Risiko einer Ptosis des Augenlids nach der Behandlung. In Abschnitt 4.2, Anleitungen für die Anwendung, wird beschrieben, wie dieses Risiko minimiert werden kann.
Die Anwendung von VISTABEL wird nicht empfohlen bei Patienten, die unter 18 Jahre sind. Es liegen begrenzte klinische Daten der Phase 3 für VISTABEL bei Patienten über 65 Jahre vor.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Theoretisch kann die Wirkung von Botulinumtoxin durch Aminoglykosidantibiotika, Spectinomycin oder andere Arzneimittel, die auf die neuromuskuläre Reizleitung wirken, z.B. neuromuskuläre Blocker, potenziert werden.
Die Wirkung einer gleichzeitigen Verabreichung oder einer Anwendung innerhalb mehrerer Monate von verschiedenen Botulinumneurotoxin-Serotypen ist nicht bekannt. Eine ausgeprägte neuromuskuläre Schwäche kann sich noch verstärken, wenn ein anderes Botulinumtoxin verabreicht wird, bevor die Wirkungen eines zuvor injizierten Botulinumtoxins abgeklungen sind.
Spezielle Untersuchungen zu Wechselwirkungen mit anderen Arzneimitteln wurden nicht durchgeführt. Wechselwirkungen mit klinischer Relevanz wurden für dieses Anwendungsgebiet nicht berichtet.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen keine ausreichenden Daten zur Anwendung von Botulinumtoxin Typ A während der Schwangerschaft vor. In Studien an Tieren wurde eine reproduktionstoxische Wirkung nachgewiesen (siehe Abschnitt 5.3). Das potentielle Risiko für den Menschen ist nicht bekannt. Es wird empfohlen, VISTABEL nicht in der Schwangerschaft und bei Frauen im gebärfähigen Alter, die nicht verhüten, anzuwenden.
Stillzeit
Es ist nicht bekannt, ob VISTABEL in die Muttermilch übergeht. Die Anwendung von VISTABEL während der Stillzeit kann nicht empfohlen werden.
Es liegen keine adäquaten Daten zu den Auswirkungen von Botulinumtoxin Typ A auf die Fertilität bei Frauen im gebärfähigen Alter vor. Studien an männlichen und weiblichen Ratten zeigten eine Verringerung der Fertilität (siehe Abschnitt 5.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu Auswirkungen auf die Fähigkeit, Fahrzeuge zu lenken und Maschinen zu bedienen, durchgeführt. VISTABEL kann jedoch zu Asthenie, Muskelschwäche, Schwindel und Sehstörungen führen, was zu einer Beeinträchtigung der Fähigkeit, Fahrzeuge zu lenken und Maschinen zu bedienen, führen kann.
4.8 Nebenwirkungen
a) Allgemein
In kontrollierten klinischen Studien zu Glabellafalten sichtbar bei maximalem Stirnrunzeln wurden bei
23.5 % (Placebo: 19,2 %) der Patienten Nebenwirkungen festgestellt, die von den Prüfärzten als auf VISTABEL bezogen eingestuft wurden. In Behandlungszyklus 1 der kontrollierten klinischen konfirmatorischen Studien zu Krähenfüßen sichtbar bei maximalem Lächeln wurden solche Ereignisse bei 7,6 % (24 Einheiten nur für Krähenfüße) und 6,2 % (44 Einheiten: 24 Einheiten für Krähenfüße, die gleichzeitig mit 20 Einheiten für Glabellafalten verabreicht wurden) der Patienten im Vergleich zu
4.5 % bei Placebo beobachtet.
Nebenwirkungen können mit der Behandlung, der Injektionstechnik oder beidem zusammenhängen. Generell treten Nebenwirkungen innerhalb der ersten Tage nach der Injektion auf und sind vorübergehend. Die meisten Nebenwirkungen, die bisher berichtet wurden, waren leicht bis mittelschwer.
Lokale Muskelschwäche stellt eine erwartete pharmakologische Wirkung von Botulinumtoxin dar. Dennoch wurde über Muskelschwäche angrenzender und/oder von der Injektionsstelle entfernter Muskeln berichtet. Blepharoptosis, die durch die Injektionstechnik bedingt sein kann, hängt mit der pharmakologischen Wirkung von VISTABEL zusammen. Wie bei jeder Injektion können im Zusammenhang mit der Injektion Schmerzen, Brennen, Stechen, Ödeme und/oder Blutergüsse auftreten. Außerdem wurden nach einer Injektion von Botulinumtoxin auch Fieber und grippeartige Symptome berichtet.
b) Nebenwirkungen - Häufigkeit
Die Nebenwirkungen werden in die nachfolgenden Systemorganklassen entsprechend der Häufigkeit des Auftretens eingeteilt:
Sehr häufig (>1/10); Häufig (>1/100, <1/10); Gelegentlich (>1/1.000, <1/100); Selten (>1/10.000, <1/1.000); Sehr selten (<1/10.000).
|
Organsystemklasse |
Bevorzugter Terminus |
Häufigkeit |
|
Infektionen und parasitäre Erkrankungen |
Infektion |
Gelegentlich |
|
Psychiatrische Erkrankungen |
Angst |
Gelegentlich |
|
Erkrankungen des Nervensystems |
Kopfschmerz, Parästhesie |
Häufig |
|
Schwindel |
Gelegentlich | |
|
Augenerkrankungen |
Augenlid Ptosis |
Häufig |
|
Blepharitis, Augenschmerzen, Sehstörungen (einschließlich unscharfes Sehen) |
Gelegentlich | |
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit |
Häufig |
|
Trockener Mund |
Gelegentlich | |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Erytheme, Spannungsgefühl der Haut |
Häufig |
|
Oedeme (Gesicht, Augenlid, periorbital), Lichtempfindlichkeit, Juckreiz, trockene Haut |
Gelegentlich | |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Lokalisierte Muskelschwäche |
Häufig |
|
Muskelzuckungen |
Gelegentlich | |
|
Allgemeine Erkrankungen und Beschwerden am V erabreichungsort |
Gesichtsschmerzen, Ödeme an der Injektionsstelle, Ekchymose, Schmerzen an der Injektionsstelle, Irritationen an der Injektionsstelle |
Häufig |
|
Grippesymptome, Asthenie, Fieber |
Gelegentlich |
Krähenfüße
Die folgenden Nebenwirkungen wurden in doppelblinden, placebokontrollierten klinischen Studien nach der Injektion von 24 Einheiten VISTABEL nur für Krähenfüße berichtet:
|
Organsystemklasse |
Bevorzugter Terminus |
Häufigkeit |
|
Augenerkrankungen |
Augenlid-Ödem |
Häufig |
|
Allgemeine Erkrankungen und Beschwerden am V erabreichungsort |
Blutungen an der Injektionsstelle*, Hämatom an der Injektionsstelle* |
Häufig |
|
Schmerzen an der Injektionsstelle*, Parästhesie an der Injektionsstelle |
Gelegentlich |
*Nebenwirkungen aufgrund der Injektion
Krähenfüße und Glabellafalten
Die folgenden Nebenwirkungen wurden bei doppelblinden, placebokontrollierten klinischen Studien nach der Injektion von 44 Einheiten VISTABEL berichtet (gleichzeitige Behandlung von Krähenfüßen und Glabellafalten):
|
Organsystemklasse |
Bevorzugter Terminus |
Häufigkeit |
|
Allgemeine Erkrankungen und Beschwerden am V erabreichungsort |
Hämatom an der Injektionsstelle* |
Häufig |
|
Blutungen an der Injektionsstelle*, Schmerzen an der Injektionsstelle* |
Gelegentlich |
*Nebenwirkungen aufgrund der Injektion
Es wurde keine Veränderung des Gesamtsicherheitsprofils nach wiederholter Anwendung beobachtet.
c) Daten nach Markteinführung (Häufigkeiten nicht bekannt)
Die folgenden Nebenwirkungen oder medizinisch relevanten unerwünschten Ereignisse wurden seit der Markteinführung des Arzneimittels zur Behandlung von Glabellafalten, Krähenfüßen und anderen klinischen Indikationen berichtet:
|
Organsystemklasse |
Bevorzugter Terminus |
|
Erkrankungen des Immunsystems |
Anaphylaxie, Angioödeme, Serumkrankheit, Urtikaria |
|
Stoffwechsel- und Ernährungsstörungen |
Anorexie |
|
Erkrankungen des Nervensystems |
Brachial-Plexopathie, Dysphonie, Dysarthrie, Gesichtsparese, Hypoästhesie, Muskelschwäche, Myasthenia gravis, periphere Neuropathie, Parästhesie, Radikulopathie, Synkope, Gesichtslähmung |
|
Augenerkrankungen |
Engwinkelglaukom (wegen Behandlung von Blepharospasmus), Lagophthalmus, Strabismus, unscharfes Sehen, Sehstörungen |
|
Erkrankungen des Ohrs und des Labyrinths |
Hypoakusis, Tinnitus, Schwindel |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Aspirationspneumonie, Dyspnoe, Bronchospasmen, Atemdepression, respiratorische Insuffizienz |
|
Erkrankungen des Gastrointestinaltrakts |
Bauchschmerzen, Durchfall, trockener Mund, Dysphagie, Übelkeit, Erbrechen |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Alopezie, psoriasisartige Dermatitis, Erythema multiforme, Hyperhidrose, Madarosis, Juckreiz, Exanthem |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Muskelatrophie, Myalgie |
|
Allgemeine Erkrankungen und Beschwerden am V erabreichungsort |
Denervierung/Muskelatrophie, Unwohlsein, Fieber |
Nebenwirkungen, die möglicherweise mit der Ausbreitung des Toxins an vom Applikationsort entfernte Stellen in Zusammenhang stehen (z. B. Muskelschwäche, Dysphagie, Verstopfung und Aspirationspneumonie, die tödlich sein kann), wurden mit Botulinumtoxin sehr selten berichtet (s. Abschnitt 4.4).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Überdosierung von VISTABEL ist ein relativer Begriff und ist abhängig von Dosierung, Injektionsstelle sowie der zugrundeliegenden Gewebeeigenschaften. Fälle systemischer Intoxikation aufgrund versehentlicher Injektion von Botulinumtoxin Typ A wurden nicht beobachtet. Eine übermäßige Dosis kann lokale oder entfernt liegende, allgemeine und profunde neuromuskuläre Paralysen hervorrufen. Fälle von oraler Aufnahme von Botulinumtoxin Typ A wurden nicht berichtet.
Symptome einer Überdosierung treten nicht unmittelbar nach einer Injektion auf. Nach versehentlicher Injektion oder Ingestion muss der Patient mehrere Tage medizinisch auf Anzeichen und Symptome einer allgemeinen Muskelschwäche oder Muskellähmung überwacht werden.
Eine Einweisung in die Klinik sollte bei Patienten erwogen werden, bei denen Symptome einer Vergiftung mit Botulinumtoxin Typ A festgestellt werden (allgemeine Schwäche, Ptosis, Diplopie, Schluck- und Sprachstörungen oder Lähmung der Atemmuskulatur).
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Muskelrelaxanzien, peripher wirkende Mittel,
ATC-Code: M03A X01
Das Botulinumtoxin Typ A (Clostridium botulinum Neurotoxin) blockiert durch Spaltung von SNAP-25 die periphere Acetylcholin-Freisetzung an den präsynaptischen Nervenendigungen. SNAP-25 ist ein Protein, das wesentlich ist für die erfolgreiche Bindung und Freisetzung von Acetylcholin aus den Vesikeln, die sich in den Nervenendigungen befinden. Dies führt durch die Denervierung des Muskels zu dessen Lähmung.
Nach der Injektion erfolgt initial eine schnelle, hoch-affine Bindung des Toxins an spezifische zelluläre Oberflächenrezeptoren. Durch einen Rezeptor-vermittelten Endozytose-Prozess wird das Toxin durch die Plasmamembran transportiert und anschließend im Cytosol freigesetzt. Dieser Prozess wird von einer progressiven Inhibition der Acetylcholin-Freisetzung begleitet. Klinische Befunde manifestieren sich innerhalb von 2-3 Tagen. Die maximale Wirkung ist 5-6 Wochen nach der Injektion zu beobachten.
Die Wiederherstellung der Impulsübertragung nach intramuskulärer Injektion erfolgt innerhalb von 12 Wochen nach Injektion durch neu gebildete Nervenendigungen und deren Wiederverbindung mit den motorischen Endplatten.
Klinische Daten:
Glabellafalten
In die klinischen Studien wurden 537 Patienten mit mittelstarken bis starken Glabellafalten sichtbar bei maximalem Stirnrunzeln eingeschlossen.
Injektionen mit VISTABEL reduzierten signifikant die Ausprägung der Glabellafalten sichtbar bei maximalem Stirnrunzeln für bis zu 4 Monate. Dabei wurde vom Prüfarzt die Ausprägung der Glabellafalten bei maximalem Stirnrunzeln bewertet und die allgemeine Bewertung des Patienten über die Veränderung des Aussehens der Glabellafalten sichtbar bei maximalem Stirnrunzeln berücksichtigt. Keiner der klinischen Endpunkte beinhaltete eine objektive Bewertung der psychologischen Folgen. Dreißig Tage nach der Injektion hatten nach Auffassung der Prüfärzte 80 % (325 von 405) der mit VISTABEL behandelten Patienten auf die Behandlung reagiert (keine oder nur leichte Faltenbildung bei maximalem Stirnrunzeln), dagegen nur 3 % (4 von 132) der mit Placebo behandelten Patienten. Zum gleichen Zeitpunkt waren 89 % (362 von 405) der mit VISTABEL behandelten Patienten der Auffassung, dass sich mindestens eine mittlere Besserung eingestellt hätte, dagegen nur 7 % (9 von 132) der mit Placebo behandelten Patienten.
Injektionen mit VISTABEL reduzierten außerdem signifikant die Glabellafalten im Ruhezustand. Von den 537 eingeschlossenen Patienten hatten 39 % (210 von 537) mittelstarke bis starke Glabellafalten im Ruhezustand (15 % hatten im Ruhezustand keine Glabellafalten). Von diesen reagierten 74 % (119 von 161) der mit VISTABEL behandelten Patienten innerhalb von 30 Tagen nach der Injektion auf die Behandlung (keine oder nur leichte Glabellafalten), dagegen nur 20 % (10 von 49) der mit Placebo behandelten Patienten.
Es liegen nur begrenzte klinische Daten der Phase 3 von VISTABEL bei Patienten vor, die über 65 Jahre alt sind. Nur 6,0 % (32 von 537) der Patienten waren über 65 Jahre alt, bei dieser Altersgruppe war die Wirksamkeit geringer.
Krähenfüße
Es wurden 1362 Patienten mit moderaten bis starken Krähenfüßen sichtbar bei maximalem Lächeln (n=445, Studie 191622-098) entweder allein oder auch mit moderaten bis starken Glabellafalten sichtbar bei maximalem Stirnrunzeln (n=917, Studie 191622-099) eingeschlossen.
Injektionen mit VISTABEL reduzierten zu allen Zeitpunkten (p<0,001) für eine Dauer von bis zu 5 Monaten die Ausprägung der Krähenfüße sichtbar bei maximalem Lächeln im Vergleich zum Placebo signifikant. Dies wurde durch den Anteil an Patienten gemessen, die eine Bewertung der Krähenfüße von „KeinG" oder „Leicht“ bei maximalem Lächeln in beiden konfirmatorischen Studien erreichten, und zwar bis Tag 150 (Studienende) in Studie 191622-098 und bis Tag 120 (Ende des ersten Behandlungszyklus) in Studie 191622-099. Sowohl bei den Bewertungen durch den Prüfarzt als auch durch die Patienten war der Anteil der Patienten, die die Ausprägung der Krähenfüße ,„Keine“ oder „Leicht“ sichtbar bei maximalem Lächeln erreichten, größer bei Patienten mit moderaten Krähenfüßen sichtbar bei maximalem Lächeln im Vergleich zu Patienten mit starken Krähenfüßen sichtbar bei maximalem Lächeln ausgehend vom jeweiligen Ausgangswert (Baseline). Tabelle 1 fasst die Ergebnisse von Tag 30 zusammen, dem Zeitpunkt des primären Wirksamkeitsendpunkts.
In Studie 191622-104 (Verlängerung von Studie 191622-099) wurden 101 Patienten eingeschlossen, die zuvor in die Placebo-Gruppe randomisiert worden waren, und erhielten ihre erste Behandlung mit einer Dosis von 44 Einheiten. Mit VISTABEL behandelte Patienten zeigten einen statistisch signifikanten Nutzen hinsichtlich des primären Wirksamkeitsendpunkts im Vergleich zu Placebo an Tag 30 nach ihrer ersten Verum-Behandlung. Die Ansprechrate ähnelte der Gruppe mit 44 Einheiten an Tag 30 nach der ersten Behandlung in Studie 191622-099. Insgesamt 123 Patienten erhielten 4 Zyklen zu 44 Einheiten VISTABEL für eine kombinierte Behandlung von Krähenfüßen und Glabellafalten.
Tabelle 1. Tag 30: Bewertung durch Prüfarzt und Patienten von Krähenfüßen bei maximalem Lächeln - Ansprechraten (% der Patienten, die eine Bewertung der Ausprägung von Krähenfüßen von „Keine“ oder „Leicht“ erreichten)
|
Klinische Studie |
Dosis |
VISTABEL |
Placebo |
VISTABEL |
Placebo |
|
Bewertung des Prüfarztes |
Bewertung des Patienten | ||||
|
191622-098 |
24 Einheiten (Krähenfüße) |
66,7 %* (148/222) |
6,7 % (15/223) |
58,1 %* (129/222) |
5,4 % (12/223) |
|
191622-099 |
24 Einheiten (Krähenfüße) |
54,9 %* (168/306) |
3,3 % (10/306) |
45,8 %* (140/306) |
3,3 % (10/306) |
|
44 Einheiten (24 Einheiten Krähenfüße; 20 Einheiten Glabellafalten) |
59,0 %* (180/305) |
3,3 % (10/306) |
48,5 %* (148/305) |
3,3 % (10/306) | |
*p<0,001 (VISTABEL vs. Placebo)
In der Patientenbewertung wurden Verbesserungen zum Ausgangswert (Baseline) hinsichtlich dem Aussehen von Krähenfüßen bei maximalem Lächeln bei VISTABEL (24 Einheiten und 44 Einheiten) im Vergleich zu Placebo an Tag 30 und zu allen Zeitpunkten nach jedem Behandlungszyklus in beiden konfirmatorischen Studien (p<0,001) beobachtet.
Die Behandlung mit 24 Einheiten VISTABEL hat auch im Ruhezustand die Ausprägung der Krähenfüße signifikant reduziert. Von den 528 behandelten Patienten zeigten 63 % (330/528) beim Ausgangswert (Baseline) im Ruhezustand moderate bis starke Krähenfüße. Von ihnen wurden 58 % (192/330) der mit VISTABEL behandelten Patienten 30 Tage nach der Injektion als Responder (keine oder leichte Ausprägung) im Vergleich zu 11 % (39/352) der mit Placebo behandelten Patienten angesehen.
Bei der Selbstbewertung der Patienten ergaben sich für VISTABEL (24 Einheiten und 44 Einheiten) im Vergleich zu Placebo auch Verbesserungen hinsichtlich Alters und Attraktivität unter Verwendung des Fragebogens Facial Line Outcomes (FLO-11) zum primären Zeitpunkt an Tag 30 (p<0,001) und zu allen darauffolgenden Zeitpunkten in beiden konfirmatorischen Studien.
In den konfirmatorischen Studien waren 3,9 % (53/1362) der Patienten älter als 65 Jahre. 36 % (an Tag 30) der Patienten in dieser Altersgruppe zeigten laut Bewertung durch den Prüfarzt ein Ansprechen auf die Behandlung von VISTABEL (24 Einheiten und 44 Einheiten). Bei einer Analyse nach Altersgruppen <50 Jahre und >50 Jahre zeigten beide Altersgruppen statistisch signifikante Verbesserungen im Vergleich zu Placebo. Das Ansprechen auf die Behandlung mit 24 Einheiten
VISTABEL war nach Bewertung durch den Prüfarzt in der Gruppe der Patienten >50 Jahre geringer als bei denen <50 Jahre (42,0 % bzw. 71,2 %).
Insgesamt war das Ansprechen auf die Behandlung mit VISTABEL bei Krähenfüßen sichtbar bei maximalem Lächeln geringer (60 %) als bei Glabellafalten sichtbar bei maximalem Stirnrunzeln (80 %).
Bei 916 der mit VISTABEL behandelten Patienten (517 Patienten mit 24 Einheiten und 399 Patienten mit 44 Einheiten) wurden Proben auf die Bildung von Antikörpern hin analysiert. Kein Patient entwickelte neutralisierende Antikörper.
5.2 Pharmakokinetische Eigenschaften
a) Allgemeine Eigenschaften des wirksamen Bestandteils:
In Untersuchungen an Ratten zur Verteilung des Toxins konnte nach Injektion für 125I-markiertes Botulinumtoxin Typ A eine langsame Diffusion in den M. gastrocnemius gezeigt werden, gefolgt von einer schnellen systemischen Metabolisierung und Ausscheidung im Harn. Die Halbwertzeit des markierten Materials betrug etwa 10 Stunden. An der Injektionsstelle wurde Radioaktivität an große Protein-Moleküle gebunden. Im Plasma erfolgte die Bindung an kleine Moleküle, was auf einen schnellen systemischen Metabolismus schließen lässt. Innerhalb von 24 Stunden nach Applikation wurden 60% der Radioaktivität über den Urin ausgeschieden. Das Toxin wird vermutlich von Proteasen metabolisiert und die Molekülkomponenten werden auf dem normalen Stoffwechselweg wiederverwertet.
Klassische Studien zur Resorption, Verteilung, Biotransformation und Elimination (ADME) des Wirkstoffs wurden bisher aufgrund der Beschaffenheit des Wirkstoffes nicht durchgeführt.
b) Eigenschaften am Patienten:
Man geht davon aus, dass in therapeutischen Dosen eine geringe systemische Verteilung von VISTABEL eintritt. In klinischen Studien konnte mit Hilfe der Einzelfaser-EMG-Technik für Muskeln, die entfernt von der Injektionsstelle lagen, eine erhöhte elektrophysiologische neuromuskuläre Aktivität gezeigt werden. Gleichzeitige klinische Befunde oder Symptome wurden nicht beobachtet.
5.3 Präklinische Daten zur Sicherheit
In Reproduktionsstudien an Mäusen, Ratten und Kaninchen zeigte sich bei hohen Dosierungen Embryotoxizität (verzögerte Knochenbildung und geringeres fetales Körpergewicht). Teratogene Effekte wurden bei diesen Tierspezies nicht beobachtet. Bei Ratten traten unerwünschte Effekte auf die männliche Fertilität und auf den Zyklus sowie die Fertilität weiblicher Ratten nur bei hohen Dosen auf.
Studien zur akuten Toxizität, Toxizität bei wiederholter Gabe, lokalen Verträglichkeit, Mutagenität, Antigenität und Blutverträglichkeit zeigten bei klinisch relevanten Dosierungen keine ungewöhnlichen, unerwünschten lokalen oder systemischen Effekte.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Albumin vom Menschen Natriumchlorid
6.2 Inkompatibilitäten
Da keine Verträglichkeitsstudien zu möglichen Inkompatibilitäten durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit 3 Jahre
Nach der Rekonstitution sollte die Injektionslösung unverzüglich verwendet werden. Es wurde jedoch eine chemische und physikalische Stabilität nach Rekonstitution über 24 Stunden bei 2 °C bis 8 °C nachgewiesen.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (2 °C - 8 °C).
Lagerungsbedingungen des rekonstituierten Arzneimittels siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
Pulver in einer Durchstechflasche (Glas Typ I) mit einem Stopfen (Chlorobutylgummi) und Bördelkappe (Aluminium).
Durchstechflasche mit 50 Allergan-Einheiten Clostridium botulinum Toxin Typ A - Packung mit einer oder zwei Durchstechflaschen.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Die Rekonstitution sollte gemäß guten Praxis Regelungen erfolgen, insbesondere im Hinblick auf aseptisches Arbeiten. VISTABEL muss mit einer 0,9%-igen konservierungsmittelfreien Natriumchloridlösung zur Injektion rekonstituiert werden. Entsprechend der folgenden Verdünnungstabelle ist die benötigte Menge Natriumchloridlösung 9 mg/ml (0,9%) zur Injektion in eine Spritze aufzuziehen, um eine rekonstituierte Lösung mit einer Konzentration von 4 Einheiten pro 0,1 ml zu erhalten.
|
Menge Lösungsmittel (0,9%-ige Natriumchloridlösung), die einer Durchstechflasche mit 50 Einheiten zugegeben werden muss |
Erhaltene Dosis (Einheiten pro 0,1 ml Lösung) |
|
1,25 ml |
4,0 Einheiten |
Der Mittelteil der Gummikappe muss mit Alkohol gereinigt werden.
Um eine Denaturierung von VISTABEL zu verhindern, wird die Lösung durch langsame Injektion des Lösungsmittels in die Durchstechflasche hergestellt und anschließend die Durchstechflasche vorsichtig geschwenkt, dabei ist eine Blasenbildung zu vermeiden. Die Durchstechflasche ist zu verwerfen, wenn in der Flasche kein Unterdruck vorhanden ist, der das Lösungsmittel aus der Spritze ansaugt. Nach der Rekonstitution ist die Lösung vor Anwendung visuell zu prüfen. Es darf nur eine klare, farblose bis leicht gelbliche Lösung ohne Partikel verwendet werden.
VISTABEL darf nach der Rekonstitution nur für eine Behandlung pro Patient verwendet werden.
Vorgehensweise zur sicheren Entsorgung der Durchstechflaschen, Spritzen und verwendeten Materialien:
Unmittelbar nach der Anwendung und vor der Entsorgung muss die unbenutzte rekonstituierte VISTABEL-Lösung in der Durchstechflasche und/oder der Spritze inaktiviert werden. Hierzu 2 ml verdünnte Natriumhypochloritlösung (0,5- oder 1%-ig) zusetzen und entsprechend den lokalen Vorschriften vernichten.
Gebrauchte Durchstechflaschen, Spritzen oder Materialien dürfen nicht entleert werden, sondern müssen in entsprechenden Behältern entsorgt und entsprechend den lokalen Vorschriften als medizinischer Bioabfall vernichtet werden.
Empfehlungen bei Unfällen während des Umgangs mit Botulinumtoxin
Wenn beim Umgang mit dem Produkt im vakuumgetrockneten oder im rekonstituierten Zustand ein
Unfall auftritt, müssen sofort die im Folgenden beschriebenen Gegenmaßnahmen eingeleitet werden.
• Das Toxin ist sehr hitzeempfindlich sowie empfindlich gegen bestimmte chemische Stoffe.
• Verschüttetes Produkt sofort aufwischen. Wenn es sich um das vakuumgetrocknete Produkt handelt, mit saugfähigem Material das in Natriumhypochloritlösung (Javelwasser) getränkt wurde oder mit trockenem, saugfähigem Material, wenn es sich um das rekonstituierte Produkt handelt.
• Kontaminierte Oberflächen müssen mit einem saugfähigen Material gereinigt werden, das mit einer Natriumhypochloritlösung (Javelwasser) getränkt wurde. Anschließend trocknen lassen.
• Wenn eine Durchstechflasche zerbricht, die Glassplitter vorsichtig aufsammeln und das Produkt, wie oben beschrieben, aufwischen. Schnittverletzungen der Haut vermeiden.
• Beim Verspritzen die Spritzer mit Natriumhypochloritlösung abwaschen und anschließend gründlich mit sehr viel Wasser abspülen.
• Wenn Spritzer ins Auge gelangen, die Augen gründlich mit sehr viel Wasser und einer Augenwaschlösung ausspülen.
• Wenn sich der Anwender verletzt (Schnitt- oder Stichverletzungen), wie oben beschrieben vorgehen und die entsprechenden medizinischen Maßnahmen wie bei einer injizierten Dosis ergreifen.
Diese Hinweise zur Handhabung und Entsorgung müssen strikt eingehalten werden.
7. INHABER DER ZULASSUNG
Allergan Pharmaceuticals Ireland
Castlebar Road
Westport
County Mayo
Irland
8. ZULASSUNGSNUMMER
63575.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/ VERLÄNGERUNG DER
ZULASSUNG
Datum der Erteilung der Zulassung: 27.01.2006 Datum der Verlängerung der Zulassung: 20.02.2008
10. STAND DER INFORMATION
02/2015
11. Verkaufsabgrenzung
Verschreibungspflichtig
17