Vitaros Hexal 300 Mikrogramm/100 Mg Creme
FACHINFORMATION
1. BEZEICHNUNG DER ARZNEIMITTEL
Vitaros HEXAL 200 Mikrogramm/100 mg Creme Vitaros HEXAL 300 Mikrogramm/100 mg Creme
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Vitaros HEXAL 200 Mikrogramm/100 mg Creme
Jedes Einzeldosisbehältnis enthält 200 Mikrogramm Alprostadil in 100 mg Creme (2 mg/g). Vitaros HEXAL 300 Mikrogramm/100 mg Creme
Jedes Einzeldosisbehältnis enthält 300 Mikrogramm Alprostadil in 100 mg Creme (3 mg/g). Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Creme
Vitaros HEXAL ist eine weiße bis hell-beige Creme.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Behandlung von Männern > 18 Jahre mit erektiler Dysfunktion, der Unfähigkeit, eine für einen befriedigenden Geschlechtsverkehr ausreichende Erektion zu erreichen oder aufrechtzuerhalten.
4.2 Dosierung und Art der Anwendung
Vitaros HEXAL wird auf die Spitze des Penis aufgetragen.
Dosierung
Vitaros HEXAL ist in zwei Dosisstärken mit je 200 bzw. 300 Mikrogramm Alprostadil in 100 mg Creme erhältlich. Vitaros HEXAL sollte bei Bedarf angewendet werden, um eine Erektion zu erzielen. Jedes Einzeldosisbehältnis mit Vitaros HEXAL ist nur zur einmaligen Anwendung bestimmt und ist nach Gebrauch ordnungsgemäß zu entsorgen. Die Wirkung setzt innerhalb von 5 bis 30 Minuten nach der Anwendung ein. Die Wirkungsdauer beträgt etwa 1 bis 2 Stunden. Die tatsächliche Dauer kann jedoch von Patient zu Patient unterschiedlich sein. Jeder Patient sollte von einer medizinischen Fachkraft in die korrekte Art der Anwendung eingewiesen werden, bevor er Vitaros HEXAL selbst anwendet. Die maximale Anwendungsfrequenz beträgt nicht mehr als 2- bis 3-mal pro Woche und nur einmal innerhalb von 24 Stunden.
Die Anfangsdosis sollte von einem Arzt festgelegt werden. Eine Anfangsdosis mit der 300-Mikrogramm Dosis kann vor allem bei Patienten mit schwerer erektiler Dysfunktion, Begleiterkrankungen oder fehlendem Ansprechen auf PDE-5-Hemmer erwogen werden. Patienten, die die 300 Mikrogramm Dosis aufgrund lokaler Nebenwirkungen nicht tolerieren, können die niedrigere 200-Mikrogramm Dosis erhalten.
Die Patienten sollten genaue Anweisungen zur korrekten Art der Anwendung erhalten.
Art der Anwendung
Tragen Sie Vitaros HEXAL unter Beachtung der folgenden Anweisungen innerhalb von 5 bis 30 Minuten vor dem Geschlechtsverkehr auf die Spitze des Penis auf:
1. Waschen Sie sich vor dem Auftragen von Vitaros HEXAL die Hände.
Nehmen Sie das Einzeldosisbehältnis aus dem Beutel, nachdem Sie den Beutel von der Mitte der schmalen Seite entgegen der Versiegelung vollständig aufgerissen haben. Heben Sie den Beutel auf, um das gebrauchte Einzeldosisbehältnis später darin zu entsorgen. Entfernen Sie die Kappe von der Spitze des Einzeldosisbehältnisses. Siehe Abbildung 1.
2. Ergreifen Sie die Spitze des Penis mit einer Hand und erweitern Sie vorsichtig die Öffnung des Penis. Siehe Abbildung 2. (Achtung: Falls Sie nicht beschnitten sind, müssen Sie zuerst die Vorhaut zurückziehen und festhalten, bevor Sie die Öffnung des Penis erweitern.)
3. Halten Sie den Zylinder des Einzeldosisbehältnisses zwischen Ihren Fingern und platzieren Sie die Spitze des Einzeldosisbehältnisses über der Öffnung des Penis. Jetzt drücken Sie den Kolben vorsichtig mit Ihrem Daumen oder Zeigefinger nach unten, bis die gesamte Creme aus dem Zylinder des Einzeldosisbehältnisses in die Öffnung und auf die Haut in der Umgebung der Verabreichungsstelle herausgedrückt ist (Abbildung 3). Achtung: Führen Sie die Spitze des Einzeldosisbehältnis nicht in die Öffnung des Penis ein.
4. Halten Sie den Penis für ungefähr 30 Sekunden nach oben, damit die Creme eindringen kann. Wahrscheinlich wird etwas Creme nicht in die Öffnung des Penis hineingelangen. Die Menge der zusätzlichen Creme ist von Patient zu Patient unterschiedlich. Es ist nicht ungewöhnlich, wenn die Hälfte der Dosis am Ende der Öffnung zurückbleibt. Verwenden Sie kein zweites Einzeldosisbehältnis, um die Creme zu ersetzen, die nicht in die Öffnung eingedrungen ist. Überschüssige Creme auf der Öffnung des Penis kann mit der Fingerspitze vorsichtig in die Öffnung und in die Haut in der Umgebung der Verabreichungsstelle eingerieben werden.
5. Beachten Sie bitte, dass jedes Behältnis mit Vitaros HEXAL nur zur einmaligen Anwendung bestimmt ist. Setzen Sie die Kappe wieder auf das Einzeldosisbehältnis, legen Sie ihn in den geöffneten Beutel, falten Sie diesen zusammen und beseitigen Sie ihn entsprechend den örtlichen Anforderungen.
6. Vitaros HEXAL kann die Augen reizen. Waschen Sie sich nach der Anwendung von Vitaros HEXAL die Hände.
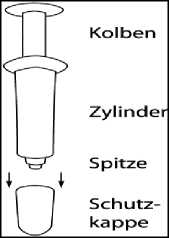
Abb. 1
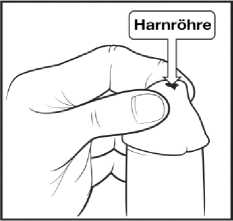
Abb. 2
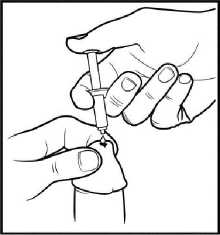
Abb. 3
4.3 Gegenanzeigen
Vitaros HEXAL darf nicht angewendet werden bei Patienten mit:
- Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
- zugrunde liegenden Erkrankungen wie orthostatische Hypotonie, Myokardinfarkt und Ohnmachtsanfällen.
- Krankheitsbildern, die für Priapismus prädisponieren können, wie Sichelzellanämie oder Sichelzellanlage, Thrombozythämie, Polyzythämie, multiples Myelom oder Leukämie.
- anormaler Penisanatomie wie schwere Hypospadie, bei Patienten mit einer anatomischen Peniskrümmung und bei Patienten mit einer Urethritis oder Balanitis (Entzündung/Infektion der Eichel des Penis).
- Neigung zu Venenthrombosen oder einem Hyperviskositätssyndrom wegen des erhöhten Risikos für Priapismus (4 oder mehr Stunden anhaltende starke Peniserektion).
- instabilem kardiovaskulärem oder zerebrovaskulärem Zustand, bei denen eine sexuelle Aktivität nicht ratsam ist.
- Vitaros HEXAL darf nicht angewendet werden bei Geschlechtsverkehr mit einer Frau im gebärfähigen Alter, außer bei Verwendung eines Kondoms.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Lokale Wirkungen
Bei der Anwendung von Vitaros HEXAL wurden, wenn auch selten, mehr als 4 Stunden anhaltende Erektionen (Priapismus) beobachtet (siehe Abschnitt 4.8).
Falls ein Priapismus auftritt, sollte der Patient umgehend ärztliche Hilfe in Anspruch nehmen. Wird der Priapismus nicht sofort behandelt, kann es zur Schädigung von Penisgewebe und zu permanentem Potenzverlust kommen.
Symptomatische Hypotonie (Schwindel) und Ohnmacht traten in den Phase-3-Studien nach Anwendung von Alprostadil bei einem geringen Prozentsatz der Patienten auf. Die Patienten sollten angewiesen werden, Aktivitäten, wie Autofahren oder gefährliche Tätigkeiten, bei denen es durch Hypotonie oder Ohnmacht zu Verletzungen kommen könnte, nach der Anwendung von Vitaros HEXAL zu vermeiden.
Vor Einleitung der Behandlung mit Vitaros HEXAL sollten behandelbare Ursachen der erektilen Dysfunktion durch geeignete diagnostische Maßnahmen ausgeschlossen werden.
Darüber hinaus sollten Patienten mit zugrunde liegenden Erkrankungen wie orthostatische Hypotonie, Myokardinfarkt und Ohnmachtsanfälle Vitaros HEXAL nicht anwenden (siehe Abschnitt 4.3).
Bei Patienten mit neurologischer Erkrankung oder Rückenmarkverletzung in der Anamnese wurden keine klinischen Studien durchgeführt.
Die Pharmakokinetik von Vitaros HEXAL bei Patienten mit Leber- und/oder Niereninsuffizienz wurde nicht ausdrücklich untersucht. Die Dosis muss bei diesen Populationen wegen des eingeschränkten Metabolismus möglicherweise verringert werden.
Allgemeine Vorsichtsmaßnahmen
Vitaros HEXAL sollte entsprechend den oben beschriebenen Anweisungen angewendet werden. Eine versehentliche intraurethrale Verabreichung kann zu Brennen oder Kribbeln und Schmerzen im Penis führen. Über eine wiederholte langfristige intraurethrale Exposition von Vitaros HEXAL ist nichts bekannt.
Die Patienten sollten informiert werden, dass Vitaros HEXAL keinen Schutz vor der Übertragung sexuell übertragbarer Krankheiten bietet. Patienten, die Vitaros HEXAL anwenden, und ihre Partnerinnen müssen in den Schutzmaßnahmen beraten werden, die erforderlich sind, um sich vor der Ausbreitung sexuell übertragbarer Krankheitserreger einschließlich des humanen Immundefizienz-Virus (HIV) zu schützen.
Die Ärzte sollten ihre Patienten dazu ermutigen, ihren Geschlechtspartner darüber zu informieren, dass sie Vitaros HEXAL anwenden. Bei den Partnerinnen der Anwender von Vitaros HEXAL kann es zu Nebenwirkungen kommen, am häufigsten zu einer Reizung der Vagina. Deshalb wird die Verwendung eines Kondoms empfohlen.
Die Wirkungen von Vitaros HEXAL auf die orale oder anale Schleimhaut wurden nicht untersucht. Bei Oralverkehr (Fellatio) oder Analverkehr sollte ein Kondom verwendet werden.
Vitaros HEXAL hat keine kontrazeptiven Eigenschaften. Paaren, die Vitaros HEXAL anwenden, wird eine angemessene Kontrazeption empfohlen, wenn die Partnerin im gebärfähigen Alter ist.
Es liegen keine Informationen zu den Wirkungen von Alprostadil in den Konzentrationen, die von der Partnerin aufgenommen werden, auf die frühe Schwangerschaft vor. Bei Geschlechtsverkehr mit Frauen im gebärfähigen Alter sowie schwangeren oder stillenden Frauen muss ein Kondom verwendet werden.
Es wurden nur Kondome aus Latexmaterial bei gemeinsamer Anwendung mit Vitaros HEXAL untersucht. Bei anderen Materialien kann das Risiko einer Beschädigung des Kondoms nicht ausgeschlossen werden.
Es wurden keine pharmakokinetischen oder pharmakodynamischen Studien zur Erfassung von Wechselwirkungen mit Vitaros HEXAL durchgeführt. Auf Basis der Art des Metabolismus (siehe Abschnitt 5.2) sind Wechselwirkungen mit anderen Arzneimitteln unwahrscheinlich.
Einfluss von Wechselwirkungen
Die Sicherheit und Wirksamkeit von Vitaros HEXAL in Kombination mit anderen Behandlungen der erektilen Dysfunktion, insbesondere mit Phosphodiesterase-5(PDE-5)-Hemmern wie Sildenafil, Tadalafil und Vardenafil, wurden nicht untersucht. Deshalb sollte Vitaros HEXAL nicht in Kombination mit PDE-5-Hemmern angewendet werden. Da sowohl Vitaros HEXAL als auch PDE-5-Hemmer kardiovaskuläre Wirkungen haben, kann ein additives erhöhtes kardiovaskuläres Risiko nicht ausgeschlossen werden.
Wechselwirkungsstudien mit Vitaros HEXAL in Kombination mit Penisimplantaten oder Relaxanzien der glatten Muskulatur wie Papaverin sowie mit Arzneimitteln zur Auslösung von Erektionen wie Alpha Rezeptorenblocker (z. B. intrakavernöses Phentolamin, Thymoxamin) wurden nicht durchgeführt. Bei kombinierter Anwendung besteht das Risiko für Priapismus (schmerzhafte, verlängerte, abnormale Erektion).
Mit Vitaros HEXAL in Kombination mit Sympathomimetika, Dekongestiva und Appetitzüglern wurden ebenfalls keine Wechselwirkungsstudien durchgeführt. Bei kombinierter Anwendung kann die Wirkung von Alprostadil abgeschwächt sein.
Wechselwirkungsstudien mit Vitaros HEXAL in Kombination mit Antikoagulanzien und Thrombozytenaggregationshemmern wurden nicht durchgeführt, aber bei kombinierter Anwendung kann das Risiko für urethrale Blutungen und Hämaturie erhöht sein.
Bei Patienten, die gleichzeitig mit Antihypertonika und vasoaktiven Arzneimitteln behandelt werden, kann, insbesondere bei älteren Patienten, das Hypotonierisiko erhöht sein.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen keine Daten über die Anwendung von Vitaros HEXAL bei Schwangeren vor. Die indirekte Exposition gegenüber Alprostadil ist bei Frauen wahrscheinlich gering.
Tierexperimentelle Studien mit höheren Dosen von Alprostadil haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3).
Schwangere dürfen Vitaros HEXAL nicht ausgesetzt werden.
Stillzeit
Es ist nicht bekannt, ob indirekte Exposition gegenüber Alprostadil durch Vitaros HEXAL zu signifikanter Ausscheidung in die Muttermilch führt. Die Anwendung von Vitaros HEXAL während der Stillzeit wird nicht empfohlen.
Fertilität
Nach wiederholter Anwendung von Alprostadil bei männlichen Kaninchen wurde eine Atrophie der Hodenkanälchen beobachtet. Es ist nicht bekannt, ob Vitaros HEXAL eine Wirkung auf die Fertilität beim Mann ausübt.
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Da in klinischen Studien mit Vitaros HEXAL in seltenen Fällen über Schwindel und Ohnmacht berichtet wurde, sollten die Patienten während der ersten 1 bis 2 Stunden nach Anwendung von Vitaros HEXAL Aktivitäten wie Autofahren oder gefährliche Tätigkeiten, bei denen es durch Ohnmacht zu Verletzungen kommen könnte, vermeiden.
4.8 Nebenwirkungen
Die häufigsten arzneimittelbedingten unerwünschten Nebenwirkungen, über die Patienten während der klinischen Studien berichteten, waren vorübergehende lokale urogenitale Reaktionen an oder nahe der Verabreichungsstelle, einschließlich Brennen, Schmerz, Jucken, Kribbeln und PenisErythem nach der Verabreichung, welche von leichter bis mäßig schwerer Intensität und vorübergehend waren (Dauer 1 bis 2 Stunden). Diese lokalen unerwünschten Ereignisse wurden von den meisten Patienten gut toleriert und waren zwischen den verschiedenen Alprostadil-Dosen vergleichbar.
Gelegentliche, jedoch potentiell schwerwiegende Nebenwirkungen in klinischen Phase-3-Studien umfassten Schwindelgefühl, Bewusstlosigkeit (Synkope) und Hypotonie (2/459 (0,4 %), 6/1591 (0,4 %) und 6/1280 (0,5 %) unter den Dosierungen 100, 200 und 300 ^g Alprostadil). Priapismus war zwar selten, wurde jedoch bei 1 Patienten (0,06 %) in den zwei 3-monatigen Studien beobachtet und bei 5 Patienten (0,4 %) in der > 6-monatigen Studie, davon 4 (0,3 %) in der 200 (ig und 1 (0,1 %) in der 300 ^g Alprostail-Gruppe.
Die häufigsten arzneimittelbedingten unerwünschten Ereignisse, über die von Partnerinnen während der placebokontrollierten, doppelblinden klinischen Studien mit multipler Anwendung (3 Monate und > 6 Monate) berichtet wurde, waren leichtes bis mäßig starkes vorübergehendes vaginales Brennen oder Jucken, das sich innerhalb von 1 bis 2 Stunden nach Einsetzen wieder zurückbildete. Es ist unbekannt, ob diese unerwünschten Ereignisse im Zusammenhang mit Vitaros HEXAL oder mit der Wiederaufnahme des Geschlechtsverkehrs verbunden gewesen waren, welcher öfter stattfand bei Partnern unter aktiver Medikation.
Tabellarische Auflistung der Nebenwirkungen
Die während der Anwendung von Vitaros HEXAL am häufigsten berichteten Nebenwirkungen sind in Tabelle 1 aufgelistet.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: sehr häufig (> 1/10), häufig (> 1/100, < 1/10), gelegentlich (> 1/1.000, < 1/100), selten (> 1/10.000, < 1/1.000), sehr selten (< 1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Priapismus (eine länger als 4 Stunden anhaltende Erektion) ist ein schwerwiegender Zustand, der umgehend von einem Arzt behandelt werden muss.
Tabelle 1: Nebenwirkungen
|
Systemorganklasse (MedDRA) |
Häufigkeit |
Nebenwirkung |
|
Erkrankungen des Nervensystems |
Gelegentlich |
Hyperästhesie |
|
Gefäßerkrankungen* |
Gelegentlich |
Schwindel Ohnmacht Hypotonie |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Häufig |
Ausschlag |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Gelegentlich |
Schmerzen in den Extremitäten |
|
Erkrankungen der Nieren und |
Häufig |
Schmerzen in der Harnröhre |
|
Harnwege |
Gelegentlich |
Harnröhrenstenose Harnwegsentzündung |
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Häufig |
Brennen im Penis Penisschmerzen Peniserythem Schmerzen im Genitalbereich Beschwerden im Genitalbereich Erythem im Genitalbereich Verstärkte Erektion Pruritus im Genitalbereich Penisödem Balanitis Kribbeln im Penis Pochen im Penis Taubheit des Penis |
|
Bei Partnerinnen: Brennendes Gefühl im Vulvovaginalbereich Vaginitis | ||
|
Gelegentlich |
Juckender Penis Ausschlag im Genitalbereich Skrotalschmerz Völlegefühl im Genitalbereich Übermäßige Steifheit Mangelnde Empfindsamkeit des Penis Anhaltende Erektion/Priapismus | |
|
Bei Partnerinnen: Vulvovaginaler Pruritus | ||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Gelegentlich |
Schmerzen am Verabreichungsort |
Spezielle Populationen
*Es gibt keine eindeutigen Hinweise, dass Alprostadil abgesehen von seinen gefäßerweiternden Wirkungen das Risiko kardiovaskulärer Ereignisse erhöht. Es kann aber nicht ausgeschlossen werden, dass bei Patienten mit zugrunde liegenden Erkrankungen/Risikofaktoren in Verbindung mit erhöhter sexueller/körperlicher Aktivität, die mit der Anwendung von Alprostadil in Zusammenhang steht, ein erhöhtes Risiko besteht (siehe Abschnitte 4.3 und 4.4).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels.
Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Über eine behandlungsbedürftige Überdosierung von Vitaros HEXAL wurde nicht berichtet. Eine Überdosierung von Vitaros HEXAL führt möglicherweise zu Hypotonie, Ohnmacht, Schwindel, Penisschmerz und Priapismus, der eine permanente Verschlimmerung der erektilen Dysfunktion zur Folge haben kann. Patienten mit Verdacht auf Überdosierung, die derartige Symptome entwickeln, sollten ärztlich überwacht werden, bis die systemischen oder lokalen Symptome abgeklungen sind.
Sollte eine 4 oder mehr Stunden anhaltende Erektion auftreten, muss der Patient angewiesen werden, ärztliche Hilfe in Anspruch zu nehmen. Folgende Maßnahmen können ergriffen werden:
- Der Patient sollte auf dem Rücken oder auf der Seite liegen. Legen Sie für 2 Minuten einen Eisbeutel abwechselnd auf die beiden oberen inneren Oberschenkel (dies kann einen Reflex zur Öffnung der Venenklappen auslösen). Falls der Patient darauf nach 10 Minuten nicht anspricht, ist diese Maßnahme abzubrechen.
- Falls diese Maßnahme unwirksam ist und die starke Erektion seit mehr als 6 Stunden anhält, sollte eine Penisaspiration durchgeführt werden. Unter aseptischen Bedingungen wird eine Butterflynadel (19-21 Gauge) in den Schwellkörper eingeführt und 20 bis 50 ml Blut abgesaugt. Das kann zu einer Abschwellung des Penis führen. Falls erforderlich, kann diese Maßnahme auf der anderen Penisseite wiederholt werden.
- Wenn diese Maßnahme auch nicht erfolgreich ist, wird die Injektion eines alpha-adrenergen Arzneimittels in den Schwellkörper empfohlen. Obwohl die übliche Kontraindikation bei intrapeniler Verabreichung eines Vasokonstriktors auf die Behandlung des Priapismus nicht zutrifft, ist bei Anwendung dieser Option Vorsicht geboten. Während der Maßnahme sind Blutdruck und Puls kontinuierlich zu überwachen. Besondere Vorsicht ist bei Patienten mit koronarer Herzkrankheit, unkontrollierter Hypertonie, zerebraler Ischämie und bei Patienten geboten, die mit Monoaminoxidasehemmern behandelt werden. In letzterem Fall sollte eine Notfallausrüstung zur Beherrschung einer hypertensiven Krise vorhanden sein.
- Für die Injektion sollten eine Phenylephrin-Lösung mit 200 Mikrogramm/ml vorbereitet und 0,5 bis 1 ml dieser Lösung alle 5 bis 10 Minuten injiziert werden. Alternativ kann eine Adrenalin-Lösung mit 20 Mikrogramm/ml verwendet werden. Falls erforderlich, kann anschließend eine weitere Aspiration von Blut über dieselbe Butterflynadel erfolgen. Die maximale Dosis von Phenylephrin beträgt 1 mg bzw. von Adrenalin 100 Mikrogramm (5 ml der Lösung).
Alternativ kann Metaraminol verwendet werden, wobei zu bedenken ist, dass dabei über tödliche hypertensive Krisen berichtet wurde. Wenn das noch immer nicht zu einer Lösung des Priapismus führt, sollte der Patient umgehend einer chirurgischen Behandlung unterzogen werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe:
Urologika, Mittel bei erektiler Dysfunktion ATC Code: G04BE01
Wirkmechanismus
Alprostadil ist chemisch identisch mit Prostaglandin E1, dessen Wirkungen eine Vasodilatation der Blutgefäße im erektilen Gewebe des Corpus cavernosum und einen Anstieg des arteriellen Blutflusses umfassen, wodurch eine Steifheit des Penis hervorgerufen wird.
Nach Anwendung von Vitaros HEXAL kommt es innerhalb von 5 bis 30 Minuten zur Erektion. Alprostadil hat bei Männern eine kurze Halbwertszeit. Die Verbesserung der Erektion kann nach der Anwendung für 1 bis 2 Stunden anhalten.
Klinische Wirksamkeit und Sicherheit
Die Wirksamkeit von Vitaros HEXAL wurde in zwei 12-wöchigen pivotalen Phase-3-Studien (100, 200 und 300 pg) bei Männern (n = 1651) mit erektiler Dysfunktion untersucht. In Bezug auf die mittlere Veränderung der ko-primären Endpunkte, d. h. der Domäne in Bezug auf die erektile Dysfunktion des IIEF-Scores (IIEF-EF), den mittleren prozentualen Erfolg bei der vaginalen Penetration (SEP-3) und den mittleren prozentualen Ejakulations-Erfolg (SEP-4), wurden statistisch signifikante (p < 0,001) Veränderungen im Vergleich zu Placebo beobachtet. Die mittlere Veränderung des IIEF-EF-Scores betrug für die Dosisstufen 100, 200 und 300 pg jeweils 1,6; 2,5 bzw. 2,4. Ebenso wurden Verbesserungen in Bezug auf die ko-primären Endpunkte des verbesserten Erfolgs bei der vaginalen Penetration (100 pg [2,9 %], 200 pg [5,1 %], 300 pg [7,2 %]) und beim Ejakulations-Erfolg (100 pg [7,0 %], 200 pg [13,8 %], 300 pg [9,1 %]) beobachtet. Ähnliche Ergebnisse wurden in den Subpopulationen der Männer, die zuvor mit Phosphodiesterase-V-Hemmern (PDE-5I) behandelt wurden oder der Männer mit Diabetes, kardiologischen Anomalien, Zustand nach Prostatektomie oder Hypertonie, beobachtet. Vergleichbare Ergebnisse wurden bei Männern im Alter von < 65 und > 65 Jahren beobachtet. Eine Post-hoc-Analyse zur Ansprechrate ergab, dass der prozentuale Anteil von Männern, die eine statistisch signifikante (p < 0,001) Verbesserung des IIEF-EF-Scores (> 4) berichteten, in den Dosisstufen 100, 200 und 300 pg 35 %, 39 % bzw. 38 %, im Vergleich zu 21 % unter Placebo betrug. In einer offenen klinischen Studie mit längerer Studiendauer führte die 300 pg-Dosis zu einer anhaltenden Verbesserung mit einer durchschnittlichen Veränderung des IIEF-EF-Scores von 6,67 im Vergleich zum Ausgangswert.
5.2 Pharmakokinetische Eigenschaften
Resorption
Die absolute Bioverfügbarkeit nach topischer Applikation wurde nicht ermittelt. In einer pharmakokinetischen Studie wurden Patienten mit erektiler Dysfunktion mit 100 mg Vitaros HEXAL-Creme in Dosen von 100, 200 und 300 Mikrogramm Alprostadil behandelt. Die Plasmakonzentrationen von PGE1 und seinem Metaboliten PGE0 waren bei den meisten Probanden zu den meisten Zeitpunkten der Blutentnahme nach der Anwendung niedrig oder nicht nachweisbar und die pharmakokinetischen Parameter konnten nicht beziffert werden. Die Cmax- und AUC-Werte von 15-Keto-PGE0 waren niedrig und zeigten einen geringeren als den dosisproportionalen Anstieg über den Dosisbereich von 100 300 Mikrogramm. Die maximalen Plasmakonzentrationen von 15-Keto-PGE0 wurden innerhalb von 1 Stunde nach der Anwendung erreicht.
Tabelle 2: Mittlere (SD) pharmakokinetische Parameter von 15 Keto-PGE0
|
Parameter |
Placebo (n=5) |
Vitaros HEXAL 100 Mikrogramm (n=5) |
Vitaros HEXAL 200 Mikrogramm (n=5) |
Vitaros HEXAL 300 Mikrogramm (n=5) |
|
AUCa (pg x h/ml) |
388 (256) |
439 (107) |
504 (247) |
960 (544) |
|
Cmax (pg/ml) |
23 (19) |
202 (229) |
120 (103) |
332 (224) |
|
tmax (h) |
6 (8) |
0,6 (0,4) |
1 (0,7) |
0,7 (0,3) |
|
t1/2 (h) |
4 (--)b |
5 (3) |
3 (1)c |
6 (6) |
|
a AUC ist die Fläche unter der Plasmakonzentrationskurve von Zeitpunkt 0 bis Stunde 24. b Nur von 1 Probanden waren Daten zur Schätzung der Halbwertszeit verfügbar. c Nur 3 Probanden hatten ausreichende Daten zur Schätzung der Halbwertszeit. SD = Standardabweichung | ||||
Verteilung
Nach dem Auftragen der Creme auf Meatus und Glans penis wird Alprostadil über Kollateralgefäße rasch vom Corpus spongiosum und Corpus cavernosum aufgenommen. Der Rest dringt über Venen des Corpus spongiosum in den venösen Beckenkreislauf.
Biotransformation
Nach topischer Applikation wird PGE1 lokal rasch durch enzymatische Oxidation der 15-Hydroxylgruppe zu 15-Keto-PGEj metabolisiert. 15-Keto-PGEj besitzt nur 1-2 % der biologischen Aktivität von PGE1 und wird rasch zu dem häufigsten inaktiven Metaboliten 13,14-Dihydro-15-Keto-PGE abgebaut, der primär über die Nieren und die Leber eliminiert wird.
Elimination
Nach intravenöser Applikation von Tritium-markiertem Alprostadil beim Mann verschwindet die markierte Substanz bereits in den ersten 10 Minuten aus dem Blut und nach 1 Stunde wird nur ein geringer Prozentsatz der Radioaktivität im Blut wiedergefunden. Die Metaboliten von Alprostadil werden primär über die Nieren ausgeschieden, wobei etwa 90 % der intravenös verabreichten Dosis innerhalb von 24 Stunden nach der Gabe mit dem Urin eliminiert werden. Der Rest wird mit den Fäzes ausgeschieden. Es gibt keine Hinweise auf eine Geweberetention von Alprostadil oder seinen Metaboliten nach intravenöser Gabe.
Pharmakokinetik bei speziellen Populationen
Patienten mit Lungenkrankheiten
Bei Patienten mit Lungenkrankheiten kann die Fähigkeit zur Ausscheidung des Arzneimittels reduziert sein. Bei Patienten mit Schocklunge (Adult Respiratory Distress Syndrome; ARDS) war die pulmonale Extraktion von venös verabreichtem PGE1 im Vergleich zu einer Kontrollgruppe mit normaler Lungenfunktion um etwa 15 % vermindert.
Geschlecht
Der Einfluss des Geschlechts auf die Pharmakokinetik von Vitaros HEXAL wurde nicht untersucht. Pharmakokinetische Studien an Partnerinnen wurden nicht durchgeführt.
Ältere Patienten sowie Kinder und Jugendliche
Der Einfluss des Alters auf die Pharmakokinetik von topisch verabreichtem Alprostadil wurde nicht untersucht. Vitaros HEXAL ist nicht für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren indiziert.
5.3 Präklinische Daten zur Sicherheit
Alprostadil, Dodecyl(N,N-dimethyl-DL-alaninat)-hydrochlorid (DDAIP) und Vitaros HEXAL (mitsamt DDAIP) haben kein genotoxisches Potenzial gezeigt.
Studien zum kanzerogenen Potenzial von Alprostadil oder Vitaros HEXAL wurden nicht durchgeführt. Beurteilungen der Kanzerogenität des Hilfsstoffs DDAIP ergaben nach topischer Verabreichung an Mäuse und subkutaner Verabreichung an Ratten keine Tumorbildung. In dem transgenen Tg.AC-Mausmodell induzierte die Gabe von DDAIP in einer Konzentration von 1,0 % und 2,5 % bei weiblichen bzw. männlichen Tieren Papillome. Dieser Effekt ist wahrscheinlich für den Menschen nicht relevant, da er vermutlich durch Reizung hervorgerufen wurde.
Alprostadil hat keinen Einfluss auf die Anzahl oder Morphologie der Spermien. Der Hilfsstoff DDAIP verursachte jedoch bei lokaler Verabreichung an Kaninchen in einer Konzentration von 5 % eine Atrophie der Hodenkanälchen. Eine direkte spermatotoxische Wirkung von DDAIP konnte nicht getestet werden. Deshalb ist die Relevanz für eine möglicherweise verminderte männliche Fertilität beim Menschen nicht bekannt. Bei Ratten hatte subkutan verabreichtes DDAIP keinen Einfluss auf die Fertilität.
Alprostadil hat sich als embryotoxisch (vermindertes fetales Gewicht) erwiesen, wenn es trächtigen Ratten als subkutaner Bolus in niedrigen Dosen verabreicht wurde. Höhere Dosen führten zu vermehrten Resorptionen, verminderter Anzahl lebender Feten, erhöhter Inzidenz von viszeralen und skelettalen Veränderungen und Missbildungen sowie zu maternaler Toxizität. Die intravaginale Verabreichung von PGE1 an trächtige Kaninchen hatte keine schädlichen Auswirkungen auf den Feten.
Studien zur Reproduktionstoxizität von DDAIP wurden nach subkutaner Verabreichung an Ratten und Kaninchen durchgeführt. Bei Ratten wurden keine Auswirkungen beobachtet, aber bei Kaninchen wurde in hohen Dosen Fetotoxizität einschließlich vermehrter Missbildungen festgestellt, die wahrscheinlich Folge maternaler Toxizität war. Bei Ratten zeigte sich kein Einfluss auf die postnatale Entwicklung.
PHARMAZEUTISCHE ANGABEN
6.
6.1 Liste der sonstigen Bestandteile
Gereinigtes Wasser Ethanol
Ethyldodecanoat Guar (Ph.Eur.)
Dodecyl(N,N-dimethyl-DL-alaninat)-hydrochlorid Kaliumdihydrogenphosphat (zur pH-Wert-Einstellung) Natriumhydroxid (zur pH-Wert-Einstellung) Phosphorsäure 85 %(zur pH-Wert-Einstellung)
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Vitaros HEXAL 200 Mikrogramm/100 mg Creme 9 Monate
Vitaros HEXAL 300 Mikrogramm/100 mg Creme 18 Monate
Nach dem Öffnen sofort verwenden und nicht verbrauchte Reste entsorgen.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (2 °C-8 °C).
Nicht einfrieren.
Ungeöffnete Beutel können vom Patienten bis zu 3 Tage vor der Anwendung außerhalb des Kühlschranks bei einer Temperatur unter 25 °C gelagert werden. Falls das Arzneimittel bis zum Ablauf dieser Zeit nicht verwendet wurde, muss es entsorgt werden.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
6.5 Art und Inhalt des Behältnisses
Vitaros HEXAL wird in einzelnen Beuteln bereitgestellt, die je 1 Einzeldosisbehältnis enthalten.
Das Einzeldosisbehältnis ist ein Behältnis, das aus einem Kolben, einem Zylinder und einer Schutzkappe besteht. Jedes Einzeldosisbehältnis befindet sich in einem Schutzbeutel.
Jedes Einzeldosisbehältnis enthält 100 mg Creme und dient zum Auftragen der Creme.
Vitaros HEXAL ist in Packungen mit 4 Einzeldosisbehältnissen erhältlich. Die Beutel bestehen aus Aluminiumfolie/Laminat.
Die Bestandteile des Einzeldosisbehältnisses sind Polypropylen und Polyethylen.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Jedes Behältnis ist nur zur einmaligen Anwendung bestimmt.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNGEN
Ferring Arzneimittel GmbH Fabrikstraße 7 D-24103 Kiel Tel.: 0431 / 5852-0 Fax.: 0431 / 5852-74
8. ZULASSUNGSNUMMERN
91864.00. 00
91865.00. 00
9. DATUM DER ERTEILUNG DER ZULASSUNGEN
09. März 2016
10. STAND DER INFORMATION
September 2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Sollten Sie weitere Fragen haben, wenden Sie sich bitte an folgende E-Mail-Adresse: info-service@ferring.de
13/13