Voltaren Plus 50Mg/50Mg Filmtabletten
Fachinformation
Novartis Pharma
Voltaren® Plus 50 mg/50 mg Filmtabletten
1. Bezeichnung des Arzneimittels
Voltaren® Plus 50 mg/50 mg Filmtabletten
2. Qualitative und quantitative Zusammensetzung
Eine Tablette enthält 50 mg Diclofenac-Natrium und 50 mg Codeinphosphat-Hemihydrat.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Filmtablette
Voltaren Plus 50 mg/50 mg Filmtabletten sind hellrot, rund und schwach gewölbt. Auf einer Seite befindet sich eine tiefe Bruchkerbe und auf beiden Seiten ein Aufdruck.
4. Klinische Angaben
4.1 Anwendungsgebiete
Zur Kurzzeitbehandlung (max. 2 Wochen) von:
- Starken Schmerzen bei Reizzuständen degenerativer Gelenkerkrankungen wie Gonarthrosen.
- Starken und sehr starken Schmerzen nach chirurgischen Eingriffen.
- Tumorschmerzen, insbesondere bei Skelettbefall oder entzündlichem peritumoralen Ödem.
Hinweis
Die Anwendung von Voltaren Plus bei Reizzuständen degenerativer Gelenkerkrankungen (Gonarthrosen) wurde in einer kontrollierten Studie über 7 Tage geprüft. Erfahrungen zur Wirksamkeit in diesem Anwendungsgebiet über den genannten Zeitraum hinaus liegen nicht vor.
4.2 Dosierung, Art und Dauer der Anwendung
Voltaren Plus wird in Abhängigkeit von der Schwere der Erkrankung dosiert. Der empfohlene Dosisbereich für Erwachsene liegt bei 1-3 Filmtabletten pro Tag (entsprechend jeweils 50-150 mg Diclofenac-Natrium und Codeinphosphat pro Tag). Die einzelnen Gaben sollten mit einem Abstand von mindestens 6 Stunden erfolgen. Die Tagesmaximaldosis von 3 Filmtabletten Voltaren Plus, entsprechend jeweils 150 mg Diclofenac-Natrium und Codeinphosphat, sollte nicht überschritten werden.
Die Einnahme nach den Mahlzeiten kann zu einer verzögerten Aufnahme der Wirkstoffe in die Blutbahn führen.
Die Filmtabletten sind deshalb bevorzugt vor den Mahlzeiten unzerkaut mit reichlich Flüssigkeit einzunehmen.
Voltaren Plus ist zur Kurzzeitanwendung (max. 2 Wochen) vorgesehen. Über die Dauer der Anwendung entscheidet der behandelnde Arzt.
Nebenwirkungen können minimiert werden, indem die niedrigste wirksame Dosis über den kürzesten, zur Symptomkontrolle erforderlichen Zeitraum angewendet wird (siehe
Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung).
Voltaren Plus ist kontraindiziert bei Kindern und Jugendlichen (siehe Abschnitt 4.3).
4.3 Gegenanzeigen
Voltaren Plus darf nicht angewendet werden:
- bei einer Überempfindlichkeit gegen die Wirkstoffe oder einen der sonstigen Bestandteile,
- bei Patienten, bei denen Acetylsalicylsäure oder andere Medikamente mit prostaglandinsynthesehemmender Wirkung Asthmaanfälle, Hautreaktionen oder Rhinitis ausgelöst haben,
- bei Magen- oder Darmgeschwüren,
- bei Meläna oder Teerstuhl,
- bei ungeklärten Blutbildungs- und Blutgerinnungsstörungen,
- bei gastrointestinalen, zerebrovaskulären oder anderen aktiven Blutungen,
- bei gastrointestinalen Blutungen oder Perforation in der Anamnese im Zusammenhang mit einer vorherigen Therapie mit nicht steroidalen Antirheumatika (NSAR),
- bei bestehenden oder in der Vergangenheit wiederholt aufgetretenen peptischen Ulzera oder Hämorrhagien (mindestens 2 unterschiedliche Episoden nachgewiesener Ulzeration oder Blutung),
- bei Ateminsuffizienz,
- bei akutem Asthmaanfall,
- bei Pneumonie,
- bei schwerer Leber- und Nierenfunktionsstörung,
- bei Koma,
- während der Schwangerschaft sowie unter der Geburt,
- bekannter Herzinsuffizienz (NYHA II-IV), ischämischer Herzkrankheit, peripherer arterieller Verschlusskrankheit und/oder zerebrovaskulärer Erkrankung.
Kinder und Jugendliche dürfen Voltaren Plus nicht einnehmen, da keine ausreichenden Erfahrungen vorliegen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Siehe Abschnitt 4.3.
Nebenwirkungen können minimiert werden, indem die niedrigste wirksame Dosis über den kürzesten, zur Symptomkontrolle erforderlichen Zeitraum, angewendet wird (siehe Abschnitt 4.2 und gastrointestinale und kardiovaskuläre Risiken weiter unten).
Voltaren Plus sollte nur unter strenger Abwägung des Nutzen-Risiko-Verhältnisses angewendet werden:
- Dbei angeborener Störung des Porphyrinstoffwechsels (z. B. akute intermittierende Porphyrie),
- bei systemischem Lupus erythematodes (SLE) sowie Mischkollagenosen (mixed connective tissue disease),
- bei Abhängigkeit von Opioiden,
- bei Bewusstseinsstörungen,
- bei Störungen des Atemzentrums und der Atemfunktion,
- bei Zuständen mit erhöhtem Hirndruck,
- während der Stillzeit,
- nach einer Cholezystektomie,
- bei gleichzeitiger Anwendung von MAO-Hemmern, in höheren Dosen:
- bei Hypotension durch Hypovolämie.
Eine besonders sorgfältige ärztliche Überwachung ist erforderlich:
- bei eingeschränkter Nierenfunktion;
- bei Leberfunktionsstörungen;
- direkt nach größeren chirurgischen Eingriffen (Cave: erhöhte Blutungsneigung bzw. Verschlechterung der Nierenfunktion);
- bei Patienten, die auf andere Stoffe allergisch reagieren, da für sie bei der Anwendung von Voltaren ebenfalls ein erhöhtes Risiko für das Auftreten von Überempfindlichkeitsreaktionen besteht.
- bei älteren Patienten.
Gastrointestinale Sicherheit
Voltaren Plus enthält als Kombinationspartner eine schnellfreisetzende Formulierung von Diclofenac. Diese Darreichungsform kann eine erhöhte Magen-DarmUnverträglichkeit, insbesondere in Kombination mit Codein, aufweisen, eine besonders sorgfältige ärztliche Überwachung ist daher erforderlich. Die maximale Anwendungsdauer von 2 Wochen darf nicht überschritten werden.
Gastrointestinale Blutungen, Ulzera und Perforationen
Gastrointestinale Blutungen, Ulzera oder Perforationen, auch mit letalem Ausgang, wurden unter allen NSAR berichtet. Sie traten mit oder ohne vorherige Warnsymptome bzw. schwerwiegende gastrointestinale Ereignisse in der Anamnese zu jedem Zeitpunkt der Therapie auf.
Das Risiko gastrointestinaler Blutung, Ulzeration oder Perforation ist höher mit steigender NSAR-Dosis, bei Patienten mit Ulzera in der Anamnese, insbesondere mit den Komplikationen Blutung oder Perforation (siehe Abschnitt 4.3), und bei älteren Patienten. Diese Patienten sollten die Behandlung mit der niedrigsten verfügbaren Dosis beginnen. Für diese Patienten sowie für Patienten, die eine begleitende Therapie mit niedrig dosierter Acetylsalicylsäure (ASS) oder anderen Arzneimitteln, die das gastrointestinale Risiko erhöhen können, benötigen (siehe Abschnitt 4.5), sollte eine Kombinationstherapie mit protektiven Arzneimitteln (z. B. Misoprostol oder Protonenpumpen-Hemmer) in Betracht gezogen werden (siehe unten und Abschnitt 4.5).
Patienten mit einer Anamnese gastrointestinaler Toxizität, insbesondere in höherem Alter, sollten jegliche ungewöhnliche Symptome im Bauchraum (vor allem gastrointestinale Blutungen) insbesondere am Anfang der Therapie melden. Vorsicht ist angeraten, wenn die Patienten gleichzeitig Arzneimittel erhalten, die das Risiko für Ulzera oder Blutungen erhöhen können, wie z. B. orale Kortikosteroide, Antikoagulanzien wie Warfarin, selektive Serotonin-Wiederaufnahme-Hemmer oder Thrombozyten-Aggregationshemmer wie ASS (siehe Abschnitt 4.5).
Die Anwendung von Voltaren Plus in Kombination mit NSAR, einschließlich selektiver Cyclooxygenase-2-Hemmer, sollte vermieden werden.
Wenn es bei Patienten unter Voltaren Plus zu gastrointestinalen Blutungen oder Ulzera kommt, ist die Behandlung abzusetzen.
NSAR sollten bei Patienten mit einer gastrointestinalen Erkrankung in der Anamnese (Colitis ulcerosa, Morbus Crohn) nur mit Vorsicht angewendet werden, da sich ihr Zustand verschlechtern kann (siehe Abschnitt 4.8).
Ältere Patienten
Bei älteren Patienten kommt es unter NSAR-Therapie häufiger zu unerwünschten Wirkungen, vor allem zu gastrointestinalen Blutungen und Perforationen, auch mit letalem Ausgang (siehe Abschnitt 4.8).
Kardiovaskuläre und zerebrovaskuläre Wirkungen
Eine angemessene Überwachung und Beratung von Patienten mit Hypertonie und/oder leichter Herzinsuffizienz (NYHA I) in der Anamnese sind erforderlich, da Flüssigkeitseinlagerung und Ödeme in Verbindung mit NSAR-Therapie berichtet wurden.
Klinische Studien und epidemiologische Daten weisen übereinstimmend auf ein erhöhtes Risiko für arterielle thrombotische Ereignisse (beispielsweise Herzinfarkt oder Schlaganfall) hin, das mit der Anwendung von Diclofenac assoziiert ist, insbesondere bei einer hohen Dosis (150 mg täglich) und bei Langzeitanwendung (siehe Abschnitt 4.3 zu Gegenanzeigen).
Patienten mit signifikanten Risikofaktoren (z. B. Hypertonie, Hyperlipidämie, Diabetes mellitus, Rauchen) für kardiovaskuläre Ereignisse sollten nur nach sorgfältiger Abwägung mit Diclofenac behandelt werden. Da die kardiovaskulären Risiken von Diclofenac mit der Dosis und der Dauer der Anwendung steigen können, sollte die niedrigste wirksame tägliche Dosis über den kürzesten möglichen Zeitraum angewendet werden. Es sollte regelmäßig überprüft werden, ob der Patient noch einer Symptomlinderung bedarf und wie er auf die Therapie anspricht.
Hautreaktionen
Unter NSAR-Therapie wurde sehr selten über schwerwiegende Hautreaktionen, einige mit letalem Ausgang, einschließlich exfoliativer Dermatitis, Stevens-Johnson-Syndrom und toxischer epidermaler Nekrolyse (Lyell-Syndrom) berichtet (siehe Abschnitt 4.8).
Das höchste Risiko für derartige Reaktionen scheint zu Beginn der Therapie zu bestehen, da diese Reaktionen in der Mehrzahl der Fälle im ersten Behandlungsmonat auftraten. Beim ersten Anzeichen von Hautausschlägen, Schleimhautläsionen oder sonstigen Anzeichen einer Überempfindlichkeitsreaktion sollte Voltaren Plus abgesetzt werden.
Hepatische Wirkungen
Vorsicht ist vor Beginn einer Behandlung von Patienten mit Leberfunktionsstörungen geboten, da sich ihr Zustand unter der Therapie mit Diclofenac verschlechtern könnte. Sollte Voltaren Plus für einen längeren Zeitraum oder wiederholt eingenommen werden, ist als Vorsichtsmaßnahme eine regelmäßige Überwachung der Leberfunktion indiziert. Wenn klinisch Anzeichen für eine Lebererkrankung festgestellt werden, sollte Voltaren Plus sofort abgesetzt werden.
Wie andere NSAR kann Diclofenac vorübergehend die Thrombozytenaggregation hemmen. Patienten mit einer Gerinnungsstörung sollten sorgfältig überwacht werden.
Bei einer längerfristigen Behandlung mit Voltaren Plus sollten Blutbild und Nierenfunktion regelmäßig überwacht werden.
Patienten, die an Heuschnupfen, Nasenpolypen oder chronisch-obstruktiven Atemwegserkrankungen leiden, sowie Patienten mit Überempfindlichkeit gegen andere Schmerz- und Rheumamittel aus der Gruppe der NSAR dürfen Voltaren Plus nur unter bestimmten Vorsichtsmaßnahmen (Notfallbereitschaft!) und direkter ärztlicher Kontrolle anwenden, da für sie ein erhöhtes Risiko für das Auftreten allergischer Reaktionen besteht.
Diese können sich äußern als Asthmaanfälle (so genannte Analgetika-Intoleranz/Analgetika-Asthma), Quincke-Ödem oder Urtikaria. Besondere Vorsicht ist auch geboten bei Patienten, die auf andere Stoffe allergisch reagieren, da für sie bei der Anwendung von Voltaren Plus ein erhöhtes Risiko für das Auftreten von Überempfindlichkeitsreaktionen besteht.
Wie andere NSAR kann Diclofenac aufgrund seiner pharmakodynamischen Eigenschaften die Anzeichen und Symptome einer Infektion maskieren.
Wenn während der Anwendung von Voltaren Plus Zeichen einer Infektion neu auftreten oder sich verschlimmern, wird dem Patienten daher empfohlen, unverzüglich den Arzt aufzusuchen. Es ist zu prüfen, ob die Indikation für eine antiinfektiöse/antibiotische Therapie vorliegt.
Bei längerer Anwendung von Voltaren Plus besteht, wie bei allen codeinhaltigen Präparaten, die Möglichkeit der Abhängigkeitsbildung.
Codein hat ein Abhängigkeitspotenzial. Bei längerem und hoch dosiertem Gebrauch entwickeln sich Toleranz, psychische und physische Abhängigkeit. Es besteht Kreuztoleranz zu anderen Opioiden.
Bei vorbestehender Opiatabhängigkeit (auch solche in Remission) ist mit schnellen Rückfällen zu rechnen. Codein wird von Heroinabhängigen als Ersatzstoff betrachtet. Auch Abhängige von Alkohol und Sedativa neigen zu Missbrauch und Abhängigkeit von Codein.
Bei längerem hoch dosierten, nicht bestimmungsgemäßem Gebrauch von Schmerzmitteln können Kopfschmerzen auftreten, die nicht durch erhöhte Dosen des Arzneimittels behandelt werden dürfen.
Ganz allgemein kann die gewohnheitsmäßige Anwendung von Schmerzmitteln, insbesondere bei Kombination mehrerer schmerzstillender Wirkstoffe, zur dauerhaften Nierenschädigung mit dem Risiko eines Nierenversagens (Analgetika-Nephropathie) führen.
Aufgrund der wichtigen Funktion der Prostaglandine für die Aufrechterhaltung der Nierendurchblutung speziell bei Patienten mit eingeschränkter Herz- oder Nierenfunktion, bei Patienten, die Diuretika einnehmen, und bei Patienten direkt nach größeren chirurgischen Eingriffen soll Voltaren Plus in diesen Fällen besonders vorsichtig angewendet werden.
Die Behandlung von Patienten nach einer Cholezystektomie sollte mit Vorsicht erfolgen. Infolge der Kontraktion des Sphincter Oddi können herzinfarktähnliche Symptome sowie eine Symptomverstärkung bei bestehender Pankreatitis auftreten.
Wegen der genetischen Variabilität des CYP2D6 können selbst therapeutische Dosen von Codein zu einer verstärkten Bildung des aktiven Metaboliten Morphin mit den klinischen Zeichen einer Morphin-Vergiftung führen (siehe Abschnitt 4.9). Daher sollte zu Beginn der Behandlung die individuelle Reaktion des Patienten auf das Medikament kontrolliert werden, um eventuelle relative Überdosierungen schnell erkennen zu können. Dies gilt insbesondere für ältere Patienten, bei eingeschränkter Nierenfunktion und bei Atemfunktionsstörungen (Gefahr des Lungenödems).
Bei älteren Patienten ist aus grundsätzlichen medizinischen Erwägungen Vorsicht geboten.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Lithium/Digoxin/Phenytoin
Bei gleichzeitiger Anwendung kann Diclofenac den Blutspiegel von Lithium, Digoxin oder Phenytoin erhöhen. Eine Kontrolle der Serum-Lithium-Spiegel ist nötig. Eine Kontrolle der Serum-Digoxin- und der Serum-Phenytoin-Spiegel wird empfohlen.
Diuretika, ACE-Hemmer und Angiotensin-II-Antagonisten
NSAR können die Wirkung von Diuretika und Antihypertensiva abschwächen.
Bei Patienten mit eingeschränkter Nierenfunktion (z. B. exsikkierte Patienten oder ältere Patienten mit eingeschränkter Nierenfunktion) kann die gleichzeitige Einnahme eines ACE-Hemmers oder Angiotensin-II-Antagonisten mit einem Arzneimittel, das die Cyclooxigenase hemmt, zu einer weiteren Verschlechterung der Nierenfunktion, einschließlich eines möglichen akuten Nierenversagens, führen, was gewöhnlich reversibel ist. Daher sollte eine Kombination nur mit Vorsicht angewendet werden, vor allem bei älteren Patienten. Die Patienten müssen zu einer adäquaten Flüssigkeitseinnahme aufgefordert werden, und eine regelmäßige Kontrolle der Nierenwerte sollte nach Beginn einer Kombinationstherapie in Erwägung gezogen werden.
Arzneimittel, die bekanntermaßen Hyperkaliämie auslösen können Die gleichzeitige Gabe von Voltaren Plus und kaliumsparenden Diuretika, Ciclosporin, Tacrolimus oder Trimethoprim kann zu einer Hyperkaliämie führen. Daher ist eine besondere Kontrolle der Serum-Kalium-Werte nötig.
Probenecid
Arzneimittel, die Probenecid enthalten, können die Ausscheidung von Diclofenac verzögern. Dadurch kann es zu einer Kumulation von Diclofenac mit Verstärkung seiner unerwünschten Wirkungen kommen.
Potente CYP2C9-Inhibitoren
Vorsicht ist angezeigt bei der gleichzeitigen Verabreichung von Diclofenac und potenten CYP2C9-Inhibitoren (z. B. Voriconazol). Da der Abbau von Diclofenac gehemmt wird, kann es zu einer signifikanten Erhöhung der Exposition und der Spitzen-Plasma-Konzentration von Diclofenac kommen.
Antiphlogistika/Antirheumatika
Die gleichzeitige Verabreichung von Diclofenac mit anderen NSAR oder mit Glukokortikoiden erhöht das Risiko von Nebenwirkungen im Magen-Darm-Trakt, z. B. gastrointestinale Ulzera oder Blutungen (siehe Abschnitt 4.4). Die Anwendung von Voltaren Plus in Kombination mit NSAR, einschließlich COX-2-Hemmern, sollte vermieden werden.
Methotrexat
Vorsicht ist angezeigt, wenn NSAR weniger als 24 Stunden vor oder nach Gabe von Methotrexat angewandt werden, weil die Konzentration von Methotrexat im Blut ansteigen und damit seine toxische Wirkung zunehmen kann.
Ciclosporin
Die Wirkung von NSAR auf die renalen Prostaglandine der Niere kann die Nephrotoxizität von Ciclosporin erhöhen.
Chinolon-Antibiotika
Vereinzelt wurde über zerebrale Krämpfe berichtet, die möglicherweise auf die gleichzeitige Anwendung von Chinolonen und NSAR zurückzuführen waren.
Antikoagulanzien
NSAR können die Wirkung von Antikoagulanzien wie Warfarin verstärken (siehe Abschnitt 4.4). Obwohl klinische Untersuchungen keine Anhaltspunkte dafür geben, dass Diclofenac die Wirkung blutgerinnungshemmender Mittel beeinflusst, liegen vereinzelte Berichte über ein erhöhtes Blutungsrisiko bei gleichzeitiger Anwendung von Diclofenac und blutgerinnungshemmenden Mitteln vor. Deshalb wird empfohlen, solche Patienten sorgfältig zu überwachen (Kontrolle des Gerinnungsstatus).
Thrombozyten-Aggregationshemmer wie Acetylsalicylsäure und selektive SerotoninWiederaufnahme-Hemmer (SSRI)
Antidiabetika
Vereinzelt wurde über eine Beeinflussung des Blutglukosespiegels nach Gabe von Diclofenac berichtet, die eine Dosisanpassung der antidiabetischen Medikation erforderte. Daher wird bei gleichzeitiger Therapie vorsichtshalber eine Kontrolle der Blutzuckerwerte empfohlen.
Antidepressiva
Bei gleichzeitiger Einnahme von MAO-Hemmern, wie zum Beispiel Tranylcypromin, kann es zu einer Verstärkung der zentralnervösen Wirkungen und zu anderen Nebenwirkungen in nicht vorhersehbarem Ausmaß kommen. Voltaren Plus sollte daher erst zwei Wochen nach dem Ende einer Therapie mit MAO-Hemmern angewendet werden.
Unter trizyklischen Antidepressiva (Imipramin, Amitriptylin) sowie Opipramol kann eine codeinbedingte Atemdepression verstärkt werden.
Sonstiges
ZNS-Sedativa
Die gleichzeitige Anwendung von Codein und anderen zentraldämpfenden Pharmaka kann zu einer Verstärkung der sedierenden und atemdepressiven Wirkung führen. Codein vermindert zusammen mit Alkohol die psychomotorische Leistungsfähigkeit stärker als die Einzelkomponenten.
Partielle Opioidagonisten/-antagonisten
Die Wirkung von Scherzmitteln wird verstärkt. Bei gleichzeitiger Anwendung mit partiellen Opioidagonisten/-antagonisten, wie zum Beispiel Buprenorphin, Pentacozin, ist eine Wirkungsabschwächung von Voltaren Plus möglich.
Metabolische Enzyme
Patienten, die CYP2D6- und CYP3A4-Enzyminhibitoren anwenden, können ein verändertes Ansprechen auf Codein zeigen. Arzneimittel, die starke Inhibitoren der Codein-O-Demethylierung (CYP2D6), wie Chinidin, sind, können die Plasmakonzentrationen der Codein-Metaboliten Morphin und Morphin-6-Glucuronid herabsetzen (siehe Abschnitt 5.2).
Enzyminduktoren, wie Phenobarbital und Rifampicin, können die metabolischen Enzyme induzieren und dadurch die Plasmakonzentrationen von Codein erniedrigen. Die gleichzeitige Gabe von Arzneimitteln, die hauptsächlich die Codein-N-Demethylierung (CYP3A4) induzieren, können die Plasmakonzentrationen von Norcodein, dem inaktiven Metaboliten von Codein, erhöhen.
Laborergebnisse
Codein kann die Erhöhung von Amylasen und Lipasen im Plasma bedingen infolge der Möglichkeit von Codein Spasmen des Sphincter Oddi auszulösen. Die Bestimmung dieser Enzymkonzentrationen kann für einige Zeit nach der Anwendung von OpiatAgonisten unzuverlässig sein.
Cimetidin
Cimetidin und andere Arzneimittel, die den Leberstoffwechsel beeinflussen, können die Wirkung von Voltaren Plus verstärken. Unter Morphinbehandlung wurde eine Hemmung des Morphinabbaus mit konsekutiv erhöhten Plasmakonzentrationen beobachtet. Für Codein ist eine solche Wechselwirkung nicht auszuschließen.
4.6 Schwangerschaft und Stillzeit
Schwangerschaft
Für Codein gibt es verschiedene Hinweise auf signifikant erhöhte Fehlbildungsraten bei einer Anwendung im ersten Trimenon der Schwangerschaft (Missbildungen des Respirationstraktes, leichte Erhöhung von Spaltbildungen an Gaumen und Lippen). Im dritten Trimenon kann eine Therapie mit Codein zu Entzugssymptomen beim Neugeborenen (bei Abbruch der Therapie vor der Geburt auch beim Fetus) führen, so dass eine Anwendung auch im dritten Trimenon kontraindiziert ist.
Während der Schwangerschaft, bei nahender Geburt oder drohender Frühgeburt darf Voltaren Plus aufgrund des arzneilich wirksamen Bestandteils Codein nicht angewendet werden, weil Codein die Plazentaschranke passiert und beim Neugeborenen zu Atemdepression führen kann (Neugeborene sind gegenüber Opioiden besonders empfindlich).
Die Hemmung der Prostaglandinsynthese kann die Schwangerschaft und/oder die embryo-fetale Entwicklung negativ beeinflussen. Daten aus epidemiologischen Studien weisen auf ein erhöhtes Risiko für Fehlgeburten sowie kardiale Missbildungen und Gastroschisis nach der Anwendung eines Prostaglandinsynthesehemmers in der Frühschwangerschaft hin. Es wird angenommen, dass das Risiko mit der Dosis und der Dauer der Therapie steigt.
Bei Tieren wurde nachgewiesen, dass die Gabe eines Prostaglandinsynthesehemmers zu erhöhtem prä- und postimplantärem Verlust und zu embryo-fetaler Letalität führt. Ferner wurden erhöhte lnzidenzen verschiedener Missbildungen, einschließlich kardiovaskulärer Missbildungen, bei Tieren berichtet, die während der Phase der Organogenese einen Prostaglandinsynthesehemmer erhielten.
Voltaren Plus sollte nicht von Frauen angewendet werden, die versuchen schwanger zu werden.
Während des dritten Schwangerschaftstrimesters können alle Prostaglandinsynthesehemmer:
- den Fetus folgenden Risiken aussetzen:
• kardiopulmonale Toxizität (mit vorzeitigem Verschluss des Ductus arteriosus und pulmonaler Hypertonie);
• Nierenfunktionsstörung, die zu Nierenversagen mit Oligohydramniose fortschreiten kann.
- die Mutter und das Kind am Ende der Schwangerschaft folgenden Risiken aussetzen:
• mögliche Verlängerung der Blutungszeit, ein thrombozytenaggregationshemmender Effekt, der selbst bei sehr geringen Dosen auftreten kann;
• Hemmung von Uteruskontraktionen, mit der Folge eines verspäteten oder verlängerten Geburtsvorganges.
Stillzeit
Diclofenac geht in geringen Mengen in die Muttermilch über (nach oralen Tagesdosen von 150 mg bis ca. 0,1 mg/l).
Codein sowie dessen Metabolit Morphin werden in die Muttermilch ausgeschieden. Im Allgemeinen ist eine einmalige Anwendung von Voltaren Plus in der empfohlenen Dosierung mit dem Stillen zu vereinbaren. Jedoch können unerwünschte Wirkungen auf den Säugling bei einer wiederholten Behandlung während der Stillzeit nicht ausgeschlossen werden. Ist eine derartige Therapie erforderlich, ist das Stillen während der Behandlung zu unterbrechen. Es muss auf Nebenwirkungen geachtet
werden wie Trinkschwäche, Somnolenz oder Lethargie, die auf eine MorphinIntoxikation hindeuten.
Eine Anwendung von Voltaren Plus in der Stillzeit sollte nach Möglichkeit vermieden werden.
Fertilität
Die Anwendung von Voltaren Plus kann, wie die Anwendung anderer Arzneimittel, die bekanntermaßen die Cyclooxigenase/Prostaglandinsynthese hemmen, die weibliche Fertilität beeinträchtigen und wird daher bei Frauen, die schwanger werden möchten, nicht empfohlen. Bei Frauen, die Schwierigkeiten haben schwanger zu werden oder bei denen Untersuchungen zur Infertilität durchgeführt werden, sollte das Absetzen von Voltaren Plus in Betracht gezogen werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Dieses Arzneimittel kann gelegentlich zentralnervöse Nebenwirkungen wie Müdigkeit, Benommenheit, Schwindel oder vereinzelt auch Sehstörungen hervorrufen. Deshalb kann im Einzelfall die Fähigkeit zum Fahren eines Kraftfahrzeugs und/oder zum Bedienen von Maschinen eingeschränkt sein. Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (>10 %)
Häufig (>1 % bis <10 %)
Gelegentlich (>0,1 % bis <1 %)
Selten (>0,01 % bis <0,1)
Sehr selten (<0,01 % oder unbekannt)
Bei den folgenden unerwünschten Arzneimittelwirkungen muss berücksichtigt werden, dass sie überwiegend dosisabhängig und interindividuell unterschiedlich sind.
Die am häufigsten beobachteten Nebenwirkungen betreffen den Verdauungstrakt. Peptische Ulzera, Perforationen oder Blutungen, manchmal tödlich, können auftreten, insbesondere bei älteren Patienten (siehe Abschnitt 4.4). Übelkeit, Erbrechen, Diarrhö, Blähungen, Verstopfung, Verdauungsbeschwerden, abdominale Schmerzen,
Teerstuhl, Hämatemesis, ulzerative Stomatitis und Verschlimmerung von Colitis ulcerosa und Morbus Crohn (siehe Abschnitt 4.4) sind nach Anwendung berichtet worden. Weniger häufig wurde Gastritis beobachtet.
Ödeme, Bluthochdruck und Herzinsuffizienz wurden im Zusammenhang mit NSAR-Behandlung berichtet.
Klinische Studien und epidemiologische Daten weisen übereinstimmend auf ein erhöhtes Risiko für arterielle thrombotische Ereignisse (beispielsweise Herzinfarkt oder Schlaganfall) hin, das mit der Anwendung von Diclofenac assoziiert ist, insbesondere bei einer hohen Dosis (150 mg täglich) und bei Langzeitanwendung (siehe Abschnitt 4.3 und 4.4 zu Gegenanzeigen sowie Besonderen Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung).
Schnellfreisetzende orale Darreichungsformen von Diclofenac können eine erhöhte Magen-Darm-Unverträglichkeit aufweisen. Dies gilt insbesondere für die Kombination mit Codein.
Herzerkrankungen
Selten bis sehr selten: Herzklopfen, Schmerzen in der Brust, Herzinsuffizienz Sehr selten: Herzinfarkt
Erkrankungen des Blutes und des Lymphsystems Gelegentlich: Störungen der Blutbildung (Thrombozytopenie, Leukopenie, Agranulozytose, Anämie, Panzytopenie), hämolytische Anämie. Erste Anzeichen können sein: Fieber, Halsschmerzen, oberflächliche Wunden im Mund, grippeartige Beschwerden, starke Abgeschlagenheit, Nasenbluten und Hautblutungen.
Selten bis sehr selten: Hämolytische Anämie
Bei der Langzeittherapie sollte das Blutbild regelmäßig kontrolliert werden.
Erkrankungen des Nervensystems Sehr häufig: Kopfschmerzen, Somnolenz
Häufig: Erregung, Reizbarkeit, Schlaflosigkeit, Müdigkeit, Benommenheit und Schwindel
Selten bis sehr selten: Sensibilitätsstörungen, Gedächtnisstörungen, Desorientierung, Krämpfe, Angstgefühle, Albträume, Zittern, Depressionen und andere psychotische Reaktionen, Störungen der Geschmacksempfindung
In Einzelfällen wurde unter der Anwendung von Diclofenac die Symptomatik einer aseptischen Meningitis mit Nackensteifigkeit, Kopfschmerzen, Übelkeit, Erbrechen, Fieber oder Bewusstseinstrübung beobachtet. Prädisponiert scheinen Patienten mit Autoimmunerkrankungen (systemischem Lupus erythematodes, Mischkollagenosen) zu sein.
Bei höheren Dosen oder bei empfindlichen Patienten können dosisabhängig die visumotorische Koordination verschlechtert und Sehstörungen verstärkt sein bzw. eine Atemdepression und Euphorie auftreten.
Augenerkrankungen
Selten bis sehr selten: Sehstörungen (Verschwommen- oder Doppeltsehen)
Erkrankungen des Ohrs oder Labyrinths
Selten bis sehr selten: Tinnitus und reversible Hörstörungen
Erkrankungen der Atemwege, des Brustraums und Mediastinums Gelegentlich: Kurzatmigkeit, Mundtrockenheit
Erkrankungen des Gastrointestinaltraktes
Sehr häufig: Magen-Darm-Beschwerden wie Übelkeit, Erbrechen, Durchfall und Obstipation, ebenso geringfügige Magen-Darm-Blutverluste, die in Ausnahmefällen eine Blutarmut verursachen können
Häufig: Dyspepsie, Blähungen, Bauchkrämpfe, Anorexie sowie Magen- oder
Darmgeschwüre, u. U. mit Blutung und Durchbruch
Gelegentlich: Hämatemesis, Meläna oder blutiger Durchfall
Der Patient ist anzuweisen, bei Auftreten dieser Symptome das Arzneimittel
abzusetzen und sofort einen Arzt aufzusuchen.
Selten bis sehr selten: Aphthöse Stomatitis, Glossitis, Ösophagusläsionen, membranartige intestinale Strikturen, Beschwerden im Unterbauch (z. B. unspezifische hämorrhagische Colitis und Exazerbation einer Colitis ulcerosa oder eines Morbus Crohn), Pankreatitis
Erkrankungen der Nieren und Harnwege
Gelegentlich: Periphere Ödeme, besonders bei Patienten mit hohem Blutdruck oder eingeschränkter Nierenfunktion
Selten bis sehr selten: Nierengewebsschädigungen (interstitielle Nephritis, Papillennekrose), die mit akuter Nierenfunktionsstörung (Niereninsuffizienz), Proteinurie und/oder Hämaturie einhergehen können.
In Einzelfällen kann es zu einem nephrotischen Syndrom kommen.
Die Nierenfunktion sollte regelmäßig kontrolliert werden.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Überempfindlichkeitsreaktionen wie Hautausschlag und Hautjucken
Gelegentlich: Urtikaria oder Alopezie
Selten bis sehr selten: Exantheme, Ekzeme, Erytheme, Photosensibilisierung, Purpura einschließlich allergischer Purpura und schwere Verlaufsformen von Hautreaktionen (Stevens-Johnson-Syndrom, Lyell-Syndrom, Erythrodermie)
Stoffwechsel- und Ernährungsstörungen Selten bis sehr selten: Gewichtszunahme
Infektionen und parasitäre Erkrankungen
In Einzelfällen ist im zeitlichen Zusammenhang mit der systemischen Anwendung von NSAR eine Verschlechterung infektionsbedingter Entzündungen (z. B. Entwicklung einer nekrotisierenden Fasciitis) beschrieben worden. Dies steht möglicherweise im Zusammenhang mit dem Wirkmechanismus der NSAR. Wenn während der Anwendung von Diclofenac Zeichen einer Infektion neu auftreten oder sich verschlimmern, wird dem Patienten daher empfohlen, unverzüglich den Arzt aufzusuchen. Es ist zu prüfen, ob die Indikation für eine antiinfektiöse/antibiotische Therapie vorliegt.
Gefäßerkrankungen
Selten bis sehr selten: Hypertonie
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Codein kann insbesondere bei Einzeldosen über 60 mg die Spannung der glatten
Muskulatur erhöhen.
Erkrankungen des Immunsystems
Gelegentlich: Schwere Überempfindlichkeitsreaktionen. Sie können sich äußern als: Gesichtsödem, Zungenschwellung, Kehlkopfschwellung mit Einengung der Luftwege, schwere Bronchospasmen, Luftnot mit und ohne Blutdruckabfall, Herzjagen, Blutdruckabfall bis zum bedrohlichen Schock.
Beim Auftreten einer dieser Erscheinungen, die schon bei Erstanwendung vorkommen können, ist sofort ärztliche Hilfe erforderlich.
Selten: Schwere Allergien
Bei hohen therapeutischen Dosen oder bei Intoxikation können Synkopen und Blutdruckabfall sowie insbesondere bei Patienten mit vorbestehenden Lungenfunktionsstörungen Lungenödeme auftreten.
Selten bis sehr selten: Vaskulitis und Pneumonitis
Leber- und Gallenerkrankungen
Häufig: Erhöhung der Serum-Transaminasen (SGOT und SGPT).
Gelegentlich: Leberschäden, akute Hepatitis mit oder ohne Gelbsucht (sehr selten sehr schwer [fulminant] verlaufend, auch ohne Prodromalsymptome).
Die Leberwerte sollen regelmäßig kontrolliert werden.
4.9 Überdosierung
a) Symptome der Intoxikation
Diclofenac: Als Symptome einer Überdosierung können zentralnervöse Störungen, wie Kopfschmerzen, Schwindel, Benommenheit, Bewusstseinseintrübung bis
Bewusstlosigkeit, Hyperventilation, bei Kindern auch myoklonische Krämpfe, auftreten. Des Weiteren kann es zu Bauchschmerzen, Übelkeit und Erbrechen kommen. Ferner sind das Auftreten von gastrointestinalen Blutungen sowie Funktionsstörungen der Leber und Nieren möglich.
Codein: Das Charakteristikum der Überdosierung ist die extreme Atemdepression. Die Symptome gleichen weitgehend der Morphinvergiftung mit extremer Somnolenz bis zu Stupor und Koma, meist verbunden mit Myosis, oft mit Erbrechen, Kopfschmerzen, Harn- und Stuhlverhalten. Zyanose, Hypoxie, kalte Haut, Skelettmuskel-Tonusverlust und Areflexie kommen vor, manchmal Bradykardie und Blutdruckabfall, gelegentlich -vor allem bei Kindern - Krämpfe ohne weitere Symptome.
b) Therapie von Intoxikationen
Ein spezifisches Antidot gegen Diclofenac existiert nicht.
Die Behandlung einer Überdosierung erfolgt symptomatisch unter Kontrolle der Vitalfunktionen. Die Behandlung von Komplikationen wie Hypotonie, Niereninsuffizienz, Krämpfe, gastrointestinale Reizungen und Atemdepression ist unterstützend und ebenfalls symptomatisch.
Spezifische Maßnahmen wie forcierte Diurese, Dialyse oder Hämoperfusion sind für die Elimination von NSAR wegen ihrer hohen Proteinbindung wahrscheinlich nicht hilfreich.
Die Wirkung von Codein kann mit Opiatantagonisten, wie z. B. Naloxon, aufgehoben werden.
Die Gabe von Naloxon muss wiederholt werden, da die Wirkungsdauer von Codein länger ist als die von Naloxon. Wenn Naloxon nicht eingesetzt werden kann, sind symptomatische Maßnahmen, vor allem stabile Seitenlagerung, Beatmung und Schockbehandlung indiziert.
Naloxon wird initial bei Erwachsenen in einer Dosis von 0,4-2 mg i.v. verabreicht.
Falls nicht vorhanden, kann Levallorphan (in schweren Fällen bei Erwachsenen 2 mg i.v.) gegeben werden.
Weitere Maßnahmen siehe Rote Liste®, Signaturverzeichnis C 85.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Codein in Kombination mit Diclofenac,
ATC-Code: N02AA65
Voltaren Plus ist die Kombination von schnellfreisetzendem Diclofenac-Natrium, einem sehr wirksamen peripher angreifenden Antirheumatikum/Antiphlogistikum, sowie von Codeinphosphat, einem vorwiegend zentral wirkenden Analgetikum.
Diclofenac-Natrium
Diclofenac ist ein nicht steroidales Antiphlogistikum/Antirheumatikum, das sich über die Prostaglandinsynthesehemmung in den üblichen tierexperimentellen Entzündungsmodellen als wirksam erwies. Beim Menschen reduziert Diclofenac entzündlich bedingte Schmerzen, Schwellungen und Fieber. Ferner hemmt Diclofenac die ADP- und kollageninduzierte Plättchenaggregation.
Codeinphosphat
Codein inhibiert die Schmerzafferenzen auf verschiedenen Ebenen des Zentralnervensystems über Hemmung von Neurotransmitterfreisetzung und
Aktivierung inhibitorischer Bahnen. Die Wirkungen kommen teilweise über den Metaboliten Morphin zustande.
Durch den unterschiedlichen Angriffspunkt der beiden Bestandteile dieser Kombination addiert sich die analgetische Wirkung, weshalb Voltaren Plus sich besonders zur Behandlung von starken und sehr starken Schmerzen bei degenerativen Gelenkerkrankungen, nach chirurgischen Eingriffen sowie bei malignen Erkrankungen eignet.
Zur Beurteilung der klinischen Wirksamkeit und Verträglichkeit von Voltaren Plus bei der Behandlung von Schmerzen bei degenerativen Gelenkerkrankungen, z. B. der Gonarthrose, wurde eine doppelblinde, multizentrische, randomisierte, aktiv kontrollierte Parallelgruppenstudie an 238 Patienten mit stark schmerzhafter dekompensierter Gonarthrose durchgeführt. Primäres Ziel der Studie war es, die Überlegenheit von Voltaren Plus (3-mal täglich 1 Tablette) im Vergleich zu Diclofenac alleine (3-mal täglich 50 mg) in Bezug auf die Zeit bis zum Wirkeintritt, definiert als Reduktion der Schmerzintensität um min. 30 % des maximalen Schmerzes, zu zeigen. Unter der Behandlung mit Voltaren Plus zeigte sich bei 24,8 % der Patienten ein Behandlungserfolg am Tag 1, gegenüber 19,3 % in der Diclofenac-Vergleichsgruppe. Dieser statistisch signifikante Behandlungsunterschied vergrößerte sich bis zum Tag 6 weiter auf 61,8 % der mit Voltaren Plus-Behandelten im Vergleich zu 51,6 % der mit Diclofenac Behandelten.
Die Analyse der unerwünschten Ereignisse in der Studie ergab in der Voltaren PlusGruppe eine im Vergleich zur Diclofenac-Gruppe höhere Zahl an Nebenwirkungen (34 % versus 19 % der Patienten) und eine höhere Abbruchquote aufgrund von Nebenwirkungen (5,3 % versus 0,9 % der Patienten). Zu den häufigsten Nebenwirkungen gehörten vor allem gastrointestinale Nebenwirkungen, gefolgt von zentralnervösen Beschwerden, allgemein körperlichen Beschwerden sowie von Muskel- und Gelenkbeschwerden.
5.2 Pharmakokinetische Eigenschaften
Diclofenac-Natrium
In Voltaren Plus liegt Diclofenac-Natrium in einer schnellfreisetzenden Formulierung vor. Nach oraler Applikation von Voltaren Plus werden maximale Plasmaspiegel von Diclofenac im Mittel innerhalb einer Stunde erreicht.
Diclofenac ist zu 99,7 % an Serumproteine gebunden, hauptsächlich an Albumin (99,4 %). Das Verteilungsvolumen beträgt 0,12-0,17 l/kg.
Diclofenac tritt in die Synovialflüssigkeit über. Dort werden die Höchstkonzentrationen 2-4 Stunden nach Erreichen der maximalen Plasmawerte gemessen. Die Eliminationshalbwertszeit aus der Synovialflüssigkeit beträgt 3-6 Stunden.
Bereits zwei Stunden nach Erreichen der maximalen Plasmakonzentration ist die Wirkstoffkonzentration in der Synovialflüssigkeit höher als im Plasma und bleibt bis zu 12 Stunden lang höher.
Die Metabolisierung von Diclofenac erfolgt rasch und fast vollständig.
Die Metaboliten sind bekannt. Die Biotransformation erfolgt teilweise durch Glukuronidierung der unveränderten Wirksubstanz, hauptsächlich aber durch ein- und mehrfache Hydroxylierung, die zur Bildung mehrerer phenolischer Metaboliten (3'-Hydroxy-, 4'-Hydroxy-, 5-Hydroxy-, 4',5-Dihydroxy- und 3'-Hydroxy-4'-methoxy-diclofenac) führt, die dann weitgehend an Glukuronsäure konjugiert werden. Zwei dieser phenolischen Metaboliten sind pharmakologisch wirksam, allerdings wesentlich geringer als Diclofenac.
Die Elimination von Diclofenac aus dem Plasma erfolgt mit einer systemischen Clearance von 263 + 56 ml/min.
Die terminale Halbwertszeit beträgt 1-2 Stunden.
Auch vier der Metaboliten, darunter die beiden aktiven Metaboliten, haben eine kurze Halbwertszeit von 1 bis 3 Stunden. Eine wesentlich längere Halbwertszeit hat der praktisch inaktive Metabolit 3'-Hydroxy-4'-methoxy-diclofenac.
Weniger als 1 % der Wirksubstanz wird in unveränderter Form renal eliminiert. Als Metaboliten werden ca. 60 % der applizierten Dosis im Urin, der Rest über die Galle in den Fäzes ausgeschieden.
Die Pharmakokinetik von Diclofenac bleibt auch bei wiederholter Verabreichung unverändert.
Bei Einhaltung der empfohlenen Dosierungsintervalle tritt keine Kumulation ein. Relevante Unterschiede von Resorption, Metabolismus und Ausscheidung, bedingt durch das Alter der Patienten, sind nicht beobachtet worden.
Untersuchungen nach einmaliger i.v. Gabe von Diclofenac-Natrium sprechen dafür, dass bei eingeschränkter Nierenfunktion nicht mit einer Kumulation der unveränderten Wirksubstanz zu rechnen ist. Dagegen lassen die genannten Untersuchungen erwarten, dass es bei stark eingeschränkter Nierenfunktion nach mehrfacher Gabe von Diclofenac-Natrium zu einer Zunahme der Metabolitenkonzentration im Plasma kommt, ohne dass dies nach derzeitiger Erkenntnis klinisch fassbare Auswirkungen hat.
Bei eingeschränkter Leberfunktion (chronische Hepatitis, Leberzirrhose ohne portale Dekompensation) verlaufen die Kinetik und der Metabolismus wie bei Patienten mit gesunder Leber.
Diclofenac wurde in geringfügiger Konzentration (100 ng/ml) in der Muttermilch einer stillenden Frau nachgewiesen. Die ausgeschiedene Menge, die ein Säugling beim Trinken der Muttermilch aufnimmt, ist vernachlässigbar und äquivalent einer Tagesdosis von 0,03 mg/kg Körpergewicht.
Codeinphosphat
Nach oraler Gabe von Voltaren Plus wird Codein rasch resorbiert. Die absolute Bioverfügbarkeit beträgt nach oraler Gabe durchschnittlich 70 %.
Maximale Plasmakonzentrationen (um 93 ng/ml) wurden nach etwa 1 Stunde erreicht (orale Gabe, 60 mg Codeinbase, 11 männliche junge Probanden).
Die Eiweißbindung liegt unter 10 %.
Die Eliminationshalbwertszeit von Codein liegt bei gesunden Erwachsenen zwischen 3 und 5 Stunden, bei niereninsuffizienten zwischen 9 und 18 Stunden. Auch im Alter ist die Elimination verlangsamt.
Codein wird in der Leber bei großen interindividuellen Unterschieden extensiv metabolisiert. Hauptmetaboliten im Plasma sind Morphin, Norcodein und die Morphin- und Codeinkonjugate, wobei die Konjugatkonzentrationen wesentlich höher als die Ausgangssubstanzen liegen.
Die Ausscheidung erfolgt vor allem renal in Form der Morphin- und Codeinkonjugate. Etwa 10 % Codein werden unverändert ausgeschieden.
Codein tritt in den fetalen Kreislauf über.
In der Muttermilch werden nach Einnahme hoher Codeindosen pharmakologisch relevante Konzentrationen erreicht.
Linearität/Nicht-Linearität
Diclofenac zeigt eine dosis-proportionale Pharmakokinetik im Dosierungsbereich zwischen 25 und 150 mg. Bei zunehmender Dosierung von Diclofenac wurde eine proportionale Zunahme von Cmax und AUC auch im Niedrig-Dosisbereich zwischen 12,5 und 50 mg berichtet.
Codein zeigt ebenfalls eine dosis-proportionale Pharmakokinetik. Bei Zunahme der Dosierung von Codeinphosphat wird über eine proportionale Zunahme von Cmax und AUC im Dosisbereich zwischen 15 und 60 mg berichtet.
Nach wiederholter Anwendung therapeutischer Dosen bleibt die Pharmakokinetik des Wirkstoffes unverändert. Eine signifikante Akkumulation des Wirkstoffes tritt nicht auf.
Eine im Jahr 1994 durchgeführte Bioverfügbarkeitsstudie an 12 Probanden ergab nach oraler Applikation von Voltaren Plus 50 mg/50 mg Filmtabletten für Diclofenac und Codein:
|
Diclofenac |
Codein | |
|
Maximale Plasmakonzentration (Cmax) [ng/ml]: |
1778,5 ± 702 |
101,3 ± 22 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax): |
22,8 min |
40,2 min |
|
Fläche unter der Konzentrations-Zeit-Kurve (AUC): |
1336,6 ± 344 |
297,7 ± 60 |
Angabe als Mittelwerte und Streubreite
Mittlere Plasmaspiegelverläufe von Diclofenac und Codein in einem KonzentrationsZeit-Diagramm:
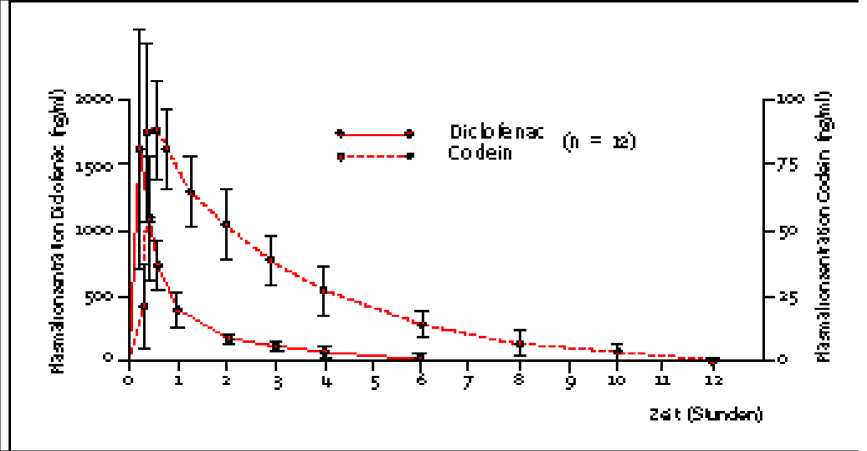
5.3 Präklinische Daten zur Sicherheit
Akute T oxizität
Die Prüfung auf akute Toxizität von Diclofenac an verschiedenen Tierspezies hat keine besondere Empfindlichkeit ergeben. Vergiftungssymptome siehe Abschnitt 4.9.
Für Codein wurde bei Untersuchungen der akuten Toxizität die orale LD50 bei verschiedenen Tierspezies mit 237-640 mg/kg KG bestimmt. Klinisch ist für den Erwachsenen bei einer Gesamtdosis von 0,5-1 g Codeinbase mit toxischen Erscheinungen zu rechnen, bei Kindern ab Dosierungen von 2 mg/kg KG Codeinbase.
Akute orale LD50 und Potenzierungsstudien mit Voltaren Plus an Mäusen, Ratten und Affen führten zu Ulkusperforation, Verklebungen im Abdomen sowie Blutungen in der Magenschleimhaut.
Chronische Toxizität
Die chronische Toxizität von Diclofenac wurde an Ratten, Hunden und Affen untersucht. Im toxischen Bereich - unterschiedlich nach Spezies ab Dosen über 0,5 bzw. 2,0 mg/kg KG - traten Ulzerationen im Magen-Darm-Trakt und dadurch ausgelöste Folgeerscheinungen wie Peritonitis, Anämie und Leukozytose auf.
Subchronische und chronische Toxizitätsstudien mit Voltaren Plus in Dosierungen von oral 1,2 mg und 4 mg/kg KG an Ratten verursachten weder Todesfälle noch offensichtliche Symptome noch klinisch-chemische oder hämatologische Veränderungen. Unter der oralen Verabreichung von 6 mg oder 12 mg Voltaren Plus/kg KG an Ratten wurden klinische Symptome, klinisch-chemische, hämatologische und pathologische Veränderungen festgestellt, wie sie im Zusammenhang mit der Bildung eines Ulcus ventriculi bekannt sind; vereinzelt kam es zum Exitus letalis.
Zusätzlich wurde bei einigen männlichen Ratten unter der oralen Dosis von 12 mg Voltaren Plus/kg KG eine leichte Proliferation der Milchdrüse beobachtet.
Im Tierexperiment wurde eine Verstärkung der gastrointestinalen Reizwirkung der Kombination gegenüber den Einzelstoffen gefunden.
Mutagenes und tumorerzeugendes Potenzial
Eine mutagene Wirkung von Diclofenac erscheint aufgrund von Ergebnissen aus In-vitro- und In-vivo-Tests ausgeschlossen. Untersuchungen zur Kanzerogenität an der Ratte ergaben keine Anhaltspunkte für tumorerzeugende Wirkungen.
Codein wurde nur unzureichend bezüglich Mutagenität geprüft. Bisherige Untersuchungen ergaben jedoch keine Hinweise auf ein mutagenes Potenzial.
Tests mit der Kombination wurden nicht durchgeführt.
Langzeitstudien an Ratten und Mäusen ergaben keine Hinweise auf ein tumorerzeugendes Potenzial von Codein. Bei Mäusen traten dosisabhängig vermehrt Hyperplasien des Follikelepithels der Schilddrüse auf.
Reproduktionstoxikologie
Das embryotoxische Potenzial von Diclofenac wurde an drei Tierarten (Ratte, Maus, Kaninchen) untersucht. Fruchttod und Wachstumsretardierung traten bei Dosen im maternal-toxischen Bereich auf. Missbildungen wurden nicht beobachtet.
Tragzeit und Dauer des Geburtsvorgangs wurden durch Diclofenac verlängert. Eine nachteilige Wirkung auf die Fertilität wurde nicht festgestellt. Dosen unterhalb der maternal-toxischen Grenze hatten keinen Einfluss auf die postnatale Entwicklung der Nachkommen.
Für Codein gibt es Hinweise auf ein teratogenes/embryotoxisches Potenzial. Untersuchungen zur Reproduktionstoxizität der Kombination liegen nicht vor.
6. Pharmazeutische Angaben
6.1 Liste der sonstige Bestandteile
Calciumhydrogenphosphat, Titandioxid (E 171), Eisen(III)-oxid (E 172), Hyprolose, Macrogolglycerolhydroxystearat (Ph.Eur.), Magnesiumstearat (Ph.Eur.) [pflanzlich], Maisstärke, Hypromellose, Poly(O-carboxymethyl)amylopektin, hochdisperses Siliciumdioxid, Talkum
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
5 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
In der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
6.5 Art und Inhalt des Behältnisses
Durchdrückpackungen zu 10, 20 und 100 Filmtabletten.
Klinikpackung: 200 (10 x 20) Filmtabletten
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
Novartis Pharma GmbH 90327 Nürnberg
Hausadresse:
Roonstraße 25 90429 Nürnberg Telefon: (09 11) 273-0 Telefax: (09 11) 273-12 653 Internet/E-Mail: www.novartis.de
Info-Service:
Telefon: (0 18 02) 23 23 00 (0,06 € pro Anruf aus dem deutschen Festnetz; max. 0,42 € pro Minute aus dem deutschen Mobilfunknetz)
Telefax: (09 11) 273-12 160
8. Zulassungsnummer
13935.00.00
9. Datum der Erteilung der Zulassung/Datum der Verlängerung der Zulassung
07. Juli 1992/10. Juli 2006
10. Stand der Information
Dezember 2013
11. Verkaufsabgrenzung
Verschreibungspflichtig