Wariviron 400Mg
Zusammenfassung der Merkmale des Arzneimittels FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
WARIVIRON 400 mg, Tabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Tablette enthält 400 mg Aciclovir.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Tablette
Weiße, runde Tablette.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Herpes zoster (Gürtelrose).
Zur Vorbeugung von schweren Herpes-simplex-Infektionen bei stark immunsupprimierten erwachsenen Patienten, wenn diese einem erhöhten Infektionsrisiko ausgesetzt sind, z. B. nach Organtransplantationen.
4.2 Dosierung und Art der Anwendung
Dosierung
Erwachsene Herpes zoster
800 mg Aciclovir 5-mal tagsüber im Abstand von 4 Stunden (tägliche Gesamtdosis 4000 mg).
Vorbeugung von Herpes-simplex-Infektionen bei immunsupprimierten Patienten mit erhöhtem Infektionsrisiko
Bei stark immunsupprimierten Patienten, wenn diese einem erhöhten Infektionsrisiko ausgesetzt sind, z. B. nach Organtransplantationen 400 mg Aciclovir 4-mal täglich im Abstand von 6 Stunden (tägliche Gesamtdosis 1600 mg).
Immunsupprimierte Patienten
Bei stark immunsupprimierten Patienten oder bei Patienten mit gestörter enteraler Resorption ist die intravenöse Infusion von Aciclovir mittels hierfür geeigneter Darreichungsformen in Erwägung zu ziehen.
Ältere Patienten
Die Möglichkeit einer Nierenfunktionsstörung bei älteren Patienten muss berücksichtigt und die Dosierung entsprechend angepasst werden (siehe „Dosierung bei eingeschränkter
Nierenfunktion“ weiter unten). Bei älteren Patienten, die hohe orale Aciclovir-Dosen erhalten, sollte für eine angemessene Flüssigkeitszufuhr gesorgt werden.
Patienten mit eingeschränkter Nierenfunktion
Bei Anwendung von Aciclovir bei Patienten mit eingeschränkter Nierenfunktion ist Vorsicht geboten.
Es ist auf eine angemessene Flüssigkeitszufuhr zu achten.
Bei Patienten mit eingeschränkter Nierenfunktion wird die folgende Dosisanpassung empfohlen:
Dosierung bei Patienten mit eingeschränkter Nierenfunktion
|
Indikation |
Kreatinin- Clearance (ml x min-1 x [1,73 m2]-1) |
Serumkreatinin (^mol/l bzw. mg/dl) |
Dosierung der Einzeldosis | |
|
Frauen |
Männer | |||
|
Herpes zoster |
25 - 10 |
280 - 550 3,17 - 6,22 |
370 - 750 4,18 - 8,48 |
800 mg Aciclovir 3-mal täglich alle 8 Stunden |
|
< 10 |
> 550 > 6,22 |
> 750 > 8,48 |
800 mg Aciclovir 2-mal täglich alle 12 Stunden | |
Art der Anwendung
Die Einnahme der Tabletten sollte möglichst nach den Mahlzeiten mit ausreichend Flüssigkeit (z. B. 1 Glas Wasser) erfolgen.
Besonders bei eingeschränkter Nierenfunktion, wie sie insbesondere bei älteren Patienten vermehrt auftreten kann (siehe Abschnitt 4.4), ist auf eine angemessene Flüssigkeitszufuhr während der Therapie zu achten.
Um einen bestmöglichen Behandlungserfolg zu erzielen, sollte Aciclovir so früh wie möglich
- d. h. möglichst nach dem Auftreten der ersten Hauterscheinungen -verabreicht werden.
Dauer der Anwendung
Die Dauer der Anwendung bei der Prophylaxe von Herpes-simplex-Infektionen bei stark immunsupprimierten Patienten wird von der Schwere der Immunsuppression und von der Dauer des Infektionsrisikos bestimmt.
Bei Herpes zoster beträgt die Behandlungsdauer 5 - 7 Tage.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Da über die vorbeugende Anwendung von Aciclovir 400 mg Tabletten bei Patienten mit eingeschränkter Nierenfunktion oder Anurie noch keine Angaben vorliegen, sollte ein Einsatz des Präparates unter diesen Bedingungen nicht erfolgen.
Patienten mit eingeschränkter Nierenfunktion und ältere Patienten Aciclovir wird renal eliminiert, daher muss die Dosis bei Patienten mit eingeschränkter Nierenfunktion reduziert werden (siehe Abschnitt 4.2). Bei älteren Patienten ist eine verringerte Nierenfunktion wahrscheinlich, daher sollte die Notwendigkeit einer Dosisreduktion für diese Patientengruppe in Betracht gezogen werden.
Sowohl ältere Patienten als auch Patienten mit eingeschränkter Nierenfunktion haben ein erhöhtes Risiko für die Entwicklung neurologischer Nebenwirkungen und sollten daher sorgfältig auf das Auftreten derartiger Wirkungen hin beobachtet werden. Aus den berichteten Fällen geht hervor, dass diese Reaktionen nach Absetzen der Behandlung im Allgemeinen reversibel waren (siehe Abschnitt 4.8).
Die gleichzeitige Verabreichung anderer nephrotoxischer Arzneimittel erhöht das Risiko einer Nierenschädigung.
Resistenzentwicklung
Bei stark immunsupprimierten Patienten kann eine längere oder wiederholte Behandlung mit Aciclovir zu einer Selektion von Virusstämmen mit reduzierter Empfindlichkeit führen, mit der Folge, dass diese Patienten auf die weitere Behandlung mit Aciclovir möglicherweise nicht mehr ansprechen (siehe Abschnitt 5.1).
Hydratationsstatus
Bei Patienten, die hohe orale Aciclovir-Dosen erhalten, sollte auf eine angemessene Flüssigkeitszufuhr geachtet werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Aciclovir wird hauptsächlich unverändert renal durch aktive tubuläre Sekretion in den Urin ausgeschieden. Gleichzeitig angewendete Arzneimittel, die ebenfalls über diesen Mechanismus ausgeschieden werden, können die Plasmakonzentration von Aciclovir erhöhen. Probenecid und Cimetidin erhöhen über diesen Mechanismus die AUC von Aciclovir und verringern dessen renale Clearance.
Bei der gemeinsamen Anwendung von Aciclovir und Mycophenolat-Mofetil (ein immunsuppressiver Wirkstoff, der bei Transplantationspatienten verwendet wird) wurde ein ähnlicher Anstieg der AUCs von Aciclovir und dem inaktiven Metaboliten von Mycophenolat-Mofetil im Plasma gefunden. Aufgrund der großen therapeutischen Breite von Aciclovir ist eine Dosisanpassung jedoch nicht erforderlich.
Die gleichzeitige Anwendung von Aciclovir und Theophyllin führte zu einem Anstieg der AUC von Theophyllin um ca. 50 %.Daher werden bei gleichzeitiger Anwendung eine engmaschige Überwachung der Theophyllin-Konzentrationen und gegebenenfalls eine Reduktion der Theophyllindosis empfohlen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Die Anwendung von Aciclovir in der Schwangerschaft sollte nur dann erfolgen, wenn der potenzielle Nutzen die möglichen Risiken überwiegt.
Nach Markteinführung wurde der Ausgang von Schwangerschaften unter der Behandlung mit allen Formen von Aciclovir in einem Schwangerschaftsregister dokumentiert. Die Befunde aus dem Register lassen keine erhöhte Zahl an Fehlbildungen bei mit Aciclovir behandelten Patienten im Vergleich zur allgemeinen Bevölkerung erkennen; erfasste Fehlbildungen zeigten weder einzigartige noch konstante Muster, die auf einen Zusammenhang hindeuten könnten.
Die systemische Verabreichung von Aciclovir in international anerkannten Standardtests hatte keine embryotoxischen oder teratogenen Auswirkungen auf Kaninchen, Ratten oder Mäuse. Ein nichtstandardisierter Test an Ratten hatte fetale Missbildungen zur Folge, allerdings nur bei Verabreichung hoher subkutaner, maternal-toxischer Dosen. Die klinische Relevanz dieser Ergebnisse ist unklar.
Stillzeit
Nach oraler Verabreichung von 200 mg Aciclovir 5-mal täglich wurden in der Muttermilch Aciclovir-Konzentrationen gefunden, die dem 0,6 - 4,1fachen der jeweiligen AciclovirPlasmaspiegel entsprechen. Ein Säugling wäre demnach Aciclovir-Konzentrationen von bis zu 0,3 mg/kg KG/Tag ausgesetzt. Deshalb soll während der Behandlung mit Aciclovir nicht gestillt werden.
Fertilität
Es liegen keine Informationen über einen Einfluss auf die weibliche Fertilität nach oraler oder intravenöser Anwendung von Aciclovir beim Menschen vor. In einer Studie an 20 männlichen Patienten mit normaler Spermienzahl, die Aciclovir oral in Dosen bis zu 1 g pro Tag über bis zu 6 Monaten einnahmen, wurden keine klinisch signifikanten Auswirkungen auf die Zahl, Motilität oder Morphologie der Spermien gefunden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zum Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Die Patienten sollten allerdings darüber informiert werden, dass im Zusammenhang mit der Anwendung von Aciclovir beispielsweise über Schläfrigkeit, Kopfschmerzen und Schwindel berichtet wurde (siehe Abschnitt 4.8). Dies sollte bei der Einschätzung, ob der Patient in der Lage ist, ein Fahrzeug zu lenken oder Maschinen zu bedienen, berücksichtigt werden.
4.8 Nebenwirkungen
Die mit den unten stehenden Nebenwirkungen verbundenen Häufigkeitseinteilungen sind Schätzungen. Für die meisten Nebenwirkungen liegen keine adäquaten Daten zur Berechnung der Häufigkeiten vor. Ferner können Nebenwirkungen abhängig von der Indikation in ihrer Häufigkeit variieren.
Bei der Bewertung von Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig Häufig Gelegentlich Selten Sehr selten Nicht bekannt
(> 1/10)
(> 1/100 bis < 1/10)
(> 1/1.000 bis < 1/100)
(> 1/10.000 bis < 1/1.000)
(<1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen des Blutes und des Lymphsystems
Sehr selten: Anämie, Thrombopenie, Leukopenie
Erkrankungen des Immunsystems
Selten: anaphylaktische Reaktionen
Psychiatrische Erkrankungen und Erkrankungen des Nervensystems
Häufig: Kopfschmerzen, Schwindel
Sehr selten: allgemeine körperliche Unruhe, Verwirrtheitszustände, Tremor, Ataxie, Dysarthrie, Halluzinationen, Symptome von Psychosen, Krampfanfälle, Somnolenz, Enzephalopathie, Bewusstseinsstörungen bis hin zum Koma.
Die oben genannten Nebenwirkungen sind im Allgemeinen reversibel und wurden überwiegend bei Patienten mit Nierenfunktionsstörungen oder anderen prädisponierenden Faktoren berichtet (siehe Abschnitt 4.4).
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Selten: Dyspnoe
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit, Erbrechen, Diarrhö, Bauchschmerzen
Leber- und Gallenerkrankungen
Selten: vorübergehende Bilirubin- und Leberenzym-Anstiege Sehr selten: Hepatitis, Ikterus
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Juckreiz, Hautausschläge (einschließlich Photosensibilitätsreaktionen) Gelegentlich: Urtikaria, vermehrter diffuser Haarausfall
Da vermehrter diffuser Haarausfall einer großen Vielzahl von Krankheitsverläufen und Arzneimitteln zugeordnet wird, ist der Zusammenhang mit der Einnahme von Aciclovirhaltigen Arzneimitteln unklar.
Selten: Angioödem
Erkrankungen der Nieren und Harnwege Selten: Serumharnstoff- und Kreatinin-Anstiege Sehr selten: akutes Nierenversagen, Nierenschmerzen
Nierenschmerzen können mit Nierenversagen einhergehen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Erschöpfung, Fieber
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger Allee 3
D-53175 Bonn
anzuzeigen.
4.9 Überdosierung
Symptome
Aciclovir wird nur zum Teil aus dem Gastrointestinaltrakt resorbiert (siehe Abschnitt 5.2). Nach der Einnahme von Einzeldosen von bis zu 20 g Aciclovir traten im Allgemeinen keine toxischen Effekte auf. Eine versehentliche, wiederholte Überdosierung von oral eingenommenem Aciclovir über mehrere Tage war verbunden mit gastrointestinalen Symptomen (wie Übelkeit und Erbrechen) und neurologischen Symptomen (Kopfschmerzen und Verwirrtheit).
Eine Überdosierung von intravenösem Aciclovir führte zum Anstieg von Serumkreatinin, Blutharnstoff (BUN) und anschließendem Nierenversagen. Neurologische Wirkungen, einschließlich Verwirrtheit, Halluzinationen, Agitation, Krampfanfälle und Koma, wurden im Zusammenhangmit einer Überdosierung beschrieben.
Maßnahmen
Patienten sollten engmaschig auf Anzeichen einer Toxizität überwacht werden. Hämodialyse verbessert deutlich die Ausscheidung von Aciclovir aus dem Blut und kann daher zur Behandlung einer Überdosierung dieses Arzneistoffs in Betracht gezogen werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antivirales Mittel zur systemischen Anwendung, Nukleoside und Nukleotide, exkl. Inhibitoren der reversen Transkriptase
ATC-Code: J05AB01
Aciclovir ist eine pharmakologisch inaktive Substanz, die erst nach der Penetration in eine Zelle, die mit Herpes-simplex-Viren (HSV) oder Varicella-zoster-Viren(VZV) infiziert ist, zu einem Virostatikum wird. Diese Aktivierung des Aciclovir wird katalysiert durch die HSV- oder VZV-Thymidinkinase, einem Enzym, das die Viren zu ihrer Replikation dringend benötigen. Vereinfacht kann man sagen, dass das Virus sein eigenes Virostatikum synthetisiert. Im Einzelnen laufen dabei folgende Schritte ab:
1. Aciclovir penetriert vermehrt in Herpes-infizierte Zellen.
2. Die in diesen Zellen vorliegende Virus-Thymidinkinase phosphoryliert Aciclovir zum Aciclovir-Monophosphat.
3. Zelluläre Enzyme überführen Aciclovir-Monophosphat in das eigentliche Virostatikum, das Aciclovir-Triphosphat.
4. Aciclovir-Triphosphat besitzt eine 10-bis 30-mal stärkere Affinität zur Virus-DNS-Polymerase als zur zellulären DNS-Polymerase und hemmt somit selektiv die Aktivität des viralen Enzyms.
5. Die Virus-DNS-Polymerase baut darüberhinaus Aciclovir in die Virus-DNS ein, wodurch ein Kettenabbruch bei der DNS-Synthese erfolgt.
Diese Einzelschritte führen insgesamt zu einer sehr wirkungsvollen Reduktion der Virusproduktion.
Im Plaque-Reduktions-Test wurde für HSV-infizierte Vero-Zellen (Zellkulturen aus dem Nierenparenchym des grünen afrikanischen Affen) ein ED50-Hemmwertvon 0,1 pmol Aciclovir/l gemessen. Dagegen war ein ED50-Wert von 300 pmol Aciclovir/l erforderlich, um das Wachstum nicht infizierter Vero-Zellkulturen zu verhindern. So ist bei nicht infizierten Zellkulturen eine bis zu 3000fach erhöhte Aciclovir-Konzentration erforderlich, um eine entsprechende Hemmung zu erreichen.
Wirkungsspektrum in vitro
• sehr empfindlich Herpes-simplex-Virus Typ I und II Varicella-zoster-Virus
• empfindlich Epstein-Barr-Virus
• teilweise empfindlich bis resistent Zytomegalie-Virus
• resistent RNS-Viren Adenoviren Pockenviren
Längerdauernde oder wiederholte Behandlungen mit Aciclovir können insbesondere bei stark immunsupprimierten Patienten zur Selektion von Virusstämmen mit verminderter Empdindlichkeit führen, die auf eine weitere Aciclovirhterapie nicht mehr ansprechen.
Die meisten klinischen Isolate mit verminderter Empfindlichkeit wiesen einen relativen Mangel an Virus-Thymidinkinase auf. Jedoch wurden auch Stämme mit veränderter viraler Thymidinkinase oder DNS-Polymerase nachgewiesen. Während es bei den Isolaten mit Mangel an Thymidinkinase zu einer Verminderung der Replikationsfähigkeit der Viren kam, blieb die Replikationsfähigkeit bei den Isolaten mit strukturellen Enzymveränderungen erhalten.
5.2 Pharmakokinetische Eigenschaften
Aciclovir wird nur teilweise aus dem Gastrointestinaltrakt resorbiert. Die im Steady State ermittelten Plasmaspitzenwerte nach wiederholter oraler Gabe von 200 mg, 400 mg und 800 mg Aciclovir in einem Abstand von4 Stunden 5-mal am Tag liegen bei durchschnittlich3,02 ± 0,5 pmol/l (200 mg), 5,21 ±1,32 pmol/l (400 mg) bzw. 8,16 ± 1,98 pmol/l(800 mg). Diese Werte werden nach etwa 1,5 ± 0,6 Stunden erreicht. Die entsprechenden Plasma-Basiswerte betragen etwa 4 Stunden nach oraler Gabe von Aciclovir 1,61 ± 0,3 pmol/l (200 mg), 2,59 ± 0,53 pmol/l (400 mg) bzw. 4,0 ± 0,72 pmol/l (800 mg). 24 Stunden nach Absetzen der Arzneimittel ist kein Aciclovir im Körper mehr nachweisbar.
Bei immunsupprimierten Kindern im Alter von 3 - 11 Jahren, denen Aciclovir per os in Dosen von 400 mg, entsprechend 300 - 650 mg Aciclovir/m2 KO, 5-mal am Tag verabreicht wurde, konnten Plasmaspitzenwerte von durchschnittlich 5,7 - 15,1 pmol/l ermittelt werden. Bei Säuglingen im Alter von 1 - 6 Wochen wurden nach der oralen Verabreichung von 600 mg Aciclovir/m2 KO alle 6 Stunden Plasmaspitzenwerte von 17,3 bzw. 8,6 pmol/l gemessen.
Bei Neugeborenen und Säuglingen bis zu 3 Monaten, bei denen alle 8 Stunden 10 mg/kg Aciclovir als 1-stündige Infusion angewendet wurden, wurden eine Cmax von 61,2 pmol/l (13,8 pg/ml) und eine Cmin von 10,1 pmol/l (2,3 pg/ml) ermittelt. Eine andere Gruppe von Neugeborenen und Säuglingen (bis zu 3 Monaten), bei denen alle 8 Stunden 15 mg/kg Aciclovir angewendet wurde, wiesen etwa dosisproportionale Anstiege mit einer Cmax von 83,5 pmol/l (18,8 pg/ml) und einer Cmin von14,1 pmol/l (3,2 pg/ml) auf.
Aus dem biexponentiellen Verlauf der Aciclovir-Kinetik kann man schlussfolgern, dass Aciclovir in hohen Konzentrationen ins Gewebe und in die Organe gelangt und aus diesen wieder langsam abflutet.
Das Verteilungsvolumen bei Erwachsenenim Steady State beträgt 50 ± 8,7 l/1,73 m2, bei Neugeborenen und Säuglingen bis zu 3 Monaten 28,8 ± 9,3 l/1,73 m2.
Für die Eiweißbindung wurden Werte zwischen 9 und 33 % ermittelt.
Verteilung in den Organen
Tierexperimentelle Versuche belegen, dass im Vergleich zum Serumspiegel höhere Aciclovirspiegel im Darm, in Niere, Leber und Lunge, niedrigere Spiegel im Muskel, Herzen, Hirn, in Ovarien und Testes der Tiere erreicht werden.
Post-mortem-Untersuchungen beim Menschen ergaben, dass Aciclovir im Speichel, im Vaginalsekret und in der Vesikelflüssigkeit von Herpesbläschen sowie in einigen Organen angereichert wird. 50 % der entsprechenden Serumkonzentrationen werden im Liquor erreicht.
Metabolismus und Elimination
Aciclovir wird bei nierengesunden Patienten zu 62 - 91 % in unveränderter Form und zu 10 -15 % als 9-Carboxymethoxymethylguanin renal eliminiert. Für Erwachsene wurden nach i.v. Gabe von Aciclovir Plasmahalbwertszeiten (t1/2ß) von 2,87 ± 0,76 Stunden und für Neugeborene und Säuglinge bis zu 3 Monaten von 4,1 ± 1,2 Stunden ermittelt. Aciclovir wird sowohl glomerulär filtriert als auch tubulär sezerniert. Wird Aciclovir eine Stunde nach Verabreichung von 1 g Probenecid gegeben, so wird die Plasmahalbwertszeit (t1/2ß) um 18 % verlängert und die Fläche unter der Plasmakonzentrationszeitkurve um 40 % vergrößert. Bei einer Bioverfügbarkeit von etwa 20 % werden ca. 80 % der Gesamt-Aciclovir-Dosis mit den Fäces ausgeschieden.
Bei Patienten mit chronischer Niereninsuffizienz beträgt die durchschnittliche Plasmahalbwertszeit etwa 19,5 Stunden. Die mittlere Plasmahalbwertszeit während der Hämodialyse beträgt 5,7 Stunden. Während der Hämodialyse fallen die AciclovirPlasmaspiegel um etwa 60 %. Bei eingeschränkter Nierenfunktion besteht eine Kumulationsgefahr bei Kreatinin-Clearance-Werten von < 25 ml x min-1 x (1,73 m2)-1 bei einer Dosierung von 5-mal 800 mg/Tag (siehe Abschnitt4.2) bzw. von < 10 ml x min-1 x (1,73 m2)-1 bei einer Dosierung von 5-mal 200 mg/Tag (siehe Abschnitt 4.2).
5.3 Präklinische Daten zur Sicherheit
Aus den Untersuchungen zur chronischen Toxizität liegen keine Erkenntnisse vor, die zu dem Verdacht führen, dass beim Menschen bisher unbekannte Nebenwirkungen auftreten könnten.
Außerdem zeigten sich in In-vivo- und In-vitro-Studien keine Hinweise auf ein reproduktionstoxisches, mutagenes oder kanzerogenes Potential.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Maisstärke, Mikrokristalline Cellulose, Polyvidon, Poly (O-carboxymethyl)stärke Natriumsalz, Hochdisperses Siliciumdioxid, Magnesiumstearat
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
4 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht zutreffend.
6.5 Art und Inhalt des Behältnisses
Originalpackung mit 35 Tabletten (N1)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
WALTER RITTER GmbH + Co. KG Spaldingstraße 110 B 20097 Hamburg Telefon: (040) 236996-0 Telefax: (040) 236996-33 E-mail: Info@walterritter.com
8. ZULASSUNGSNUMMER
32612.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
11.12.1995
10. STAND DER INFORMATION
Juli 2015
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
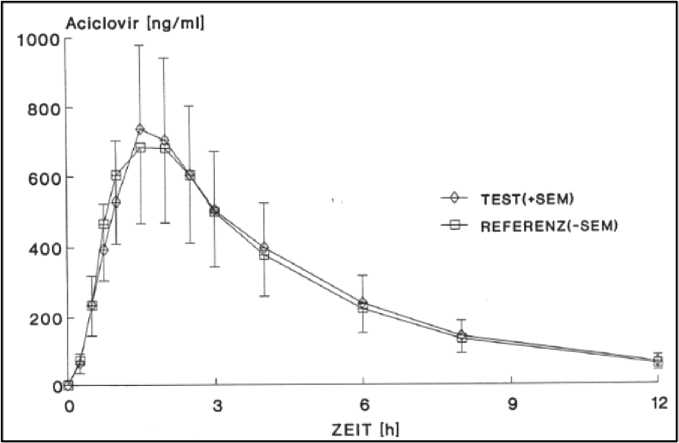
Eine vergleichende Bioverfügbarkeitsuntersuchung (single dose, randomisiert, two-way cross-over mit einer 8-tägigen Auswaschphase zwischen jeder Periode) von Wariviron 400 mg mit dem Originator Zovirax 400 mg wurde im Jahr 1991 an 22 gesunden männlichen Probanden durchgeführt; Pharmakinet, 1991.
Blutproben wurden wiederholt vor und 15, 30, 45, 60, 90, 120, 150, 180, 240, 360, 480 und 720 Minuten nach Tabletteneinnahme auf nüchternen Magen genommen.
Daraus ergaben sich folgende Werte:
|
Parameter |
Wariviron |
Referenzpräparat |
90 % Konfidenzintervall |
|
Cmax (ng/ml) |
773.2 ± 343.6 |
757.0 ± 193.5 |
88.6 - 115.7 % |
|
AUC0-» (h.ng/ml) |
3752.9 ± 1351.5 |
3595.8 ± 944.9 |
94.4 - 114.4 % |
Angabe der Werte als Mittelwerte und Streubreite (Standardabweichung).
Für diese Parameter liegt das 90 % Konfidenzintervall von Test- und Referenzpräparat zwischen 80 und 125 %, die untersuchten Präparate sind somit bioäquivalent.
Mittlere Plasmaspiegelverläufe von Aciclovir im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm:
10