Wilate 1000
Gebrauchsinformation: Information für Anwender
Wilate 500, 500 I.E. VWF/500 I.E. FVIII, Pulver und Lösungsmittel zur Herstellung einer intravenösen Injektionslösung
Wilate 1000, 1000 I.E. VWF/1000 I.E. FVIII, Pulver und Lösungsmittel zur Herstellung einer intravenösen Injektionslösung
von Willebrand-Faktor vom Menschen/Blutgerinnungsfaktor VIII vom Menschen
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
1. Was ist Wilate und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Wilate beachten?
3. Wie ist Wilate anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Wilate aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist Wilate und wofür wird es angewendet?
Wilate gehört zur Arzneimittelgruppe der sog. Gerinnungsfaktoren. Es enthält die Blutgerinnungsfaktoren von Willebrand-Faktor (VWF) und Faktor VIII (FVIII) vom Menschen. Zusammen sind diese beiden Eiweiße (Proteine) an der Blutgerinnung beteiligt.
Von Willebrand-Erkrankung
Wilate dient zur Behandlung und Vorbeugung von Blutungen bei Patienten mit der von Willebrand-Erkrankung. Die von Willebrand-Erkrankung ist ein Sammelbegriff für verschiedene Ausprägungstypen einer Krankheit. Die von Willebrand-Erkrankung ist eine Störung der Blutgerinnung. Bei dieser Erkrankung können Blutungen länger andauern als im Normalfall. Die Ursache ist entweder ein Mangel an VWF im Blut oder eine Funktionsstörung des vorhandenen VWF.
Hämophilie A
Wilate dient zur Behandlung und Vorbeugung von Blutungen bei Patienten mit Hämophilie A (Bluterkrankheit). Bei dieser Erkrankung können Blutungen länger andauern als im Normalfall. Die Ursache liegt in einem angeborenen Mangel an FVIII im Blut.
2. Was sollten Sie vor der Anwendung von Wilate beachten?
Wilate darf nicht angewendet werden, - wenn sie überempfindlich (allergisch) gegen den VWF oder den FVIII vom Menschen oder einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels sind.
Warnhinweise und Vorsichtsmaßnahmen:
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker bevor Sie Wilate anwenden.
• Alle Arzneimittel, die wie Wilate aus menschlichem Blut (enthält Proteine) hergestellt und die in eine Vene injiziert werden (intravenöse Verabreichung), können allergische Reaktionen auslösen. Bitte achten Sie auf frühe Zeichen einer allergischen Reaktion (Hypersensitivität):
- Quaddelbildung (Nesselsucht)
- Hautausschlag
- Engegefühl in der Brust
- keuchende Atmung
- niedriger Blutdruck
- akute allergische Allgemeinreaktion (Anaphylaxie, d.h. einzelne oder alle genannten Symptome entwickeln sich sehr rasch und treten mit großer Intensität auf).
Wenn Sie diese Symptome bemerken, brechen Sie die Injektion sofort ab und benachrichtigen Sie Ihren Arzt.
• Während der Herstellung von Präparaten aus menschlichem Blut oder Plasma werden Maßnahmen ergriffen, um eine Infektion der Patienten zu verhindern. Diese Maßnahmen beinhalten die sorgfältige Auswahl der Blut- und Plasmaspender, um infektiöse Spender auszuschließen, die Testung jeder Spende und des Plasmapools auf Marker von Viren/Infektionen, und die Einführung von Schritten, die Viren inaktivieren oder entfernen.
Trotzdem kann die Möglichkeit der Übertragung von Infektionen bei der Anwendung von Arzneimitteln, die aus menschlichem Blut oder Plasma hergestellt wurden, nicht völlig ausgeschlossen werden. Dies gilt auch für unbekannte oder neu auftretende Viren oder andere infektiöse Erreger.
Die Maßnahmen werden als sicher für umhüllte Viren wie das humane Immundefizienzvirus (HIV), Hepatitis B-Virus, Hepatitis C-Virus und für das nicht umhüllte Hepatitis A-Virus angesehen.
Die Maßnahmen können von begrenzter Wirksamkeit gegen nicht umhüllte Viren wie Parvovirus B19 sein.
Eine Parvovirus B19-Infektion kann für schwangere Frauen (Infektionsrisiko für das Baby) und Patienten mit Immunschwäche oder einigen Arten von Blutarmut (z.B. Sichelzellanämie oder einem gesteigerten Abbau von roten Blutkörperchen) schwerwiegende Folgen haben.
Notieren Sie bei jeder Verabreichung von Wilate den Namen und die Chargennummer des Präparates, um die verwendeten Chargen nachverfolgen zu können.
Ihr Arzt kann Ihnen empfehlen, einen angemessenen Impfschutz (Hepatitis A und B) vorzunehmen, wenn Sie regelmäßig Präparate aus menschlichem Blut oder Plasma (z.B. VWF/FVIII-haltige Präparate) erhalten.
Von Willebrand-Erkrankung
- siehe Abschnitt 4. (Von Willebrand-Erkrankung) für Nebenwirkungen, die bei der Behandlung der von Willebrand-Erkrankung auftreten können.
Hämophilie A
- siehe Abschnitt 4. (Hämophilie A) für Nebenwirkungen, die bei der Behandlung der Hämophilie A auftreten können.
Anwendung von Wilate zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker wenn Sie andere Arzneimittel anwenden, kürzlich andere Arzneimittel angewendet haben oder beabsichtigen andere Arzneimittel anzuwenden.
Obwohl Wechselwirkungen mit anderen Arzneimitteln nicht bekannt sind, informieren Sie bitte Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen/anwenden bzw. vor kurzem eingenommen/angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
Wilate darf während der Injektion nicht mit anderen Medikamenten gemischt werden.
Schwangerschaft,Stillzeit und Zeugungs-/Gebärfähigkeit
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker um Rat.
Wilate enthält Natrium
Wilate 500 enthält pro Flasche bis zu 2,55 mmol (58,7 mg) Natrium. Wilate 1000 enthält pro Flasche bis zu 5,1 mmol (117,3 mg) Natrium. Dies ist zu berücksichtigen, wenn Sie auf eine natriumarme Ernährung achten müssen.
3. Wie ist Wilate anzuwenden?
Wilate wird nach Auflösen im beigefügten Lösungsmittel in eine Vene injiziert (intravenöse Verabreichung). Die Behandlung sollte unter ärztlicher Kontrolle begonnen werden. Siehe auch Anleitung zur Behandlung.
Dosierung
Ihr Arzt wird Sie über Ihre individuelle Dosierung und Behandlungshäufigkeit, mit der Wilate angewendet wird, informieren. Wenden Sie Wilate immer genau nach Anweisung des Arztes an. Bitte fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht ganz sicher sind.
Wenn Sie eine größere Menge Wilate angewendet haben, als Sie sollten
Symptome einer Überdosierung mit VWF oder FVIII vom Menschen wurden bislang nicht beobachtet. Jedoch sollte die empfohlene Dosierung nicht überschritten werden.
Wenden Sie nicht die doppelte Dosis an, wenn Sie die vorherige Anwendung vergessen haben.
Wenn Sie weitere Fragen zur Anwendung des Arzneimittels haben, fragen Sie Ihren Arzt oder Apotheker.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann Wilate Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Gelegentlich wurden Überempfindlichkeitsreaktionen oder allergische Reaktionen beobachtet. Folgende Symptome können auftreten:
■ Brennen und Stechen an der Injektionsstelle
■ Schüttelfrost
■ Hitzegefühl
■ Kopfschmerzen
■ Quaddelbildung (Nesselsucht)
■ niedriger Blutdruck (Hypotonie)
■ Antriebslosigkeit
■ Übelkeit
■ nervöse Unruhe
■ Herzrasen
■ Engegefühl in der Brust
■ Kribbeln auf der Haut
■ Erbrechen
■ keuchende Atmung
■ plötzliche Schwellungen, die an verschiedenen Stellen des Körpers auftreten können (Angioödem)
Wenn Sie eines der o.g. Symptome bemerken, benachrichtigen Sie bitte Ihren Arzt.
■ Wenn Sie die folgenden Symptome eines Angioödems bemerken, unterbrechen Sie bitte sofort die Injektion und suchen Sie Ihren Arzt auf:
o geschwollenes Gesicht, Zunge oder Rachen
o Schluckbeschwerden
o Quaddelbildung (Nesselsucht) mit Atembeschwerden
■ In seltenen Fällen wurde Fieber beobachtet
■ In sehr seltenen Fällen können sich Überempfindlichkeitsreaktionen zu einer akuten allergischen Allgemeinreaktion (Anaphylaxie) entwickeln (d.h. einzelne oder alle genannten Symptome entwickeln sich sehr rasch und treten mit großer Intensität auf), die mit Schock einhergehen kann. Im Falle eines anaphylaktischen Schocks muss eine entsprechende Schockbehandlung durchgeführt werden.
Von Willebrand-Erkrankung
• Bei der Verwendung von FVIII-haltigen von Willebrandfaktor-Präparaten zur Behandlung der von Willebrand-Erkrankung kann eine längere Behandlung einen extremen Anstieg des FVIII-Gehaltes im Blut verursachen. Dies kann das Risiko einer Störung der Blutzirkulation erhöhen (Thrombose).
Wenn bei Ihnen bereits klinische oder labordiagnostische Risikofaktoren bestehen, sollten Sie auf frühe Anzeichen einer Thrombose überwacht werden. In diesem Fall kann Ihr Arzt Maßnahmen zur Vorbeugung von thrombotischen Ereignissen gemäß den aktuellen Richtlinien ergreifen.
• Patienten mit von Willebrand-Erkrankung (speziell Typ 3) können Inhibitoren (neutralisierende Antikörper) gegen den VWF entwickeln. In diesem sehr seltenen Fall können die Inhibitoren die Wirkung von Wilate beeinträchtigen.
Falls Ihre Blutung trotz verordneter Dosierung andauert, sollte Ihr Blut auf diese Inhibitoren getestet werden.
Inhibitoren können das Risiko einer schweren allergischen Reaktion (anaphylaktischer Schock) erhöhen. Wenn Sie allergische Reaktionen erleiden, sollte Ihr Blut auf Inhibitoren getestet werden.
Sollten in Ihrem Blut Inhibitoren festgestellt werden, kontaktieren Sie einen Arzt mit Erfahrung in der Behandlung von Patienten mit Gerinnungsstörungen. Bei Patienten, deren Blut einen hohen Inhibitorgehalt aufzeigt, sollte eine andere Art der Behandlung in Erwägung gezogen werden.
Hämophilie A
• Die Bildung von Inhibitoren (neutralisierende Antikörper) ist eine bekannte Komplikation bei Patienten mit Hämophilie A, die mit FVIII behandelt werden. In diesen seltenen Fällen kann die Wirkung von Wilate beeinträchtigt sein und die Blutung kann andauern. Kontaktieren Sie ein spezialisiertes Hämophiliezentrum, wenn Wilate Ihre Blutung nicht stoppen kann. Regelmäßige Bluttests zur Feststellung eines Inhibitors werden in diesem Fall durchgeführt.
Inhibitoren können das Risiko einer schweren allergischen Reaktion (anaphylaktischer Schock) erhöhen. Wenn Sie allergische Reaktionen erleiden, sollte Ihr Blut auf Inhibitoren getestet werden.
Gelegentlich: betrifft 1 bis 10 Patienten von 1.000
Selten: betrifft 1 bis 10 Patienten von 10.000
Sehr selten: betrifft weniger als 1 Patienten von 10.000
Zur Anwendung von Wilate bei bislang unbehandelten Patienten liegen keine ausreichenden Daten vor.
Zur Anwendung von Wilate bei Kindern unter 6 Jahren liegen keine ausreichenden Daten vor.
Information zur Virussicherheit, siehe Punkt 2 (Besondere Vorsicht bei der Anwendung).
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Straße 51-59, 63225 Langen, Telefon: +49 6103 77 0, Telefax: +49 6103 77 1234, Website: www.pei.de anzeigen.
Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, das mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist Wilate aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Pulver und Lösungsmittel im Kühlschrank lagern (+ 2°C bis +8°C).
Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Sie dürfen das Arzneimittel nach dem auf dem Karton und dem Etikett nach „verwendbar bis" angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats
Wilate kann auch bei Raumtemperatur (bis max. 25°C) 2 Monate aufbewahrt werden.
In diesem Fall läuft die Haltbarkeit des Produktes 2 Monate nach der ersten Entnahme aus dem Kühlschrank ab. Das neue Haltbarkeitsdatum muss vom Patienten außen auf dem Karton vermerkt werden.
Das Pulver darf erst unmittelbar vor der Injektion aufgelöst werden.
Die Haltbarkeit der gebrauchsfertigen Lösung wurde für 4 Stunden bei Raumtemperatur (bis max. 25°C) nachgewiesen. Aus mikrobiologischer Sicht ist die gebrauchsfertige Lösung jedoch umgehend nach Herstellung zu verwenden.
Die gebrauchsfertige Lösung ist nur zum einmaligen Gebrauch bestimmt. Nicht verbrauchte Lösung verwerfen.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
6. Inhalt der Packung und weitere Informationen
Was Wilate enthält
- Die Wirkstoffe sind: von Willebrand-Faktor vom Menschen und Blutgerinnungsfaktor VIII
vom Menschen in Kombination.
- Die sonstigen Bestandteile sind: Natriumchlorid, Glycin, Saccharose, Natriumcitrat und
Calciumchlorid. Lösungsmittel: Wasser für Injektionszwecke mit 0,1% Polysorbat 80.
Wie Wilate aussieht und Inhalt der Packung
Pulver, gefriergetrocknet: weißes oder leicht gelbliches Pulver oder krümelige Substanz.
Gebrauchsfertige Lösung: klar bis leicht schillernd.
Wilate besteht aus einem Pulver und Lösungsmittel zur Herstellung einer intravenösen
Injektionslösung. Es ist in 2 Packungsgrößen erhältlich:
- Wilate 500, 500 I.E. VWF und 500 I.E. FVIII, Pulver und Lösungsmittel zur Herstellung einer intravenösen Injektionslösung, enthält nominal 500 I.E. VWF vom Menschen und 500 I.E. FVIII vom Menschen pro Flasche. Das Arzneimittel enthält etwa 100 I.E./ml VWF vom Menschen und 100 I.E./ml FVIII vom Menschen nach Auflösen in 5 ml Wasser für Injektionszwecke mit 0,1% Polysorbat 80 (Lösungsmittel).
- Wilate 1000, 1000 I.E. VWF und 1000 I.E. FVIII, Pulver und Lösungsmittel zur Herstellung einer intravenösen Injektionslösung, enthält nominal 1000 I.E. VWF vom Menschen und 1000 I.E. FVIII vom Menschen pro Flasche. Das Arzneimittel enthält etwa 100 I.E./ml VWF vom Menschen und 100 I.E./ml FVIII vom Menschen nach Auflösen in 10 ml Wasser für Injektionszwecke mit 0,1% Polysorbat 80 (Lösungsmittel).
Inhalt der Packung
1 Durchstechflasche mit gefriergetrocknetem Pulver 1 Durchstechflasche mit Lösungsmittel
1 Gerätesatz bestehend aus 1 Transferset [Mix2VialTM], 1 Flügelkanüle, 1 Einmalspritze
2 Alkoholtupfer
Pharmazeutischer Unternehmer und Hersteller
OCTAPHARMA GmbH Niederlassung Dessau
Elisabeth-Selbert-Str. 11 Otto-Reuter-Str. 3
40764 Langenfeld 06847 Dessau-Roßlau
Tel.: 02173-917-0 Tel.: 0340-5508-0
Fax: 02173-917-111 Fax: 0800-2896-282
E-Mail: info@octapharma.de E-Mail: vertrieb@octapharma.de
Falls weitere Informationen über das Arzneimittel gewünscht werden, setzen Sie sich bitte mit dem pharmazeutischen Unternehmer in Verbindung.
Diese Packungsbeilage wurde zuletzt überarbeitet im August 2014.
Herkunftsland des Blutplasmas: Deutschland, Estland, Finnland, Kroatien, Luxemburg, Norwegen, Österreich, Portugal, Schweden, Schweiz, Slowenien, Spanien, Tschechische Republik, Ungarn, USA
Wilate 500: Zul.-Nr.: PEI.H.01918.03.1 Wilate 1000: Zul.-Nr.: PEI.H.01918.04.1
Es wird auf die Dokumentationspflicht gemäß Transfusionsgesetz hingewiesen.
Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:
Österreich, Belgien, Bulgarien, Zypern, Tschechische Republik, Estland, Deutschland, Griechenland, Ungarn, Irland, Italien, Lettland, Litauen, Luxemburg, Niederlande, Polen, Portugal, Rumänien, Slowenien, Slowakei, Spanien, Vereinigtes Königreich: Wilate 500/Wilate 1000
Finnland, Norwegen, Schweden: Wilate Dänemark: Wilnativ
Anleitung zur Behandlung
• Bitte lesen Sie alle Anweisungen durch und befolgen Sie sie sorgfältig.
• Verwenden Sie Wilate nicht mehr nach dem Verfalldatum, das auf dem Etikett und dem Umkarton angegeben ist.
• Bitte achten Sie bei allen Arbeitsschritten strikt auf Hygiene.
• Die gebrauchsfertige Injektionslösung in der Spritze ist klar oder leicht schillernd (opaleszent). Verwenden Sie keine Lösungen, die trübe aussehen oder Rückstände enthalten.
• Das gebrauchsfertige Präparat unmittelbar nach dem Auflösen verwenden, um mikrobielle Verunreinigungen zu verhindern.
• Verwenden Sie bitte ausschließlich das mitgelieferte Injektionszubehör. Die Anwendung anderer Injektions-/Infusionsbestecke kann mit Risiken verbunden sein oder die Wirksamkeit beeinträchtigen.
Anleitung für das Auflösen:
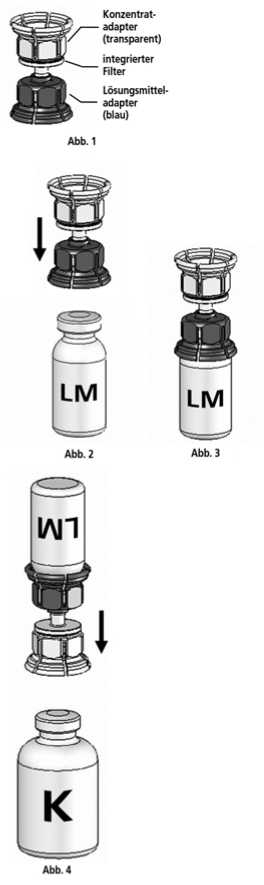
1. Lösungsmittel und Konzentrat in den ungeöffneten Flaschen auf Zimmertemperatur bringen. Nicht direkt aus dem Kühlschrank verwenden.
2. Die Schutzkappen von der Konzentratflasche und Lösungsmittelflasche entfernen und die Gummistopfen beider Flaschen mit einem Alkoholtupfer desinfizieren.
3. Die Lösungsmittelflasche auf eine feste, ebene Fläche stellen. Das in Abb. 1 beschriebene Mix2VialTM-Set mit dem blauen Adapter auf die Lösungsmittelflasche (LM) aufsetzen und bis zum Anschlag nach unten drücken (Abb. 2+3).
4. Die Konzentratflasche (K) auf eine feste, ebene Fläche stellen. Die Lösungsmittelflasche (LM) mit dem Mix2Vial™-Set umdrehen und senkrecht mit dem transparenten Ende auf die Konzentratflasche (K) aufsetzen und bis zum Anschlag nach unten drücken (Abb. 4). Das Vakuum in der Konzentratflasche saugt das Lösungsmittel an.
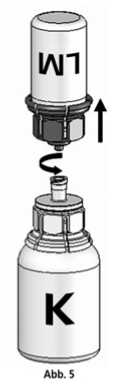
5. Die Konzentratflasche mit Mix2VialTM-Set und der verbundenen Lösungsmittelflasche leicht schwenken (nicht schütteln) bis das Produkt vollständig gelöst ist. Das Konzentrat löst sich bei Zimmertemperatur spätestens nach 10 Minuten vollständig. Dabei ist eine leichte Schaumbildung möglich, die sich auflösen wird. Die Lösungsmittelflasche zusammen mit dem blauen Adapter von der Konzentratflasche abdrehen (Abb. 5) und die Lösungsmittelflasche mit dem blauen Adapter verwerfen.
Injektion:
Der Puls sollte vor und während der Injektion gemessen werden. Eine deutliche Erhöhung der Pulsfrequenz klingt normalerweise nach Verlangsamen oder Unterbrechen der Injektion schnell wieder ab.
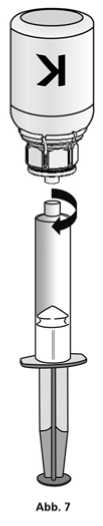
1. Die Spritze mit dem transparenten Adapter der Konzentratflasche verbinden. Die Flasche samt Einmalspritze umdrehen und das aufgelöste Präparat in die Spritze aufziehen (Abb. 6).
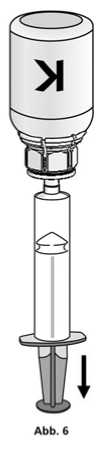
Die Injektionslösung in der Spritze sollte klar oder leicht schillernd sein. Nachdem das Produkt in die Spritze überführt wurde, den Spritzenzylinder fassen und die Spritze vom transparenten Adapter der Konzentratflasche entfernen (Abb. 7). Verwerfen Sie die Konzentratflasche mit dem Adapter.
c\j co
Vorgesehene Injektionsstelle mit einem Alkoholtupfer desinfizieren.
Die beigepackte Flügelkanüle auf die Spritze aufsetzen.
Stechen Sie die Flügelkanüle in die gewählte Vene. Wenn Sie die Vene vor der Punktion gestaut haben, damit Sie sie besser sehen können, müssen Sie die Stauung öffnen, bevor Sie mit der Injektion beginnen. Es darf kein Blut in die Spritze gelangen, da dies zur Bildung von Blutgerinnseln führen könnte.
5. Injizieren Sie die Lösung langsam in die Vene, wobei die Injektionsgeschwindigkeit höchstens 2 - 3 ml pro Minute betragen sollte.
Wenn Sie mehr als eine Flasche des Konzentrates benötigen, kann die Flügelkanüle in der Vene belassen werden. Zum Herstellen der gebrauchsfertigen Lösung immer ein neues Mix2Vial™-Set benutzen.
Nicht verbrauchte Lösung und Abfallmaterialien müssen entsprechend den gültigen Vorschriften entsorgt werden.
Wilate sollte nicht mit anderen Medikamenten gemischt oder gleichzeitig mit anderen intravenösen Zubereitungen im gleichen Schlauchsystem verabreicht werden.
Zur intravenösen Gabe soll ausschließlich das beigefügte Injektionsset verwendet werden, da eine Adsorption von VWF/FVIII an den Innenoberflächen nicht geeigneter Injektionssets nicht ausgeschlossen werden kann.
11 /11