Wilate 900
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
Wilate 450, 450 I.E. FVIII/400 I.E. VWF, Pulver und Lösungsmittel zur Herstellung einer intravenösen Injektionslösung
Wilate 900, 900 I.E. FVIII/800 I.E. VWF, Pulver und Lösungsmittel zur Herstellung einer intravenösen Injektionslösung
Blutgerinnungsfaktor VIII vom Menschen/von Willebrand-Faktor vom Menschen
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Anwendung dieses Arzneimittels beginnen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese dieselben Symptome haben wie Sie.
- Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker.
Diese Packungsbeilage beinhaltet:
1. Was ist Wilate und wofür wird es angewendet?
2. Was müssen Sie vor der Anwendung von Wilate beachten?
3. Wie ist Wilate anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Wilate aufzubewahren?
6. Weitere Informationen
1. WAS IST WILATE UND WOFÜR WIRD ES ANGEWENDET?
Wilate gehört zur Arzneimittelgruppe der sog. Gerinnungsfaktoren. Es enthält die Blutgerinnungsfaktoren VIII (FVIII) und von Willebrand-Faktor (VWF) vom Menschen. Zusammen sind diese beiden Eiweiße (Proteine) an der Blutgerinnung beteiligt.
Von Willebrand-Erkrankung
Wilate dient zur Behandlung und Vorbeugung von Blutungen bei Patienten mit der von Willebrand-Erkrankung. Die von Willebrand-Erkrankung ist ein Sammelbegriff für verschiedene Ausprägungstypen einer Krankheit. Alle Typen der von Willebrand-Erkrankung sind angeboren. Bei dieser Erkrankung können Blutungen länger andauern als im Normalfall. Die Ursache ist entweder ein Mangel an VWF im Blut oder eine Funktionsstörung des vorhandenen VWF.
Hämophilie A
Wilate dient zur Behandlung und Vorbeugung von Blutungen bei Patienten mit Hämophilie A (Bluterkrankheit). Bei dieser Erkrankung können Blutungen länger andauern als im Normalfall. Die Ursache liegt in einem angeborenen Mangel an FVIII im Blut.
Wilate darf nicht angewendet werden, wenn:
Sie überempfindlich (allergisch) gegen den FVIII oder den VWF vom Menschen bzw. gegen einen der sonstigen Bestandteile von Wilate reagieren.
Besondere Vorsicht bei der Anwendung von Wilate ist in folgenden Fällen erforderlich:
• Alle Arzneimittel, die wie Wilate aus menschlichem Blut (enthält Proteine) hergestellt und die in eine Vene injiziert werden (intravenöse Verabreichung), können allergische Reaktionen auslösen. Bitte achten Sie auf frühe Zeichen einer allergischen Reaktion (Hypersensitivität):
- Quaddelbildung (Nesselsucht)
- Hautausschlag
- Engegefühl in der Brust
- keuchende Atmung
- niedriger Blutdruck
- akute allergische Allgemeinreaktion (Anaphylaxie, d.h. einzelne oder alle genannten Symptome entwickeln sich sehr rasch und treten mit großer Intensität auf).
Wenn Sie diese Symptome bemerken, brechen Sie die Injektion sofort ab und benachrichtigen Sie Ihren Arzt.
• Während der Herstellung von Präparaten aus menschlichem Blut oder Plasma werden Maßnahmen ergriffen, um eine Infektion der Patienten zu verhindern. Diese Maßnahmen beinhalten die sorgfältige Auswahl der Blut- und Plasmaspender, um infektiöse Spender auszuschließen und die Testung jeder Spende und des Plasmapools auf Marker von Viren/Infektionen. Die Hersteller dieser Präparate haben zudem Maßnahmen eingeführt, die Viren inaktivieren oder entfernen.
Trotzdem kann die Möglichkeit der Übertragung von Infektionen bei der Anwendung von Arzneimitteln, die aus menschlichem Blut oder Plasma hergestellt wurden, nicht völlig ausgeschlossen werden. Dies gilt auch für unbekannte oder neu auftretende Viren oder andere infektiöse Erreger.
Die Maßnahmen werden als sicher für umhüllte Viren wie das humane Immundefizienzvirus (HIV), Hepatitis B-Virus (HBV), Hepatitis C-Virus (HCV) und für das nicht umhüllte Hepatitis A-Virus (HAV) angesehen.
Die Maßnahmen können von begrenzter Wirksamkeit gegen nicht umhüllte Viren wie Parvovirus B19 sein.
Eine Parvovirus B19-Infektion kann für schwangere Frauen (Infektionsrisiko für das Baby) und Patienten mit Immunschwäche oder einigen Arten von Blutarmut (z.B. Sichelzellanämie oder einem gesteigerten Abbau von roten Blutkörperchen) schwerwiegende Folgen haben.
• Notieren Sie bei jeder Verabreichung von Wilate den Namen und die Chargennummer des Präparates, um die verwendeten Chargen nachverfolgen zu können.
• Ihr Arzt kann Ihnen empfehlen, einen angemessenen Impfschutz (Hepatitis A und B) vorzunehmen, wenn Sie regelmäßig Präparate aus menschlichem Blut oder Plasma (z.B. FVIII/VWF-haltige Präparate) erhalten.
Von Willebrand-Erkrankung
- siehe Abschnitt 4. (Von Willebrand-Erkrankung) für Nebenwirkungen, die bei der Behandlung der von Willebrand-Erkrankung auftreten können.
Hämophilie A
- siehe Abschnitt 4. (Hämophilie A) für Nebenwirkungen, die bei der Behandlung der Hämophilie A auftreten können.
Bei Anwendung von Wilate mit anderen Arzneimitteln
Obwohl Wechselwirkungen mit anderen Arzneimitteln nicht bekannt sind, informieren Sie bitte Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen/anwenden bzw. vor kurzem eingenommen/angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
Wilate darf während der Injektion nicht mit anderen Medikamenten gemischt werden.
Schwangerschaft und Stillzeit
Fragen Sie vor der Anwendung von Wilate Ihren Arzt oder Apotheker um Rat.
Wichtige Informationen über bestimmte sonstige Bestandteile von Wilate
Wilate 450 enthält pro Flasche bis zu 2,55 mmol (58,7 mg) Natrium. Wilate 900 enthält pro Flasche bis zu 5,1 mmol (117,3 mg) Natrium. Dies ist zu berücksichtigen, wenn Sie auf eine natriumarme Ernährung achten müssen.
3. WIE IST WILATE ANZUWENDEN?
Wilate wird nach Auflösen im beigefügten Lösungsmittel in eine Vene injiziert (intravenöse Verabreichung). Die Behandlung sollte unter ärztlicher Kontrolle begonnen werden. Siehe auch Anleitung zur Behandlung.
Dosierung
Ihr Arzt wird Sie über Ihre individuelle Dosierung und Behandlungshäufigkeit, mit der Wilate angewendet wird, informieren. Wenden Sie Wilate immer genau nach Anweisung des Arztes an. Bitte fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht ganz sicher sind.
Wenn Sie eine größere Menge Wilate angewendet haben, als Sie sollten
Symptome einer Überdosierung mit FVIII oder VWF vom Menschen wurden bislang nicht beobachtet. Jedoch sollte die empfohlene Dosierung nicht überschritten werden.
Wenn Sie die Anwendung von Wilate vergessen haben
Wenden Sie nicht die doppelte Dosis an, wenn Sie die vorherige Anwendung vergessen haben.
Wenn Sie weitere Fragen zur Anwendung des Arzneimittels haben, fragen Sie Ihren Arzt oder Apotheker.
Wie alle Arzneimittel kann Wilate Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Gelegentlich wurden Überempfindlichkeitsreaktionen oder allergische Reaktionen beobachtet. Folgende Symptome können auftreten:
■ Brennen und Stechen an der Injektionsstelle
■ Schüttelfrost
■ Hitzegefühl
■ Kopfschmerzen
■ Quaddelbildung (Nesselsucht)
■ niedriger Blutdruck (Hypotonie)
■ Antriebslosigkeit
■ Übelkeit
■ nervöse Unruhe
■ Herzrasen
■ Engegefühl in der Brust
■ Kribbeln auf der Haut
■ Erbrechen
■ keuchende Atmung
■ plötzliche Schwellungen, die an verschiedenen Stellen des Körpers auftreten können (Angioödem)
Wenn Sie eines der o.g. Symptome bemerken, benachrichtigen Sie bitte Ihren Arzt.
■ Wenn Sie die folgenden Symptome eines Angioödems bemerken, unterbrechen Sie bitte sofort die Injektion und suchen Sie Ihren Arzt auf:
o geschwollenes Gesicht, Zunge oder Rachen
o Schluckbeschwerden
o Quaddelbildung (Nesselsucht) mit Atembeschwerden
■ In seltenen Fällen wurde Fieber beobachtet
■ In sehr seltenen Fällen können sich Überempfindlichkeitsreaktionen zu einer akuten allergischen Allgemeinreaktion (Anaphylaxie) entwickeln (d.h. einzelne oder alle genannten Symptome entwickeln sich sehr rasch und treten mit großer Intensität auf), die mit Schock einhergehen kann. Im Falle eines anaphylaktischen Schocks muss eine entsprechende Schockbehandlung durchgeführt werden.
Von Willebrand-Erkrankung
• Bei der Verwendung von FVIII-haltigen von Willebrandfaktor-Präparaten zur Behandlung der von Willebrand-Erkrankung kann eine längere Behandlung einen extremen Anstieg des FVIII-Gehaltes im Blut verursachen. Dies kann das Risiko einer Störung der Blutzirkulation erhöhen (Thrombose).
Wenn bei Ihnen bereits klinische oder labordiagnostische Risikofaktoren bestehen, sollten Sie auf frühe Anzeichen einer Thrombose überwacht werden. In diesem Fall kann
Ihr Arzt Maßnahmen zur Vorbeugung von thrombotischen Ereignissen gemäß den aktuellen Richtlinien ergreifen.
• Patienten mit von Willebrand-Erkrankung (speziell Typ 3) können Inhibitoren (neutralisierende Antikörper) gegen den VWF entwickeln. In diesem sehr seltenen Fall können die Inhibitoren die Wirkung von Wilate beeinträchtigen.
Falls Ihre Blutung trotz verordneter Dosierung andauert, sollte Ihr Blut auf diese Inhibitoren getestet werden.
Inhibitoren können das Risiko einer schweren allergischen Reaktion (anaphylaktischer Schock) erhöhen. Wenn Sie allergische Reaktionen erleiden, sollte Ihr Blut auf Inhibitoren getestet werden.
Sollten in Ihrem Blut Inhibitoren festgestellt werden, kontaktieren Sie einen Arzt mit Erfahrung in der Behandlung von Patienten mit Gerinnungsstörungen. Bei Patienten, deren Blut einen hohen Inhibitorengehalt aufzeigt, sollte eine andere Art der Behandlung in Erwägung gezogen werden.
Hämophilie A
• Die Bildung von Inhibitoren (neutralisierende Antikörper) ist eine bekannte Komplikation bei Patienten mit Hämophilie A, die mit FVIII behandelt werden. In diesen seltenen Fällen kann die Wirkung von Wilate beeinträchtigt sein und die Blutung kann andauern. Kontaktieren Sie ein spezialisiertes Hämophiliezentrum, wenn Wilate Ihre Blutung nicht stoppen kann. Regelmäßige Bluttests zur Feststellung eines Inhibitors werden in diesem Fall durchgeführt.
Inhibitoren können das Risiko einer schweren allergischen Reaktion (anaphylaktischer Schock) erhöhen. Wenn Sie allergische Reaktionen erleiden, sollte Ihr Blut auf Inhibitoren getestet werden.
Gelegentlich: mehr als 1 von 1.000, aber weniger als 1 von 100 Patienten Selten: mehr als 1 von 10.000, aber weniger als 1 von 1.000 Patienten Sehr selten: weniger als 1 von 10.000 Patienten und Einzelfälle
Zur Anwendung von Wilate bei bislang unbehandelten Patienten sind bisher keine ausreichenden Daten vorhanden.
Zur Anwendung von Wilate bei Kindern unter 6 Jahren sind bisher keine ausreichenden Daten vorhanden.
Information zur Virussicherheit, siehe unter Punkt 2 (Besondere Vorsicht bei der Anwendung).
Informieren Sie bitte Ihren Arzt oder Apotheker, wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind.
5. WIE IST WILATE AUFZUBEWAHREN?
Arzneimittel für Kinder unzugänglich aufbewahren.
Pulver und Lösungsmittel bei + 2°C bis +8°C (im Kühlschrank) lagern.
Nicht einfrieren.
Beide Flaschen im Originalkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Sie dürfen das Arzneimittel nach dem auf dem Karton und dem Etikett angegebenen Verfalldatum (verwendbar bis) nicht mehr anwenden.
Wilate kann auch bei Raumtemperatur (bis max. 25°C) 2 Monate aufbewahrt werden.
In diesem Fall läuft die Haltbarkeit des Produktes 2 Monate nach der ersten Entnahme aus dem Kühlschrank ab. Das neue Haltbarkeitsdatum muss vom Patienten außen auf dem Karton vermerkt werden.
Das Pulver darf erst unmittelbar vor der Injektion aufgelöst werden.
Die Haltbarkeit der gebrauchsfertigen Lösung wurde für 12 Stunden bei Raumtemperatur (bis max. 25°C) nachgewiesen. Aus mikrobiologischer Sicht ist die gebrauchsfertige Lösung jedoch umgehend nach Herstellung zu verwenden.
Die gebrauchsfertige Lösung ist nur zum einmaligen Gebrauch bestimmt. Nicht verbrauchte Lösung verwerfen.
6. WEITERE INFORMATIONEN
Was Wilate enthält:
- Die Wirkstoffe sind: Blutgerinnungsfaktor VIII vom Menschen und von Willebrand-Faktor
vom Menschen in Kombination.
- Die sonstigen Bestandteile sind: Natriumchlorid, Glycin, Saccharose, Natriumcitrat und
Calciumchlorid. Lösungsmittel: Wasser für Injektionszwecke mit 0,1% Polysorbat 80.
Wie Wilate aussieht und Inhalt der Packung
Pulver, gefriergetrocknet: weißes oder leicht gelbliches Pulver oder krümelige Substanz.
Gebrauchsfertige Lösung: klar bis leicht schillernd.
Wilate besteht aus einem Pulver und Lösungsmittel zur Herstellung einer intravenösen
Injektionslösung. Es ist in 2 Packungsgrößen erhältlich:
- Wilate 450, 450 I.E. FVIII und 400 I.E. VWF, Pulver und Lösungsmittel zur Herstellung einer intravenösen Injektionslösung, enthält nominal 450 I.E. FVIII vom Menschen und 400 I.E. VWF vom Menschen pro Flasche. Das Arzneimittel enthält etwa 90 I.E./ml FVIII vom Menschen und 80 I.E./ml VWF vom Menschen nach Auflösen in 5 ml Wasser für Injektionszwecke mit 0,1% Polysorbat 80 (Lösungsmittel).
- Wilate 900, 900 I.E. FVIII und 800 I.E. VWF, Pulver und Lösungsmittel zur Herstellung einer intravenösen Injektionslösung, enthält nominal 900 I.E. FVIII vom Menschen und 800 I.E. VWF vom Menschen pro Flasche. Das Arzneimittel enthält etwa 90 I.E./ml FVIII
vom Menschen und 80 I.E./ml VWF vom Menschen nach Auflösen in 10 ml Wasser für Injektionszwecke mit 0,1% Polysorbat 80 (Lösungsmittel).
Inhalt der Packung
1 Durchstechflasche mit gefriergetrocknetem Pulver 1 Durchstechflasche mit Lösungsmittel
1 Gerätesatz bestehend aus 1 Überleitungskanüle, 1 Butterfly, 1 Filter, 1 Einmalspritze
2 Alkoholtupfer
Pharmazeutischer Unternehmer und Hersteller
OCTAPHARMA GmbH Niederlassung Dessau
Elisabeth-Selbert-Str. 11 Otto-Reuter-Str. 3
40764 Langenfeld 06847 Dessau-Roßlau
Tel.: 02173-917-0 Tel.: 0340-5508-0
Fax: 02173-917-111 Fax: 0800-2896-282
E-Mail: info@octapharma.de E-Mail: vertrieb@octapharma.de
Falls weitere Informationen über das Arzneimittel gewünscht werden, setzen Sie sich bitte mit dem pharmazeutischen Unternehmer in Verbindung.
Diese Gebrauchsinformation wurde zuletzt genehmigt im November 2010
Herkunftsland des Blutplasmas: Deutschland, Estland, Finnland, Luxemburg, Österreich, Polen, Schweden, Schweiz, Tschechische Republik, USA
Wilate 450: Zul.-Nr.: PEI.H.01918.01.1 Wilate 900: Zul.-Nr.: PEI.H.01918.02.1
Es wird auf die Dokumentationspflicht gemäß Transfusionsgesetz hingewiesen.
Lesen Sie sich die folgende Anleitung durch und befolgen Sie diese sorgfältig!
Anleitung zur Herstellung der Injektionslösung:
1. Lösungsmittel (LM) und Konzentrat (Wilate) in den ungeöffneten Flaschen auf Zimmertemperatur bringen. Wird zum Erwärmen des Lösungsmittels ein Wasserbad benutzt, muss sorgfältig darauf geachtet werden, dass das Wasser nicht mit den Gummistopfen (latexfrei) oder dem Verschluss der Flaschen in Berührung kommt. Die Temperatur des Wasserbades darf maximal 37°C betragen.
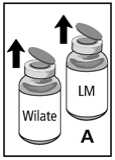
2. Die Schutzkappen von der Konzentratflasche und der Flasche mit Lösungsmittel entfernen (Abb. A) und die Gummistopfen beider Flaschen mit einem Alkoholtupfer desinfizieren.
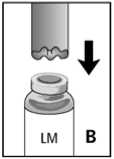
3. Die Lösungsmittelflasche auf eine ebene Unterlage stellen. Die Überleitungskanüle mit dem gewellten Rand auf die Lösungsmittelflasche aufsetzen ("Welle zum Wasser”) und bis zum Anschlag nach unten drücken (Abb. B).
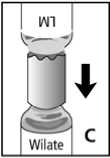
4. Die Konzentratflasche auf eine ebene Unterlage stellen. Danach die Schutzkappe von der Überleitungskanüle entfernen. Die freigelegte Nadel nicht berühren! Lösungsmittelflasche mit Überleitungskanüle drehen, die Nadel senkrecht durch das Zentrum des Gummistopfens der Konzentratflasche stechen und schnell bis zum Anschlag nach unten drücken (Abb. C). Das Vakuum in der Konzentratflasche saugt das Lösungsmittel an.
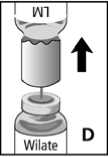
5. Lösungsmittelflasche samt Überleitungskanüle von der Konzentratflasche abziehen (Abb. D). Wilate löst sich schnell, daher braucht die Konzentratflasche nur leicht geschwenkt zu werden.
Die gebrauchsfertige Lösung sollte umgehend verwendet werden.
Die gebrauchsfertige Lösung ist klar bis leicht schillernd.
Trübe Lösungen oder Lösungen mit Rückständen dürfen nicht verwendet werden.
Injektion:
Als Sicherheitsmaßnahme sollte der Puls des Patienten vor und während der Injektion gemessen werden. Falls ein merklicher Anstieg der Pulsfrequenz festgestellt wird, sollte die Injektionsgeschwindigkeit verringert oder die Behandlung unterbrochen werden.
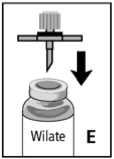
1. Schutzhülle von dem Filter abziehen. Den Filter durch den Gummistopfen der Konzentratflasche stechen (Abb. E).
2. Den Kolben der Einmalspritze zurückziehen, damit Luft in die Spritze gelangt.
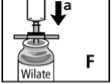
3. Den Verschluss von dem Filter abdrehen und die Einmalspritze auf den Filter aufsetzen (Abb. Fa).
4. Die Luft in die Flasche injizieren (Abb. Fb).
nen
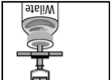
5. Flasche samt Einmalspritze umdrehen und das aufgelöste Präparat in die Spritze aufziehen (Abb. G).
6. Spritze von dem Filter abziehen.
7. Vorgesehene Injektionsstelle mit einem Alkoholtupfer reinigen.
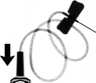
8. Die beigepackte Einmalkanüle (Butterfly) auf die Spritze aufsetzen (Abb. H) und das Präparat sofort intravenös injizieren. Injektionsgeschwindigkeit 2-3 ml pro Minute.
JK_-
9. Erhält der Patient mehr als eine Flasche des Konzentrates, kann die gleiche Einmalkanüle (Butterfly) verwendet werden. Die Spritze kann ebenfalls für mehrere Präparatflaschen benutzt werden. Allerdings ist zum Aufziehen der gebrauchsfertigen Lösung jedes Mal ein neuer Filter zu benutzen.
Nicht verwendete Arzneimittel oder Abfallmaterial sind entsprechend den nationalen Anforderungen zu entsorgen.
Wilate sollte nicht mit anderen Medikamenten gemischt oder gleichzeitig mit anderen intravenösen Zubereitungen im gleichen Schlauchsystem verabreicht werden.
Zur intravenösen Gabe soll ausschließlich das beigefügte Injektionsset verwendet werden, da eine Adsorption von FVIII/VWF an den Innenoberflächen nicht geeigneter Injektionssets nicht ausgeschlossen werden kann.
11