Willfact 500 I.e.
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
WILLFACT 500 I.E.
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Von-Willebrand-Faktor vom Menschen
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen.
• Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
• Wenn Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt oder Apotheker.
• Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
• Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Diese Packungsbeilage beinhaltet:
1. Was ist WILLFACT und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von WILLFACT beachten?
3. Wie ist WILLFACT anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist WILLFACT aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist WILLFACT und wofür wird es angewendet?
WILLFACT ist ein Mittel zum Stillen von Blutungen, das als Wirkstoff von-Willebrand-Faktor (vWF) vom Menschen enthält.
WILLFACT wird angewendet zur Vorbeugung und Behandlung von operationsbedingten oder sonstigen Blutungen bei Patienten mit von-Willebrand-Krankheit, bei denen eine alleinige Therapie mit Desmopressin (DDAVP) unwirksam ist oder Gegenanzeigen vorliegen.
2. Was sollten Sie vor der Anwendung von WILLFACT beachten?
Gegenanzeigen
WILLFACT darf nicht angewendet werden,
• wenn Sie überempfindlich (allergisch) gegen von-Willebrand-Faktor vom Menschen oder einen der sonstigen Bestandteile von WILLFACT sind.
• wenn Sie an Hämophilie A leiden.
Besondere Vorsicht bei der Anwendung von WILLFACT ist erforderlich:
Ihre Behandlung mit WILLFACT wird stets von einem Arzt überwacht, der Erfahrung in der Behandlung von Gerinnungsstörungen hat.
Wenn bei Ihnen eine akute Blutung auftritt und eine Blutuntersuchung ergibt, dass Ihr Faktor-VIII-Blutwert erniedrigt ist, erhalten Sie innerhalb der ersten zwölf Stunden das vWF-Präparat in Kombination mit einem Faktor-VIII-Präparat.
Allergische Reaktionen
Wie bei jedem aus menschlichem Blut oder Plasma gewonnenen Protein-Arzneimittel zur intravenösen Anwendung sind Uberempfindlichkeitsreaktionen in Form einer Allergie möglich. Während Ihrer Injektion werden Sie speziell daraufhin beobachtet, ob bei Ihnen Frühzeichen für Überempfindlichkeit auftreten, z. B. Quaddeln, Nesselsucht (generalisierte Urtikaria), Engegefühl in der Brust, Rasselgeräusche (Giemen), Blutdruckabfall (Hypotonie) und allergische, schockartige Reaktionen (Anaphylaxie). Wenn diese Symptome auftreten, wird die Injektion sofort abgebrochen.
Gefahr einer Thrombose
Es ist auch möglich, dass Blutgefäße durch Blutgerinnsel verstopft werden (Thrombosen). Diese Gefahr besteht besonders dann, wenn aus Ihrer medizinischen Vorgeschichte oder aus Ihren Laborwerten hervorgeht, dass Sie bestimmte Risikofaktoren aufweisen. In diesem Fall werden Sie besonders sorgfältig auf die Frühzeichen einer Thrombose hin überwacht, und es wird eine vorbeugende Behandlung (Prophylaxe) gegen Venenverschlüsse durch Blutgerinnsel eingeleitet.
Bei der Anwendung eines vWF-Präparats, das zusätzlich auch Faktor VIII enthält, muss Ihr Arzt beachten, dass die Behandlung auf Dauer zu einem übermäßigen Anstieg von FVIII:C im Blut führen kann. Wenn Sie ein solches FVIII-haltiges vWF-Präparat erhalten, wird Ihr Arzt Ihren FVIII:C-Plasmaspiegel regelmäßig überwachen. Damit wird sichergestellt, dass Ihr FVIII:C-Plasmaspiegel nicht dauerhaft überhöht ist, denn hierdurch könnte die Thrombosegefahr steigen.
Eingeschränkte Wirksamkeit
Es ist möglich, dass im Körper von Patienten mit von-Willebrand-Krankheit, insbesondere beim Erkrankungstyp III, Eiweißstoffe gebildet werden, die die Wirkung des vWF aufheben. Diese Eiweiße werden als Antikörper oder Inhibitoren bezeichnet. Wenn die Laborwerte entsprechende Hinweise ergeben, oder wenn die Blutung trotz einer eigentlich ausreichenden Dosis WILLFACT nicht aufhört, wird Ihr Arzt prüfen, ob bei Ihnen vWF-Inhibitoren gebildet werden. Liegen diese Inhibitoren in hoher Konzentration vor, ist eine Therapie mit vWF möglicherweise nicht wirksam, und es muss über andere Behandlungsmöglichkeiten nachgedacht werden. Auch die neue Behandlung erfolgt durch einen Arzt, der Erfahrung in der Behandlung von Gerinnungsstörungen hat.
Unbedenklichkeit der Ausgangsstoffe von WILLFACT (Plasma)
Die Anwendung von Arzneimitteln aus menschlichem Blut oder Plasma ist grundsätzlich mit der Gefahr von Infektionen verbunden. Dagegen werden verschiedene Standardmaßnahmen ergriffen; unter anderem die gezielte Auswahl der Spender, Kontrolluntersuchungen der Einzelspenden und des gesammelten PlasmaMaterials auf typische Infektionszeichen sowie Vorkehrungen zur Inaktivierung bzw. Entfernung von Viren bei der Verarbeitung. Dennoch lässt sich bei der Anwendung von Arzneimitteln, die aus menschlichem Blut oder Plasma gewonnen wurden, die Möglichkeit einer Übertragung von Infektionserregern nicht vollständig ausschließen. Das gilt auch für Infektionen durch unbekannte oder neu auftretende Viren und andere Krankheitserreger.
Die angewandten Maßnahmen gelten als sicher wirksam gegen „umhüllte“ Viren wie das HumanImmunschwäche-Virus (HIV), Hepatitis-B-Virus (HBV) oder Hepatitis-C-Virus (HCV). Die Wirkung der angewandten Maßnahmen gegen nicht umhüllte Viren wie Hepatitis-A-Virus und Parvovirus B19 ist möglicherweise begrenzt. Eine Infektion mit Parvovirus B19 kann für Schwangere (Ansteckung des Ungeborenen) und für Menschen mit Immunschwäche oder bestimmten Formen der Blutarmut schwerwiegende Folgen haben.
Impfungen
Wenn Sie regelmäßig mit von-Willebrand-Faktor aus menschlichem Plasma behandelt werden, werden entsprechende Impfungen (Hepatitis A und Hepatitis B) empfohlen.
Aufzeichnen der Chargennummer
Bei jeder Anwendung von WILLFACT notiert der Arzt oder einer seiner Mitarbeiter den Namen und die Chargennummer des Arzneimittels, um im Bedarfsfall nachvollziehen zu können, welche Packung(en) Sie genau erhalten haben. Die Chargennummer gibt an, in welchem Herstellungsgang die jeweilige Packung des Arzneimittels produziert wurde.
Bei Anwendung von WILLFACT mit anderen Arzneimitteln
Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen/anwenden bzw. vor kurzem eingenommen/angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
Bei Anwendung von WILLFACT zusammen mit Nahrungsmitteln und Getränken
Es sind keine Wechselwirkungen von vWF-Präparaten mit Nahrungsmitteln und Getränken bekannt. Sie
müssen also auf keine bestimmten Speisen oder Getränke verzichten.
Schwangerschaft und Stillzeit
WILLFACT darf während der Schwangerschaft und Stillzeit nur verwendet werden, wenn es unbedingt erforderlich ist. Die Unbedenklichkeit von WILLFACT während der Schwangerschaft und Stillzeit ist bisher nicht in kontrollierten klinischen Studien untersucht worden. Tierexperimentelle Studien sind unzureichend, um die Unbedenklichkeit bezüglich der Fruchtbarkeit und Schwangerschaft sowie der Entwicklung des Kindes vor, während und nach der Geburt zu beurteilen.
Fragen Sie vor der Anwendung von allen Arzneimitteln Ihren Arzt oder Apotheker um Rat. Verkehrstüchtigkeit und das Bedienen von Maschinen
Es wurden keine Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen beobachtet.
Wichtige Informationen über bestimmte sonstige Bestandteile von WILLFACT
Eine Durchstechflasche WILLFACT enthält 3,4 mg Natrium.
Wenn Sie eine kochsalzfreie oder kochsalzarme Diät einhalten müssen, sollten Sie dies berücksichtigen.
3. Wie ist WILLFACT anzuwenden?
Die Behandlung sollte nur unter Aufsicht eines in der Behandlung von Blutgerinnungsstörungen erfahrenen Arztes eingeleitet werden.
Dosierung
Die Höhe Ihrer Dosis ist von Ihrem Zustand und Ihrem Körpergewicht abhängig.
Zur Behandlung von Blutungen oder Verletzungen beträgt die erste WILLFACT-Dosis 40 bis 80 I.E./kg in Kombination mit der erforderlichen Menge des Faktor-VIII-Präparats und wird unmittelbar vor der Operation oder sobald wie möglich nach Einsetzen einer Blutung oder nach einem schweren Trauma verabreicht. Die erforderliche Menge des Faktor-VIII-Präparats wird anhand des Ausgangswerts Ihres FVIII:C-Plasmaspiegels so berechnet, dass ein entsprechender FVIII:C-Plasmaspiegel erreicht wird.
Wenn es erforderlich ist, erhalten Sie weitere Gaben von WILLFACT in einer Dosierung von 40 bis 80 I.E./kg täglich in Form von einer oder zwei Injektionen über einen oder mehrere Tage.
Auch zur langfristigen Vorbeugung kann WILLFACT eingesetzt werden; die Dosishöhe ist auch hierbei individuell verschieden. WILLFACT-Dosen zwischen 40 und 60 I.E./kg, zwei- bis dreimal wöchentlich gegeben, reduzieren die Anzahl der Blutungsepisoden.
Bitte sprechen Sie mit Ihrem Arzt, wenn Sie den Eindruck haben, dass die Wirkung von WILLFACT zu stark oder zu schwach ist.
Wenn Sie eine größere Menge WILLFACT angewendet haben, als Sie sollten:
Es liegen keine Berichte zu den Symptomen einer WILLFACT-Überdosierung vor.
Ein Thromboserisiko lässt sich jedoch bei einer erheblichen Überdosierung nicht ausschließen.
Wenn Sie weitere Fragen zur Anwendung des Arzneimittels haben, fragen Sie Ihren Arzt oder Apotheker.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann WILLFACT Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt.
Sehr häufig: Betrifft mehr als 1 Anwender von 10.
Häufig: Betrifft 1 bis 10 Anwender von 100.
Gelegentlich: Betrifft 1 bis 10 Anwender von 1.000.
Selten: Betrifft 1 bis 10 Anwender von 10.000.
Sehr selten: Betrifft weniger als 1 Anwender von 10.000.
Nicht bekannt: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar.
Obwohl die Sicherheit von WILLFACT als gut angesehen wird, können möglicherweise allergische oder anaphylaktische Reaktionen auftreten.
Folgende Nebenwirkungen traten „gelegentlich“ auf:
• Beschleunigter Herzschlag (Tachykardie)
• Engegefühl in der Brust
• Kopfschmerzen
• Ruhelosigkeit
• Kribbeln
• Rasselgeräusche (Giemen)
• Übelkeit
• Erbrechen
• Quincke-Ödem (Angioödem)
• Nesselsucht (generalisierte Urtikaria)
• Quaddeln
• Blutdruckabfall (Hypotonie)
• Brennen und Stechen an der Einstichstelle
• Schüttelfrost
• Rötung/Hitze
• Überempfindlichkeits- oder allergische Reaktionen
In einigen Fällen können sich die genannten Erscheinungen zu einer schweren allergischen Reaktion (Anaphylaxie) weiterentwickeln (mit Schock).
• Teilnahmslosigkeit (Lethargie)
Folgende Nebenwirkungen wurden „selten“ beobachtet:
• Fieber
Folgende Nebenwirkungen traten „sehr selten“ auf:
Antikörper (Inhibitoren) gegen vWF: Sehr selten kommt es vor, dass im Körper von Patienten mit von-Willebrand-Krankheit, insbesondere beim Erkrankungstyp III, Eiweißstoffe gebildet werden, die die Wirkung des vWF aufheben. Diese Eiweiße werden als Antikörper oder Inhibitoren bezeichnet. Während einer WILLFACT-Behandlung ist dies jedoch noch nie beobachtet worden. Patienten, die mit vWF behandelt werden, müssen vom Arzt mit Hilfe geeigneter klinischer Beobachtungen und Untersuchungen von Laborwerten sorgfältig auf das Auftreten von Inhibitoren hin überwacht werden. Treten derartige Inhibitoren auf, zeigt sich dies in Form eines unzureichenden klinischen Ansprechens. Die Antikörper bilden AntikörperAntigen-Komplexe und treten in Verbindung mit anaphylaktischen Reaktionen auf.
Nach der Behebung des Mangels an von-Willebrand-Faktor durch das Arzneimittel ist es in Situationen mit erhöhter Thrombosegefahr (nach Operationen, bei Bettlägerigkeit, bei Mangel entweder eines Gerinnungshemmers oder fibrinolytischer Enzyme) erforderlich, dass Sie auf Frühzeichen einer Thrombose oder allgemein erhöhten Gerinnungsaktivität in den Gefäßen überwacht werden und eine Vorbeugung gegen Thrombose erhalten.
Wenn Sie FVIII-haltige vWF-Präparate erhalten, kann aufgrund dauerhaft erhöhter FVIII:C-Plasmaspiegel auch die Thrombosegefahr steigen.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt über „Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Str. 51-59, 63225 Langen; Tel: +49 6103 77 0 ; Fax: +49 6103 77 1234; Webseite: www.pei.de“ anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist WILLFACT aufzubewahren?
• In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen. Nicht über 25°C lagern. Nicht einfrieren.
• Es wird empfohlen, das Arzneimittel unmittelbar nach der Rekonstitution zu verwenden. Die Stabilität wurde jedoch über einen Zeitraum von 24 Stunden bei 25°C nachgewiesen.
• Arzneimittel für Kinder unzugänglich aufbewahren.
• Sie dürfen das Arzneimittel nach dem auf dem Etikett der Durchstechflasche und dem Umkarton angegebenen Verfallsdatum nicht mehr anwenden.
• Sie dürfen WILLFACT nicht verwenden, wenn Sie bemerken, dass die Lösung Eintrübungen oder Ablagerungen aufweist.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
6. Inhalt der Packung und weitere Informationen Was WILLFACT enthält
Der Wirkstoff ist: Von-Willebrand-Faktor vom Menschen (500 I.E./Durchstechflasche), angegeben in Internationalen Einheiten (I.E.) der Ristocetin-Cofactor-Aktivität (vWF:RCo). Nach Rekonstitution mit 5 ml Wasser für Injektionszwecke enthält eine Durchstechflasche 100 I.E. von-Willebrand-Faktor vom Menschen pro 1 ml.
Vor Hinzufügen von Albumin ist die spezifische Aktivität größer oder gleich 50 I.E. von vWF:RCo/mg Protein.
Die sonstigen Bestandteile sind:
Pulver: Albumin vom Menschen, Argininhydrochlorid, Glycin, Natriumcitrat und Calciumchlorid-Dihydrat. Lösungsmittel: Wasser für Injektionszwecke.
Wie WILLFACT aussieht und Inhalt der Packung
WILLFACT liegt als Pulver und Lösungsmittel zur Herstellung einer Injektionslösung vor (500 I.E./5 ml). Eine Packung WILLFACT enthält eine Durchstechflasche mit 500 I.E. von-Willebrand-Faktor vom Menschen und eine Durchstechflasche mit 5 ml Wasser für Injektionszwecke zur Rekonstitution mit Transfersystem.
Pharmazeutischer Unternehmer und Hersteller
LFB-BIOMEDICAMENTS
3, avenue des Tropiques,
BP 305 - LES ULIS,
91958 Courtabreuf Cedex FRANKREICH
Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:
Dänemark
Deutschland
Estland
Lettland
Litauen
Norwegen
Österreich
Polen
Portugal
Schweden
Slowakische Republik
Slowenien
Spanien
Tschechische Republik Ungarn
Vereinigtes Königreich
Willfact
WILLFACT 500 I.E.
Willfact
Willfact
Willfact 100 TV/ ml, milteliai ir tirpiklis injekciniam tirpalui Willfact
Willfact 100 I.E./ml Pulver und Lösungsmittel zur Herstellung einer
Injektionslösung
Willfact
Willfact
Willfact
Willfact
Willefact 500 i.e Prasek in vehikel za raztopino za injiciranje
Willfact
Willfact
Willfact
Willfact
Diese Gebrauchsinformation wurde zuletzt genehmigt im Februar 2015.
Herkunftsländer des verwendeten Blutplasmas
Deutschland, Österreich und USA.
Die folgenden Informationen sind nur für Ärzte bzw. medizinisches Fachpersonal bestimmt Rekonstitution:
Die gegenwärtig geltenden Richtlinien für aseptische Verfahren sind einzuhalten. Das Transfersystemwird, wie unten beschrieben, nur zur Rekonstitution des Arzneimittels verwendet. Es ist nicht für die Verabreichung des Arzneimittels an den Patienten gedacht.

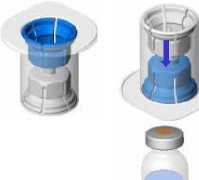


• Erwärmen Sie die beiden Durchstechflaschen (Pulver und Lösungsmittel) auf eine Temperatur von maximal 25 °C.
• Entfernen Sie die Schutzkappen von der Durchstechflasche mit Lösungsmittel (Wasser für Injektionszwecke) und der Durchstechflasche mit Pulver.
• Desinfizieren Sie die Oberfläche beider Stopfens.
• Entfernen Sie die Kappe vom Mix2Vial-Set. Befestigen Sie das Mix2Vial-Set mit dem blauen Adapter am Stopfen der Durchstechflasche mit Lösungsmittel ohne das Set aus seiner Verpackung zu nehmen.
• Entfernen Sie die Verpackung und werfen Sie sie weg. Achten Sie darauf, den nun frei gewordenen Teil des Sets nicht zu berühren.


• Drehen Sie die Lösungsmittelflasche mit dem aufgesetzten Set um und befestigen Sie dieses mit dem transparenten Adapter an der Durchstechflasche mit Pulver. Das Lösungsmittel fließt automatisch in die Durchstechflasche mit Pulver. Halten Sie die beiden Flaschen und schwenken Sie sie vorsichtig, bis das Produkt vollständig gelöst ist.
• Halten Sie nun die Flasche mit dem rekonstituierten Produkt in einer Hand und die Lösungsmittelflasche in der anderen Hand und schrauben Sie das Mix2Vial-Set auseinander, um die Durchstechflaschen zu trennen.
Das Pulver löst sich im Allgemeinen schnell und sollte sich in weniger als 10 Minuten vollständig gelöst haben.
Die Lösung sollte klar sein oder leicht opaleszierend und farblos oder leicht gelblich sein.
Anwendung:

• Halten Sie die Durchstechflasche mit dem rekonstituierten Produkt senkrecht, während Sie eine sterile Spritze mit dem Mix2Vial-Adapter verbinden. Danach ziehen Sie das Präparat langsam in die Spritze auf.
• Wenn das Präparat in die Spritze aufgezogen ist, halten Sie die Spritze (mit dem Kolben nach unten gerichtet) gut fest, schrauben den Mix2Vial-Adapter ab und ersetzen ihn durch eine intravenöse Nadel oder Flügelkanüle.
• Drücken Sie die Luft aus der Spritze und stechen Sie die Nadel nach Desinfektion der Punktionsstelle in die gewählte Vene.
• Injizieren Sie die Lösung unmittelbar nach der Rekonstitution langsam als Einzeldosis intravenös mit einer Höchstgeschwindigkeit von 4 ml/Minute.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.