Xalatan 0,005% Augentropfen
alt informationenPFIZER ((Logo))
Gebrauchsinformation: Information für den Anwender
Xalatan® 0,005 % Augentropfen
Augentropfen, Lösung Latanoprost
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen. Auch wenn Sie Xalatan oder ein ähnliches Arzneimittel schon vorher einmal angewendet haben, empfehlen wir Ihnen, diesen Text sorgfältig durchzulesen, da sich die Informationen möglicherweise geändert haben.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt, den Arzt, der Ihr Kind behandelt, oder Ihren Apotheker.
- Dieses Arzneimittel wurde Ihnen oder Ihrem Kind persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt, den Arzt, der Ihr Kind behandelt, oder Ihren Apotheker. Siehe Abschnitt 4.
Diese Packungsbeilage beinhaltet:
1. Was ist Xalatan und wofür wird es angewendet?
2. Was müssen Sie vor der Anwendung von Xalatan beachten?
3. Wie ist Xalatan anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Xalatan aufzubewahren?
6. Weitere Informationen
1. WAS IST XALATAN UND WOFÜR WIRD ES ANGEWENDET?
Xalatan gehört zu einer Gruppe von Arzneimitteln, die Prostaglandinanaloga genannt werden. Es wirkt, indem es den natürlichen Abfluss von Flüssigkeit aus dem Augeninneren in das Blut erhöht.
Xalatan wird zur Behandlung von Erkrankungen angewendet, die als Offenwinkelglaukom (Grüner Star) und okuläre Hypertension bekannt sind. Diese beiden Erkrankungen werden von erhöhtem Augeninnendruck begleitet, der möglicherweise Ihr Sehvermögen beeinträchtigen kann.
Weiterhin wird Xalatan zur Behandlung von erhöhtem Augeninnendruck und Glaukom bei Kindern und Säuglingen aller Altersstufen angewendet.
2. WAS MÜSSEN SIE VOR DER ANWENDUNG VON XALATAN BEACHTEN?
Xalatan kann von erwachsenen Männern und Frauen (auch von älteren Personen) und von Kindern ab der Geburt bis 18 Jahre angewendet werden. Bei Frühgeburten (weniger als
36 Schwangerschaftswochen) wurde Xalatan nicht untersucht.
Xalatan darf nicht angewendet werden:
• wenn Sie überempfindlich (allergisch) gegen Latanoprost oder einen der sonstigen Bestandteile von Xalatan sind (zu den sonstigen Bestandteilen Ihres Arzneimittels beachten Sie bitte den Abschnitt 6)
• wenn Sie schwanger sind oder versuchen, schwanger zu werden
• wenn Sie zurzeit stillen
Besondere Vorsicht bei der Anwendung von Xalatan ist erforderlich
Sprechen Sie vor der Anwendung von Xalatan mit Ihrem Arzt, dem Arzt, der Ihr Kind behandelt, oder Ihrem Apotheker, wenn Sie glauben, dass eine der folgenden Aussagen auf Sie oder Ihr Kind zutrifft:
• wenn bei Ihnen oder Ihrem Kind eine Augenoperation bevorsteht oder vor Kurzem durchgeführt wurde (einschließlich einer Operation wegen Grauem Star)
• wenn Sie oder Ihr Kind an Augenproblemen leiden (z. B. an Augenschmerzen, Augenirritationen, Augenentzündungen oder verschwommenes Sehen)
• wenn Sie oder Ihr Kind an trockenen Augen leiden
• wenn Sie oder Ihr Kind an schwerem Asthma leiden oder das Asthma nicht ausreichend behandelt ist
• wenn Sie oder Ihr Kind Kontaktlinsen tragen. Wenn Sie den Anweisungen für Träger von Kontaktlinsen im Abschnitt 3 folgen, können Sie Xalatan jedoch trotzdem anwenden
• wenn Sie derzeit oder in der Vergangenheit an einer viralen Augeninfektion erkrankt sind bzw. erkrankt waren, die durch das Herpes-simplex-Virus (HSV) verursacht wurde
Bei Anwendung von Xalatan zusammen mit anderen Arzneimitteln
Bei Anwendung von Xalatan kann es zu Wechselwirkungen mit anderen Arzneimitteln kommen. Bitte informieren Sie Ihren Arzt, den Arzt, der Ihr Kind behandelt, oder Ihren Apotheker, wenn Sie oder Ihr Kind andere Arzneimittel einnehmen/ anwenden bzw. vor Kurzem eingenommen/ angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
Schwangerschaft
Wenn Sie schwanger sind, dürfen Sie Xalatan nicht anwenden. Informieren Sie Ihren Arzt umgehend, wenn Sie schwanger sind, glauben, schwanger zu sein, oder wenn Sie eine Schwangerschaft planen.
Stillzeit
Wenn Sie stillen, dürfen Sie Xalatan nicht anwenden.
Verkehrstüchtigkeit und das Bedienen von Maschinen
Wenn Sie Xalatan anwenden, kann es bei Ihnen zu einer vorübergehenden Beeinträchtigung der Sicht kommen. Fahren Sie in diesem Fall kein Auto und benutzen Sie keine Werkzeuge oder Maschinen, bis Ihre Sicht wieder klar ist.
Wichtige Informationen über bestimmte sonstige Bestandteile von Xalatan
Xalatan enthält das Konservierungsmittel Benzalkoniumchlorid. Dieses Konservierungsmittel kann Reizungen am Auge oder Störungen auf der Oberfläche des Auges hervorrufen. Benzalkoniumchlorid kann von Kontaktlinsen aufgenommen werden und zur Verfärbung weicher Kontaktlinsen führen. Vermeiden Sie daher den Kontakt mit weichen Kontaktlinsen.
Wenn Sie oder Ihr Kind Kontaktlinsen tragen, sollten diese vor der Anwendung von Xalatan entfernt und frühestens 15 Minuten nach der Anwendung wieder eingesetzt werden. Beachten Sie die Anweisungen für Träger von Kontaktlinsen im Abschnitt 3.
3. WIE IST XALATAN ANZUWENDEN?
Wenden Sie Xalatan immer genau nach Anweisung Ihres Arztes oder des Arztes, der Ihr Kind behandelt, an. Bitte fragen Sie bei Ihrem Arzt oder dem Arzt, der Ihr Kind behandelt, oder Ihrem Apotheker nach, wenn Sie sich nicht ganz sicher sind.
Die übliche Dosis für Erwachsene (auch für ältere Personen) und Kinder beträgt täglich 1 Tropfen in jedes erkrankte Auge. Die Anwendung sollte möglichst am Abend erfolgen.
Wenden Sie Xalatan nicht häufiger als einmal täglich an, weil sich die Wirksamkeit bei häufigerer Anwendung verringern kann.
Wenden Sie Xalatan stets wie von Ihrem Arzt oder von dem Arzt, der Ihr Kind behandelt, verordnet an, bis er Ihnen sagt, dass Sie damit aufhören können.
Träger von Kontaktlinsen
Wenn Sie oder Ihr Kind Kontaktlinsen tragen, sollten diese vor der Anwendung von Xalatan entfernt und frühestens 15 Minuten nach der Anwendung wieder eingesetzt werden.
Anwendungshinweise
((Für Xalatan im Tropfbehältnis mit Schraubkappe und äußerer Schutzkappe))
1. Waschen Sie Ihre Hände und setzen oder stellen Sie sich bequem hin.
2. Schrauben Sie die äußere Schutzkappe von der Flasche ab (diese Kappe kann weggeworfen werden).
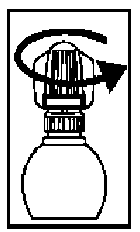
3. Schrauben Sie die Innenkappe der Flasche auf. Die Innenkappe bitte aufbewahren.
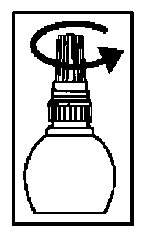
4. Ziehen Sie mit Ihrem Finger vorsichtig das untere Augenlid des erkrankten Auges nach unten.
5. Bringen Sie die Flaschenöffnung nahe an das Auge, ohne es zu berühren.
6. Drücken Sie die Flasche vorsichtig zusammen, so dass nur 1 Tropfen in Ihr Auge fällt. Lassen Sie dann Ihr Augenlid wieder los.
7. Drücken Sie 1 Minute lang mit einem Finger auf den inneren Augenwinkel neben der Nase. Halten Sie das Auge dabei geschlossen.
8. Wenn es Ihr Arzt verordnet hat, wiederholen Sie den Vorgang an Ihrem anderen Auge.
9. Verschließen Sie das Tropfbehältnis wieder mit der Innenkappe.
((Anwendungshinweise
[Für Xalatan im Tropfbehältnis mit Schraubkappe und Originalitätsverschluss]
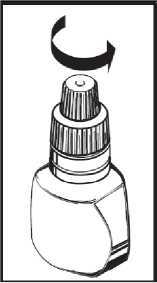
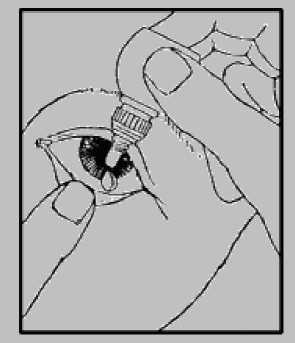
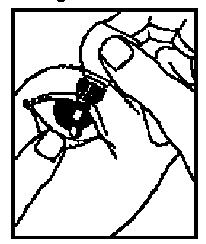
1. Waschen Sie Ihre Hände und setzen oder stellen Sie sich bequem hin.
2. Schrauben Sie die Schutzkappe ab. Die Schutzkappe muss aufbewahrt werden.
3. Ziehen Sie mit Ihrem Finger vorsichtig das untere Augenlid des erkrankten Auges nach unten.
4. Bringen Sie die Flaschenöffnung nahe an das Auge, ohne es zu berühren.
5. Drücken Sie die Flasche vorsichtig zusammen, sodass nur 1 Tropfen in Ihr Auge fällt. Lassen Sie dann Ihr Augenlid wieder los.
6. Drücken Sie 1 Minute lang mit einem Finger auf den inneren Augenwinkel neben der Nase. Halten Sie das Auge dabei geschlossen.
7. Wenn es Ihr Arzt verordnet hat, wiederholen Sie den Vorgang an Ihrem anderen Auge.
8. Verschließen Sie die Flasche wieder mit der Schutzkappe.))
Wenn Sie Xalatan zusammen mit anderen Augentropfen anwenden
Lassen Sie zwischen der Anwendung von Xalatan und anderen Augentropfen mindestens 5 Minuten vergehen.
Wenn Sie eine größere Menge von Xalatan angewendet haben, als Sie sollten
Sollten zu viele Tropfen in das Auge gelangt sein, kann es zu leichten Reizungen im Auge kommen. Die Augen können dann tränen und sich röten, was jedoch bald vorübergeht.
Wenn Sie deshalb besorgt sind, fragen Sie Ihren Arzt oder den Arzt, der Ihr Kind behandelt, um Rat.
Sollten Sie oder Ihr Kind Xalatan versehentlich verschluckt haben, wenden Sie sich bitte so schnell wie möglich an Ihren Arzt.
Wenn Sie die Anwendung von Xalatan vergessen haben
Führen Sie die Behandlung mit der nächsten Dosis zum normalen Zeitpunkt fort. Tropfen Sie keine doppelte Dosis ein, um die versäumte Dosis nachzuholen. Wenn Sie sich über irgendetwas unsicher sind, fragen Sie Ihren Arzt oder Apotheker um Rat.
Wenn Sie die Anwendung von Xalatan abbrechen
Wenn Sie die Anwendung von Xalatan abbrechen wollen, sollten Sie dies vorher mit Ihrem Arzt oder dem Arzt, der Ihr Kind behandelt, besprechen.
4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Wie alle Arzneimittel kann Xalatan Nebenwirkungen haben, die aber nicht bei jedem
auftreten müssen.
Folgende Nebenwirkungen sind bei der Anwendung von Xalatan bekannt:
Sehr häufig (kann mehr als 1 von 10 Behandelten betreffen):
• Durch einen erhöhten Anteil von braunem Farbstoff in der Iris, der farbigen Augenregion, kann sich Ihre Augenfarbe verändern. Wenn Sie gemischtfarbige Augen (blau-braune, grau-braune, gelb-braune oder grün-braune Augen) haben, ist es wahrscheinlicher, dass Sie derartige Veränderungen bemerken, als wenn Sie einfarbige Augen (blaue, graue, grüne oder braune Augen) haben. Veränderungen Ihrer Augenfarbe können sich über Jahre hinweg entwickeln, normalerweise treten sie jedoch innerhalb von 8 Behandlungsmonaten auf. Die Farbveränderung kann dauerhaft sein und auffälliger, wenn Sie Xalatan nur an einem Auge anwenden. Mit der Veränderung der Augenfarbe scheinen keine weiteren Probleme verbunden zu sein. Wenn die Behandlung mit Xalatan beendet wird, verändert sich die Augenfarbe nicht mehr.
• Rötung des Auges
• Augenreizungen wie Brennen, Jucken, Stechen und Fremdkörpergefühl
• Die Wimpern des behandelten Auges und die Flaumhaare um das behandelte Auge herum können sich zunehmend verändern, was hauptsächlich bei Behandelten mit japanischer Herkunft beobachtet wird. Dabei können Ihre Wimpern dunkler, länger, dicker und zahlreicher werden.
Häufig (kann bis zu 1 von 10 Behandelten betreffen):
• Irritationen oder Störungen der Augenoberfläche, Entzündung des Augenlidrandes (Blepharitis), Schmerzgefühl im Auge und Lichtempfindlichkeit (Photophobie)
Gelegentlich (kann bis zu 1 von 100 Behandelten betreffen):
• Geschwollenes Augenlid, trockenes Auge, Entzündung oder Irritationen der Augenoberfläche (Keratitis), verschwommenes Sehen und Bindehautentzündung (Konjunktivitis)
• Hautausschlag
Selten (kann bis zu 1 von 1 000 Behandelten betreffen):
• Entzündung der Iris, der farbigen Augenregion (Iritis/ Uveitis), Schwellungen der Netzhaut (Makulaödem), Beschwerden wie eine Schwellung oder ein Jucken/ Reizung der Augenoberfläche, Schwellungen im Bereich des Auges (periorbitale Ödeme), fehlgerichtet wachsende Wimpern, oder es kann sich eine zweite Reihe von Wimpernhärchen bilden
• Hautreaktionen auf dem Augenlid, Dunkelfärbung der Lidhaut
• Asthma, Verstärkung von bestehendem Asthma und Atemnot (Dyspnoe)
Sehr selten (kann bis zu 1 von 10 000 Behandelten betreffen):
• Brustenge (instabile Angina pectoris), Brustschmerzen, tiefliegend erscheinende Augen (Vertiefung des Oberlidsulkus)
Darüber hinaus wurden die folgenden Nebenwirkungen von Patienten berichtet:
• Mit Flüssigkeit gefüllter Hohlraum in der farbigen Augenregion (Iriszyste), Kopfschmerzen, Benommenheit, Wahrnehmung des Herzschlags (Palpitationen), Muskelschmerzen, Gelenkschmerzen und Entwicklung einer viralen Augeninfektion, die durch das Herpes-simplex-Virus (HSV) verursacht wurde
Die Nebenwirkungen, die im Vergleich mit Erwachsenen bei Kindern häufiger auftraten, sind eine laufende, juckende Nase und Fieber.
In sehr seltenen Fällen entwickelten Patienten mit ausgeprägten Hornhautdefekten unter der Therapie mit phosphathaltigen Augentropfen Trübungen der Hornhaut durch die Bildung von Kalziumphosphat.
Meldungen von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. WIE IST XALATAN AUFZUBEWAHREN?
Arzneimittel für Kinder unzugänglich aufbewahren.
Sie dürfen Xalatan nach dem auf der Faltschachtel und auf der Tropfflasche angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Ungeöffnete Flaschen dürfen bei Raumtemperatur (nicht über 25 °C) gelagert werden und müssen vor Licht geschützt werden.
Nach dem ersten Öffnen sollte die Flasche bei Raumtemperatur (nicht über 25 °C) gelagert und innerhalb von 4 Wochen aufgebraucht werden. Wenn Sie Xalatan nicht benutzen, ist die
Tropfflasche immer in der Faltschachtel aufzubewahren, um den Inhalt vor Licht zu schützen.
((Ungeöffnete Flaschen müssen im Kühlschrank (2 bis 8 °C) und vor Licht geschützt gelagert werden.
Nach dem ersten Öffnen ist es nicht mehr nötig, die Flasche im Kühlschrank aufzubewahren Sie sollte jedoch nicht über 25 °C gelagert und innerhalb von 4 Wochen aufgebraucht werden. Wenn Sie Xalatan nicht benutzen, ist die Tropfflasche immer in der Faltschachtel aufzubewahren, um den Inhalt vor Licht zu schützen.))
Das Arzneimittel darf nicht im Abwasser oder Haushaltsabfall entsorgt werden. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr benötigen. Diese Maßnahme hilft die Umwelt zu schützen.
6. WEITERE INFORMATIONEN Was Xalatan enthält
Der Wirkstoff ist 0,005 % (50 Mikrogramm/ml) Latanoprost.
Die sonstigen Bestandteile sind Benzalkoniumchlorid, Natriumchlorid (Ph.Eur.), Natriumdihydrogenphosphat 1 H2O (E 339a), Dinatriumhydrogenphosphat (E 339b) gelöst in Wasser für Injektionszwecke.
Wie Xalatan aussieht und Inhalt der Packung
Die Xalatan-Augentropfen-Lösung ist eine klare, farblose Flüssigkeit.
Xalatan ist in Packungsgrößen zu 1 Packung, 3 Packungen und 6 Packungen erhältlich. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Jede Packung enthält 1 Flasche Xalatan. Jede Flasche enthält 2,5 ml Xalatan-AugentropfenLösung.
Pharmazeutischer Unternehmer
PHARMACIA GmbH
Linkstr. 10
10785 Berlin
Tel.: 030 550055-51000
Fax: 030 550054-10000
Mitvertreiber
PFIZER PHARMA GmbH
Linkstr. 10
10785 Berlin
Tel.: 030 550055-51000
Fax: 030 550054-10000
Hersteller
Pfizer Manufacturing Belgium NV Rijksweg 12 2870 Puurs
Belgien
Diese Gebrauchsinformation wurde zuletzt überarbeitet im Januar 2014.
Notieren Sie sich hier das Datum des ersten Öffnens der Tropfflasche:
1. Tropfflasche:_
2. Tropfflasche:_
3. Tropfflasche:_
4. Tropfflasche:_
5. Tropfflasche:_
6. Tropfflasche:_
palde-4v25xt-at-0
palde-4v25xt-at-0 - 8 - 27.01.2014