Yanimo Respimat 2,5 Mikrogramm/2,5 Mikrogramm Pro Hub Lösung Zur Inhalation
F achinformation
Boehringer n| \v Ingelheim
1. BEZEICHNUNG DES ARZNEIMITTELS
Yanimo® Respimat® 2,5 Mikrogramm/2,5 Mikrogramm pro Hub Lösung zur Inhalation
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Die abgegebene Dosis beträgt 2,5 Mikrogramm Tiotropium (als Tiotropiumbromid 1 H2O) und 2,5 Mikrogramm Olodaterol (als Olodaterolhydrochlorid) pro Hub.
Die abgegebene Dosis ist die Menge, die für den Patienten nach Passieren des Mundstücks verfügbar ist.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Lösung zur Inhalation
Klare, farblose Lösung zur Inhalation
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Yanimo Respimat ist indiziert als Bronchodilatator zur Dauerbehandlung, um bei erwachsenen Patienten mit chronisch obstruktiver Lungenerkrankung (COPD) die Symptome zu lindern.
4.2 Dosierung und Art der Anwendung
Dosierung
Das Arzneimittel ist nur zur Inhalation bestimmt. Die Patrone kann nur in den Respimat Inhalator eingesetzt und mit diesem verwendet werden.
Eine therapeutische Dosis besteht aus 2 Hüben aus dem Respimat Inhalator.
Erwachsene
Die empfohlene Tagesdosis beträgt 5 Mikrogramm Tiotropium und 5 Mikrogramm Olodaterol, entsprechend der Inhalation von 2 Hüben aus dem Respimat Inhalator einmal täglich zur gleichen Tageszeit.
Die empfohlene Dosis sollte nicht überschritten werden.
Ältere Patienten
Ältere Patienten können Yanimo Respimat in der empfohlenen Dosis anwenden.
Leberfunktionsstörung und Nierenfunktionsstörung
Yanimo Respimat enthält Tiotropium, das vorwiegend renal ausgeschieden wird, sowie Olodaterol, das überwiegend in der Leber metabolisiert wird.
Leberfunktionsstörung
Patienten mit leichter und mittelgradiger Leberfunktionsstörung können Yanimo Respimat in der empfohlenen Dosis anwenden.
Zur Anwendung von Olodaterol bei Patienten mit schwerer Leberfunktionsstörung liegen keine Daten vor.
Nierenfunktionsstörung
Patienten mit einer Nierenfunktionsstörung können Yanimo Respimat in der empfohlenen Dosis anwenden.
Für Patienten mit mittelgradiger bis schwerer Nierenfunktionsstörung (Kreatinin-Clearance < 50 ml/min) bitte die Abschnitte 4.4 und 5.2 beachten.
Yanimo Respimat enthält Olodaterol. Bei Patienten mit schwerer Nierenfunktionsstörung gibt es nur begrenzte Erfahrungen mit der Anwendung von Olodaterol.
Kinder und Jugendliche
Es gibt keinen relevanten Nutzen von Yanimo Respimat bei Kindern und Jugendlichen unter 18 Jahren.
Art der Anwendung
Um die richtige Anwendung des Arzneimittels zu gewährleisten, soll der Patient von einem Arzt oder medizinisch-pharmazeutischem Fachpersonal im Gebrauch des Inhalators geschult werden.
Gebrauchsanweisung
Einleitung
Lesen Sie diese Gebrauchsanweisung, bevor Sie Yanimo Respimat zum ersten Mal anwenden. Wenden Sie diesen Inhalator einmal täglich an. Inhalieren Sie bei jeder Anwendung nacheinander 2 Hübe
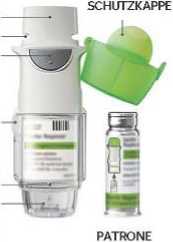
MUNDSTÜCK LUFTSCHLrTZE AUSLÖSER
ENTRIEGELUNGSTASTE
DURCHSICHTIGES GEHÄUSEUNTERTEIL DORN ZUM AUFSTECHEN DER PATRONE
• Wenn Sie den Yanimo Respimat länger als 7 Tage nicht benutzt haben, müssen Sie zunächst einen Sprühstoß in Richtung Boden abgeben.
• Wenn Sie den Yanimo Respimat länger als 21 Tage nicht benutzt haben, müssen Sie die Schritte 4 bis 6 erneut ausführen, wie unter “Vorbereitung für die erste Anwendung” beschrieben, bis eine sichtbare Sprühwolke austritt. Wiederholen Sie dann die Schritte 4 bis 6 noch weitere 3-mal.
• Der Dorn zum Aufstechen der Patrone am Boden des durchsichtigen Gehäuseunterteils darf nicht berührt werden.
Pflege des Yanimo Respimat
Reinigen Sie das Mundstück einschließlich der Metalldüse im Inneren des Mundstücks mindestens einmal wöchentlich nur mit einem feuchten Tuch oder Papiertuch.
Leichte Verfärbungen des Mundstücks haben keine Auswirkungen auf die Funktionsfähigkeit des Yanimo Respimat.
Falls erforderlich, kann die Außenseite des Yanimo Respimat Inhalators mit einem feuchten Tuch abgewischt werden.
Wann ist ein neuer Yanimo Respimat zu besorgen?

• Bei Anwendung wie vorgesehen (2 Hübe einmal täglich) enthält der Yanimo Respimat 60 Hübe (30 Dosen).
• Der Dosisanzeiger gibt in etwa an, wie viele Hübe noch vorhanden sind.
• Wenn der Dosisanzeiger den Anfang des roten Bereiches der Skala erreicht, sind noch etwa 14 Hübe (Dosis für 7 Tage) vorhanden. Zu diesem Zeitpunkt ist die Verordnung eines neuen Yanimo Respimat notwendig.
• Sobald der Dosisanzeiger das Ende des roten Bereiches der Skala erreicht, wird der Yanimo Respimat automatisch gesperrt - es kann keine weitere Dosis abgegeben werden. Das durchsichtige Gehäuseunterteil kann nicht weiter gedreht werden.
• Der Yanimo Respimat sollte 3 Monate nach der Vorbereitung für die erste Anwendung entsorgt werden, selbst wenn er in der Zwischenzeit nicht vollständig geleert oder gar nicht angewendet wurde.
1. Das durchsichtige Gehäuseunterteil abziehen
Achten Sie darauf, dass die Schutzkappe geschlossen ist.
Drücken Sie auf die Entriegelungstaste und ziehen Sie gleichzeitig mit der anderen Hand das durchsichtige Gehäuseunterteil ab.
2. Die Patrone einsetzen
Schieben Sie das schmale Ende (Oberseite) der Patrone in den Inhalator.
Drücken Sie den Inhalator auf einer stabilen Fläche fest nach unten, bis die Patrone einrastet.
Die Patrone darf anschließend nicht wieder entfernt werden.
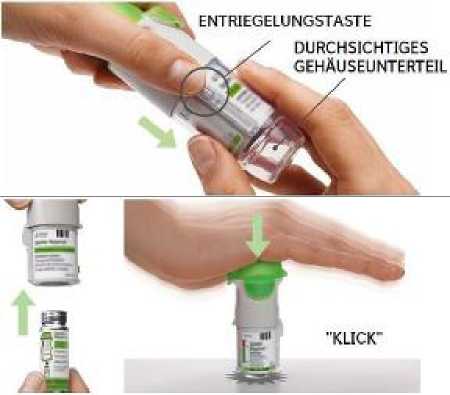
3. Das durchsichtige Gehäuseunterteil wieder aufstecken
Stecken Sie das durchsichtige Gehäuseunterteil wieder so auf, dass es in die Entriegelungstaste einrastet.
Das durchsichtige Gehäuseunterteil darf anschließend nicht wieder entfernt werden.

4. Drehen
Achten Sie darauf, dass die Schutzkappe geschlossen ist.
Drehen Sie das durchsichtige Gehäuseunterteil in Richtung der Pfeile auf dem Etikett bis es einrastet (eine halbe Umdrehung).
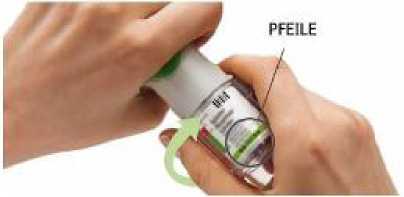
6. Auslösen
Halten Sie den Inhalator mit der Öffnung in Richtung Boden.
Drücken Sie den Auslöser.
Schließen Sie die Schutzkappe.
Wiederholen Sie die Schritte 4 bis 6 so oft, bis eine sichtbare Sprühwolke austritt. Wiederholen Sie dann die Schritte 4 bis 6 noch weitere 3-mal.
Der Inhalator ist nun für die Anwendung bereit. Die o. g. Schritte beeinträchtigen nicht die Anzahl der verfügbaren Dosen. Nach dieser Vorbereitung wird der Inhalator die vorgesehenen 60 Hübe (30 Dosen) abgeben._

Drehen
• Achten Sie darauf, dass die Schutzkappe geschlossen ist.
• Drehen Sie das durchsichtige Gehäuseunterteil in Richtung der Pfeile auf dem Etikett bis es einrastet (eine halbe Umdrehung).
Auslösen
• Atmen Sie langsam und vollständig aus.
• Umschließen Sie das Mundstück mit den Lippen, ohne die Luftschlitze zu verdecken. Halten Sie den Inhalator waagerecht in Richtung Rachen.
• Atmen Sie langsam und tief durch den Mund ein, drücken Sie gleichzeitig den Auslöser und atmen Sie weiter langsam ein, solange es nicht unangenehm wird.
• Halten Sie den Atem möglichst 10 Sekunden lang an oder solange, dass es nicht unangenehm wird.
• Wiederholen Sie die Schritte “Drehen” -“Öffnen” - “Auslösen” einmal, um den 2. Hub zu inhalieren.
• Schließen Sie die Schutzkappe bis zum nächsten Gebrauch des Inhalators.

Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Anamnestisch bekannte Überempfindlichkeit gegen Atropin oder eines seiner Derivate, z. B. Ipratropium oder Oxitropium.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Asthma
Yanimo Respimat darf bei Asthma nicht angewendet werden. Die Wirksamkeit und Sicherheit von Yanimo Respimat bei Asthma wurde nicht untersucht.
Nicht zur Akutbehandlung
Yanimo Respimat darf nicht zur Behandlung akuter Bronchospasmen, d. h. nicht als Notfallmedikament, eingesetzt werden.
Paradoxe Bronchospasmen
Wie andere Inhalativa kann auch Yanimo Respimat paradoxe Bronchospasmen auslösen, die lebensbedrohlich sein können. Falls ein paradoxer Bronchospasmus auftritt, muss Yanimo Respimat sofort abgesetzt und durch eine alternative Therapie ersetzt werden.
Anticholinerge Effekte von Tiotropium
Engwinkelglaukom, Prostatahyperplasie oder Blasenhalsobstruktion
Aufgrund der anticholinergen Aktivität von Tiotropium sollte Yanimo Respimat bei Patienten mit Engwinkelglaukom, Prostatahyperplasie oder Blasenhalsobstruktion mit Vorsicht angewendet werden.
Okuläre Symptome
Die Patienten sollten darauf hingewiesen werden, dass das Spray nicht in die Augen gelangen darf. Sie sollten darüber informiert werden, dass dies zur Auslösung oder Verschlimmerung eines Engwinkelglaukoms, zu Augenschmerzen oder Augenbeschwerden, zu vorübergehendem verschwommenen Sehen, zu Augenhalos oder verändertem Farbempfinden, verbunden mit geröteten Augen aufgrund konjunktivaler Stauung oder eines kornealen Ödems, führen kann. Bei Auftreten von zwei oder mehreren dieser Augensymptome sollten die Patienten die Anwendung von Yanimo Respimat beenden und unverzüglich einen Facharzt aufsuchen.
Zahnkaries
Mundtrockenheit, die unter Behandlung mit Anticholinergika beobachtet wurde, kann langfristig mit Zahnkaries assoziiert sein.
Patienten mit Nierenfunktionsstörung
Da bei Patienten mit mittelgradiger bis schwerer Nierenfunktionsstörung (Kreatinin-Clearance < 50 ml/min) die Plasmakonzentration von Tiotropium mit nachlassender Nierenfunktion ansteigt, sollte Yanimo Respimat nur angewendet werden, wenn der zu erwartende Nutzen gegenüber einem potentiellen Risiko überwiegt. Es liegen keine Langzeiterfahrungen bei Patienten mit schwerer Nierenfunktionsstörung vor (siehe Abschnitt 5.2).
Wirkungen auf das Herz-Kreislauf-System
Die Erfahrung mit Yanimo Respimat ist begrenzt bei Patienten mit anamnestisch bekanntem Myokardinfarkt innerhalb des letzten Jahres, mit instabiler oder lebensbedrohlicher kardialer Arrhythmie, mit Hospitalisierung wegen Herzinsuffizienz innerhalb des letzten Jahres oder mit diagnostizierter paroxysmaler Tachykardie (> 100 Schläge pro Minute), da diese Patienten von den
klinischen Studien ausgeschlossen wurden. Yanimo Respimat sollte bei diesen Patientengruppen mit Vorsicht angewendet werden.
Wie andere ß2-Adrenozeptor-Agonisten kann auch Olodaterol bei manchen Patienten klinisch relevante kardiovaskuläre Wirkungen zeigen, die sich in beschleunigtem Puls, erhöhtem Blutdruck und/oder anderen Symptomen äußern. In solchen Fällen kann es notwendig sein, die Behandlung abzubrechen. Darüber hinaus wurden unter der Behandlung mit ß-Adrenozeptor-Agonisten EKG-Veränderungen beobachtet, z. B. eine Abflachung der T-Welle und eine Senkung der ST-Strecke. Die klinische Relevanz dieser Beobachtungen ist jedoch nicht bekannt.
Die Anwendung lang-wirksamer ß2-Adrenozeptor-Agonisten sollte mit Vorsicht erfolgen bei Patienten mit kardiovaskulären Erkrankungen, insbesondere mit ischämischer Herzerkrankung, schwerer kardialer Dekompensation, kardialen Arrhythmien, hypertropher obstruktiver Kardiomyopathie, Hypertonie und Aneurysma, bei Patienten mit konvulsiven Erkrankungen oder Thyreotoxikose, bei Patienten mit bekannter oder vermuteter Verlängerung des QT-Intervalls (z. B. QT > 0,44 s) sowie bei Patienten, die ungewöhnlich stark auf sympathomimetische Amine ansprechen.
Hypokaliämie
ß2-Adrenozeptor-Agonisten können bei manchen Patienten eine signifikante Hypokaliämie auslösen, die zu unerwünschten kardiovaskulären Effekten führen kann. Der Abfall des Serum-Kaliumspiegels ist normalerweise vorübergehend und erfordert keine Supplementierung. Bei Patienten mit schwerer COPD kann eine Hypokaliämie durch Hypoxie und Begleittherapie verstärkt werden (siehe Abschnitt 4.5). Dies kann die Anfälligkeit für Herzrhythmusstörungen erhöhen.
Hyperglykämie
Die Inhalation hoher Dosen von ß2-Adrenozeptor-Agonisten kann zu einem Anstieg des Blutzuckerspiegels führen.
Anästhesie
Bei einer anstehenden Operation unter Narkose mit halogenierten Kohlenwasserstoffen ist wegen einer erhöhten Anfälligkeit für kardiale Nebenwirkungen durch ß-adrenerge Bronchodilatatoren Vorsicht geboten.
Yanimo Respimat sollte nicht zusammen mit anderen lang-wirksame ß2-Adrenozeptor-Agonisten enthaltenden Arzneimitteln angewendet werden.
Patienten, die bisher regelmäßig (z. B. 4-mal täglich) kurz-wirksame ß2-Adrenozeptor-Agonisten inhaliert haben, sollten angewiesen werden, diese nur noch zur Linderung akuter respiratorischer Symptome anzuwenden.
Yanimo Respimat sollte nicht häufiger als einmal täglich angewendet werden.
Überempfindlichkeit.
Wie bei allen Arzneimitteln sind nach der Anwendung von Yanimo Respimat allergische Reaktionen vom Soforttyp möglich.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden zwar keine formalen in vivo-Studien zur Erfassung von Wechselwirkungen zwischen Yanimo Respimat und anderen Arzneimitteln durchgeführt, doch ergaben sich bei gleichzeitiger Anwendung von inhaliertem Yanimo Respimat mit anderen COPD-Arzneimitteln einschließlich kurzwirksamer sympathomimetischer Bronchodilatatoren und inhalierter Kortikosteroide keine klinischen Hinweise auf Arzneimittelwechselwirkungen.
Anticholincrgc Wirkstoffe
Die gleichzeitige Anwendung von Tiotropiumbromid, einem der Wirkstoffe von Yanimo Rcspimat, mit anderen Anticholinergika enthaltenden Arzneimitteln wurde nicht untersucht und wird daher nicht empfohlen.
Adrenerge Wirkstoffe
Die gleichzeitige Anwendung anderer adrenerger Wirkstoffe (allein oder als Bestandteil einer Kombinationstherapie) kann die Nebenwirkungen von Yanimo Respimat verstärken.
Xanthin-Derivate. Steroide und Diuretika
Die gleichzeitige Behandlung mit Xanthin-Derivaten. Steroiden oder nicht-kaliumsparenden Diuretika kann zu einer Verstärkung der hypokaliämischen Wirkung von Adrenozeptor-Agonisten führen (siehe Abschnitt 4.4).
ß-Blocker
ß-Rezeptorenblocker können die Wirkung von Olodaterol abschwächen oder antagonisieren. Kardioselektive ß-Rezeptorenblocker können erwogen werden. sind aber mit Vorsicht anzuwenden.
MAO-Hemmer. trizyklische Antidepressiva sowie Wirkstoffe. die die QTc-Zeit verlängern Monoaminoxidase-Hemmer. trizyklische Antidepressiva oder andere Arzneimittel. die bekanntermaßen das QTc-Intervall verlängern. können die Wirkung von Yanimo Respimat auf das Herz-Kreislauf-System verstärken.
Pharmakokineti sche Arzneimittelwechselwirkungen
In Arzneimittel-Wechselwirkungsstudien mit gleichzeitiger Anwendung von Fluconazol. als beispielhaftem Inhibitor der CYP2C9. wurden keine relevanten Auswirkungen auf die systemische Exposition gegenüber Olodaterol beobachtet.
Die gleichzeitige Anwendung von Ketoconazol. als potentem P-Glykoprotein- und CYP3A4-Inhibitor. erhöhte die systemische Exposition gegenüber Olodaterol um ca. 70 %. Eine Dosisanpassung von Yanimo Respimat ist nicht erforderlich.
In vitro-Untersuchungen haben gezeigt. dass Olodaterol in den im klinischen Alltag erreichten Plasmakonzentrationen weder CYP-Enzyme noch Wirkstoff-Transportproteine hemmt.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Tiotropium
Die Datenlage zur Anwendung von Tiotropium bei schwangeren Frauen ist sehr begrenzt. Tierexperimentelle Studien ergaben für klinisch relevante Dosen keine Hinweise auf direkte oder indirekte schädliche Wirkungen in Bezug auf eine Reproduktionstoxizität (siehe Abschnitt 5.3).
Olodaterol
Für Olodaterol liegen keine klinischen Daten über exponierte Schwangerschaften vor. Präklinische Daten zu Olodaterol zeigten für Dosen. die einem Vielfachen der therapeutischen Dosen entsprachen. die für ß-Adrenozeptor-Agonisten typischen Wirkungen (siehe Abschnitt 5.3).
Aus Vorsichtsgründen empfiehlt es sich. die Anwendung von Yanimo Respimat während der Schwangerschaft zu vermeiden.
Wie andere ß2-Adrenozeptor-Agonisten kann Olodaterol. einer der Bestandteile von Yanimo Respimat. aufgrund seines relaxierenden Effekts auf die glatte Uterusmuskulatur die Wehentätigkeit hemmen.
Stillzeit
Es liegen keine klinischen Daten über Tiotropium- und/oder Olodaterol-exponierte stillende Mütter vor.
In tierexperimentellen Studien mit Tiotropium und Olodaterol wurden diese Substanzen und/oder ihre Metaboliten in der Milch von laktierenden Ratten nachgewiesen; es ist jedoch nicht bekannt, ob Tiotropium und/oder Olodaterol beim Menschen in die Muttermilch übergeht.
Es sollte eine Entscheidung getroffen werden, ob das Stillen fortgesetzt bzw. unterbrochen oder die Behandlung mit Yanimo Respimat fortgesetzt bzw. unterbrochen werden sollte. Dabei soll sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Yanimo Respimat-Therapie für die Frau berücksichtigt werden.
Fertilität
Es liegen keine klinischen Daten zur Fertilität für Tiotropium und Olodaterol bzw. die Kombination beider Komponenten vor. In präklinischen Studien mit den individuellen Komponenten Tiotropium und Olodaterol zeigten sich keinerlei Hinweise auf negative Auswirkungen auf die Fertilität (siehe Abschnitt 5.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Jedoch sollte den Patienten mitgeteilt werden, dass in Zusammenhang mit der Anwendung von Yanimo Respimat über Schwindel und verschwommenes Sehen berichtet wurde. Deshalb sollte beim Autofahren und Bedienen von Maschinen zur Vorsicht geraten werden. Beim Auftreten solcher Symptome sollten die Patienten potenziell gefährliche Tätigkeiten wie Autofahren oder das Bedienen von Maschinen vermeiden.
4.8 Nebenwirkungen
a. Zusammenfassung des Sicherheitsprofils
Viele der aufgeführten Nebenwirkungen lassen sich auf die anticholinergen Eigenschaften von Tiotropiumbromid bzw. auf die ß2-adrenergen Eigenschaften von Olodaterol, der beiden Wirkstoffe in Yanimo Respimat, zurückführen.
b. Tabellarische Zusammenfassung der Nebenwirkungen
Die den nachstehend aufgeführten Nebenwirkungen zugeordneten Häufigkeitsangaben beruhen auf den Rohinzidenzraten von unerwünschten Arzneimittelwirkungen (d. h. Ereignissen, die Yanimo Respimat zugeschrieben wurden), die in der Dosisgruppe mit Tiotropium 5 Mikrogramm/Olodaterol 5 Mikrogramm (1302 Patienten) beobachtet wurden. Es handelt sich um gepoolte Daten aus 5 aktivoder placebokontrollierten klinischen Parallelgruppenstudien mit COPD-Patienten und einer Behandlungsdauer zwischen 4 bis 52 Wochen.
Nebenwirkungen, die in allen klinischen Studien mit Yanimo Respimat berichtet wurden, sind nachfolgend entsprechend der jeweiligen Systemorganklasse dargestellt.
Enthalten sind auch alle Nebenwirkungen, die zuvor bereits mit einem der Einzelwirkstoffe beobachtet wurden.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10); Häufig (> 1/100 bis < 1/10); Gelegentlich (> 1/1.000 bis < 1/100); Selten (> 1/10.000 bis < 1/1.000); Sehr selten (< 1/10.000); Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Systemorganklasse |
Nebenwirkung |
Häufigkeit |
|
Infektionen und parasitäre Erkrankungen |
Nasopharyngitis |
selten |
|
Stoffwechsel- und Ernährungsstörungen |
Dehydratation |
nicht bekannt |
|
Erkrankungen des Nervensystems |
Schwindel |
gelegentlich |
|
Insomnie |
gelegentlich | |
|
Kopfschmerzen |
gelegentlich | |
|
Augenerkrankungen |
Verschwommenes Sehen |
selten |
|
Glaukom |
nicht bekannt | |
|
Erhöhter Augeninnendruck |
nicht bekannt | |
|
Herzerkrankungen |
Vorhofflimmern |
gelegentlich |
|
Palpitationen |
gelegentlich | |
|
Tachykardie |
gelegentlich | |
|
Supraventrikuläre Tachykardie |
selten | |
|
Gefäßerkrankungen |
Hypertonie |
gelegentlich |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Husten |
gelegentlich |
|
Dysphonie |
selten | |
|
Epistaxis |
selten | |
|
Laryngitis |
selten | |
|
Pharyngitis |
selten | |
|
Bronchospasmus |
nicht bekannt | |
|
Sinusitis |
nicht bekannt | |
|
Erkrankungen des Gastrointestinaltrakts |
Mundtrockenheit |
häufig |
|
Obstipation |
gelegentlich | |
|
Gingivitis |
selten | |
|
Übelkeit |
selten | |
|
Oropharyngeale Candidose |
selten | |
|
Intestinale Obstruktion paralytischer Ileus |
nicht bekannt | |
|
Zahnkaries |
nicht bekannt | |
|
Dysphagie |
nicht bekannt | |
|
Gastroösophageale Refluxkrankheit |
nicht bekannt | |
|
Glossitis |
nicht bekannt | |
|
Stomatitis |
nicht bekannt | |
|
Erkrankungen der Haut und des Unterhautzellgewebes, Erkrankungen des Immunsystems |
Angioneurotisches Ödem |
selten |
|
Urtikaria |
selten | |
|
Überempfindlichkeit |
selten | |
|
Pruritus |
selten | |
|
Anaphylaktische Reaktion |
nicht bekannt | |
|
Hautausschlag |
nicht bekannt | |
|
Trockene Haut |
nicht bekannt | |
|
Hautinfektion und Hautgeschwür |
nicht bekannt | |
|
Skelettmuskulatur-, Bindegewebs-und Knochenerkrankungen |
Rückenschmerzen1 |
selten |
|
Arthralgie |
selten | |
|
Gelenkschwellung |
nicht bekannt | |
|
Erkrankungen der Nieren und Harnwege |
Harnverhalt |
selten |
|
Dysurie |
selten | |
|
Harnwegsinfekt |
nicht bekannt |
1 Nebenwirkungen, die mit Yanimo Respimat, nicht aber mit den Einzelwirkstoffen berichtet wurden.
c. Beschreibung ausgewählter Nebenwirkungen
Yanimo Respimat verfügt aufgrund seiner Bestandteile Tiotropium und Olodaterol sowohl über anticholinerge als auch ß2-adrenerge Eigenschaften.
Nebenwirkungsprofil von Anticholinergika
In den 52-wöchigen klinischen Langzeitstudien mit Yanimo Respimat war die am häufigsten beobachtete anticholinerge Nebenwirkung Mundtrockenheit, die bei etwa 1,7 % der Patienten unter Behandlung mit Yanimo Respimat, bei 2,7 % der Patienten unter Tiotropium 5 Mikrogramm und bei 1 % der Patienten unter Olodaterol 5 Mikrogramm auftrat. Mundtrockenheit führte bei einem von 1029 Patienten (0,1 %), die mit Yanimo Respimat behandelt wurden, zum Absetzen der Studienbehandlung.
Schwerwiegende Nebenwirkungen passend zu anticholinergen Effekten umfassen Glaukom, Obstipation, intestinale Obstruktion einschließlich paralytischem Ileus und Harnverhalt.
Nebenwirkungsprofil von ß-adrenergen Substanzen
In den 52-wöchigen klinischen Langzeitstudien mit Yanimo Respimat bestanden die am häufigsten beobachteten ß-adrenergen Nebenwirkungen in Palpitationen, Tachykardie und Hypertonie. Olodaterol, einer der Wirkstoffe von Yanimo Respimat, gehört zur therapeutischen Klasse der langwirksamen ß2-Adrenozeptor-Agonisten. Daher ist auf Anzeichen für sonstige, oben nicht aufgeführte Nebenwirkungen von ß-Adrenozeptor-Agonisten zu achten, wie Arrhythmie, Myokardischämie, Angina pectoris, Hypotonie, Tremor, Nervosität, Muskelkrämpfe, Erschöpfung, Unwohlsein, Hypokaliämie, Hyperglykämie und metabolische Azidose.
d. Andere spezielle Patientengruppen
Mit zunehmendem Alter kann es zu einer Verstärkung der anticholinergen Wirkungen kommen. Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Die Datenlage zur Überdosierung von Yanimo Respimat ist begrenzt. Yanimo Respimat wurde in Dosierungen von bis zu 5 Mikrogramm / 10 Mikrogramm (Tiotropium/Olodaterol) bei COPD-Patienten und von bis zu 10 Mikrogramm / 40 Mikrogramm (Tiotropium/Olodaterol) bei gesunden Probanden untersucht; dabei wurden keine klinisch relevanten Wirkungen beobachtet. Eine Überdosierung könnte zu übersteigerten antimuskarinischen Wirkungen von Tiotropium und/oder übersteigerten ß2-agonistischen Wirkungen von Olodaterol führen.
Symptome
Überdosierung des Anticholinergikums Tiotropium
Hohe Dosen von Tiotropium können zu anticholinergen Anzeichen und Symptomen führen.
Jedoch wurden nach einer einzelnen inhalierten Dosis von bis zu 340 Mikrogramm Tiotropiumbromid bei gesunden Probanden keine systemischen anticholinergen Nebenwirkungen beobachtet. Darüber hinaus wurden nach einer 14-tägigen Behandlung von gesunden Probanden mit Dosen von bis zu 40 Mikrogramm Tiotropium-Lösung zur Inhalation über Mund-/Halstrockenheit und Trockenheit der Nasenschleimhaut hinaus, mit Ausnahme einer ausgeprägten Verminderung des Speichelflusses ab Tag 7, keine relevanten unerwünschten Ereignisse beobachtet.
Überdosierung des ß2-Agonisten Olodaterol
Eine Überdosierung von Olodaterol führt voraussichtlich zu den für ß2-Adrenozeptor-Agonisten typischen Symptomen in übersteigerter Form, z. B. Myokardischämie, Hypertonie oder Hypotonie, Tachykardie, Arrhythmie, Palpitationen, Schwindel, Nervosität, Insomnie, Angst, Kopfschmerzen, Tremor, Mundtrockenheit, Muskelkrämpfe, Übelkeit, Erschöpfung, Unwohlsein, Hypokaliämie, Hyperglykämie und metabolische Azidose.
Behandlung von Überdosierungen
Die Behandlung mit Yanimo Respimat sollte unterbrochen werden. Eine supportive und symptomatische Behandlung ist indiziert, in schweren Fällen eine Hospitalisierung. Wenn die Anwendung eines kardioselektiven ß-Blockers erwogen wird, ist größtmögliche Vorsicht geboten, da ß-Blocker Bronchospasmen auslösen können.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Mittel bei obstruktiven Atemwegserkrankungen; Sympathomimetika in Kombination mit Anticholinergika ATC-Code: R03AL06
Wirkmechanismus
Yanimo Respimat
Yanimo Respimat ist eine Lösung zur Inhalation mit einer Fixdosiskombination aus Tiotropium, einem lang-wirksamen Muskarinrezeptor-Antagonisten, und Olodaterol, einem lang-wirksamen ß2-Adrenozeptor-Agonisten (LAMA/LABA). Diese Wirkstoffe werden mittels Yanimo Respimat Inhalator in Form einer feinen Sprühwolke abgegeben.
Die beiden Wirkstoffe sorgen aufgrund ihrer unterschiedlichen Wirkmechanismen für eine zusätzliche Bronchodilatation. Da Muskarinrezeptoren offenbar verstärkt in den zentralen Atemwegen, ß2-Adrenozeptoren hingegen stärker in den peripheren Atemwegen exprimiert werden, dürfte die Kombination von Tiotropium und Olodaterol in allen Bereichen der Lungen für eine optimale Bronchodilatation sorgen.
Tiotropium
Tiotropiumbromid ist ein lang-wirksamer spezifischer Muskarinrezeptor-Antagonist. Die Substanz weist eine ähnliche Affinität zu den Muskarinrezeptor-Subtypen M1 bis M5 auf. In den Atemwegen bindet Tiotropiumbromid kompetitiv und reversibel an die M3-Rezeptoren der glatten Bronchialmuskulatur und antagonisiert dadurch die cholinerge (bronchokonstriktive) Wirkung von Acetylcholin, was zu einer Relaxation der glatten Bronchialmuskulatur führt. Diese Wirkung erwies sich als dosisabhängig und hielt länger als 24 Stunden an. Als N-quartäres Anticholinergikum ist Tiotropiumbromid nach inhalativer Anwendung topisch (broncho-)selektiv und zeigt eine akzeptable therapeutische Breite, bevor es zu systemischen anticholinergen Effekten kommt.
Olodaterol
Olodaterol weist eine hohe Affinität und hohe Selektivität für den humanen ß2-Adrenozeptor auf.
In vitro-Untersuchungen haben gezeigt, dass Olodaterol an ß2-Adrenozeptoren eine 241-fach stärkere agonistische Wirkung als an ß1-Adrenozeptoren und eine 2299-fach stärkere agonistische Wirkung als an ß3-Adrenozeptoren ausübt.
Die pharmakologischen Wirkungen dieses Wirkstoffes beruhen auf der Bindung und Aktivierung von ß2-Adrenozeptoren nach topischer Verabreichung durch Inhalation.
Die Aktivierung dieser Rezeptoren in den Atemwegen führt zu einer Stimulierung der intrazellulären Adenylatzyklase, eines Enzyms, das die Synthese von zyklischem Adenosin-3',5'-Monophosphat
(cAMP) vermittelt. Ein erhöhter cAMP-Spiegel löst über die Relaxation der glatten Muskulatur in den Atemwegen eine Bronchodilatation aus.
Olodaterol verfügt über das präklinische Profil eines lang-wirksamen selektiven ß2-Adrenozeptor-Agonisten (LABA) mit schnellem Wirkungseintritt und einer Wirkdauer von mindestens 24 Stunden. ß-Adrenozeptoren werden in drei Subtypen eingeteilt, wobei ß1-Adrenozeptoren vorwiegend in der Herzmuskulatur, ß2-Adrenozeptoren vorwiegend in der glatten Muskulatur der Atemwege und ß3-Adrenozeptoren überwiegend im Fettgewebe exprimiert werden. ß2-Agonisten führen zur Bronchodilatation. Der ß2-Adrenozeptor ist zwar der vorherrschende adrenerge Rezeptor in der glatten Muskulatur der Atemwege, doch findet er sich auch auf der Oberfläche verschiedener anderer Zellen, z. B. auf Lungenepithel- und Endothelzellen und im Herzen. Die genaue Funktion der kardialen ß2-Rezeptoren ist nicht bekannt, doch wirft ihr Vorhandensein die Möglichkeit auf, dass selbst hochselektive ß2-Adrenozeptor-Agonisten kardiale Wirkungen ausüben könnten.
Wirkungen auf die Elektrophysiologie des Herzens Tiotropium
In einer entsprechenden QT-Studie, die 53 gesunde Probanden einschloss, verlängerte über 12 Tage verabreichtes Tiotropiumbromid-Inhalationspulver in Dosen von 18 Mikrogramm und 54 Mikrogramm (also das 3-Fache der therapeutischen Dosis), das QT-Intervall im EKG nicht signifikant.
Olodaterol
Die Auswirkungen von Olodaterol auf das QT/QTc-Intervall im EKG wurden in einer doppelblinden, randomisierten, Placebo- und aktiv-(Moxifloxacin-)kontrollierten Studie an 24 gesunden männlichen und weiblichen Probanden untersucht. Olodaterol in Einzeldosen von 10, 20, 30 und 50 Mikrogramm führte im Vergleich zu Placebo über einen Zeitraum von 20 Minuten bis 2 Stunden nach der Verabreichung zu einer dosisabhängigen Zunahme der mittleren Veränderung des QT-Intervalls gegenüber Baseline: von 1,6 ms (10 Mikrogramm Olodaterol) bis 6,5 ms (50 Mikrogramm Olodaterol). Nach individueller Korrektur der QT-Zeiten (QTcI) lag die Obergrenze des zweiseitigen 90 %-Konfidenzintervalls bei allen Dosisstufen bei weniger als 10 ms.
Die Effekte von 5 Mikrogramm und 10 Mikrogramm Olodaterol auf die Herzfrequenz und den Herzrhythmus wurden im Rahmen der 48-wöchigen Placebo-kontrollierten Phase III-Studien in einer Untergruppe von 772 Patienten mittels kontinuierlicher EKG-Aufzeichnung über 24 Stunden (Langzeit-EKG) beurteilt. Dabei wurden hinsichtlich der Größenordnungen der mittleren Veränderungen von Herzfrequenz oder Extrasystolen keine dosis- oder zeitbezogenen Tendenzen oder Muster beobachtet. Veränderungen der Extrasystolen von Baseline bis zum Behandlungsende zeigten keine bedeutsamen Unterschiede zwischen 5 Mikrogramm Olodaterol, 10 Mikrogramm Olodaterol und Placebo.
Yanimo Respimat
Zwei 52-wöchige, randomisierte, doppelblinde Studien mit Yanimo Respimat schlossen 5162 COPD-Patienten ein. In einer gepoolten Analyse lagen die Anteile von Patienten mit Veränderungen vom Baseline-korrigierten QTcF-Intervall (Frequenzkorrektur nach Fridericia) von > 30 msec 40 Minuten nach der Anwendung an Tag 85, 169 und 365 in einem Bereich von 3,1 %, 4,7 % und 3,6 % für die Yanimo Respimat-Gruppe, verglichen mit 4,1 %, 4,4 % und 3,6 % für die Olodaterol 5 MikrogrammGruppe und 3,4 %, 2,3 % und 4,6 % für die Tiotropium 5 Mikrogramm-Gruppe.
Klinische Wirksamkeit und Sicherheit
Das klinische Phase III-Entwicklungsprogramm für Yanimo Respimat umfasste drei randomisierte, doppelblinde Studien:
(i) zwei replizierte Parallelgruppenstudien über 52 Wochen zum Vergleich von Yanimo Respimat mit Tiotropium 5 Mikrogramm und Olodaterol 5 Mikrogramm (1029 Patienten erhielten Yanimo Respimat) [Studien 1 und 2]
(ii) eine Crossover-Studie über 6 Wochen zum Vergleich von Yanimo Respimat mit Tiotropium 5 Mikrogramm, Olodaterol 5 Mikrogramm und Placebo (139 Patienten erhielten Yanimo Respimat) [Studie 3]
In diesen Studien wurden die Vergleichspräparate Tiotropium 5 Mikrogramm, Olodaterol 5 Mikrogramm und Placebo mittels Respimat Inhalator verabreicht.
Patientencharakteristika
Die Mehrzahl der 5162 Patienten, die für die weltweit durchgeführten 52-wöchigen Studien (Studien 1 und 2) rekrutiert wurden, war männlich (73 %) sowie „weiß“ (71 %) oder „asiatisch“ (25 %); das mittlere Lebensalter betrug 64,0 Jahre. Das mittlere FEVi nach Bronchodilatation betrug 1,37 l (GOLD II [50 %], GOLD III [39 %], GOLD IV [11 %]). Die mittlere Ansprechbarkeit auf ß2-Agonisten lag bei 16,6 % des Ausgangswertes (0,171 l). Als Begleittherapie erlaubte pulmonale Medikamente umfassten inhalierte Steroide (47 %) und Xanthine (10 %).
Die 6-wöchige Studie (Studie 3) wurde in Europa und Nordamerika durchgeführt. Die Mehrzahl der 219 rekrutierten Patienten war männlich (59 %) sowie „weiß“ (99 %); das mittlere Lebensalter betrug
61,1 Jahre. Das mittlere FEVi nach Bronchodilatation betrug 1,55 l (GOLD II [64 %], GOLD III [34 %], GOLD IV [2 %]). Die mittlere Ansprechbarkeit auf ß2-Agonisten lag bei 15,9 % des Ausgangswertes (0,193 l). Als Begleittherapie erlaubte pulmonale Medikamente umfassten inhalative Steroide (41 %) und Xanthine (4 %).
Auswirkungen auf die Lungenfunktion
In den 52-wöchigen Studien bewirkte Yanimo Respimat (verabreicht einmal täglich morgens) innerhalb von 5 Minuten nach der ersten Dosis eine deutliche Verbesserung der Lungenfunktion im Vergleich zu Tiotropium 5 Mikrogramm (mittlere Zunahme des FEV1 um 0,137 l für Yanimo Respimat vs. 0,058 l für Tiotropium 5 Mikrogramm [p < 0,0001]) und zu Olodaterol 5 Mikrogramm (0,125 l [p = 0,16]).
In beiden Studien wurden für Yanimo Respimat verglichen mit Tiotropium 5 Mikrogramm und Olodaterol 5 Mikrogramm signifikante Verbesserungen von FEV1-AUC0-3h-Antwort und trough FEV1-Antwort nach 24 Wochen (primäre Lungenfunktionsendpunkte) beobachtet (Tabelle 1).
Tabelle 1: Unterschied der FEVI-AUC0_3h- und trough FEV1-Antwort zwischen Yanimo
Respimat und Tiotropium 5 Mikrogramm bzw. Olodaterol 5 Mikrogramm nach 24 Wochen (Studien 1 und 2)
|
FEV1-AUC0-3h-Antwort |
Trough FEV1-Antwort | |||||||
|
Studie 1 |
Studie 2 |
Studie 1 |
Studie 2 | |||||
|
n |
Mittelwert |
n |
Mittelwert |
n |
Mittelwert |
n |
Mittelwert | |
|
Yanimo Respimat versus |
522 |
-- |
502 |
-- |
521 |
-- |
497 |
-- |
|
Tiotropium 5 Mikrogramm |
526 |
0,117 l |
500 |
0,103 l |
520 |
0,071 l |
498 |
0,050 l |
|
Olodaterol 5 Mikrogramm |
525 |
0,123 l |
507 |
0,132 l |
519 |
0,082 l |
503 |
0,088 l |
FEV1-Ausgangswert vor Behandlung: Studie 1 = 1,16 l; Studie 2 = 1,15 l p < 0,0001 für alle Vergleiche n = Anzahl Patienten
Patienten mit einem höheren Reversibilitätsgrad an Baseline zeigten im Allgemeinen eine bessere bronchodilatatorische Antwort mit Yanimo Respimat als Patienten mit einem niedrigeren Reversibilitätsgrad an Baseline.
Die gegenüber Tiotropium 5 Mikrogramm und Olodaterol 5 Mikrogramm verbesserten bronchodilatatorischen Wirkungen von Yanimo Respimat blieben während der gesamten 52-wöchigen Behandlungsphase erhalten. Yanimo Respimat führte im Vergleich zu Tiotropium 5 Mikrogramm und Olodaterol 5 Mikrogramm außerdem zu einer Verbesserung der morgendlichen und abendlichen maximalen exspiratorischen Atemflussrate (PEFR), die anhand der täglichen Aufzeichnungen der Patienten ermittelt wurde.
In der 6-wöchigen Studie zeigte Yanimo Respimat während des gesamten 24-stündigen Dosierungsintervalls eine signifikant größere FEVi-Antwort als Tiotropium 5 Mikrogramm, Olodaterol 5 Mikrogramm und Placebo (p < 0,0001) (Tabelle 2).
Tabelle 2: Mittlerer Unterschied des FEV1 (l) über 3 Stunden, 12 Stunden und 24 Stunden
sowie Unterschied des trough FEV1 (l) für Yanimo Respimat im Vergleich zu Tiotropium 5 Mikrogramm, Olodaterol 5 Mikrogramm und Placebo nach 6 Wochen (Studie 3)
|
n |
3 h-Mittelwert |
n |
12 h-Mittelwert |
24 h-Mittelwert1 |
Trough | |
|
Yanimo Respimat versus |
138 |
138 | ||||
|
Tiotropium 5 Mikrogramm |
137 |
0,109 |
135 |
0,119 |
0,110 |
0,079 |
|
Olodaterol 5 Mikrogramm |
138 |
0,109 |
136 |
0,126 |
0,115 |
0,092 |
|
Placebo |
135 |
0,325 |
132 |
0,319 |
0,280 |
0,207 |
|
1 primärer End |
punkt | |||||
FEV1-Ausgangswert vor Behandlung = 1,30 l p < 0,0001 für alle Vergleiche n = Anzahl Patienten
Gesundheitsbezogene Lebensqualität
Yanimo Respimat führte zu einer Verbesserung der gesundheitsbezogenen Lebensqualität, was sich in einer Reduktion des Gesamtscores im Fragenbogen "St. George Respiratory Questionnaire" (SGRQ) zeigte. Nach 24 Wochen ergab sich für Yanimo Respimat eine statistisch signifikante Verbesserung im mittleren SGRQ-Gesamtscore im Vergleich zu Tiotropium 5 Mikrogramm und Olodaterol 5 Mikrogramm (siehe Tabelle 3); Verbesserungen zeigten sich in allen Domänen des SGRQ. Ein größerer Anteil der mit Yanimo Respimat behandelten Patienten zeigte eine klinisch relevante Verbesserung im SGRQ-Gesamtscore (MCID, definiert als Abnahme von mindestens 4 Einheiten von Baseline) verglichen mit Tiotropium 5 Mikrogramm (57,5 % vs. 48,7 %, p = 0,0001) und mit Olodaterol 5 Mikrogramm (57,5 % vs. 44,8 %, p < 0,0001).
Tabelle 3: Gesamtscore des SGRQ nach 24 Wochen Behandlung
|
n |
Mittelwert unter Behandlung (Veränderung gegenüber Baseline) |
Unterschied zu Yanimo Respimat | ||
|
Mittelwert (p-Wert) | ||||
|
Gesamtscore |
Baseline |
43,5 | ||
|
Yanimo Respimat |
979 |
36,7 (-6,8) | ||
|
Tiotropium 5 Mikrogramm |
954 |
37,9 (-5,6) |
-1,23 (p = 0,025) | |
|
Olodaterol 5 Mikrogramm |
954 |
38,4 (-5,1) |
-1,69 (p = 0,002) |
n = Anzahl Patienten
Dyspnoe
Nach 24 Wochen betrug der mittlere TDI-Focal-Score für Yanimo Respimat 1,98 Einheiten und war signifikant besser als für Tiotropium 5 Mikrogramm (mittlerer Unterschied 0,36, p = 0,008) und Olodaterol 5 Mikrogramm (mittlerer Unterschied 0,42, p = 0,002).
Ein größerer Anteil der mit Yanimo Respimat behandelten Patienten zeigte eine klinisch relevante Verbesserung des TDI-Focal-Scores (MCID, definiert als ein Unterschied von mindestens einer
Einheit) verglichen mit Tiotropium 5 Mikrogramm (54,9 % vs. 50,6 %, p = 0,0546) und Olodaterol 5 Mikrogramm (54,9 % vs. 48,2 %, p = 0,0026).
Anwendung von Notfallmedikation
Mit Yanimo Respimat behandelte Patienten wendeten tagsüber und nachts weniger Salbutamol als Notfallmedikation an als mit Tiotropium 5 Mikrogramm und Olodaterol 5 Mikrogramm behandelte Patienten (mittlere Anwendung von Notfallmedikation am Tag unter Yanimo Respimat 0,76 Mal pro Tag, verglichen mit 0,97 Mal pro Tag unter Tiotropium 5 Mikrogramm und 0,87 Mal pro Tag unter Olodaterol 5 Mikrogramm, p < 0,0001; mittlere Anwendung von Notfallmedikation in der Nacht unter Yanimo Respimat 1,24 Mal pro Tag, verglichen mit 1,69 Mal pro Tag unter Tiotropium 5 Mikrogramm und 1,52 Mal pro Tag unter Olodaterol 5 Mikrogramm, p < 0,0001).
Allgemeine Bewertung durch den Patienten
Die mit Yanimo Respimat behandelten Patienten nahmen eine stärkere Verbesserung ihres respiratorischen Zustandes wahr als die Patienten, die Tiotropium 5 Mikrogramm und Olodaterol 5 Mikrogramm erhielten, wie anhand der PGR-Skala (Patients Global Rating) ermittelt wurde.
Exazerbationen
Tiotropium 5 Mikrogramm hat früher bereits eine statistisch signifikante Reduktion des Risikos für eine COPD-Exazerbation im Vergleich zu Placebo gezeigt. COPD-Exazerbationen wurden als ein zusätzlicher Endpunkt in die zulassungsrelevanten 52-wöchigen Studien (Studien 1 und 2) aufgenommen. Im kombinierten Datensatz betrug der Anteil von Patienten, die mindestens eine mittelschwere/schwere COPD-Exazerbation erlitten, 27,7 % unter Yanimo Respimat und 28,8 % unter Tiotropium 5 Mikrogramm (p = 0,39). Diese Studien waren nicht speziell darauf ausgerichtet, die Wirkung der Behandlungen auf COPD-Exazerbationen zu untersuchen.
Inspiratorische Kapazität, Atembeschwerden und Belastungsausdauer Die Wirkung von Yanimo Respimat auf inspiratorische Kapazität, Atembeschwerden und symptomlimitierte Belastungsausdauer wurde in drei randomisierten, doppelblinden Studien an COPD-Patienten untersucht:
(i) zwei replizierte Crossover-Studien über 6 Wochen zum Vergleich von Yanimo Respimat mit Tiotropium 5 Mikrogramm, Olodaterol 5 Mikrogramm und Placebo während einer Fahrradergometrie unter konstanter Belastung (450 Patienten erhielten Yanimo Respimat) [Studien 4 und 5]
(ii) eine Parallelgruppenstudie über 12 Wochen zum Vergleich von Yanimo Respimat mit Placebo während einer Fahrradergometrie unter konstanter Belastung (139 Patienten erhielten Yanimo Respimat) und einer Laufbandergometrie unter konstanter Geschwindigkeit (Untergruppe von Patienten) [Studie 6]
Nach 6 Wochen zeigte sich für Yanimo Respimat zwei Stunden nach Anwendung eine signifikante Verbesserung der inspiratorischen Kapazität in Ruhe im Vergleich zu Tiotropium 5 Mikrogramm (0,114 l, p < 0,0001, Studie 4; 0,088 l, p = 0,0005, Studie 5), zu Olodaterol 5 Mikrogramm (0,119 l, p < 0,0001, Studie 4; 0,080 l, p = 0,0015, Studie 5) und zu Placebo (0,244 l, p < 0,0001, Studie 4;
0,265 l, p < 0,0001, Studie 5).
In den Studien 4 und 5 fand sich für Yanimo Respimat nach 6 Wochen eine signifikante Verbesserung der Belastungsdauer während einer Fahrradergometrie unter konstanter Belastung im Vergleich zu Placebo (Studie 4: geometrische mittlere Belastungsdauer von 454 Sekunden unter Yanimo Respimat im Vergleich zu 375 Sekunden unter Placebo, Verbesserung um 20,9 %, p < 0,0001; Studie 5: geometrische mittlere Belastungsdauer von 466 Sekunden unter Yanimo Respimat im Vergleich zu 411 Sekunden unter Placebo, Verbesserung um 13,4 %, p < 0,0001).
In Studie 6 zeigte sich für Yanimo Respimat nach 12 Wochen eine signifikante Verbesserung der Belastungsdauer während einer Fahrradergometrie unter konstanter Belastung gegenüber Placebo (geometrische Belastungsdauer von 528 Sekunden unter Yanimo Respimat gegenüber 464 Sekunden unter Placebo, Verbesserung um 13,8 %, p = 0,021).
Kinder und Jugendliche
Die Europäische Arzneimittel-Agentur hat für Yanimo Respimat eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen bei chronisch obstruktiver Lungenerkrankung (COPD) im Rahmen einer Entscheidung über die Freistellung für Arzneimittelklassen gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
5.2 Pharmakokinetische Eigenschaften
a. Allgemeine Einführung
Nach Inhalation von Tiotropium und Olodaterol in Kombination waren die pharmakokinetischen Parameter für beide Wirkstoffe ähnlich denen, die nach separater Anwendung der einzelnen Wirkstoffe beobachtet wurden.
Tiotropium und Olodaterol zeigen im therapeutischen Bereich eine lineare Pharmakokinetik. Bei wiederholter einmal-täglicher Inhalation wurde nach 7 Tagen der Steady-State der Tiotropium-Plasmakonzentration bzw. nach 8 Tagen der Steady-State der Olodaterol-Plasmakonzentration erreicht. Die Akkumulation nahm im Vergleich zu einer Einzeldosis bis auf das 1,8-Fache zu.
b. Allgemeine Merkmale der Wirkstoffe nach Anwendung des Arzneimittels Resorption
Tiotropium: Daten zur Ausscheidung mit dem Urin bei jungen gesunden Probanden deuten darauf hin, dass etwa 33 % der mittels Respimat Inhalator inhalierten Dosis den systemischen Kreislauf erreichen. Die absolute Bioverfügbarkeit betrug nach Gabe einer oral verabreichten Lösung 2-3 %. Maximale Tiotropium-Plasmakonzentrationen werden 5 bis 7 Minuten nach Inhalation mittels Respimat beobachtet.
Olodaterol: Bei gesunden Probanden wurde die absolute Bioverfügbarkeit von Olodaterol nach Inhalation auf etwa 30 % geschätzt, wohingegen die absolute Bioverfügbarkeit bei Verabreichung als orale Lösung weniger als 1 % betrug. Maximale Olodaterol-Plasmakonzentrationen werden normalerweise innerhalb von 10 bis 20 Minuten nach der Inhalation des Arzneimittels mittels Respimat erreicht.
Verteilung
Tiotropium weist eine Plasmaproteinbindung von 72 % und ein Verteilungsvolumen von 32 l/kg auf. Studien an Ratten haben gezeigt, dass Tiotropium die Bluthirnschranke nicht in relevantem Ausmaß durchdringt.
Olodaterol zeigt eine Plasmaproteinbindung von ungefähr 60 % und ein Verteilungsvolumen von 1110 l. Olodaterol ist ein Substrat für die Transportproteine PGP, OAT1, OAT3 und OCT1. Für die folgenden Transportproteine ist Olodaterol kein Substrat: BCRP, MRP, OATP2, OATP8, OATP-B, OCT2 und OCT3.
Biotransformation
Tiotropium: Das Ausmaß der Metabolisierung ist gering. Dies zeigt sich daran, dass 74 % einer intravenösen Dosis unverändert über den Urin ausgeschieden werden. Der Ester Tiotropium wird nicht-enzymatisch zu seiner Alkohol- (N-Methylscopin) und Säureverbindung (Dithienylglycolsäure) aufgespalten, die beide nicht an Muskarinrezeptoren binden. In vitro-Studien an humanen Lebermikrosomen und humanen Hepatozyten deuten darauf hin, dass ein weiterer Teil des Arzneimittels (< 20 % der Dosis nach intravenöser Anwendung) durch Cytochrom P450 (CYP) 2D6-und 3A4-abhängige Oxidation und anschließende Glutathion-Konjugation zu einer Reihe von Phase II-Metaboliten metabolisiert wird.
Olodaterol wird im Wesentlichen durch direkte Glucuronidierung sowie durch O-Demethylierung an der Methoxygruppe und nachfolgende Konjugation metabolisiert. Von den sechs bekannten Metaboliten bindet nur das unkonjugierte Demethylierungsprodukt an ß2-Rezeptoren. Dieser Metabolit ist jedoch nach chronischer Inhalation der empfohlenen therapeutischen Dosis oder in bis zu 4-fach höheren Dosen im Plasma nicht nachweisbar. An der O-Demethylierung von Olodaterol sind die Cytochrom-P450-Isoenzyme CYP2C9 und CYP2C8 beteiligt, während CYP3A4 unbedeutend ist. An der Bildung von Olodaterol-Glucuroniden sind nachweislich die Isoformen UGT2B7, UGT1A1, UGT1A7 und UGT1A9 der Uridindiphosphat-Glycosyltransferase beteiligt.
Elimination
Tiotropium: Die Gesamt-Clearance bei gesunden Probanden liegt bei 880 ml/min. Intravenös verabreichtes Tiotropium wird überwiegend unverändert über den Urin ausgeschieden (74 %). Nach Inhalation durch COPD-Patienten bis zum Steady-State beträgt die Ausscheidung mit dem Urin 18,6 % der Dosis, wobei die restliche Dosis überwiegend als nicht-resorbierte Substanz im Darm vorliegt und über die Fäzes ausgeschieden wird. Die renale Clearance von Tiotropium übersteigt die glomeruläre Filtrationsrate, was auf eine aktive Ausscheidung in den Urin hinweist. Die effektive Halbwertszeit von Tiotropium nach Inhalation durch COPD-Patienten bewegt sich im Bereich von 27 bis 45 Stunden.
Olodaterol: Die Gesamt-Clearance von Olodaterol bei gesunden Probanden liegt bei 872 ml/min und die renale Clearance bei 173 ml/min. Nach intravenöser Gabe von 14C-markiertem Olodaterol wurden 38 % der radioaktiven Dosis im Urin und 53 % in den Fäzes nachgewiesen. Der im Urin nachgewiesene Anteil an unverändertem Olodaterol lag nach intravenöser Gabe bei 19 %. Nach oraler Anwendung wurden nur 9 % der Radioaktivität (0,7 % unverändertes Olodaterol) im Urin nachgewiesen, der Hauptanteil (84 %) hingegen in den Fäzes gefunden. Über 90 % der Dosis wurden innerhalb von 6 Tagen nach intravenöser bzw. 5 Tagen nach oraler Verabreichung ausgeschieden. Nach Inhalation belief sich die Ausscheidung von unverändertem Olodaterol im Urin innerhalb des Dosierungsintervalls bei gesunden Probanden im Steady-State auf 5-7 % der Dosis. Nach Inhalation sinkt die Olodaterol-Plasmakonzentration in einem mehrphasigen Verlauf, die terminale Halbwertszeit beträgt etwa 45 Stunden.
c. Patientencharakteristika
Tiotropium: Wie bei allen vorwiegend renal ausgeschiedenen Arzneimitteln zu erwarten, war fortgeschrittenes Alter mit einer Abnahme der renalen Clearance von Tiotropium von 347 ml/min bei COPD-Patienten < 65 Jahren auf 275 ml/min bei COPD-Patienten > 65 Jahren verbunden. Dies führte nicht zu einem entsprechenden Anstieg der AUC0-6ss- oder Cmax,ss-Werte.
Olodaterol: Unter Verwendung von Daten aus zwei kontrollierten klinischen Studien, an denen 405 Patienten mit COPD und 296 Patienten mit Asthma teilgenommen hatten, wurde eine pharmakokinetische Metaanalyse durchgeführt. Die Analyse zeigte, dass aufgrund von Effekten von Lebensalter, Geschlecht und Körpergewicht auf die systemische Exposition keine Dosisanpassung notwendig ist.
Rasse
Olodaterol: Der Vergleich pharmakokinetischer Daten innerhalb und zwischen Studien mit Olodaterol ergab eine Tendenz zu einer höheren systemischen Exposition für Japaner und „andere Asiaten“ im Vergleich zu „Kaukasiern“.
In klinischen Studien mit Olodaterol mit einer Dauer von bis zu einem Jahr, an denen „Asiaten“ und „Kaukasier“ teilnahmen, die Olodaterol Respimat in Dosen bis zum 2-Fachen der empfohlenen therapeutischen Dosis erhielten, ergaben sich keine Bedenken bezüglich der Sicherheit.
Niereninsuffizienz
Tiotropium: Eine einmal tägliche Inhalation von Tiotropium bis zum Steady-State führte bei COPD-Patienten mit leichter Nierenfunktionsstörung (CLKr 50-80 ml/min) gegenüber nierengesunden COPD-Patienten (CLKr > 80 ml/min) zu geringfügig erhöhten AUC0_6,ss-Werten (1,8 bis 30 % höher) und ähnlichen Cmax,ss-Werten. Bei Patienten mit mittelgradiger bis schwerer Nierenfunktionsstörung (CLKr < 50 ml/min) kam es nach intravenöser Gabe von Tiotropium, verglichen mit nierengesunden Patienten, zu einer Verdopplung der Gesamtexposition (82 % höhere AUC0-4h und 52 % höhere Cmax). Dieser Befund bestätigte sich nach Inhalation des Trockenpulvers.
Olodaterol: Bei Patienten mit einer Nierenfunktionsstörung gab es keine klinisch relevante Erhöhung der systemischen Exposition.
Leberinsuffizienz
Tiotropium: Eine Leberinsuffizienz dürfte voraussichtlich keinen relevanten Einfluss auf die Pharmakokinetik von Tiotropium besitzen. Tiotropium wird vorwiegend renal eliminiert (74 % bei jungen gesunden Probanden) und durch einfache nicht-enzymatische Esterspaltung zu pharmakologisch inaktiven Produkten abgebaut.
Olodaterol: Patienten mit leichter bis mittelschwerer Leberfunktionsstörung zeigten weder bei der Olodaterol-Elimination noch bei der Proteinbindung Unterschiede im Vergleich zur gesunden Kontrollgruppe. Bei Patienten mit schwerer Leberfunktionsstörung wurde keine Studie durchgeführt.
5.3 Präklinische Daten zur Sicherheit
Tiotropium + Olodaterol
Präklinische Effekte der Kombination Tiotropium/Olodaterol wurden nur nach Expositionen beobachtet, die ausreichend weit über der maximalen humantherapeutischen Exposition lagen, was eine nur geringe Relevanz für die klinische Anwendung anzeigt.
Tiotropium
Studien zur Genotoxizität und zum kanzerogenen Potenzial ließen keine besonderen Gefahren für den Menschen erkennen.
Schädliche Auswirkungen auf Schwangerschaft, embryonale/fetale Entwicklung, Geburtsvorgang oder postnatale Entwicklung konnten nur für matemal-toxische Dosisstufen nachgewiesen werden. Tiotropiumbromid erwies sich bei Ratten und Kaninchen nicht als teratogen. Respiratorische (Reizungen) und urogenitale (Prostatitis) Veränderungen sowie Reproduktionstoxizität wurden nach lokalen oder systemischen Expositionen beobachtet, die mehr als das 5-Fache der therapeutischen Exposition betrugen.
Olodaterol
Studien zur Genotoxizität und zum kanzerogenen Potenzial ließen keine besonderen Gefahren für den Menschen erkennen.
Bei Ratten wurde eine erhöhte Inzidenz von Mesovarium-Leiomyomen beobachtet, bei Mäusen eine erhöhte Inzidenz von Leiomyomen und Leiomyosarkomen des Uterus. Dies gilt als Klasseneffekt bei Nagetieren nach einer Langzeitexposition gegenüber hohen Dosen von ß2-Agonisten. Bisher sind ß2-Agonisten nicht mit Krebserkrankungen beim Menschen in Zusammenhang gebracht worden.
Bei Ratten traten nach der Inhalation von Dosen von 1054 Mikrogramm/kg/Tag keine teratogenen Effekte auf (entspricht mehr als dem 2600-Fachen der Humanexposition (AUC0-24h) bei einer Dosis von 5 Mikrogramm). Bei trächtigen NZW-Kaninchen führte eine inhalative Olodaterol-Dosis von 2489 Mikrogramm/kg/Tag (etwa das 7130-Fache der Humanexposition bei einer Dosis von 5 Mikrogramm, bezogen auf die AUC0-24h) zu einer fetalen Toxizität, wie sie typischerweise nach ß-Adrenozeptor-Stimulation auftritt; diese schloss eine ungleichmäßige Verknöcherung, verkürzte/verkrümmte Knochen, teilgeöffnete Augen, Gaumenspalten und kardiovaskuläre Abnormitäten ein. Nach einer Inhalationsdosis von 974 Mikrogramm/kg/Tag traten keine signifikanten Effekte auf (entspricht etwa dem 1353-Fachen der 5 Mikrogramm-Dosis, bezogen auf die AUC0-241O.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Benzalkoniumchlorid Natriumedetat (Ph.Eur.)
Salzsäure 3,6 % (zur pH-Wert-Einstellung) Gereinigtes Wasser
6.2 Inkompatibilitäten
Nicht zutreffend.
3 Jahre
Haltbarkeit nach Anbruch: 3 Monate
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht einfrieren.
6.5 Art und Inhalt des Behältnisses
Art und Material des Behältnisses, das in Kontakt mit dem Arzneimittel kommt:
Die Lösung ist abgefüllt in einer Polyethylen/Polypropylen-Patrone mit einer Schutzkappe aus Polypropylen mit integriertem Silikondichtungsring. Die Patrone befindet sich in einem Aluminiumzylinder.
Jede Patrone enthält 4 ml Lösung zur Inhalation.
Packungsgrößen und beigefügtes Medizinprodukt:
Einzelpackung:
Doppelpackung:
Dreifachpackung:
Klinikpackung:
1 Respimat Inhalator und 1 Patrone mit 60
2 Einzelpackungen, bestehend aus jeweils 60 Hüben (30 therapeutischen Dosen)
3 Einzelpackungen, bestehend aus jeweils 60 Hüben (30 therapeutischen Dosen)
8 Einzelpackungen, bestehend aus jeweils 60 Hüben (30 therapeutischen Dosen)
Hüben (30 therapeutischen Dosen)
1 Respimat Inhalator und 1 Patrone mit
1 Respimat Inhalator und 1 Patrone mit
1 Respimat Inhalator und 1 Patrone mit
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Boehringer Ingelheim International GmbH Binger Straße 173 55216 Ingelheim am Rhein Deutschland
8. ZULASSUNGSNUMMER(N)
92214.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG 01. Juli 2015
10. STAND DER INFORMATION
Februar 2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Dieses Arzneimittel enthält eine Zubereitung aus Stoffen, deren Wirkung in Kombination in der medizinischen Wissenschaft noch nicht allgemein bekannt ist.
Örtlicher Vertreter des Zulassungsinhabers in Deutschland
Boehringer Ingelheim Pharma GmbH & Co. KG
Binger Straße 173
55216 Ingelheim am Rhein
Deutschland
Telefon: 0 800 / 77 90 900 Telefax: 0 61 32 / 72 99 99 E-Mail: info@boehringer-ingelheim.de
Seite 21 von 21