Zeldox 10 Mg/Ml Suspension Zum Einnehmen
PFIZER ((Logo))
Gebrauchsinformation: Information für den Anwender
ZELDOX®
10 mg/ml Suspension zum Einnehmen
Ziprasidon
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Einnahme
dieses Arzneimittels beginnen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker.
Diese Packungsbeilage beinhaltet:
1. Was ist Zeldox 10 mg/ml Suspension und wofür wird es angewendet?
2. Was müssen Sie vor der Einnahme von Zeldox 10 mg/ml Suspension beachten?
3. Wie ist Zeldox 10 mg/ml Suspension einzunehmen?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Zeldox 10 mg/ml Suspension aufzubewahren?
6. Weitere Informationen
1. Was ist Zeldox 10 mg/ml Suspension und wofür wird es angewendet?
Zeldox 10 mg/ml Suspension gehört zu einer Gruppe von Arzneimitteln, die als Antipsychotika bezeichnet werden.
Zeldox 10 mg/ml Suspension wird bei Erwachsenen zur Behandlung von Schizophrenie eingesetzt. Dabei handelt es sich um eine psychische Erkrankung, die mit folgenden Symptomen einhergeht: Hören, Sehen und Spüren von Dingen, die nicht wirklich vorhanden sind; Glauben an Dinge, die nicht wahr sind; übermäßiges Misstrauen; Abwesenheitsgefühl und Schwierigkeiten beim Aufbauen von sozialen Kontakten; Nervosität; Depressionen oder Ängstlichkeit.
Weiterhin wird Zeldox 10 mg/ml Suspension bei Erwachsenen sowie bei Kindern und Jugendlichen im Alter von 10 bis 17 Jahren zur Behandlung von manischen oder gemischten Episoden mittleren Schweregrades im Rahmen einer bipolaren Störung eingesetzt, einer psychischen Erkrankung, die mit wechselnden Phasen von euphorischen (manischen) oder depressiven Gemütszuständen einhergeht. Die typischen Symptome während der manischen Episoden sind vor allem: euphorisches Verhalten, übertriebene Selbsteinschätzung, Zunahme an Energie, verminderter Schlafbedarf, Konzentrationsmangel oder Hyperaktivität und wiederholtes hochriskantes Verhalten.
2. Was müssen Sie vor der Einnahme von Zeldox 10 mg/ml Suspension beachten?
Zeldox 10 mg/ml Suspension darf nicht eingenommen werden,
- wenn Sie überempfindlich (allergisch) gegenüber Ziprasidon oder einem der sonstigen Bestandteile von Zeldox 10 mg/ml Suspension sind. Eine allergische Reaktion kann sich als Ausschlag, Juckreiz, Gesichts- oder Lippenschwellung oder Atemprobleme zeigen;
- wenn Sie an einer Herzerkrankung leiden oder litten oder kürzlich einen Herzinfarkt hatten;
- wenn Sie bestimmte Arzneimittel gegen Herzrhythmusstörungen einnehmen oder Arzneimittel, die den Herzrhythmus beeinflussen können.
Beachten Sie hierzu bitte auch den Abschnitt „Bei Einnahme von Zeldox 10 mg/ml Suspension mit anderen Arzneimitteln“ weiter unten.
Besondere Vorsicht bei der Einnahme von Zeldox 10 mg/ml Suspension ist erforderlich
Sprechen Sie mit Ihrem Arzt, bevor Sie dieses Arzneimittel anwenden,
- wenn Sie oder ein Verwandter schon einmal venöse Thrombosen (Blutgerinnsel) hatten, denn derartige Arzneimittel werden mit dem Auftreten von Blutgerinnseln in Verbindung gebracht;
- wenn Sie Leberprobleme haben;
- wenn Sie an Krampfanfällen oder Epilepsie leiden oder litten;
- wenn Sie älter sind (über 65 Jahre) und an Demenz leiden;
- wenn Sie ein erhöhtes Schlaganfallrisiko oder eine vorübergehende Verringerung der Blutversorgung des Gehirns haben;
- wenn Sie einen langsamen Ruhepuls haben und/ oder wissen, dass Sie möglicherweise infolge von anhaltenden schweren Durchfällen oder Erbrechen oder durch die Einnahme von Diuretika („Wassertabletten“) an Salzmangel leiden;
- wenn Sie einen schnellen oder unregelmäßigen Herzschlag, Ohnmachtsanfälle, Bewusstlosigkeit oder Schwindelgefühl beim Aufstehen haben, da dies ein Hinweis auf eine unregelmäßige Herzfunktion sein kann.
Wenn bei Ihnen ein Labortest (z. B. Blut, Urin, Leberfunktion, Herzrhythmus) durchgeführt werden soll, informieren Sie bitte Ihren Arzt vorher, dass Sie Zeldox 10 mg/ml Suspension einnehmen, da sich hierdurch die Testergebnisse verändern können.
Bei Einnahme von Zeldox 10 mg/ml Suspension mit anderen Arzneimitteln
Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen/ anwenden bzw. vor Kurzem eingenommen/ angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
NEHMEN SIE ZELDOX NICHT EIN, wenn Sie bestimmte Arzneimittel gegen Herzrhythmusstörungen einnehmen oder Arzneimittel, die den Herzrhythmus beeinflussen können, wie etwa
- Klasse-IA- und Klasse-III-Antiarrhythmika, Arsentrioxid, Halofantrin, Levomethadylacetat, Mesoridazin, Thioridazin, Pimozid, Sparfloxacin, Gatifloxacin, Moxifloxacin, Dolasetronmesilat, Mefloquin, Sertindol oder Cisaprid. Diese Arzneimittel beeinflussen den Herzrhythmus, indem sie das QT-Intervall verlängern. Wenn Sie hierzu weitere Fragen haben, sollten Sie mit Ihrem Arzt sprechen.
Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie derzeit oder vor Kurzem Arzneimittel zur Behandlung folgender Erkrankungen einnehmen bzw. eingenommen haben:
- bakterielle Infektionen; derartige Arzneimittel sind als Antibiotika wie z. B. Makrolidantibiotika oder Rifampicin bekannt;
- Stimmungsschwankungen (können von depressiven Zuständen bis zur Euphorie reichen), Agitiertheit und Verwirrtheit; dies sind die Stimmung stabilisierende Arzneimittel, wie Lithium, Carbamazepin oder Valproat;
- Depressionen; einschließlich bestimmter serotonerger Arzneimittel, z. B. SSRIs wie z. B. Fluoxetin, Paroxetin, Sertralin oder pflanzliche Arzneimittel/ Naturheilmittel, die Johanniskraut enthalten;
- Epilepsie; z. B. Phenytoin, Phenobarbital, Carbamazepin oder Ethosuximid;
- Parkinsonsche Krankheit; z. B. Levodopa, Bromocriptin, Ropinirol oder Pramipexol;
- oder wenn Sie derzeit oder vor Kurzem eines der folgenden Arzneimittel einnehmen bzw. eingenommen haben: Verapamil, Chinidin, Itraconazol oder Ritonavir.
Beachten Sie hierzu auch den vorangegangenen Abschnitt „Zeldox 10 mg/ml Suspension darf nicht eingenommen werden“.
Bei Einnahme von Zeldox 10 mg/ml Suspension zusammen mit Nahrungsmitteln und Getränken
Zeldox 10 mg/ml Suspension MUSS ZU EINER HAUPTMAHLZEIT EINGENOMMEN WERDEN.
Während der Behandlung mit Zeldox 10 mg/ml Suspension sollten Sie keinen Alkohol trinken, da sich hierdurch das Risiko für das Auftreten von Nebenwirkungen erhöhen kann.
Schwangerschaft und Stillzeit
Schwangerschaft
Da dieses Arzneimittel möglicherweise Ihrem Baby schaden kann, sollten Sie Zeldox 10 mg/ml Suspension nicht einnehmen, wenn Sie schwanger sind, außer Ihr Arzt hat es Ihnen empfohlen. Verwenden Sie stets eine wirksame Verhütungsmethode. Informieren Sie umgehend Ihren Arzt, wenn Sie während der Einnahme von Zeldox 10 mg/ml Suspension schwanger geworden sind oder wenn Sie vorhaben, schwanger zu werden.
Bei neugeborenen Babys von Müttern, die Zeldox im letzten Trimenon (letzte 3 Monate der Schwangerschaft) einnahmen, können folgende Symptome auftreten: Zittern, Muskelsteifheit und/ oder -schwäche, Schläfrigkeit, Ruhelosigkeit, Atembeschwerden und Schwierigkeiten bei der Nahrungsaufnahme. Wenn Ihr Baby eines dieser Symptome entwickelt, sollten Sie Ihren Arzt kontaktieren.
Stillzeit
Während der Behandlung mit Zeldox 10 mg/ml Suspension dürfen Sie nicht stillen, da kleine Mengen davon in die Muttermilch übergehen können. Wenn Sie vorhaben zu stillen, sprechen Sie mit Ihrem Arzt, bevor Sie dieses Arzneimittel einnehmen.
Fragen Sie vor der Einnahme/ Anwendung von allen Arzneimitteln Ihren Arzt oder Apotheker um Rat.
Verkehrstüchtigkeit und das Bedienen von Maschinen
Während der Behandlung mit Zeldox 10 mg/ml Suspension können Sie sich müde fühlen. Wenn dies auftritt, dürfen Sie kein Fahrzeug führen und keine Werkzeuge oder Maschinen bedienen, bis die Müdigkeit wieder abgeklungen ist.
Wichtige Informationen über bestimmte sonstige Bestandteile von Zeldox 10 mg/ml Suspension
Zeldox 10 mg/ml Suspension enthält Methyl-4-hydroxybenzoat (E218) und Propyl-4-hydroxybenzoat (E216). Diese können Überempfindlichkeitsreaktionen, auch Spätreaktionen, hervorrufen.
Zeldox 10 mg/ml Suspension zum Einnehmen enthält 4,65 mg Natrium pro dosiertem Milliliter. Dies sollten Sie berücksichtigen, wenn Sie auf den Natriumgehalt in der Ernährung achten müssen. Die übliche Dosis beträgt 4 bis 8 ml zweimal täglich und die tägliche Gesamtaufnahme an Natrium liegt somit zwischen 37,2 und 74,4 mg.
3. Wie ist Zeldox 10 mg/ml Suspension einzunehmen?
Nehmen Sie Zeldox 10 mg/ml Suspension immer genau nach der Anweisung des Arztes ein. Bitte fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht ganz sicher sind.
Nehmen Sie Zeldox 10 mg/ml Suspension stets kurz vor oder nach einer Mahlzeit ein. Zeldox 10 mg/ml Suspension darf nicht mit Essen oder Flüssigkeit vor Einnahme vermischt oder verdünnt werden. Benutzen Sie für die Einnahme immer die mitgelieferte Applikationsspritze.
Erwachsene
Zeldox 10 mg/ml Suspension sollte zweimal täglich eingenommen werden, einmal morgens bei einem ausgiebigen Frühstück und einmal abends beim Abendessen. Die übliche Dosis ist 40 bis 80 mg zweimal täglich. Sie sollten dieses Arzneimittel jeden Tag zur gleichen Zeit einnehmen.
Bei einer längeren Behandlung kann es sein, dass Ihr Arzt Ihre Dosis anpasst. Eine Maximaldosis von 160 mg täglich sollte nicht überschritten werden.
Kinder und Jugendliche mit bipolarer Störung
Die übliche Anfangsdosis ist 20 mg zu einer Mahlzeit. Danach wird Ihr Arzt die für Sie optimale Dosis festlegen.
Bei Kindern mit einem Körpergewicht unter 45 kg sollte eine Maximaldosis von 80 mg täglich und bei Kindern über 45 kg sollte eine Maximaldosis von 160 mg täglich nicht überschritten werden.
Die Sicherheit und Wirksamkeit von Zeldox in der Behandlung von Schizophrenie bei Kindern und Jugendlichen wurden nicht untersucht.
Ältere Personen (älter als 65 Jahre)
Wenn Sie älter sind, wird Ihr Arzt die für Sie geeignete Dosis festlegen. Die Dosis bei über 65Jährigen ist manchmal niedriger als bei jüngeren Menschen. Ihr Arzt wird Ihnen die für Sie geeignete Dosis mitteilen.
Patienten mit Leberproblemen
Wenn Sie Probleme mit der Leber haben, kann es sein, dass Sie Zeldox 10 mg/ml Suspension in einer niedrigeren Dosis einnehmen müssen. Ihr Arzt wird die für Sie geeignete Dosis festlegen.
Wenn Sie eine größere Menge Zeldox 10 mg/ml Suspension eingenommen haben, als Sie sollten,
informieren Sie umgehend Ihren Arzt oder suchen Sie die nächstgelegene Notfallambulanz eines Krankenhauses auf. Nehmen Sie dabei die Faltschachtel von Zeldox 10 mg/ml Suspension mit.
Wenn Sie zu viel Zeldox 10 mg/ml Suspension eingenommen haben, kann es zu Müdigkeit, Schüttelbewegungen, Krampfanfällen und unwillkürlichen Kopf- und Halsbewegungen kommen.
Wenn Sie die Einnahme von Zeldox 10 mg/ml Suspension vergessen haben
Es ist wichtig, dass Sie Zeldox 10 mg/ml Suspension jeden Tag regelmäßig zur gleichen Zeit einnehmen. Wenn Sie eine Dosis vergessen haben, holen Sie diese nach, sobald Sie es bemerken, außer es ist bereits Zeit für die nächste Einnahme. Nehmen Sie in diesem Fall einfach die nächste Dosis ein. Nehmen Sie keine doppelte Dosis ein, um eine vergessene Einnahme auszugleichen.
Wenn Sie die Einnahme von Zeldox 10 mg/ml Suspension abbrechen
Ihr Arzt wird Ihnen sagen, wie lange Sie Zeldox 10 mg/ml Suspension einnehmen müssen. Sie sollten die Anwendung von Zeldox nicht abbrechen, es sei denn, Ihr Arzt hat es so angeordnet.
Es ist wichtig, dass Sie die Behandlung fortsetzen, auch wenn Sie sich besser fühlen. Wenn Sie die Behandlung zu früh beenden, kann es sein, dass Ihre Beschwerden zurückkehren.
Hinweise zur Entnahme
Zeldox 10 mg/ml Suspension soll immer mit der Applikationsspritze, die jeder Packung beigefügt ist, direkt in den Mund verabreicht werden. Sie darf nicht verdünnt oder mit Nahrung oder Getränken gemischt werden. Beachten Sie bitte die folgenden Anweisungen, wie man die Applikationsspritze benutzt.
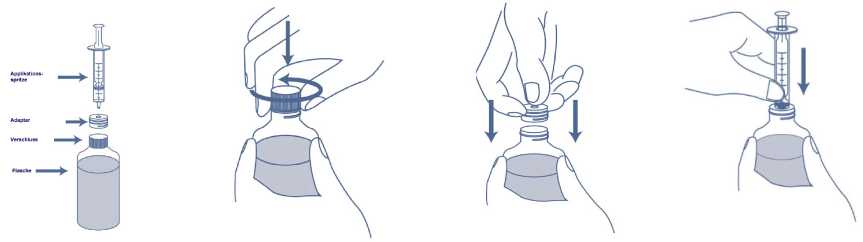
1. Schütteln Sie vor Gebrauch die verschlossene Flasche. Entfernen Sie den kindergesicherten Verschluss durch Drücken auf den Verschluss und gleichzeitiges Drehen gegen den Uhrzeigersinn.
2. Ihr Apotheker hat vielleicht schon den Adapter für die Applikationsspritze auf den Flaschenhals gesteckt. Wenn nicht, stecken Sie den beigefügten Adapter auf den Flaschenhals. Der Adapter ist so konstruiert, dass die Applikationsspritze mit dem Arzneimittel aus der Flasche gefüllt werden kann.
3. Stellen Sie die Flasche auf eine ebene Fläche und halten Sie sie mit einer Hand fest. Mit der anderen Hand stechen Sie die Spitze der Applikationsspritze in den Adapter.
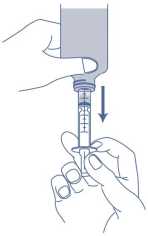
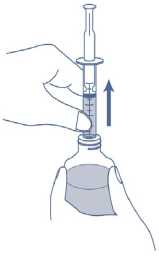
4. Drehen Sie die Flasche auf den Kopf und halten Sie dabei die Applikationsspritze fest an ihrem Platz. Ziehen Sie den Kolben der Applikationsspritze langsam, bis die gewünschte Menge des Arzneimittels aus der Flasche gezogen wurde. Die Applikationsspritze hat Markierungen mit 1,0 ml (10 mg). Um die Dosierung genau abzumessen, sollte die Oberkante des schwarzen Ringes mit der Markierung für die erforderliche Menge des Arzneimittels auf der Applikationsspritze übereinstimmen.
5. Wenn große Blasen sichtbar sind, drücken Sie den Kolben langsam wieder in die Applikationsspritze zurück. Dadurch wird das Arzneimittel wieder in die Flasche zurückbefördert. Wiederholen Sie anschließend noch einmal Schritt 4.
6. Halten Sie die Applikationsspritze und die Flasche fest in der Hand. Drehen Sie die Flasche zusammen mit der Applikationsspritze dann wieder in die aufrechte Position zurück. Trennen Sie die Applikationsspritze von der Flasche.
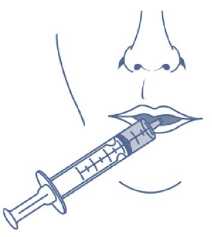
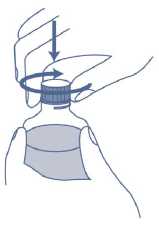
7. Stecken Sie die Spitze der Applikationsspritze in den Mund. Richten Sie die Spitze der Applikationsspritze gegen die Innenseite Ihrer Backen. Drücken Sie LANGSAM den Kolben in die Applikationsspritze hinein. Spritzen Sie das Arzneimittel nicht schnell heraus.
8. Belassen Sie den Adapter an seinem Platz und schrauben Sie den kindersicheren Verschluss wieder auf die Flasche. Waschen Sie die Applikationsspritze wie nachfolgend beschrieben aus.
Hinweise zur Reinigung und Aufbewahrung der Applikationsspritze
1. Die Applikationsspritze muss nach jeder Dosis ausgewaschen werden. Ziehen Sie dazu den Kolben aus der Applikationsspritze heraus und waschen Sie beide Teile mit warmem Seifenwasser. Anschließend mit klarem Wasser ausspülen.
2. Trocknen Sie beide Teile ab. Stecken Sie den Kolben zurück in die Applikationsspritze. Bewahren Sie sie zusammen mit dem Arzneimittel an einem sauberen und sicheren Ort auf.
Wenn Sie weitere Fragen zur Anwendung des Arzneimittels haben, fragen Sie Ihren Arzt
oder Apotheker.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann Zeldox 10 mg/ml Suspension Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen. Die meisten Nebenwirkungen sind jedoch vorübergehend. Manchmal kann es auch schwierig sein, die Beschwerden durch Ihre Erkrankung von einer Nebenwirkung zu unterscheiden.
Wenn Sie eine der folgenden schweren Nebenwirkungen haben, BEENDEN Sie die Einnahme von Zeldox 10 mg/ml Suspension und suchen Sie sofort Ihren Arzt auf:
Gelegentliche Nebenwirkungen (betreffen 1 bis 10 Behandelte von 1 000)
• schneller oder unregelmäßiger Herzschlag, Schwindelgefühl beim Aufstehen, was ein Hinweis auf eine gestörte Herzfunktion sein kann. Dies könnten Beschwerden einer Erkrankung sein, die als orthostatische Hypotonie bekannt ist.
• unwillkürliche/ ungewöhnliche Bewegungen, besonders im Gesicht oder der Zunge
Nebenwirkungen mit unbekannter Häufigkeit (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
• Schwellungen in Gesicht, Lippen, Zunge oder Hals, Schluck- oder Atemprobleme, Nesselfieber. Dies können Zeichen einer schweren allergischen Reaktion, wie z. B. ein Angioödem, sein.
• Fieber, beschleunigte Atmung, Schweißausbruch, Muskelsteifigkeit, Schüttelbewegungen, Schluckbeschwerden und verminderte Wahrnehmungsfähigkeit. Dies können Zeichen eines sogenannten malignen neuroleptischen Syndroms sein.
• Verwirrtheit, Agitiertheit, erhöhte Temperatur, Schweißausbruch, fehlende Koordination der Muskulatur, Muskelzucken. Dies können Zeichen eines so genannten SerotoninSyndroms sein.
• schneller, unregelmäßiger Herzschlag und Ohnmachtsanfälle, die Zeichen für eine Torsade de pointes genannte, lebensgefährliche Erkrankung sein können.
Sie können eine der nachfolgend aufgeführten Nebenwirkungen bekommen. Diese sind im Allgemeinen leicht bis mäßig ausgeprägt und können im Laufe der Zeit auch wieder zurückgehen. Wenn eine Nebenwirkung jedoch schwerwiegend oder anhaltend ist, sollten Sie Ihren Arzt aufsuchen.
Häufige Nebenwirkungen (betreffen 1 bis 10 Behandelte von 100)
• Unruhe
• Bewegungsstörungen einschließlich unwillkürliche Bewegungen, Muskelsteifigkeit und -starrheit, verlangsamte Bewegungen, Schüttelbewegungen, allgemeine Kraftlosigkeit und Müdigkeit
• Schläfrigkeit
• Schwindelgefühl
• Kopfschmerzen
• Verstopfung, Übelkeit, Erbrechen und Magenverstimmung, Mundtrockenheit, erhöhter Speichelfluss
• verschwommenes Sehen
Gelegentliche Nebenwirkungen (betreffen 1 bis 10 Behandelte von 1 000)
• gesteigerter Appetit
• Probleme bei gezielten Bewegungen
• Aufgeregtheit oder Angst, Engegefühl im Hals, Albträume
• Krampfanfälle, unwillkürliche Augenbewegungen in eine bestimmte Richtung,
Ungeschicklichkeit, Sprachstörungen, Taubheitsgefühl, Kribbeln, Aufmerksamkeitsstörungen, Sabbern, starke Schläfrigkeit tagsüber, Erschöpfung
• Herzklopfen (Palpitationen), das Gefühl, beim Aufstehen aus Sitzposition ohnmächtig zu werden, Kurzatmigkeit
• Lichtempfindlichkeit, Ohrgeräusche
• Halsschmerzen, Schluckbeschwerden, geschwollene Zunge, Durchfall, Blähungen, Magenbeschwerden
• juckender Hautausschlag, Akne
• Muskelkrämpfe, steife oder geschwollene Gelenke
• Durst, Schmerzen, Beschwerden im Brustbereich, Gangstörungen
Seltene Nebenwirkungen (betreffen 1 bis 10 Behandelte von 10 000)
• laufende Nase
• Abnahme des Calciumspiegels im Blut
• Panikattacken, depressive Verstimmung, verzögerte Denkvorgänge, Emotionslosigkeit
• Schiefhals (Tortikollis), Lähmung, Syndrom der ruhelosen Beine
• teilweiser oder vollständiger Verlust der Sehfähigkeit auf einem Auge, Augenjucken, trockene Augen, Sehstörungen
• Ohrenschmerzen
• Schluckauf
• Sodbrennen
• dünner Stuhlgang
• Haarausfall, Gesichtsschwellung, Hautirritationen
• Unfähigkeit, den Mund zu öffnen
• Harninkontinenz, Schmerzen oder Schwierigkeiten beim Wasserlassen
• verminderte oder verstärkte Erektion, abgeschwächter Orgasmus, anormaler Milchfluss
• Vergrößerung der Brustdrüsen bei Frauen und Männern
• Hitzegefühl, Fieber
• Abnahme oder Zunahme der weißen Blutzellen (bei Blutuntersuchungen)
• ungewöhnliche Werte beim Leberfunktionstest
• hoher Blutdruck
• ungewöhnliche Ergebnisse bei Blut- oder Herzfrequenzuntersuchungen
• erhabene und entzündete rote Hautflecken, die mit weißen Schuppen bedeckt sind und als Psoriasis bekannt sind
Nebenwirkungen mit unbekannter Häufigkeit (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
• schwere allergische Reaktion
• Bei älteren Personen mit Demenz wurde unter der Einnahme von Antipsychotika im Vergleich zu denjenigen, die keine Antipsychotika erhielten, ein leichter Anstieg von Todesfällen beobachtet.
• Blutgerinnsel in den Venen, vor allem in den Beinen (mit Schwellungen, Schmerzen und Rötungen der Beine), die möglicherweise über die Blutbahn in die Lunge gelangen und dort Brustschmerzen sowie Schwierigkeiten beim Atmen verursachen können. Wenn Sie eines dieser Symptome bei sich beobachten, holen Sie bitte unverzüglich ärztlichen Rat ein.
• Einschlafstörungen, unwillkürliches Wasserlassen
• übermäßig heiterer Gemütszustand, merkwürdige Denkmuster und Überaktivität
• Bewusstlosigkeit
• große Quaddeln mit starkem Juckreiz
• ungewöhnliche, schmerzhafte Dauererektion des Penis
• Gesichtsmuskelschwäche
• Arzneimittelentzugssyndrom des Neugeborenen
Informieren Sie bitte Ihren Arzt oder Apotheker, wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind.
5. Wie ist Zeldox 10 mg/ml Suspension aufzubewahren?
Arzneimittel für Kinder unzugänglich aufbewahren.
Sie dürfen das Arzneimittel nach dem auf dem Umkarton nach „Verwendbar bis" angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Nach dem Öffnen der Flasche sollte der Inhalt innerhalb von 2 Monaten aufgebraucht werden.
Arzneimittel dürfen nicht im Abwasser entsorgt werden. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr benötigen. Diese Maßnahme hilft die Umwelt zu schützen.
6. Weitere Informationen
Was Zeldox 10 mg/ml Suspension enthält
• Der Wirkstoff ist Ziprasidon. 1 ml der Suspension enthält Ziprasidonhydrochlorid-Monohydrat entsprechend 10 mg Ziprasidon.
• Die sonstigen Bestandteile sind Methyl-4-hydroxybenzoat (E218), Propyl-4-hydroxybenzoat (E216), Citronensäure (E330), Natriumcitrat (E331), Natriumchlorid, Xylitol (E967), Xanthangummi (E415), Polysorbat 80 [pflanzlich] (E433), hochdisperses Siliciumdioxid, Kirscharoma SN080109 und gereinigtes Wasser.
Wie Zeldox 10 mg/ml Suspension aussieht und Inhalt der Packung
Der Inhalt ist eine weiß bis gelbliche, opake, wässrige Suspension mit Kirschgeschmack.
Zeldox 10 mg/ml Suspension zum Einnehmen ist in Flaschen mit 60 ml erhältlich.
Den Flaschen ist eine 8-ml-Applikationsspritze zum Einnehmen und ein Adapter zum Durchstechen beigelegt. Die 8-ml-Applikationsspritze hat Markierungen mit 1,0 ml (10 mg).
Pharmazeutischer Unternehmer
PFIZER PHARMA GmbH
Linkstr. 10
10785 Berlin
Tel.: 030 550055-51000
Fax: 030 550054-10000
Hersteller
R-Pharm Germany GmbH Heinrich-Mack-Str. 35 89257 Illertissen Deutschland
oder
Pfizer Service Company BVBA Hoge Wei 10 B-1930 Zaventem Belgien
Mitvertreiber
PHARMACIA GmbH
Linkstr. 10
10785 Berlin
Tel.: 030 550055-51000
Fax: 030 550054-10000
Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:
Dänemark, Deutschland, Finnland, Island, Italien, Norwegen, Österreich, Portugal, Schweden, Spanien: Zeldox Griechenland: Geodon
Diese Gebrauchsinformation wurde zuletzt überarbeitet im Oktober 2014.
palde-4v26zx-su-10
palde-4v26zx-su-10 10 14.08.2014