Zomacton 10 Mg/Ml Pulver Und Lösungsmittel Zur Herstellung Einer Injektionslösung In Einer Fertigspritze
FACHINFORMATION
(Zusammenfassung der Merkmale eines Arzneimittels)
1. BEZEICHNUNG DES ARZNEIMITTELS
ZOMACTON 10 mg/ml
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Somatropin* 10 mg
(10 mg/ml in einer Durchstechflasche nach Zubereitung)
* Hergestellt in Escherichia coli mit rekombinanter DNA-Technologie Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1
3. DARREICHUNGSFORM
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung.
ZOMACTON ist ein weißes bis fast weißes, lyophilisiertes Pulver in einer Durchstechflasche. Das Lösungsmittel in einer Spritze ist klar und farblos.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
ZOMACTON wird angewendet zur:
• Langzeitbehandlung einer Wachstumsstörung von Kindern, infolge unzureichender Sekretion körpereigenen Wachstumshormons.
• Langzeitbehandlung einer Wachstumsstörung infolge Ullrich-Turner-Syndroms gesichert durch Chromosomenanalyse.
4.2 Dosierung, Art und Dauer der Anwendung
Die Therapie mit ZOMACTON sollte nur unter Aufsicht eines qualifizierten Arztes, der Erfahrung in der Behandlung von Patienten mit Wachstumshormonmangel hat, erfolgen.
Die Dosierung von ZOMACTON erfolgt individuell nach Anweisung des Arztes.
Die Behandlungsdauer, normalerweise ein Zeitraum von mehreren Jahren, ist abhängig vom maximal zu erreichenden therapeutischen Nutzen.
Die subkutane Injektion von Wachstumshormon kann zur Abnahme oder Zunahme des Fettgewebes an der Injektionsstelle führen. Daher wird empfohlen, die Injektionsstelle zu wechseln.
Es wird eine Dosierung von 0,17 - 0,23 mg/kg Körpergewicht/Woche (ca. 4,9 - 6,9 mg/m Körperoberfläche) empfohlen, .aufgeteilt in 6 - 7 tägliche subkutane Injektionen (dies entspricht einer tägliches Injektion von etwa 0,02 - 0,03 mg/kg Körpergewicht oder 0,7 - 1,0 mg/m2 Körperoberfläche).
Die Gesamtdosis pro Woche von 0,27 mg/kg Körpergewicht bzw. 8 mg/m2 Körperoberfläche sollte nicht überschritten werden (dies entspricht einer täglichen Injektion von bis zu 0,04 mg/kg).
ULLRICH-TURNER-SYNDROM:
2
Allgemein wird eine Dosierung von 0,33 mg/kg Körpergewicht (ca. 9,86 mg/m Körperoberfläche) pro Woche, aufgeteilt in 6 - 7 subkutane Injektionen, empfohlen. Dies entspricht einer täglichen Injektion von 0,05 mg/kg Körpergewicht oder 1,40 - 1,63 mg/m2 Körperoberfläche.
Hinweise für die Herstellung siehe Abschnitt 6.6.
Verabreichung:
Die Verabreichung von ZOMACTON 10 mg/ml erfolgt entweder mit dem ZomaJet Vision X, einem nadellosen Injektionsgerät, oder mit einer herkömmlichen Spritze.
Entsprechende Gebrauchsanweisungen für die Handhabung des ZomaJet Vision X sind in einer Broschüre enthalten, die dem Patienten mit dem Gerät überreicht wird.
4.3 Gegenanzeigen
Überempfindlichkeit gegenüber Somatropin oder einen anderen Bestandteil.
Bei Anzeichen einer Tumoraktivität darf Somatropin nicht angewendet werden. Vor Beginn einer Therapie mit Wachstumshormonen müssen intrakranielle Tumoren inaktiv und eine Anti-Tumor-Therapie abgeschlossen sein. Bei Hinweisen auf Tumorwachstum sollte die Behandlung abgebrochen werden.
Kinder mit geschlossenen Epiphysenfugen sollten nicht mit Somatropin zur Wachstumsförderung behandelt werden.
Patienten mit akuten kritischen Erkrankungen, die an Komplikationen nach Operationen am offenen Herzen, Operationen des Bauchraums, multiplen Unfalltraumata, akuter respiratorischer Insuffizienz oder Ähnlichem leiden, sollten nicht mit Somatropin behandelt werden.
Bei Kindern mit chronischer Nierenerkrankung sollte die Behandlung mit Somatropin nach einer Nierentransplantation abgebrochen werden.
4.4 Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die empfohlene tägliche Gesamtdosis sollte nicht überschritten werden (siehe Abschnitt 4.2).
Sehr selten wurden Fälle von Myositis beobachtet, die möglicherweise durch das Konservierungsmittel Metacresol verursacht wurden. Bei Auftreten einer Myalgie oder
unverhältnismäßig großem Schmerz an der Injektionsstelle sollte eine Myositis in Betracht gezogen werden. Ist dies der Fall, sollte eine ZOMACTON-Formulierung ohne Metacresol angewendet werden.
ZOMACTON darf nicht zur Langzeitbehandlung von Kindern mit Wachstumsstörungen aufgrund eines genetisch gesicherten Prader-Willi-Syndroms eingesetzt werden, es sei denn, sie haben auch einen diagnostizierten Wachstumshormonmangel. Es gibt Berichte über Schlafapnoe und plötzlichen Tod nach Therapiebeginn mit Wachstumshormon bei Kindern mit Prader-Willi-Syndrom, bei denen einer oder mehrere der folgenden Risikofaktoren vorlagen: schwere Fettleibigkeit, Verengung der oberen Atemwege, Schlafapnoe oder unerkannte Atemwegsinfektionen in der Vorgeschichte.
Selten wurde eine benigne intrakranielle Hypertension beobachtet. Bei schweren oder wiederkehrenden Kopfschmerzen, Sehstörungen und Übelkeit/Erbrechen sollte eine Funduskopie durchgeführt werden, um ein Papillenödem zu erkennen. Bei nachgewiesenem Papillenödem sollte eine benigne intrakranielle Hypertension in Betracht gezogen und ggf. die Therapie mit Wachstumshormon abgebrochen werden (siehe auch Abschnitt 4.8). Z.Zt. gibt es keine Empfehlungen für eine klinisch gesicherte Therapieentscheidung bei Patienten mit überstandener intrakranieller Hypertension. Wenn die Wachstumshormontherapie wieder aufgenommen wird, ist eine sorgfältige Überwachung hinsichtlich intrakranieller Hypertension erforderlich.
Bei wenigen Patienten mit Wachstumshormonmangel wurde eine Leukämie festgestellt. Diese trat sowohl bei Patienten auf, die mit Wachstumshormon behandelt wurden, als auch bei unbehandelten Patienten. Es gibt jedoch keine Hinweise, dass Leukämie bei mit Wachstumshormon behandelten Patienten ohne Risikofaktoren häufiger auftritt.
Wie bei allen Somatropin-haltigen Arzneimitteln kann ein geringer Prozentsatz Patienten Antikörper gegen Somatropin entwickeln. Die Bindungskapazität dieser Antikörper ist gering, und es wurden keine Auswirkungen auf die Wachstumsrate festgestellt. Patienten, die nicht auf die Therapie ansprechen, sollten auf Antikörper getestet werden.
Wachstumshormon erhöht die extrathyroidale Konversion von T4 in T3 und kann so eine beginnende Hypothyreose demaskieren. Bei allen Patienten sollte daher die Schilddrüsenfunktion überwacht werden. Bei Patienten mit Hypophysenunterfunktion muss die Standard-Substitutionstherapie während der Somatropin-Therapie engmaschig überwacht werden.
Da Somatropin die Insulin-Sensitivität verringern kann, sollten Patienten auf eine nachweisbare Glukose-Intoleranz überwacht werden. Bei Patienten mit Diabetes mellitus kann es notwendig sein, die Insulindosis nach Beginn der Somatropin-Therapie anzupassen. Patienten mit Diabetes oder Glukose-Intoleranz sollten während der Somatropin-Therapie engmaschig überwacht werden. Zomacton sollte weiterhin mit Vorsicht bei Patienten mit einer familiären Prädisposition für dieses Krankheitsbild eingesetzt werden
Patienten mit Wachstumshormonmangel infolge einer intrakraniellen Läsion sollten hinsichtlich einer Verschlechterung oder eines Wiederauftretens des zugrunde liegenden Krankheitsprozesses überwacht werden. Bei Überlebenden einer Krebserkrankung im Kindesalter, die nach ihrem ersten Neoplasma mit Somatropin behandelt wurden, wurde über ein erhöhtes Risiko für ein weiteres Neoplasma berichtet. Bei Patienten, die wegen ihres ersten Neoplasmas mit einer Bestrahlung des Kopfes behandelt wurden, traten intrakranielle Tumoren, vor allem Melangiome, am häufigsten auf.
Bei Verschlechterung oder Wiederauftreten der intrakraniellen Läsion ist die Therapie mit ZOMACTON abzubrechen. Bei Patienten mit früheren malignen Erkrankungen sollte besonders auf Anzeichen eines Rezidivs geachtet werden.
Skoliose kann bei Kindern mit schnellem Längenwachstum voranschreiten. Anzeichen einer Skoliose während der Somatropin-Behandlung sollten überwacht werden.
Bei Patienten mit endokrinologischen Störungen wird häufiger eine Verschiebung der Oberschenkelkopfepiphyse beobachtet. Daher sollte der behandelnde Arzt auf ein Hinken oder Klagen über Hüft- oder Knieschmerzen achten.
Die Auswirkungen der Wachstumshormonbehandlung auf den Heilungsprozess wurden in zwei placebo-kontrollierten Studien an 522 kritisch erkrankten Erwachsenen mit Komplikationen nach Operationen am offenen Herzen, Operationen des Bauchraums, multiplen Unfalltraumata oder akuter respiratorischer Insuffizienz untersucht.
Die Mortalität war bei den Wachstumshormon-behandelten Patienten höher (42 % vs. 19 %; Dosen von 5,3 bis 8 mg/Tag) als bei den Placebo-behandelten. Deshalb sollten diese Patienten nicht mit Wachstumshormon behandelt werden. Da es keine Informationen zur Sicherheit einer Wachstumshormonbehandlung bei kritisch erkrankten Patienten gibt, sollte das Nutzen-/Risiko-Verhältnis sorgfältig abgewogen werden.
Vor Zulassung wurde an ausschließlich kaukasischen Kindern eine 12-wöchige Studie zur lokalen Verträglichkeit von ZOMACTON 10 mg/ml mit dem nadelfreien Injektionsgerät ZomaJet Vision X durchgeführt.
Bei Patienten, die mit Somatropin behandelt werden, sollte eine Pankreatitis, die selten vorkommt, in Betracht gezogen werden. Das gilt insbesondere für Kinder, die Abdominalkrämpfe entwickeln.
ZOMACTON enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro Dosiereinheit.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die gleichzeitige Gabe von Glucocorticoiden kann den wachstumsfördernden Effekt von Somatropin-haltigen Arzneimitteln verringern. Daher sollte bei Patienten, bei denen aufgrund ungenügender ACTH-Ausschüttung eine Substitution mit Glucocorticoiden erforderlich ist, die Dosierung sorgfältig angepasst werden, um eine Hemmung des Wachstumshormons zu vermeiden.
Hohe Dosen von Androgenen, Östrogenen oder Anabolika können die Knochenreifung beschleunigen und daher die maximal erreichbare Körpergröße vermindern.
Somatropin kann eine Insulinresistenz verursachen. Bei Patienten mit Diabetes kann daher eine Anpassung der Insulindosierung notwendig sein.
Eine Interaktions-Studie an erwachsenen Patienten mit GH-Mangel zeigte, dass Somatropin die Clearance von Substanzen, die bekanntlich durch Cytochrom P450 Isoenzyme metabolisiert werden, beschleunigen kann. Insbesondere die Clearance der Substanzen, die über Cytochrom P450 3A4 metabolisiert werden (z.B. Sexualhormone, Kortikosteroide, Antikonvulsiva und Cyclosporin) kann besonders beschleunigt werden. Dies führt zu reduzierten Plasmaspiegeln dieser Substanzen. Die klinische Signifikanz ist nicht bekannt.
4.6 Schwangerschaft und Stillzeit
Es liegen keine klinischen Daten zur Auswirkung von ZOMACTON auf eine Schwangerschaft vor.
Es gibt keine Daten über die Anwendung von Somatropin bei trächtigen Tieren (siehe Abschnitt 5.3 Präklinische Daten zur Sicherheit).
Daher sollte ZOMACTON während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine Verhütungsmittel verwenden, nicht angewendet werden.
Es wurden keine Studien mit Somatropin-haltigen Arzneimitteln bei stillenden Frauen durchgeführt. Es ist nicht bekannt, ob Somatropin in die Muttermilch übergeht. Somatropinhaltige Arzneimittel sollten daher mit Vorsicht während der Stillzeit eingesetzt werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Somatropin-haltige Arzneimittel haben keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Die subkutane Injektion von Wachstumshormon kann zur Zu- oder Abnahme des Fettgewebes sowie zu punktuellen und kleinflächigen Blutungen an der Injektionsstelle führen. Selten können an der Injektionsstelle Schmerzen und juckende Hautrötungen auftreten.
|
Sehr häufig (>1/10) |
Häufig (>1/100, <1/10) |
Gelegentlich (>1/1.000, <1/100) |
Selten (>1/10.000, <1/1.000) |
Sehr selten (<1/10.000) | |
|
Erkrankungen des Blutes und des Lymphsystems |
Anämie | ||||
|
Herzerkrankungen |
Tachykardie, Hypertension (bei Erwachsenen) |
Hypertension (bei Kindern) | |||
|
Erkrankunen des Ohrs und des Labyrinths |
Schwindel | ||||
|
Endokrine Erkrankungen |
Hypothyreose | ||||
|
Augenerkrankungen |
Papillenödem, Diplopie | ||||
|
Erkrankungen des Gastrointestinaltrakts |
Erbrechen, Abdominalschmerz, Flatulenz, Übelkeit |
Diarrhoe | |||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Ödem (bei Erwachsenen), peripheres Ödem (bei Erwachsenen) |
Ödem (bei Kindern), peripheres Ödem (bei Kindern), Reaktionen an der Injektionsstelle, Asthenie |
Schwäche, Atrophie an der Injektionsstelle, Blutungen an der Injektionsstelle, Injektionsstelle geschwollen, Hypertrophie | ||
|
Erkrankungen des Immunsystems |
Bildung von Antikörpern | ||||
|
Untersuchungen |
Anormaler Nierenfunktionstest | ||||
|
Stoffwechsel- und Ernährungsstörungen |
Milde Hyperglykämie (bei Erwachsenen) |
Beeinträchtigte Glukosetoleranz (bei Kindern) |
Hypoglykämie, Hyperphosphatämie |
Diabetes mellitus Typ II | |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Arthralgie (bei Erwachsenen), Myalgie (bei Erwachsenen) |
Arthralgie (bei Kindern), Myalgie (bei Kindern) Steifheit in den Extremitäten (bei Erwachsenen) |
Muskelatrophie, Knochenschmerzen, Karpaltunnelsyndrom, Steifheit in den Extremitäten (bei Kindern) | ||
|
Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen) |
Maligne Neoplasmen, Neoplasmen |
Leukämie (bei Kindern) |
|
Sehr häufig (>1/10) |
Häufig (>1/100, <1/10) |
Gelegentlich (>1/1.000, <1/100) |
Selten (>1/10.000, <1/1.000) |
Sehr selten (<1/10.000) | |
|
Erkrankungen des Nervensystems |
Kopfschmerzen (bei Erwachsenen), Parästhesie (bei Erwachsenen) |
Kopfschmerzen, Hypertension, Schlaflosigkeit (bei Erwachsenen) |
Somnolenz, Nystagmus |
Neuropathie, erhöhter intrakranieller Druck, Schlaflosigkeit (bei Kindern), Parästhesie (bei Kindern) | |
|
Psychiatrische Erkrankungen |
Persönlichkeitsstörungen | ||||
|
Erkrankungen der Nieren und Harnwege |
Harninkontinenz, Hämaturie, Polyurie, Störung der Harnfrequenz, Harnanormalität | ||||
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Ausfluss, Gynäkomastie (bei Erwachsenen) |
Gynäkomastie (bei Kindern) | |||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Lipodystrophie, Hautatrophie, Dermatitis exfoliativa, Urtikaria, Hirsutismus, Hauthypertrophie |
Nach Markteinführung wurde während der Therapie mit Wachstumshormon über das Auftreten von Pankreatitis berichtet (Häufigkeit unbekannt).
Antikörper gegen Somatropin: Das Protein Somatropin kann die Bildung von Antikörpern fördern. Je nach Arzneimittel konnte die Prozentzahl der behandelten Patienten, die Antikörper gebildet hatten, identifiziert werden. Ihre Bindungsfähigkeit und Titer sind im Allgemeinen niedrig und haben keine klinischen Folgen. Bei Nichtansprechen auf die Somatropin-Therapie sollte jedoch auf Antikörper getestet werden.
Leukämie: Sehr selten wurden Fälle von Leukämie bei Kindern mit Wachstumshormonmangel berichtet, von denen einige mit Somatropin behandelt worden waren und nach Markteinführung beobachtet wurden.
Bei Kindern, die mit Wachstumshormon behandelt wurden, wurden eine Lösung der Femoralepiphyse und Morbus Legg-Calve-Perthes beobachtet. Verschiebung der Oberschenkelkopfepiphyse kommt bei endokrinologischen Störungen häufiger vor, während Morbus Legg-Calve-Perthes häufiger bei Kleinwuchs beobachtet wird. Es ist jedoch nicht bekannt, ob diese beiden Krankheitsbilder unter der Somatropin-Therapie häufiger auftreten oder nicht. Bei Beschwerden oder Schmerzen im Bereich der Hüfte bzw. Knie sollten diese Möglichkeiten in Betracht gezogen werden.
Andere Nebenwirkungen sind Klasseneffekte, wie Hypergklykämie aufgrund verringerter Insulin-Sensitivität, erniedrigtes freies Thyroxin und die mögliche Entwicklung einer benignen intrakraniellen Hypertension.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Die empfohlene ZOMACTON-Dosierung sollte nicht überschritten werden.
Über eine Überdosierung mit dem Wachstumshormon wurde bisher nicht berichtet, jedoch kann eine akute Überdosierung zur Hypoglykämie und anschließend zur reaktiven Hyperglykämie führen.
Die Auswirkungen einer langzeitigen Überdosierung sind unbekannt. Eine solche Überdosierung könnte zu Symptomen führen wie bei einer Überproduktion von Wachstumshormon (wie z.B. Akromegalie).
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Somatropin und Somatropin-Agonisten ATC-Code: H01 AC01
Pharmakodynamische Eigenschaften
Die Aminosäuresequenz, Kettenlänge (191 Aminosäuren) und das pharmakokinetische Profil entsprechen denen des natürlich vorkommenden hypophysären Wachstumshormons. ZOMACTON hat die gleichen pharmakologischen Wirkungen wie das endogene Hormon.
Skelettsystem
Beim Menschen bewirkt Wachstumshormon generell ein proportionales
Knochenwachstum. Bei Kindern mit nachgewiesenem hypophysären
Wachstumshormonmangel bewirkt die exogene Gabe von ZOMACTON eine Zunahme des Längenwachstums. Die messbare Höhenzunahme nach ZOMACTON-Gabe resultiert aus der Wirkung des Wachstumshormons auf die Epiphysenplatten der Röhrenknochen. Bei Kindern, die nicht genügend hypophysäres körpereigenes Wachstumshormon bilden, bewirkt ZOMACTON höhere Wachstumsraten und höhere IGF-1-Konzentrationen (Insulin-like Growth Faktor/Somatomedin C) vergleichbar denen, die nach Therapie mit hypophysärem Wachstumshormon erreicht wurden. Erhöhte Serumkonzentrationen der alkalischen Phosphatase spielen ebenfalls eine Rolle.
Andere Organe und Gewebe
Das Wachstumshormon bewirkt auch eine Größenzunahme anderer Organe, proportional zur Zunahme an Körpergewicht. Die Veränderungen umfassen: ein schnelleres Wachstum des Bindegewebes, der Haut und der Hautanhangsgebilde; eine Zunahme der Skelettmuskulatur mit erhöhter Zahl der Zellen und Vergrößerung der Zellen; Wachstum der Thymusdrüse, Vergrößerung der Leber mit gesteigerter zellulärer Proliferation und eine geringe Größenzunahme der Gonaden, der Nebennieren und der Schilddrüse.
Über ein disproportioniertes Wachstum der Haut, der platten Knochen sowie eine beschleunigte Sexualreife ist in Verbindung mit der Wachstumshormontherapie nicht berichtet worden.
Eiweiß-, Kohlehydrat- und Fettstoffwechsel
Wachstumshormon bewirkt eine Stickstoffretention und erhöht den Aminosäuretransport ins Gewebe; dies verstärkt die Proteinsynthese. Der Verbrauch an Kohlehydraten und die Lipogenese werden durch Wachstumshormon vermindert. Wachstumshormon besitzt in hohen Dosen oder bei Insulinmangel diabetogene Eigenschaften. Dies kann zu Symptomen führen, die für den Nüchternzustand typisch sind (z.B. Kohlehydratintoleranz, Hemmung der Lipogenese, Fettabbau und Ketose).
Mineralstoffwechsel
Die Behandlung mit Wachstumshormon führt nicht zu Veränderungen der Natrium-, Kalium- und Phosphorwerte. Eine erhöhte Calziumausscheidung durch die Nieren wird durch eine höhere Resorption im Darm wieder ausgeglichen. Die Calziumkonzentrationen im Serum unterscheiden sich nicht signifikant bei Patienten, die mit ZOMACTON oder hypophysärem Wachstumshormon behandelt wurden. Sowohl nach ZOMACTON als auch nach hypophysärem Wachstumshormon traten erhöhte Serumkonzentrationen der anorganischen Phosphate auf. Eine Kumulation dieser Mineralien weist auf einen erhöhten Bedarf während der Gewebssynthese hin.
5.2 Pharmakokinetische Eigenschaften
24 Probanden erhielten subkutan 1,67 mg Somatropin, entweder durch konventionelle subkutane Injektion oder mit dem nadelfreien Injektionsgerät ZomaJet Vision. 3,5 - 4
Stunden nach der Injektion des Arzneimittels wurden maximale Plasmaspiegel von ca. 20 ng/ml nachgewiesen.
Bei Verabreichung der Substanz mit dem nadelfreien Injektionsgerät ZomaJet Vision ist die terminale Halbwertszeit 2,6 Stunden. Dies ist wahrscheinlich darauf zurückzuführen, dass der Resorptionsprozess geschwindigkeitsbegrenzend ist.
Daten von anderen Somatropin-haltigen Arzneimitteln legen nahe, dass die Bioverfügbarkeit von subkutan verabreichtem Somatropin bei gesunden Erwachsenen ca. 80 % beträgt und dass sowohl die Leber als auch die Nieren wichtige Protein-katabolisierende Organe zum Abbau der Substanz sind.
5.3 Präklinische Daten zur Sicherheit
Nicht-klinische Daten aus konventionellen Studien zur Toxizität und Genotoxizität bei wiederholter Verabreichung zeigten keine spezielle Gefährdung für den Menschen.
Genetisch hergestelltes Somatropin entspricht dem endogenen humanen hypophysären Wachstumshormon. Es hat die gleichen biologischen Eigenschaften und wird üblicherweise in physiologischen Dosen angewendet. Da in den Bereichen Sicherheitspharmakologie, Reproduktionstoxizität und Karzinogenität keine Effekte zu erwarten sind, wurden hierzu keine Studien durchgeführt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
1 Durchstechflasche enthält;
Mannitol
Natriummonohydrogenphosphat-Dodecahydrat (Ph.Eur.) Natriumdihydrogenphosphat-Dihydrat
1 Spritze mit 1 ml Lösungsmittel enthält:
Metacresol (Ph. Eur.)
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Da keine Vergleichsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
2 Jahre
Nach der Zubereitung maximal 28 Tage im Kühlschrank bei +2 °C - +8 °C lagern.
Nach der Zubereitung die Durchstechflaschen aufrecht lagern.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (+2 °C - +8 °C); in der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Lagerungsbedingungen des rekonstituierten Arzneimittels siehe Abschnitt 6.3.
Sets für die Anwendung mit dem nadelfreien Injektionsgerät ZomaJet Vision X:
Pulver: Durchstechflasche (Glasart I) mit einem Stopfen (Gummi, Halobutylpolymer), einer Bördelkappe aus Aluminium und einer „Flip-Off“-Kappe aus Plastik Lösungsmittel: Spritze (Glasart I) mit Kappe (Gummi, Halobutylpolymer), Kolbenstopfen (Gummi, Halobutylpolymer) und Durchstechflaschen-Adapter (Polykarbonat und Silikongummi)
Packungsgrößen:1,3 und 5
Sets für die Anwendung mit einer herkömmlichen Spritze:
Pulver: Durchstechflasche (Glasart I) mit einem Stopfen (Gummi, Halobutylpolymer), einer Bördelkappe aus Aluminium und einer „Flip-Off“-Kappe aus Plastik Lösungsmittel: Spritze (Glasart I) mit Kappe (Gummi, Halobutylpolymer), Kolbenstopfen (Gummi, Halobutylpolymer) und Transfer-Konnektor für das Lösungsmittel (Polykarbonat)
Packungsgrößen: 1, 3 und 5
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Herstellung
Das Pulver darf nur mit dem in der Spritze beigefügten Lösungsmittel gelöst werden. Die detaillierte Anleitung für die Zubereitung steht in der Gebrauchsinformation.
Es folgt eine allgemeine Beschreibung der Zubereitung und Verabreichung. Die Zubereitung soll möglichst aseptisch erfolgen.
1. Waschen Sie sich die Hände.
2. Entfernen Sie die gelbe Plastikschutzkappe von der Durchstechflasche.
3. Reinigen Sie den Gummistopfen der Durchstechflasche mit einer antiseptischen Lösung, um den Inhalt vor Verunreinigung zu schützen.
4. Setzen Sie den Durchstechflaschen-Adapter oder den Transfer-Konnektor für das Lösungsmittel in die Mitte des Gummistopfens der Durchstechflasche, so dass der Dorn nach unten zeigt. Drücken Sie jetzt den Adapter fest nach unten, bis er einrastet. Entfernen Sie die Kappe des Durchstechflaschen-Adapters.
5. Nehmen Sie die Spritze und entfernen Sie die graue Kappe. Stecken Sie die
Spritze in den Durchstechflaschen-Adapter/Transfer-Konnektor der
Durchstechflasche und injizieren Sie das Lösungsmittel langsam in die
Durchstechflasche. Achten Sie darauf, dass das Lösungsmittel an der Wand der Durchstechflasche herunterläuft, um Schaumbildung zu vermeiden.
6. Setzen Sie die Kappe des Durchstechflaschen-Adapters/Transfer-Konnektors
wieder auf den Durchstechflaschen-Adapter bzw. Transfer-Konnektor.
7. Schwenken Sie die Durchstechflasche, bis sich das Pulver vollständig gelöst hat. Nicht schütteln, dies kann die Denaturierung des Wirkstoffs zur Folge haben.
8. Sollte die Lösung trübe sein oder Schwebstoffe enthalten, darf sie nicht verwendet werden. Sollte die Lösung trübe sein, wenn sie aus dem Kühlschrank kommt, warten Sie, bis sie Zimmertemperatur erreicht hat. Sollte die Trübung weiter bestehen, muss die Durchstechflasche und ihr Inhalt vernichtet werden. Der Inhalt muss nach der Zubereitung klar und farblos sein.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Herstellung der Lösung mit dem Durchstechflaschen-Adapter zur Verwendung
mit dem ZomaJet Vision X.
11
Fertigspntze
graue Spntzen-trappe_
^^^^weiße Kappe des | I Durchstech-_ flaschen-Adapters
IQ GEI
Durchstech
flaschen-Adapter gelbe Kappe
Zomacton 10 mg Durchstechflasche

Schritt 1: Entfernen Sie die gelbe Kappe von der ZOMACTON-Durchstechflasche.
Schritt 2: Setzen Sie den Durchstechflaschen-Adapter so auf die Mitte des Gummistopfens der Durchstechflasche, dass der Dorn nach unten zeigt. Drücken Sie jetzt den Adapter fest nach unten, bis er einrastet.
«r—>


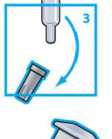
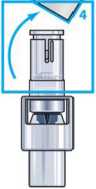
Schritt 3 und 4: Entfernen Sie die graue Spritzenkappe sowie die weiße Kappe des Durchstechflaschen-Adapters.
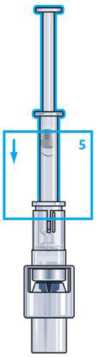
Schritt 5: Stellen Sie die Durchstechflasche mit ZOMACTON auf eine gerade Unterlage und halten Sie den Durchstechflaschen-Adapter fest. Stecken Sie anschließend die Spritze fest in den Durchstechflaschen-Adapter.
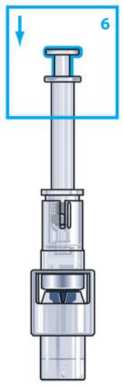
Schritt 6: Drücken Sie den Spritzenkolben langsam herunter. Achten Sie darauf, dass das gesamte Lösungsmittel in die ZOMACTON-Durchstechflasche gedrückt wird.

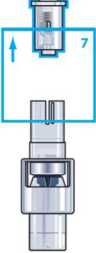
Schritt 7: Halten Sie die ZOMACTON-Durchstechflasche am Adapter fest und ziehen Sie die Spritze ab. Der Adapter bleibt auf der Durchstechflasche.
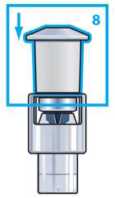
Schritt 8: Drücken Sie die weiße Kappe des Durchstechflaschen-Adapters wieder fest auf den Adapter, bis sie einrastet.
Schritt 9: Schwenken Sie die Durchstechflasche vorsichtig, bis sich das Pulver vollständig zu einer klaren, farblosen Lösung gelöst hat.
Stellen Sie die Durchstechflasche mit der zubereiteten ZOMACTON-Lösung aufrecht in den Kühlschrank bei +2 °C bis +8 °C.
Vermeiden Sie Schütteln oder kräftiges Mischen. Sollte die Lösung trübe sein oder Teilchen enthalten, müssen die Durchstechflasche und ihr Inhalt vernichtet werden. Sollte die Lösung trübe sein, wenn sie aus dem Kühlschrank kommt, warten Sie bitte, bis sie Zimmertemperatur erreicht hat. Sollte die Trübung weiter bestehen, dürfen Sie die Lösung nicht anwenden. Sie müssen die Durchstechflasche und den Inhalt dann vernichten.
Herstellung der Lösung mit dem Lösungsmittel-Transfer-Konnektor zur Injektion mit einer herkömmlichen Spritze
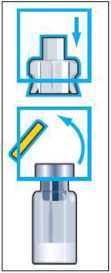
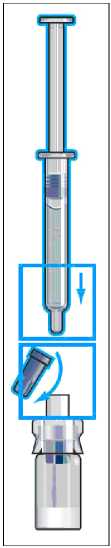

Schritt 1: Entfernen Sie die gelbe Kappe von der ZOMACTON-Durchstechflasche. Setzen Sie dann den Lösungsmittel-Transfer-Konnektor in die Mitte des Gummistopfens der Durchstechflasche, so dass der Dorn nach unten zeigt. Drücken Sie jetzt den Konnektor fest nach unten, bis er einrastet.
Schritt 2: Entfernen Sie die graue Spritzenkappe.
Schritt 3: Stellen Sie die Durchstechflasche mit ZOMACTON auf eine gerade Unterlage und halten Sie den LösungsmittelTransfer-Konnektor fest. Stecken Sie anschließend die Spritze fest in den Lösungsmittel-Transfer-Konnektor. Drücken Sie den Spritzenkolben langsam herunter. Achten Sie darauf, dass das gesamte Lösungsmittel in die ZOMACTON-Durchstechflasche gedrückt wird.
Schritt 4: Halten Sie die Durchstechflasche fest und ziehen Sie die Spritze ab. Der Lösungsmittel-Transfer-Konnektor bleibt auf der Durchstechflasche. Drücken Sie die Kappe wieder auf den Lösungsmittel- Transfer-Konnektor.
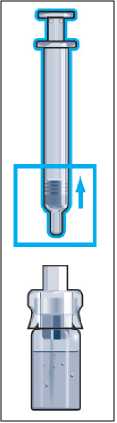
Schritt 5: Schwenken Sie die Durchstechflasche vorsichtig, bis sich das Pulver vollständig zu einer klaren, farblosen Lösung gelöst hat.
Stellen Sie die Durchstechflasche mit der zubereiteten ZOMACTON-Lösung aufrecht in den Kühlschrank bei +2 °C bis +8 °C.
Vermeiden Sie Schütteln oder kräftiges Mischen. Sollte die Lösung trübe sein oder Teilchen enthalten, müssen die Durchstechflasche und ihr Inhalt vernichtet werden. Sollte die Lösung trübe sein, wenn sie aus dem Kühlschrank kommt, warten Sie bitte, bis sie Zimmertemperatur erreicht hat. Sollte die Trübung weiter bestehen, dürfen Sie die Lösung nicht anwenden. Sie müssen die Durchstechflasche und den Inhalt dann vernichten.
7. INHABER DER ZULASSUNG
FERRING GmbH Wittland 11 24109 Kiel
8. ZULASSUNGSNUMMER
69950.00.00
9. DATUM DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
13.01.2009 / 27.08.2012
10. STAND DER INFORMATION
Februar 2014
11. Verkaufsabgrenzung
Verschreibungspflichtig
Sollten Sie weitere Fragen haben, wenden Sie sich bitte an folgende e-mail Adresse: info-service@ferring.de
17/17