Acc Injekt
F achinform ation
1. BEZEICHNUNG DES ARZNEIMITTELS
ACC® injekt
300 mg/3 ml Injektionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Ampulle mit 3 ml Injektionslösung enthält 300 mg Acetylcystein.
Sonstige Bestandteile mit bekannter Wirkung: Natriumverbindungen Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionslösung
Klare, farblose und wässrige Lösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Zur inhalativen oder intravenösen sekretolytischen Therapie bei akuten und chronischen bronchopulmonalen Erkrankungen, die mit einer Störung von Schleimbildung und -transport einhergehen.
Die intravenöse Therapie ist zur Anwendung bei Intensivpatienten und nur für den Fall, dass eine orale Gabe nicht möglich ist, vorgesehen.
4.2 Dosierung und Art der Anwendung
Soweit nicht anders verordnet, wird für ACC injekt folgende Dosierung empfohlen:
Intravenöse Therapie
Kinder unter 1 Jahr dürfen nur bei lebenswichtiger Indikation und nicht ambulant einer i.v.-Therapie mit Acetylcystein unterzogen werden (siehe Abschnitt 4.3). Falls die Indikation zur parenteralen Behandlung dennoch gestellt wird, soll die Tagesdosis für Kinder unter 6 Jahren 10 mg Acetylcystein/kg Körpergewicht (KG) betragen.
Bei Kindern unter 6 Jahren soll in der Regel die orale Behandlung bevorzugt werden.
Kinder von 6-14 Jahren
1-2-mal täglich A Ampulle (1,5 ml) ACC injekt i.v. (entsprechend 150-300 mg Acetylcystein pro Tag)
Erwachsene
1-2-mal täglich 1 Ampulle (3 ml) ACC injekt i.v. (entsprechend 300-600 mg Acetylcystein pro Tag) Inhalative Therapie
Kinder von 6-14 Jahren inhalieren 1-2-mal täglich den Inhalt von A Ampulle (1,5 ml) ACC injekt (entsprechend 150-300 mg Acetylcystein).
Erwachsene inhalieren 2-mal täglich den Inhalt von 1 Ampulle (3 ml) ACC injekt (entsprechend 600 mg Acetylcystein).
Art und Gesamtdauer der Anwendung
Intravenöse Therapie
Die 1. Dosis soll mit isotonischer Natriumchlorid-Lösung oder mit 5%iger Glucose-Lösung 1:1 verdünnt werden.
Die angegebenen Dosen sollten möglichst als Infusion verwendet werden.
Die i.v.-Injektion sollte langsam (über ca. 5 Minuten) erfolgen.
Die Injektionslösung sollte nur angewendet werden, wenn eine orale Gabe nicht möglich ist.
Inhalative Therapie
Bei inhalativer Anwendung empfiehlt sich die Inhalation der unverdünnten Arzneistoff-Lösung (10%ige Acetylcystein-Lösung) mit Hilfe eines Kompressionsverneblers.
Die Dauer der Anwendung richtet sich nach Art und Schwere der Erkrankung und sollte vom behandelnden Arzt entschieden werden.
Die Behandlung sollte bis zur Umstellung auf einzunehmende (orale) Darreichungsformen fortgeführt werden.
Bei chronischer Bronchitis und Mukoviszidose sollte die Behandlung, möglichst in oraler Darreichungsform, über einen längeren Zeitraum erfolgen, um eine Infektprophylaxe zu erreichen.
Hinweis
Ein beim Öffnen der Ampullen auftretender leichter Geruch nach Schwefelwasserstoff ist auf geringe Mengen flüchtiger, schwefelhaltiger Verbindungen zurückzuführen. Die schwefelhaltige Aminosäure Acetylcystein wird unter dem Einfluss von Luftsauerstoff und Feuchtigkeit oxidativ zersetzt. Wirksamkeit und Unbedenklichkeit sind dadurch nicht nachteilig beeinflusst.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Bei Säuglingen und Kleinkindern unter 1 Jahr darf ACC injekt nur bei lebenswichtiger Indikation und unter stationärer ärztlicher Kontrolle angewendet werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Sehr selten ist über das Auftreten von schweren Hautreaktionen wie Stevens-Johnson-Syndrom und Lyell-Syndrom in zeitlichem Zusammenhang mit der Anwendung von Acetylcystein berichtet worden.
Bei Neuauftreten von Haut- und Schleimhautveränderungen sollte daher unverzüglich ärztlicher Rat eingeholt und die Anwendung von Acetylcystein beendet werden (siehe auch Abschnitt 4.8).
Vorsicht in der Anwendung bei Patienten mit Asthma bronchiale und bei Patienten mit Ulkusanamnese. Verschlimmert sich die Atemnot nach der Inhalation akut (paradoxe Bronchospastik), so sollte die Behandlung sofort abgesetzt und der Behandlungsplan überprüft werden.
Bei Patienten mit Histaminintoleranz ist Vorsicht geboten. Eine längerfristige Therapie sollte bei diesen Patienten vermieden werden, da ACC injekt den Histaminstoffwechsel beeinflusst und zu Intoleranzerscheinungen (z. B. Kopfschmerzen, Fließschnupfen, Juckreiz) führen kann.
Die Anwendung von Acetylcystein, insbesondere zu Beginn der Behandlung, kann zu einer Verflüssigung und damit zu einer Volumensteigerung des Bronchialsekrets führen. Ist der Patient nicht in der Lage dieses ausreichend abzuhusten, sollten geeignete Maßnahmen (z. B. posturale Drainage und Absaugen) durchgeführt werden.
Die intravenöse Behandlung mit Acetylcystein sollte unter strenger ärztlicher Kontrolle erfolgen. Die nach einer intravenösen Perfusion von Acetylcystein auftretenden Nebenwirkungen treten häufiger auf, wenn das Arzneimittel zu schnell oder in einer zu großen Menge angewendet wurde. Daher wird empfohlen, sich genau an die Angaben unter Abschnitt 4.2 zu halten.
1 Ampulle ACC injekt enthält 21,26 mmol (489 mg) Natrium. Dies ist zu berücksichtigen bei Personen unter natriumkontrollierter (natriumarmer/kochsalzarmer) Diät.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Wechselwirkungsstudien wurden nur bei Erwachsenen durchgeführt.
Antitussiva (hustenstillende Mittel)
Bei kombinierter Anwendung von ACC injekt mit Antitussiva (hustenstillende Mittel) kann aufgrund des eingeschränkten Hustenreflexes ein gefährlicher Sekretstau entstehen, sodass die Indikation zu dieser Kombinationsbehandlung besonders sorgfältig gestellt werden sollte.
Antibiotika
Berichte über eine Inaktivierung von Antibiotika (Tetracycline, Aminoglykoside, Penicilline) durch Acetylcystein betreffen bisher ausschließlich In-vitro-Versuche, bei denen die betreffenden Substanzen direkt gemischt wurden. Dennoch soll aus Sicherheitsgründen die orale Applikation von Antibiotika getrennt und in einem mindestens 2-stündigen Abstand zeitversetzt erfolgen. Dies gilt nicht für Cefixim und Loracarbef.
Glyceroltrinitrat
Es ist über eine Verstärkung des vasodilatatorischen und thrombozytenaggregationshemmenden Effekts von Glyceroltrinitrat (Nitroglycerin) bei gleichzeitiger Gabe von Acetylcystein berichtet worden. Die klinische Relevanz dieser Befunde ist bisher noch nicht geklärt.
Wenn eine gemeinsame Behandlung mit Nitroglycerin und Acetylcystein als notwendig erachtet wird, sollte der Patient auf eine möglicherweise auftretende Hypotonie hin überwacht werden, die schwerwiegend sein kann und sich durch möglicherweise auftretende Kopfschmerzen andeuten kann.
Veränderungen bei der Bestimmung von Laborparameter
Acetylcystein kann die kolorimetrische Gehaltsbestimmung von Salicylaten beeinflussen.
Bei Harnuntersuchungen kann Acetylcystein die Ergebnisse der Bestimmung von Ketonkörpern beeinflussen.
4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft
Für Acetylcystein liegen keine ausreichenden klinischen Daten über exponierte Schwangere vor. Tierexperimentelle Studien lassen nicht auf direkte oder indirekte schädliche Auswirkungen auf Schwangerschaft, embryonale/fetale Entwicklung, Geburt oder postnatale Entwicklung schließen (siehe auch Abschnitt 5.3). Die Anwendung in der Schwangerschaft sollte nur nach strenger Nutzen-RisikoAbwägung erfolgen.
Stillzeit
Es liegen keine Informationen zur Ausscheidung in die Muttermilch vor. Die Anwendung in der Stillzeit sollte nur nach strenger Nutzen-Risiko-Abwägung erfolgen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Keine bekannt
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Gelegentlich: Kopfschmerzen, Fieber, allergische Reaktionen (Juckreiz, Urtikaria, Exanthem, Rash, Bronchospastik, Angioödem, Tachykardie und Blutdrucksenkung)
Sehr selten: anaphylaktische Reaktionen bis hin zum Schock Nicht bekannt: Gesichtsödeme
Erkrankungen des Ohrs und des Labyrinths
Gelegentlich: Tinnitus
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Selten: Dyspnoe, Bronchospasmen - überwiegend bei Patienten mit hyperreaktivem Bronchialsystem bei Asthma bronchiale
Nicht bekannt: Rhinorrhö (äußere Anwendung)
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Stomatitis, Bauchschmerzen, Übelkeit, Erbrechen, Sodbrennen und Durchfall
Selten: Dyspepsie
Erkrankungen der Haut und des Unterhautzellgewebes
Nicht bekannt: Flush (intravenöse Anwendung)
Untersuchungen
Nicht bekannt: verlängerte Prothrombinzeit (intravenöse Anwendung)
Darüber hinaus wurde sehr selten über das Auftreten von Blutungen im Zusammenhang mit der Gabe von Acetylcystein berichtet, zum Teil im Rahmen von Überempfindlichkeitsreaktionen. Eine Minderung der Blutplättchenaggregation in Gegenwart von Acetylcystein ist durch verschiedene Untersuchungen bestätigt worden, aber eine Bewertung im Hinblick auf die klinische Relevanz ist zur Zeit noch nicht möglich.
Sehr selten ist über das Auftreten von schweren Hautreaktionen wie Stevens-Johnson-Syndrom und Lyell-Syndrom in zeitlichem Zusammenhang mit der Anwendung von Acetylcystein berichtet worden. In den meisten dieser berichteten Fälle wurde mindestens ein weiterer Arzneistoff gleichzeitig eingenommen, durch den möglicherweise die beschriebenen mukokutanen Wirkungen verstärkt werden könnten.
Bei Neuauftreten von Haut- und Schleimhautveränderungen sollte daher unverzüglich ärztlicher Rat eingeholt und die Anwendung von Acetylcystein beendet werden. Die Anwendung von Acetylcystein muss sofort beendet werden.
Verschiedene Studien bestätigen eine Abnahme der Thrombozytenaggregation während der Anwendung von Acetylcystein. Die klinische Signifikanz dessen ist bisher unklar.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Mit oralen Darreichungsformen von Acetylcystein ist bis heute kein Fall einer toxischen Überdosierung beobachtet worden. Freiwillige Probanden wurden über 3 Monate mit einer Dosis von 11,6 g Acetylcystein/Tag behandelt, ohne dass schwerwiegende Nebenwirkungen beobachtet wurden. Orale Dosen bis zu 500 mg Acetylcystein/kg KG wurden ohne Vergiftungserscheinungen vertragen.
Nach intravenöser Anwendung
Symptome der Intoxikation
Überdosierungen können zu gastrointestinalen Symptomen wie Übelkeit, Erbrechen und Durchfall führen. Bei Säuglingen besteht die Gefahr der Hypersekretion.
Therapiemaßnahmen bei Überdosierung Gegebenenfalls symptomatisch
Ein spezifisches Antidot ist nicht bekannt. Acetylcystein ist dialysierbar.
Aus der intravenösen Acetylcystein-Behandlung der Paracetamol-Vergiftung liegen beim Menschen Erfahrungen mit Tagesmaximaldosen von bis zu 30 g Acetylcystein vor. Die i.v.-Gabe von extrem hohen Acetylcystein-Konzentrationen hat insbesondere bei schneller Applikation zu teilweise irreversiblen „anaphylaktoiden“ Reaktionen geführt. In einem Fall wurden nach massiver i.v.-Überdosierung epileptische Anfälle und Hirnödem mit Todesfolge berichtet.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Mukolytika ATC-Code: R05CB01
Acetylcystein ist ein Derivat der Aminosäure Cystein. Acetylcystein wirkt sekretolytisch und sekretomotorisch im Bereich des Bronchialtraktes. Es wird diskutiert, dass es die verbindenden Disulfidbrücken zwischen den Mukopolysaccharidfasern sprengt und einen depolymerisierenden Effekt auf DNS-Fasern (im eitrigen Schleim) ausübt. Durch diese Mechanismen soll die Viskosität des Schleims herabgesetzt werden.
Ein alternativer Mechanismus von Acetylcystein soll auf der Fähigkeit seiner reaktiven SH-Gruppe beruhen, chemische Radikale zu binden und damit zu entgiften.
Ferner trägt Acetylcystein zu erhöhter Glutathion-Synthese bei, die für die Detoxifikation von Noxen von Wichtigkeit ist. Dies erklärt seine Wirkung als Gegenmittel bei Paracetamol-Vergiftungen.
Ein protektiver Effekt bei prophylaktischer Gabe von Acetylcystein auf die Häufigkeit und Schwere von bakteriellen Exazerbationen bei Patienten mit chronischer Bronchitis/Mukoviszidose ist beschrieben.
5.2 Pharmakokinetische Eigenschaften
Acetylcystein wird nach oraler Aufnahme rasch und nahezu vollständig resorbiert und in der Leber zu Cystein, dem pharmakologisch aktiven Metaboliten, sowie Diacetylcystin, Cystin und weiteren gemischten Disulfiden metabolisiert. Aufgrund des hohen First-Pass-Effektes ist die Bioverfügbarkeit von oral verabreichtem Acetylcystein sehr gering (ca. 10 %). Beim Menschen werden die maximalen Plasmakonzentrationen nach 1-3 Stunden erreicht, wobei die maximale Plasmakonzentration des
Metaboliten Cystein im Bereich von etwa 2 Mikromol/l liegt. Die Proteinbindung von Acetylcystein wurde mit etwa 50 % ermittelt.
Acetylcystein und seine Metaboliten treten im Organismus in 3 unterschiedlichen Formen auf: teils in freier Form, teils über labile Disulfidbrücken an Protein gebunden und teils als eingebaute Aminosäure. Die Exkretion erfolgt fast ausschließlich in Form inaktiver Metaboliten (anorganische Sulfate, Diacetylcystin) über die Nieren. Die Plasmahalbwertszeit von Acetylcystein beträgt ca. 1 Stunde und wird hauptsächlich durch die rasche hepatische Biotransformation bestimmt. Eine Einschränkung der Leberfunktion führt daher zu verlängerten Plasmahalbwertszeiten bis zu 8 Stunden.
Pharmakokinetische Untersuchungen mit intravenöser Gabe von Acetylcystein ergaben ein Verteilungsvolumen von 0,47 l/kg (gesamt) bzw. 0,59 l/kg (reduziert), die Plasmaclearance wurde mit 0,11 l/h/kg (gesamt) sowie 0,84 l/h/kg (reduziert) ermittelt. Die Eliminationshalbwertszeit nach i.v.-Gabe beträgt 30-40 Minuten, wobei die Ausscheidung einer 3-phasigen Kinetik folgt (alpha-, beta- und terminale gamma-Phase).
N-Acetylcystein passiert die Plazenta und ist im Nabelschnurblut nachweisbar. Es liegen keine Informationen zur Ausscheidung in die Muttermilch vor.
Zum Verhalten von Acetylcystein an der Blut-Hirn-Schranke liegen für die Anwendung am Menschen keine Erkenntnisse vor.
5.3 Präklinische Daten zur Sicherheit Akute Toxizität
Siehe Abschnitt 4.9
Chronische Toxizität
Untersuchungen an verschiedenen Tierspezies (Ratte, Hund) mit einer Dauer bis zu 1 Jahr zeigten keine pathologischen Veränderungen.
Tumorerzeugendes und mutagenes Potential
Mutagene Wirkungen von Acetylcystein sind nicht zu erwarten. Ein In-vitro-Test verlief negativ. Untersuchungen auf ein tumorerzeugendes Potential von Acetylcystein wurden nicht durchgeführt. Reproduktionstoxikologie
Embryotoxizitätsstudien wurden bei trächtigen Kaninchen und Ratten durchgeführt, die orale Dosen von Acetylcystein während der Organogenese erhielten. Die Dosis betrug 250, 500 und 750 mg/kg bei Kaninchen und 500-1.000 und 2.000 mg/kg bei Ratten. Es wurden keine Missbildungen in einer der beiden experimentellen Studien beobachtet.
Fertilitätsstudien, peri- und postnatale Studien wurden mit oral verabreichtem Acetylcystein an Ratten durchgeführt. Die Ergebnisse dieser Studien zeigten, dass Acetylcystein Gonadenfunktion, Fertilitätsrate, Geburt, Stillen oder die Entwicklung von neugeborenen Tieren nicht beeinträchtigt.
N-Acetylcystein passiert die Plazenta bei Ratten und wurde im Fruchtwasser nachgewiesen. Die Konzentration des Metaboliten L-Cystein liegt bis zu 8 Stunden nach oraler Verabreichung in Plazenta und Fetus über der mütterlichen Plasmakonzentration.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
• Ascorbinsäure (Vitamin C)
• Natriumedetat (Ph.Eur.)
• Natriumhydroxid
• Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Bei einer Reihe von Antibiotika ist eine physikalische Unverträglichkeit oder Inaktivierung infolge Mischung mit Acetylcystein bekannt. Hierzu zählen Penicilline, Ampicillin, Cephalosporine, Erythromycin, einige Tetracycline und Amphotericin B. Diese Antibiotika sollten daher nicht in einer gemeinsamen Lösung mit Acetylcystein verabreicht werden (siehe auch Abschnitt 4.5).
6.3 Dauer der Haltbarkeit
2 Jahre
Haltbarkeit nach Anbruch oder Verdünnung
Nach Anbruch Rest verwerfen!
Die chemische und physikalische Stabilität der gebrauchsfertigen Zubereitung wurde für 24 Stunden bei 20 °C nachgewiesen. Aus mikrobiologischer Sicht sollte die gebrauchsfertige Zubereitung sofort verwendet werden.
Wenn die gebrauchsfertige Zubereitung nicht sofort verwendet wird, ist der Anwender für die Dauer und die Bedingungen der Aufbewahrung verantwortlich.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
6.5 Art und Inhalt des Behältnisses
Braunglasampullen (Typ I) mit einem weißen Punkt
Packung mit 5 Ampullen mit je 3 ml Injektionslösung
Bündelpackungen mit 50 und 100 (2 x 50) Ampullen mit je 3 ml Injektionslösung Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Keine besonderen Anforderungen für die Beseitigung.
Hinweis zur Handhabung der OPC (one-point-cut)-Ampullen Anfeilen nicht mehr erforderlich.
Punkt nach oben. Im Ampullenspieß befindliche Lösung durch Klopfen oder Schütteln nach unten fließen lassen.

Ampullenspieß vom Punkt nach hinten wegbrechen.
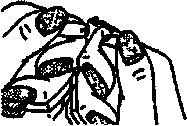
7. INHABER DER ZULASSUNG
Hexal AG Industriestraße 25 83607 Holzkirchen Telefon: (08024) 908-0 Telefax: (08024) 908-1290 E-Mail: medwiss@hexal.com
8. ZULASSUNGSNUMMER
8371.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 19. April 1989
Datum der letzten Verlängerung der Zulassung: 16. Oktober 2012
10. STAND DER INFORMATION
Mai 2015
11. VERKAUFSABGRENZUNG
V erschreibungspflichtig