Acesal
Fachinformation
Acesal®
1. BEZEICHNUNG DES ARZNEIMITTELS
Acesal®, 500 mg, Tabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Tablette enthält 500 mg Acetylsalicylsäure.
Vollständige Auflistung der sonstigen Bestandteile s. Abschnitt 6.1.
3. DARREICHUNGSFORM
Tabletten
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Leichte bis mäßig starke Schmerzen, wie Kopfschmerzen, Zahnschmerzen, Regelschmerzen; Fieber.
Bitte beachten Sie die Angaben für Kinder (s. Abschnitt 4.4 „Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung").
4.2 Dosierung und Art der Anwendung
Dosierung
|
Alter |
Einzeldosis |
Tagesgesamtdosis |
|
10 - 14 Jahre |
1 Tablette Acesal (entsprechend 500 mg Acetylsalicylsäure) |
3 Tabletten Acesal (entsprechend 1500 mg Acetylsalicylsäure) |
|
Jugendliche und Erwachsene |
1 - 2 Tabletten Acesal (entsprechend 500 - 1000 mg Acetylsalicylsäure) |
3 - 6 Tabletten Acesal (entsprechend 1500 - 3000 mg Acetylsalicylsäure) |
Die Einzeldosis kann, falls erforderlich, in Abständen von 4 - 8 Stunden bis zu 3-mal täglich eingenommen werden.
Art der Anwendung
Acesal mit reichlich Flüssigkeit (z. B. 1 Glas Wasser) einnehmen.
Acesal soll längere Zeit oder in höheren Dosen nicht ohne Befragen des Arztes angewendet werden.
4.3 Gegenanzeigen
Acesal darf nicht angewendet werden
• bei Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile,
• wenn in der Vergangenheit gegen Salicylate oder andere nichtsteroidale Entzündungshemmer mit Asthmaanfällen oder in anderer Weise allergisch reagiert wurde,
• bei gastrointestinalen Blutungen oder Perforation (Magen- oder Darm-Durchbruch) in der Vorgeschichte, die durch eine vorherige Therapie mit NSAR bedingt waren,
• bei aktiven oder in der Vorgeschichte bekannten Magen- und ZwölffingerdarmGeschwüren / Hämorrhagie mit mindestens zwei unverkennbaren Episoden von erwiesener Ulzeration oder Blutungen,
• bei krankhaft erhöhter Blutungsneigung (Thrombozytopenie, Vitamin-K-Mangel, Hämophilie),
• bei Leber- und Nierenversagen (GFR weniger als 10 ml / min),
• bei schwerer Herzinsuffizienz,
• bei Kombination mit Methotrexat 15 mg oder mehr pro Woche,
• bei Jugendlichen unter 15 Jahren mit Fieber aufgrund eines erhöhten Risikos für das Reye-Syndrom,
• in den letzten 3 Monaten der Schwangerschaft.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Eine besonders sorgfältige ärztliche Überwachung ist erforderlich bei Patienten mit:
• Überempfindlichkeit gegen andere Entzündungshemmer / Antirheumatika oder andere allergene Stoffe.
• Allergien (z. B. mit Hautreaktionen, Juckreiz, Nesselfieber) oder Asthma, Heuschnupfen, Nasenschleimhautschwellungen (Nasenpolypen), chronischen Atemwegserkrankungen.
• gleichzeitiger Therapie mit blutgerinnungshemmenden Arzneimitteln.
• Magen- oder Darm-Geschwüren oder Magen- Darm-Blutungen in der Vorgeschichte.
• eingeschränkter Leber- und Nierenfunktion.
• bekannten Läsionen der Magenschleimhaut.
• Dyspepsie.
• Bluthochdruck und/oder Herzinsuffizienz in der Anamnese: vor der Behandlung ist der Arzt oder der Apotheker zu befragen. Im Zusammenhang mit einer NSAR-Behandlung wurde über Flüssigkeitseinlagerung und Ödeme berichtet.
• vor anstehenden Operationen (auch bei kleineren Eingriffen wie z. B. Zahnextraktionen). Es kann zur Verlängerung der Blutungszeit kommen.
• bei Glucose-6-Phosphatdehydrogenasemangel.
• Hyperurikämie.
Hinweise zu gastrointestinalen Wirkungen
• Die gleichzeitige Gabe von Acetylsalicylsäure und anderen NSAR, einschließlich COX-2-selektiven Inhibitoren, sollte vermieden werden.
• Während der Behandlung mit allen NSAR sind schwerwiegende gastrointestinale Blutungen, Geschwüre und Perforationen, auch mit letalem Ausgang, zu jedem Zeitpunkt der Therapie mit oder ohne Warnsignale oder früheren schwerwiegenden gastrointestinalen Nebenwirkungen, berichtet worden.
• Patienten mit einer Anamnese gastrointestinaler Toxizität, insbesondere in höherem Alter, sollen jedes ungewöhnliche Symptom im Magen-Darm-Bereich (vor allem gastrointestinale Blutungen) melden, insbesondere zu Beginn einer Therapie.
• Vorsicht ist bei Patienten geboten, die gleichzeitig mit Arzneimitteln behandelt werden, die das Risiko für Ulzera oder Blutungen erhöhen, wie z. B. orale Kortikoide, Antikoagulanzien, Warfarin, selektive Serotoninwiederaufnahmeinhibitoren oder Thrombozytenaggregationshemmer wie z. B. Acetylsalicylsäure in geringen Dosen zur Behandlung kardiovaskulärer Erkrankungen.
• Beim Auftreten von gastrointestinalen Blutungen oder Ulzera sollte die Behandlung mit Acetylsalicylsäure abgebrochen werden (s. Abschnitt 4.3 „Gegenanzeigen“).
• Das Risiko einer gastrointestinalen Blutung, Ulzeration und Perforation erhöht sich mit ansteigender Dosis der NSAR, für Patienten mit Ulzera in der Anamnese, insbesondere in Verbindung mit den Komplikationen Blutung oder Perforation (s. Abschnitt 4.3 „Gegenanzeigen“) und für ältere Patienten. Diese Patientengruppen sollten einleitend mit der niedrigsten möglichen Dosis behandelt werden. Eine Behandlung mit NSAR in Kombination mit protektiven Arzneimitteln (z. B. Misoprostol oder Protonenpumpenhemmer) sollte in diesen Fällen in Erwägung gezogen werden. Dies gilt auch für Patienten, die gleichzeitig andere Arzneimittel einnehmen, die das Risiko gastrointestinaler Nebenwirkungen erhöhen (s. Abschnitt 4.5 „Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen“).
Sonstige Hinweise
• Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactose-Mangel oder Glucose-Galactose-Malabsorption sollten Acesal nicht einnehmen.
• Bei dauerhafter Einnahme von Schmerzmitteln können Kopfschmerzen auftreten, die zu erneuter Einnahme und damit wiederum eine Fortdauer der Kopfschmerzen führen können.
• Die gewohnheitsmäßige Einnahme von Schmerzmitteln kann zur dauerhaften Nierenschädigung mit dem Risiko eines Nierenversagens (Analgetika-Nephropathie) führen. Dieses Risiko ist besonders groß, wenn mehrere verschiedene Schmerzmittel kombiniert eingenommen werden.
• Acetylsalicylsäure vermindert in niedriger Dosierung die Harnsäureausscheidung. Bei Patienten, die bereits zu geringer Harnsäureausscheidung neigen, kann dies unter Umständen einen Gichtanfall auslösen.
• Nebenwirkungen können reduziert werden, indem die geringste wirksame Dosis über den kürzesten, zur Symptomenkontrolle erforderlichen Zeitraum angewendet wird (s. Abschnitt 4.2 „Dosierung, Art und Dauer der Anwendung“). Die maximale Dosis von 3 g pro Tag sollte nicht überschritten werden.
• Bei Anwendung von NSAR können durch gleichzeitigen Genuss von Alkohol wirkstoffbedingte Nebenwirkungen, insbesondere solche, die den Gastrointestinaltrakt oder das zentrale Nervensystem betreffen, verstärkt werden.
• Bei hohem Fieber, Anzeichen einer Sekundärinfektion oder Anhalten der Symptome über mehr als 3 Tage muss der Arzt konsultiert werden.
• Patienten, die an Asthma, Heuschnupfen, Nasenschleimhautschwellungen (Nasenpolypen) oder chronischen Atemwegsinfektionen (besonders gekoppelt mit heuschnupfenartigen Erscheinungen) leiden, und Patienten mit Überempfindlichkeit gegen Schmerz- und Rheumamittel aller Art sind bei Anwendung von Acesal durch Asthmaanfälle (sogenannte Analgetika-Intoleranz/Analgetika-Asthma), örtliche Haut-, Schleimhautschwellung (sog. Quincke-Ödem) oder Urticaria eher gefährdet als andere Patienten. Das gleiche gilt für Patienten, die auch gegen andere Stoffe allergisch reagieren, wie z. B. mit Hautreaktionen, Juckreiz oder Nesselfieber.
• Vor operativen Eingriffen sollte Acesal abgesetzt werden, sofern keine zwingende Indikation für die Anwendung besteht.
Altere Patienten
Bei älteren Menschen kommt es unter NSAR-Therapie häufiger zu unerwünschten
Wirkungen, insbesondere Blutungen und Perforationen im Gastrointestinaltrakt, die
lebensbedrohlich sein können.
Kinder und Jugendliche
Acesal 500 mg soll bei Kindern und Jugendlichen mit fieberhaften Erkrankungen nur auf
ärztliche Anweisung und nur dann angewendet werden, wenn andere Maßnahmen nicht wirken.
Sollte es bei diesen Erkrankungen zu lang anhaltendem Erbrechen kommen, so kann dies ein
Zeichen des Reye-Syndroms, einer sehr seltenen, aber lebensbedrohlichen Krankheit sein, die unbedingt sofortiger ärztlicher Behandlung bedarf.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die Wirkung der nachfolgend genannten Arzneistoffe bzw. Präparategruppen kann bei gleichzeitiger Behandlung mit Acesal beeinflusst werden:
Gastrointestinale Organe und Stoffwechsel
• Antidiabetika: erhöhtes Risiko einer Hypoglykämie.
• Antazida: erhöhen den Harn-pH und damit die renale Clearance durch verminderte tubuläre Reabsorption von Acetylsalicylsäure, Risiko für reduzierte Wirkung von Acetylsalicylsäure.
• NSAR: erhöhtes Risiko für gastrointestinale Ulzera und Blutungen in Dosierungen ab 3 g Acetylsalicylsäure pro Tag und mehr.
• Alkohol: erhöhtes Risiko für Magen-Darm-Geschwüre und Blutungen.
Blut- und blutbildendes System
Acetylsalicylsäure kann bei gleichzeitiger Einnahme folgender Wirkstoffe das Blutungsrisiko erhöhen, wenn es vor einer Thrombolyse-Therapie eingenommen wurde. Daher muss bei Patienten, bei denen eine Thrombolysebehandlung durchgeführt werden soll, auf Zeichen äußerer oder innerer Blutungen aufmerksam geachtet werden.
• Warfarin, Phenprocoumon, Dicumarol: Hemmung der Gerinnungskaskade und eventuell antagonistische Wirkung auf Vitamin K.
• Abciximab, Tirofiban, Eptifibatid: Thrombozytenaggregationshemmung und eventuell Inhibierung von Glykoproteinen IIb und IIIa.
• Clopidogrel, Ticlopidin (ADP Hemmer): Thrombozytenaggregationshemmung.
• Heparin, Cumarin (Antikoagulantien): Inhibierung von Antithrombin III.
Herz- und Kreislaufsystem
• Chinidin (Antiarrhythmikum): Hemmung der Gerinnungsreaktion und Verlängerung der Blutungszeit.
• Digoxin: Erhöhung der Digoxin-Spiegel.
• ACE-Hemmer: Verminderung der Prostaglandinsynthese und damit mögliche Wirkungsabschwächung von ACE-Hemmern bei Dosierungen ab 3 g Acetylsalicylsäure pro Tag.
• Furosemid, Spironolacton und andere Diuretika: Hemmung der proximalen tubulären Sekretion von Furosemid, veränderte Reninwirkung bei Spironolacton und damit Verminderung der diuretischen Wirkung bei Dosierungen ab 3 g Acetylsalicylsäure pro Tag.
• Probenecid, Sulfinpyrazon, Benzbromaron und andere Urikosurika: Abnahme von Harnsäureausscheidung, besonders bei hohen Dosierungen.
Endokrines System
Korticosteroide (wie z. B. systemische Glukokortikoide): erhöhtes Risiko für gastrointestinale Störungen wie Blutungen oder Magen-Darm-Geschwüre, Steigerung der renalen Clearance, erhöhter Metabolismus und subtherapeutische Serumkonzentrationen von Salicylaten, Ausnahme: Hydrocortison als Ersatztherapie bei Morbus Addison.
Muskeln, Gelenke und Knochen
• NSAR und COX-2-Hemmer wie Celecoxib: erhöhtes Risiko für gastrointestinale Störungen und Blutungen.
• Ibuprofen*: verminderte Wirkung niedrig-dosierter Acetylsalicylsäure auf die Blutplättchenaggregation bei gleichzeitiger Anwendung (s. Abschnitt 5.1
„Pharmakodynamische Eigenschaften “).
• Methotrexat (Zytostatikum): Reduktion der Clearance durch Acetylsalicylsäure, erhöhtes Risiko von toxischen Methotrexatwirkungen und somit von Leukopenie, Thrombozytopenie, Anämie, Nephrotoxizität und mukosalen Geschwüren.
• Experimentelle Daten deuten darauf hin, dass Ibuprofen bei gleichzeitiger Anwendung mit
Acetylsalicylsäure die Wirkung von niedrig-dosierter Acetylsalicylsäure auf die Blutplättchenaggregation hemmen kann. Jedoch lassen sich wegen der begrenzten Datenlage sowie der Unsicherheiten bei einer Extrapolation von ex vivo Daten auf die klinische Situation keine sicheren Schlussfolgerungen bezüglich der regelmäßigen Anwendung von Ibuprofen treffen. Bei gelegentlicher Anwendung von Ibuprofen ist eine klinisch relevante Wechselwirkung nicht wahrscheinlich (s. Abschnitt 5.1 „Pharmakodynamische
Eigenschaften“).
Zentrales Nervensystem
• NSAR und orale Glukokortikoide: Erhöhung des Risikos für gastrointestinale Ulzera und Blutungen in Dosierungen ab 3g Acetylsalicylsäure pro Tag und mehr.
• Valproinsäure: Veränderung der Proteinbindung und des Metabolismus von Valproinsäure bei gleichzeitiger Einnahme von Acetylsalicylsäure, erhöhtes Risiko einer Überdosierung mit Valproinsäure, ZNS-Depression und gastrointestinale Störungen.
Sinnesorgane
• Selektive Serotoninwiederaufnahmehemmer: erhöhtes Risiko von Magen-DarmGeschwüren und Blutungen.
• Acetazolamid (Augeninnendruck- und blutdrucksenkende Arzneimittel): eventuell Wirkungsverstärkung von Salicylaten durch Verschiebung der Konzentrationen vom Plasma ins Gewebe (Erbrechen, Tachypnoe, Tachykardie, Verwirrtheit) sowie Toxizität durch erhöhte Acetazolamidkonzentration (Müdigkeit, Lethargie, Somnolenz, Verwirrung, hyperchlorämische metabolische Azidose).
Sonstige
• Varizellen-Impfung (Windpockenimpfung): erhöhtes Risiko für das Reye-Syndrom.
• Ciclosporin, Tacrolimus (Immunsupressiva): Risiko für dosisabhängige Störung der Thrombozytenfunktion und eine Verstärkung der Wirkung von Acesal.
• Gingko (Gingko biloba): erhöhtes Blutungsrisiko.
4.6 Fertiliät, Schwangerschaft und Stillzeit
Schwangerschaft
Eine Hemmung der Prostaglandinsynthese kann die Schwangerschaft und/oder die embryonale/fetale Entwicklung negativ beeinflussen.
Daten aus epidemiologischen Studien weisen auf ein erhöhtes Risiko für Fehlgeburten sowie kardiale Missbildungen und Gastroschisis nach der Anwendung eines Prostaglandinsynthesehemmers in der Frühschwangerschaft hin. Es wird angenommen, dass das Risiko mit der Dosis und der Dauer der Therapie steigt.
Bei Tieren wurde nachgewiesen, dass die Gabe eines Prostaglandinsynthesehemmers zu erhöhtem prä- und post-implantärem Verlust und zu embryo-fetaler Letalität führt. Ferner wurden erhöhte Inzidenzen verschiedener Missbildungen, einschließlich kardiovaskulärer Missbildungen, bei Tieren berichtet, die während der Phase der Organogenese einen Prostaglandinsynthesehemmer erhielten.
Während des ersten und zweiten Schwangerschaftstrimesters sollte Acetysalicylsäure nur gegeben werden, wenn dies unbedingt notwendig ist. Falls Acetysalicylsäure von einer Frau
angewendet wird, die versucht schwanger zu werden, oder wenn Acetysalicylsäure während des ersten und zweiten Trimesters der Schwangerschaft angewendet wird, sollte die Dosis so niedrig und die Dauer der Anwendung so kurz wie möglich gehalten werden.
Während des dritten Schwangerschaftstrimesters können alle Prostaglandinsynthesehemmer: den Fetus folgenden Risiken aussetzen:
• kardiopulmonale Toxizität (mit vorzeitigem Verschluss des Ductus arteriosus und pulmonaler Hypertonie);
• Nierenfunktionsstörung, die zu Nierenversagen mit Oligohydramniose fortschreiten kann;
die Mutter und das Kind, am Ende der Schwangerschaft, folgenden Risiken aussetzen:
• mögliche Verlängerung der Blutungszeit, ein thrombozytenaggregationshemmender Effekt, der selbst bei sehr geringen Dosen auftreten kann;
• Hemmung von Uteruskontraktionen, mit der Folge eines verspäteten oder verlängerten Geburtsvorganges.
Daher ist Acetysalicylsäure während des dritten Schwangerschaftstrimesters kontraindiziert (s. Abschnitt 4.3 „Gegenanzeigen“).
Stillzeit
Acetylsalicylsäure und ihre Abbauprodukte gehen in geringen Mengen in die Muttermilch über. Da nachteilige Wirkungen für den Säugling bisher nicht bekannt geworden sind, wird bei kurzfristiger Anwendung der empfohlenen Dosis eine Unterbrechung des Stillens nicht erforderlich. Bei längerer Anwendung bzw. Einnahme höherer Dosen sollte dennoch abgestillt werden.
Fertilität
Es existiert eine gewisse Evidenz dafür, dass Arzneistoffe, die die Cyclooxygenase-/ Prostaglandin-synthese hemmen, die weibliche Fertilität über eine Wirkung auf die Ovulation beeinträchtigen können. Dies ist nach Absetzen der Behandlung reversibel.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es sind keine besonderen Vorsichtsmaßnahmen erforderlich.
Da bei Anwendung von Acesal in höherer Dosierung zentralnervöse Nebenwirkungen wie Benommenheit, Schwindel oder Übelkeit auftreten können, kann im Einzelfall die Fähigkeit zum Fahren eines Kraftfahrzeuges und zur Bedienung von Maschinen wie auch zum Arbeiten ohne sicheren Halt eingeschränkt sein.
4.8 Nebenwirkungen
Die Aufzählung der folgenden unerwünschten Wirkungen umfasst alle bekannt gewordenen Nebenwirkungen unter der Behandlung mit Acetylsalicylsäure, auch solche unter hochdosierter Langzeittherapie bei Rheumapatienten. Die Häufigkeitsangaben, die über Einzelfälle hinausgehen, beziehen sich auf die kurzzeitige Anwendung bis zu Tagesdosen von maximal 3 g Acetylsalicylsäure.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt:
Sehr häufig Häufig Gelegentlich Selten Sehr selten Nicht bekannt
(> 1/10)
(> 1/100, < 1/10)
(> 1/1.000, < 1/100)
(> 1/10.000, < 1/1.000)
(<1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen des Gastrointestinaltrakts
Häufig. Erytheme und Erosionen im oberen Gastrointestinaltrakt, Magen-Darm-Beschwerden wie Sodbrennen, Übelkeit, Erbrechen, Bauchschmerzen, Durchfall.
Gelegentlich: Ulzera und Blutungen im oberen Gastrointestinaltrakt mit Begleitsymptomatik wie Erbrechen von Blut (Hämatemesis) und Teerstuhl (Meläna). Der Patient sollte angehalten werden, beim Auftreten von abdominalen Schmerzen, Teerstuhl oder Hämatemesis Acetylsalicylsäure abzusetzen und den Arzt sofort zu informieren.
Selten, schwere Blutungen im oberen Gastrointestinaltrakt, Magen-Darm -Blutungen, MagenDarm-Geschwüre, die selten zur Perforation führen können, insbesondere bei älteren Patienten. Magen-Darm-Blutungen, die sehr selten zu einer Eisenmangelanämie führen können.
Sehr selten Stomatitis und Ösophagitis; toxische Wirkungen am unteren Gastrointestinaltrakt mit Ulzeration, Strikturen, Kolitis, Verschärfung bestehender Darmentzündungen.
Erkrankungen der Leber
Selten: erhöhte Transaminasewerte im Blut.
Sehr selten: leichte, reversible und dosisabhängige toxische Begleithepatitis, besonders während bestimmter viraler Erkrankungen (Influenza A, Influenza B, Varizellen). Die Verwendung von Salicylaten ist möglicherweise einer der Faktoren in der Pathogenese des Reye-Syndroms bei Kindern.
Endokrine Erkrankungen Selten. Hypoglykämie.
Erkrankungen des Nervensystems Häufig: Kopfschmerzen, Schlaflosigkeit.
Gelegentlich: Schwindelanfälle, Benommenheit (Schwindel und mentale Verwirrung können Anzeichen einer Überdosierung sein).
Selten: intrazerebrale Blutung.
Erkrankungen des Gehörorgans
Gelegentlich. gestörtes Hörvermögen und Tinnitus können Anzeichen einer Überdosierung sein.
Selten: dosisabhängiger reversibler Gehörverlust und Taubheit bereits bei einer niedrigen Plasma-Salicylat-Konzentration.
Erkrankungen des Blutes und Lymphsystems
Häufig: verlängerte Blutungszeiten, Hemmung der Thrombozytenaggregation.
Gelegentlich: verborgene gastrointestinale Blutungen.
Selten: Anämie bei Langzeittherapie, Hämolyse bei Patienten mit einem Glucose-6-Phosphatdehydrogenase-Mangel (G6PD).
Sehr selten. Blutgerinnungsstörungen (Hypoprothrombinämie) bei hoher Dosierung, Thrombozytopenie, Neutropenie, Eosinophilie, Agranulozytose und aplastische Anämie; schwerwiegende Blutungen wie z. B. intrazerebrale Blutungen, besonders bei Patienten mit nicht eingestelltem Bluthochdruck und / oder gleichzeitiger Behandlung mit Antikoagulantien, die in Einzelfällen lebensbedrohlich sein können; Eisenmangelanämie. Nicht bekannt. Blutungen wie z. B. Nasenbluten, Zahnfleischbluten oder Hautblutungen. Diese Wirkung kann 4 bis 8 Tage nach der Einnahme anhalten.
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeitsreaktionen wie z.B. Hautreaktionen.
Selten: Überempfindlichkeitsreaktionen wie schwere Hautreaktionen (bis hin zu Erythema multiforme) eventuell mit Blutdruckabfall, Anfälle von Atemnot, anaphylaktische Reaktionen, Quincke-Ödeme, vor allem bei Asthmatikern.
Erkrankungen der Atemwege
Häufig: Bronchospasmen bei Asthma-Patienten.
Erkrankungen der Haut
Gelegentlich: allergische Reaktionen wie Urtikaria oder Angioödeme bei Allergikern.
Sehr selten: Hautreaktionen wie Hautausschlag mit Rötung und Blasenbildung (z. B. Erythema exsudativum multiforme, Stevens-Johnson-Syndrom, Lyell-Syndrom), kleinfleckige Kapillarblutungen in der Haut (Purpura, hämorrhagische Vasculitis).
Hinweise
Bei hochdosierter Langzeittherapie sollten regelmäßige Kontrollen des Hb-Wertes durchgeführt werden.
Die Häufigkeit der dosisabhängigen Nebenwirkungen kann bei entsprechend disponierten Patienten durch gleichzeitige Gabe von die Magensekretion hemmenden oder H+-Ionen puffernden Prinzipien gemindert werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de, anzuzeigen.
4.9 Überdosierung
Mit einer Intoxikation muss bei älteren Personen und vor allem bei Kleinkindern gerechnet werden (therapeutische Überdosierung oder häufiger versehentliche Intoxikationen können bei ihnen tödlich wirken).
Bei Kindern kann eine akute Vergiftung mit Acetylsalicylsäure bereits durch eine einzige Dosis von 150 mg / kg Körpergewicht bzw. durch eine Tagesdosis von 100 mg / kg an 2 aufeinanderfolgenden Tagen auftreten.
Bei Erwachsenen können deutliche Vergiftungszeichen bei Dosierungen von 300 mg / kg Körpergewicht auftreten.
Symptome einer Überdosierung:
Leichte Intoxikation:
Zu den Symptomen einer leichten Intoxikation gehören Fieber, Tinnitus, Hörstörungen, Kopfschmerzen, Müdigkeit, Vertigo, leichte Exsikkose, Übelkeit, Erbrechen, metabolische Azidose, respiratorische Alkalose, Tachypnoe. Diese Symptome werden in allen Fällen von Überdosierung festgestellt und können durch Dosisreduktion abgestellt werden.
Schwere Intoxikation:
Zu den Symptomen einer schweren Intoxikation gehören: Fieber, Hyperventilation, Hypotonie, Ketose, respiratorische Alkalose, metabolische Azidose, Koma, kardiovaskulärer Schock, Atemversagen, schwere Hypoglykämie (besonders bei Kindern), Enzephalopathie, Herzrhythmusstörungen, zerebrale und pulmonale Ödeme, Krämpfe, Gerinnungsstörungen, epileptische Anfälle.
Notfallbehandlung:
• sofortige Einweisung in die Fachabteilung eines Krankenhauses;
• Magenspülung und orale Verabreichung von Aktivkohle (besonders beim Verdacht auf Überdosierung mit mehr als 120 mg / kg Körpergewicht);
• Kontrolle des Säure-Basen-Gleichgewichts und der Serum-Elektrolyte (mindestens alle 2 Stunden);
• forcierte alkalische Diurese, um einen Urin-pH-Wert zwischen 7,5 und 8 zu erreichen (eine gesteigerte alkalische Diurese muss berücksichtigt werden, wenn die Plasmasalicylatkonzentration bei Erwachsenen größer als 500 mg / l (3,6 mmol/l) oder bei Kindern größer als 300 mg / l (2,2 mmol/l) ist;
• Möglichkeit der Hämodialyse bei schwerer Intoxikation;
• Flüssigkeitsverlust muss ersetzt werden;
• Überwachung der Prothrombinzeit und/oder des INR;
• weitere symptomatische Behandlung.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Nervensystem, andere Analgetika und Antipyretika.
ATC Code: N 02 BA 01
Acetylsalicylsäure gehört zur Gruppe der säurebildenden nichtsteroidalen Antiphlogistika mit analgetischen, antipyretischen und antiphlogistischen Eigenschaften. Ihr Wirkungsmechanismus beruht auf der irreversiblen Hemmung von Cyclooxygenase-Enzymen, die an der Prostaglandinsynthese beteiligt sind.
Acetylsalicylsäure in oralen Dosierungen zwischen 0,5 und 1,0 g wird angewendet zur Behandlung von leichten bis mäßig starken Schmerzen und bei erhöhter Temperatur, wie z. B. bei Erkältung oder Grippe, zur Temperatursenkung und zur Behandlung von Gelenk-und Muskelschmerzen.
Acetylsalicylsäure hemmt außerdem die Thrombozytenaggregation, da sie die Synthese von Thromboxan A2 in den Thrombozyten blockiert. Dafür werden bei verschiedenen kardiovaskulären Indikationen Dosierungen von 75 bis 300 mg täglich eingesetzt.
Es wird ebenfalls zur Behandlung akuter und chronisch entzündlicher Erkrankungen wie z. B. rheumatoide Arthritis, Osteoarthritis und Spondylitis ankylosans angewendet. Dafür werden generell hohe Dosierungen von 4 bis 8 g pro Tag auf mehrere Einzeldosen verteilt, benutzt.
5.2 Pharmakokinetische Eigenschaften Resorption
Nach oraler Verabreichung wird nicht-ionisierte Acetylsalicylsäure schnell und vollständig aus dem Gastrointestinaltrakt resorbiert.
Nahrung kann die Resorption von Acetylsalicylsäure verzögern.
Während eines Migräne-Anfalls wird auch eine Verzögerung der Resorption von Acetylsalicylsäure bei Patienten beobachtet.
Erhöhte Resorption wiederum wird bei Patienten mit Achlorhydrie bzw. durch gleichzeitige Einnahme von Polysorbaten und Antazida beobachtet.
Verteilung
Während und nach der Resorption wird Acetylsalicylsäure in ihren aktiven Hauptmetaboliten Salicylsäure umgewandelt.
Sowohl Acetylsalicylsäure als auch Salicylsäure werden zu 80 - 90 % an Plasmaproteine gebunden und schnell in alle Teile des Körpers verteilt.
Die maximalen Plasmaspiegel von Acetylsalicylsäure und Salicylsäure werden nach 10 - 20 Minuten beziehungsweise 0,3 - 2 Stunden erreicht.
Höchste Serumkonzentrationen von Acetylsalicylsäure werden nach 30 min und von Salicylsäure innerhalb von 1 - 2 Stunden beobachtet.
Schmerzstillende Wirkung wird nach 30 - 60 min erwartet.
Maximal schmerzlindernde Leistung wird nach 2 - 4 Stunden beobachtet. Die Wirkungsdauer einer Einzeldosis kann 4 - 8 Stunden betragen.
Salicylsäure tritt in die Muttermilch über und ist plazentagängig.
Metabolismus
Die Umwandlung von Acetylsalicylsäure zu Salicylat erfolgt sehr schnell. Dennoch wird in den ersten 20 min nach oraler Einnahme überwiegend Acetylsalicylsäure im Blutplasma beobachtet.
Weitere Metabolite sind Salicylursäure, Salicylphenolglucuronid, Salicylacylglucuronid, Gentisinsäure und Gentisursäure.
Eliminierung
Salicylsäure wird vor allem durch Metabolisierung in der Leber abgebaut.
Die Eliminationskinetik von Salicylsäure ist dosisabhängig, da der Metabolismus durch die Kapazität der Leberenzyme begrenzt wird. Die Eliminationshalbwertzeit liegt daher bei niedrigen Dosierungen (z. B. 325 mg) zwischen 2 bis 3 Stunden und bei hohen Dosierungen zwischen 15 - 30 Stunden.
Salicylsäure und ihre Metabolite werden vor allem über die Nieren mit dem Urin ausgeschieden, in Abhängigkeit von der Dosis und dem pH-Wert des Urins. Etwa 30 % einer Einzeldosis werden dabei mit alkalischem Urin und nur 2 % mit saurem Urin ausgeschieden. Die Ausscheidung über die Nieren erfolgt mittels glomerulärer Filtration, aktiver tubulärer Sekretion sowie passiver tubulärer Resorption.
Bioverfügbarkeit
Eine im Jahr 1993 durchgeführte Bioverfügbarkeitsuntersuchung an 24 Probanden ergab im Vergleich zum Referenzpräparat folgendes Ergebnis:
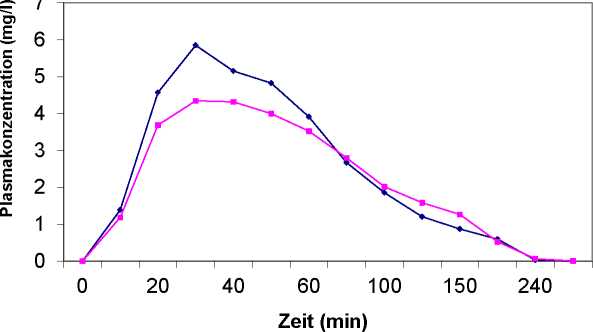
Acesal
Referenzpräparat
|
Acetylsalicylsäure |
Testpräparat |
Referenz Präparat |
|
maximale Plasmakonzentration (Cmax) in mg/l |
6,70 (4.45 -10.09) |
5,50 11 (3.90 - 7.77) |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax) in h |
0.76 ± 0.53 |
0.85 ± 0.61 |
|
Fläche unter der Konzentrations-Zeit-Kurve (AUC) in mg/l h |
7.48 (6.11 - 9.15) |
7.12 (5.68 - 8.92) |
Angabe der Werte als Mittelwert und Streubreite (s. Abb. 1)
Abb1: Mittlere Acetylsalicylsäure Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrations-ZeitDiagramm:
|
Salicylsäure |
Testpräparat |
Referenzpräparat |
|
maximale Plasmakonzentration (Cmax) in mg/l |
34.8 (28.9 - 41.8) |
3ä4IT (27.3 - 40.9) |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax) in h |
2.15 ± 0.76 |
2.28 ± 0,71 |
|
Fläche unter der Konzentrations-Zeit-Kurve (AUC) in mg/l h |
182.8 (150.4 - 222.1) |
179.7 (144.1 - 224.1) |
1) Geometrisches Mittel und geometrischer 68 %-Bereich entsprechend Mittelwert ± Standardabweichung nach logarithmischer Transformation. Gemäß "Note for guidance: Investigation of bioavailability and bioequivalence. CPMP working party on efficacy of medicinal products. III/54/89-EN, Final, December 1991" ist für AUC und Cmax eine logarithmische Normalverteilung zugrunde zu legen.
Angabe der Werte als Mittelwert und Streubreite (s. Abb. 2)
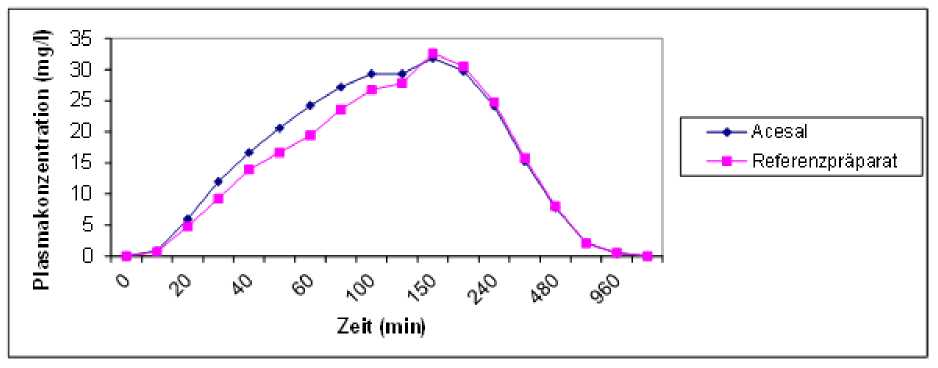
Abb.2: Mittlere Salicylsäure Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagram:
5.3 Präklinische Daten zur Sicherheit
In tierexperimentellen Untersuchungen traten neben den bereits unter "Nebenwirkungen" beschriebenen Effekten Nierenschäden nach Verabreichung hoher Acetylsalicylsäuredosen auf.
Acetylsalicylsäure wurde ausführlich in vitro und in vivo bezüglich mutagener Wirkungen untersucht. Die Gesamtheit der Befunde ergibt keine relevanten Verdachtsmomente für eine mutagene Wirkung. Gleiches gilt für Untersuchungen zur Kanzerogenität.
Salicylate haben in Tierversuchen an mehreren Tierspezies teratogene Wirkungen gezeigt (z. B. kardiale Missbildungen, skelettale Missbildungen und Bauchwanddefekte). Implantationsstörungen, embryo- und fetotoxische Wirkungen sowie Störungen der Lernfähigkeit sind bei Nachkommen nach pränataler Exposition beschrieben worden.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Mikrokristalline Cellulose; Kartoffelstärke; Lactose-Monohydrat; Carboxymethylstärke-Natrium (Typ A) (Ph. Eur); Gelatine
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
18 Monate
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
6.5 Art und Inhalt des Behältnisses
Acesal sind weiße, runde, gewölbte Tabletten mit der Prägung „ACESAL“ beidseitig. Packungen mit 20 und 50 Tabletten.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine speziellen Anforderungen.
7. INHABER DER ZULASSUNG
DR. KADE Pharmazeutische Fabrik GmbH
Rigistraße 2, 12277 Berlin
Tel.: 030/7 20 82-0, Telefax: 030/7 20 82-200
E-Mail: info@kade.de
8. ZULASSUNGSNUMMER
3000022.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
08.10.1997 / 23.01.2004
10. STAND DER INFORMATION
März 2014
11. VERKAUFSABGRENZUNG
Apothekenpflichtig