Actikerall 5 Mg/G + 100 Mg/G Lösung Zur Anwendung Auf Der Haut
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Actikerall 5 mg/g + 100 mg/g Lösung zur Anwendung auf der Haut
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 g Lösung zur Anwendung auf der Haut enthält 5 mg Fluorouracil und 100 mg Salicylsäure.
Sonstige Bestandteile mit bekannter Wirkung: 80 mg Dimethylsulfoxid/g Lösung. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Lösung zur Anwendung auf der Haut.
Actikerall ist eine klare, farblose bis hellorange-weiße Lösung.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Actikerall wird zur topischen Behandlung leicht tastbarer und/oder mäßig dicker hyperkeratotischer aktinischer Keratosen (Grad I/II) bei immunkompetenten erwachsenen Patienten angewendet.
Die Intensitätsstufe Grad I/II basiert auf der vierstufigen Skala von Olsen et al. (1991), siehe Abschnitt 5.1.
4.2 Dosierung und Art der Anwendung Dosierung bei Erwachsenen einschließlich älterer Patienten Lösung zur Anwendung auf der Haut.
Actikerall sollte einmal täglich auf die aktinischen Keratosen aufgetragen werden, bis die Läsionen vollständig abgeheilt sind oder bis zu maximal 12 Wochen. Falls schwere Nebenwirkungen auftreten, wird die Häufigkeit der Anwendung auf dreimal pro Woche reduziert, bis eine Besserung der Nebenwirkungen eintritt. Werden Hautareale mit dünner Epidermis behandelt, sollte die Lösung weniger oft aufgetragen und der Therapieverlauf häufiger kontrolliert werden.
Bereits nach sechs Wochen kann ein Ansprechen auf das Arzneimittel festgestellt werden. Dieses verstärkt sich im Laufe der Zeit. Daten liegen über die Behandlung für bis zu 12 Wochen vor. Eine vollständige Heilung der Läsion(en) oder die optimale therapeutische Wirkung kann möglicherweise erst bis zu acht Wochen nach Behandlungsende sichtbar sein.
Bei der Beurteilung von Behandlungsmöglichkeiten für rezidivierende Läsionen sollte der Arzt berücksichtigen, dass die Wirksamkeit einer wiederholten Behandlung mit Actikerall formal nicht in klinischen Studien untersucht wurde.
Kinder und Jugendliche
Kinder und Jugendliche sind in der Regel nicht von aktinischen Keratosen betroffen. Die Unbedenklichkeit und Wirksamkeit von Actikerall ist bei Kindern und Jugendlichen bisher noch nicht nachgewiesen.
Art der Anwendung
Multipel auftretende aktinische Keratosen können gleichzeitig behandelt werden. Erfahrungswerte liegen für die gleichzeitige Behandlung von bis zu zehn Läsionen vor. Die Gesamtfläche der mit Actikerall zu behandelten Haut sollte 25 cm2 (5 cm x 5 cm) nicht übersteigen.
Actikerall sollte nur mit den aktinischen Keratosen und einem Randbereich von maximal 0,5 cm der die Läsion umgebenden gesunden Haut in Kontakt kommen.
Actikerall wird auf aktinische Keratosen mit einem Pinselapplikator aufgetragen, der sich direkt am Flaschenverschluss befindet. Um zu verhindern, dass der Pinsel zu stark mit Lösung getränkt ist, sollte er vor der Anwendung am Flaschenhals abgestreift werden.
Das behandelte Areal darf nach dem Auftragen nicht abgedeckt werden, damit die Lösung auf dem betroffenen Bereich trocknen und einen Film bilden kann.
Vor jeder erneuten Anwendung von Actikerall sollte der bereits bestehende Film durch einfaches Abziehen entfernt werden. Mit warmem Wasser lässt sich der Film eventuell leichter lösen.
4.3 Gegenanzeigen
Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Actikerall darf während der Stillzeit, während einer bestehenden Schwangerschaft oder bei Frauen, bei denen eine Schwangerschaft nicht mit Sicherheit ausgeschlossen werden kann, nicht angewendet werden.
Actikerall darf nicht zur Behandlung von Patienten mit Niereninsuffizienz eingesetzt werden.
Actikerall darf nicht in Verbindung mit Brivudin, Sorivudin und Analoga angewendet werden. Brivudin, Sorivudin und Analoga sind potente Hemmstoffe des Fluorouracil degradierenden Enzyms Dihydropyrimidin-Dehydrogenase (DPD) (siehe auch Abschnitt 4.4 und 4.5).
Actikerall darf nicht mit Augen oder Schleimhäuten in Berührung kommen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Actikerall enthält das Zytostatikum 5-Fluorouracil.
Das Enzym Dihydropyrimidin-Dehydrogenase (DPD) spielt eine wichtige Rolle beim Abbau von Fluorouracil. Hemmung, Mangel oder verminderter Aktivitätsgrad dieses Enzyms können zu einer Akkumulation von Fluorouracil führen.
Gegebenenfalls ist die Bestimmung der DPD-Enzymaktivität vor Beginn der Behandlung mit Fluorouracil oder anderen Fluoropyrimidinen erforderlich.
Bei Patienten, welche Phenytoin gleichzeitig mit Fluorouracil anwenden, ist eine regelmäßige Kontrolle der Phenytoin-Plasmaspiegel angeraten.
Bei Patienten mit Sensibilitätsstörungen (z. B. bei Diabetes mellitus) ist eine engmaschige ärztliche Kontrolle des behandelten Bereiches erforderlich.
Aktinische Keratosen entstehen durch chronische UV-Schäden, und jede lokale Reizung an den mit Actikerall behandelten Hautstellen kann sich durch Sonnenexposition verschlechtern. Patienten sollte angeraten werden, die Haut gegen weitere übermäßige und gehäufte Sonneneinstrahlung zu schützen, insbesondere an den behandelten Hautstellen.
Basalzellkarzinome sowie Morbus Bowen sollten nicht mit diesem Arzneimittel behandelt werden, da hierfür keine Erfahrungen vorliegen.
Actikerall sollte nicht auf blutenden Läsionen angewendet werden.
Es liegen keine Erfahrungen mit der Behandlung von aktinischen Keratosen in einem Hautareal vor, das gleichzeitig von einer anderen Hautkrankheit betroffen ist. Der Arzt sollte in Betracht ziehen, dass sich das Behandlungsergebnis unterscheiden kann.
Zum gegenwärtigen Zeitpunkt liegen außer für das Gesicht, die Stirn und die nackte Kopfhaut keine Daten über die Behandlung weiterer Körperbereiche mit Actikerall vor.
Werden Hautareale mit dünner Epidermis behandelt, sollte die Lösung weniger oft aufgetragen und der Therapieverlauf häufiger kontrolliert werden.
Dimethylsulfoxid kann Hautreizungen hervorrufen.
Die Flasche ist nach jedem Gebrauch fest zu verschließen, da die Lösung ansonsten schnell eintrocknet und nicht mehr ordnungsgemäß angewendet werden kann.
Die Lösung darf bei Kristallbildung nicht verwendet werden.
Actikerall Lösung sollte nicht mit Textilien oder Acryl (z. B. Acryl-Badewannen) in Berührung gelangen, da die Lösung nicht entfernbare Flecken verursachen kann.
Achtung Feuergefahr: Von offenem Feuer und Flammen fernhalten.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Das Enzym Dihydropyrimidin-Dehydrogenase (DPD) spielt eine wichtige Rolle beim Abbau von Fluorouracil. Nukleosid-Analoga wie Brivudin und Sorivudin können zu einem drastischen Anstieg der Plasmakonzentrationen von Fluorouracil oder anderen Fluoropyrimidinen und folglich zu einer damit verbundenen Zunahme der Toxizität führen. Daher sollte ein Zeitabstand von mindestens vier Wochen zwischen der Anwendung von Fluorouracil und Brivudin, Sorivudin und Analoga eingehalten werden.
Im Fall einer versehentlichen Verabreichung von Nukleosid-Analoga wie Brivudin und Sorivudin an Patienten, die mit Fluorouracil behandelt werden, müssen wirkungsvolle Maßnahmen zur Reduzierung der Fluorouracil-Toxizität ergriffen werden. Gegebenenfalls ist die Einweisung in ein Krankenhaus angezeigt. Alle Maßnahmen zur Verhinderung systemischer Infektionen und Dehydration sollten eingeleitet werden.
Bei gleichzeitiger Verabreichung von Phenytoin und Fluorouracil wurden erhöhte Plasmaspiegel von Phenytoin berichtet, die Symptome einer Phenytoin-Intoxikation hervorgerufen haben (siehe Abschnitt 4.4).
Es gibt keinen Nachweis einer relevanten systemischen Resorption von Salicylsäure. Jedoch kann resorbierte Salicylsäure mit Methotrexat und Sulfonylharnstoffen interagieren.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen keine Daten über die Anwendung von topischem Fluorouracil bei Schwangeren vor. Bei systemisch verabreichten Fluorouracil wurde bei Tieren eine teratogene Wirkung beobachtet. Salicylsäure kann den Schwangerschaftsausgang bei Nagetieren negativ beeinflussen.
Stillzeit
Es ist nicht bekannt, ob Fluorouracil oder seine Metaboliten nach topischer Anwendung in die Muttermilch übergehen. Ein Risiko für das Neugeborene kann nicht ausgeschlossen werden.
Fertilität
Fertilitätsstudien mit systemisch angewendetem Fluorouracil zeigten eine transiente Infertilität bei männlichen und reduzierte Trächtigkeitsraten bei weiblichen Nagetieren. Jedoch ist aufgrund der sehr geringen Resorption der Wirkstoffe nach Anwendung von Actikerall auf der Haut eine Relevanz für die Anwendung beim Menschen unwahrscheinlich.
Actikerall ist während der Schwangerschaft und Stillzeit kontraindiziert (siehe Abschnitt 4.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Actikerall hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Nebenwirkungen sind gemäß MedDRA Systemorganklassen und mit absteigenden Häufigkeiten im Folgenden angeführt. Die Häufigkeiten sind folgendermaßen definiert: Sehr häufig (>1/10); Häufig (>1/100 bis <1/10); Gelegentlich (>1/1.000 bis <1/100); Selten (>1/10.000 bis <1/1.000); Sehr selten (<1/10.000) und Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Sehr häufig: Am Verabreichungsort: Erythem, Entzündung, Reizung (einschließlich Brennen), Schmerz, Pruritus.
Häufig: Am Verabreichungsort: Bluten, Erosion, Wundschorf.
Gelegentlich: Am Verabreichungsort: Dermatitis, Ödem, Ulzeration.
Erkrankungen der Haut und des Unterhautzellgewebes:
Häufig: Hautabschilferung.
Erkrankungen des Nervensystems:
Häufig: Kopfschmerz.
Augenerkrankungen:
Gelegentlich: Trockene Augen, Augenjucken, vermehrte Tränensekretion.
Leichte bis moderate Reizungen und Entzündungen an der Applikationsstelle traten bei der Mehrzahl der Patienten auf, die wegen aktinischen Keratosen mit der Lösung behandelt wurden. Im Fall schwerwiegender Reaktionen kann die Behandlungshäufigkeit reduziert werden.
Da das Arzneimittel sehr stark hornschichtaufweichend wirkt, können weißliche Verfärbungen und Abschilferungen der Haut auftreten, insbesondere in der unmittelbaren Umgebung der aktinischen Keratosen.
Aufgrund der enthaltenen Salicylsäure kann es durch Anwendung dieses Arzneimittels bei Patienten mit entsprechender Disposition zu leichten Reizungszeichen wie Dermatitis und kontaktallergischen Reaktionen kommen. Derartige kontaktallergische Reaktionen können in Form von Jucken, Rötungen und Bläschen auch außerhalb des Applikationsareals auftreten.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels.
Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Bei vorschriftsmäßiger Anwendung auf der Haut sind systemische Intoxikationen durch die Wirkstoffe oder sonstigen Bestandteile praktisch ausgeschlossen. Eine weit häufigere als die empfohlene Anzahl von Anwendungen führt zu einer gesteigerten Häufigkeit der Reaktionen an der Applikationsstelle und erhöht auch den Schweregrad der Reaktionen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Fluorouracil, Kombinationen, ATC-Code: L01BC52 Fluorouracil:
Der Wirkstoff Fluorouracil (FU) gehört zu den als Antimetaboliten wirkenden Zytostatika. Aufgrund seiner strukturellen Ähnlichkeit mit dem in Nukleinsäuren vorkommenden Thymin (5-Methyluracil) verhindert FU dessen Bildung und Verwertung und hemmt daher sowohl die DNA- als auch die RNA-Synthese. Dies resultiert in einer Wachstumshemmung insbesondere solcher Zellen, die sich - wie bei aktinischen Keratosen - in einem Stadium forcierten Wachstums befinden und daher FU in vermehrtem Maße aufnehmen. Folglich wird auch das Virenwachstum gehemmt, das mit der Entwicklung von aktinischen Keratosen einhergehen kann.
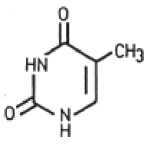
Thymin
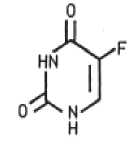
Fluorouracil
Salicylsäure:
Topische Salicylsäure weist eine keratolytische Wirkung auf und reduziert die mit aktinischen Keratosen einhergehende Hyperkeratose. Salicylsäure gehört zu den aromatischen Säuren und den Phenolen und ist fettlöslich. Ihr Wirkprinzip als Keratolytikum und Korneolytikum wird in Zusammenhang gesehen mit der Interferenz auf die Korneozytenadhäsion, der solubilisierenden Wirkung auf die interzelluläre Zementsubstanz sowie mit der Lockerung und Ablösung der Korneozyten. Durch die Wirkweise als organisches Lösungsmittel kann Salicylsäure die interzellulären Lipide entfernen, die an den so genannten „comified envelope“, einer Ummantelung der komifizierten Zellen, kovalent gebunden sind.
In einer randomisierten, placebo-kontrollierten, doppelblinden, dreiarmigen und multizentrischen Phase-III-Studie mit Parallelgruppen wurden 470 Patienten mit aktinischen Keratosen des klinischen Grades I bis II entweder mit einer Lösung mit Fluorouracil (5 mg/g) und Salicylsäure (100 mg/g) (5-FU-SA) oder einem Vehikel oder Diclofenac in Hyaluronsäuregel (30 mg/g) (DG) behandelt. 187 Patienten wurden bis zu 12 Wochen mit der Kombination 5-FU-SA behandelt. Den primären Endpunkt stellte die histologische Untersuchung einer Läsion acht Wochen nach Behandlungsende dar. Die topische Behandlung mit 5-FU-SA zeigte im Vergleich zur Behandlung mit dem Vehikel und mit DG eine überlegene Wirkung. Die sekundären Wirksamkeitsendpunkte - vollständige klinische Abheilung, Verminderung der Zielläsionen, Verminderung der Läsionsfläche, globales ärztliches Abschlussurteil und Einschätzung der Wirkung seitens des Patienten -bestätigten die Ergebnisse des primären Endpunktes. Bei 72,0 % der Patienten in der mit 5-FU-SA behandelten Gruppe war die aktinische Keratose im entnommenen Biopsiegewebe histologisch nicht mehr nachweisbar, wohingegen die histologische Clearance in der mit DG und mit dem Vehikel behandelten Gruppen bei 59,1 % bzw. 44,8 % lag (per Protokollanalyse). Die am häufigsten aufgetretenen Nebenwirkungen bei 5-FU-SA waren Reizungen an der Applikationsstelle (einschließlich Brennen)
(86,1 %) und Entzündungen an der Applikationsstelle (73,3 %). Darüber hinaus traten häufig Pruritus an der Applikationsstelle (44,9 %) und Schmerzen an der Applikationsstelle (25,1 %) auf. Als weitere Nebenwirkungen traten Erytheme und Erosionen am betroffenen Areal auf. Der Behandlungsabbruch aufgrund von Hautreaktionen und Reaktionen an der Applikationsstelle war gering (0,5 %).
Es gibt ausschließlich klinische Erfahrungen mit der Anwendung von Actikerall im Gesicht, auf der Stirn und der nackten Kopfhaut. Bei der Entscheidung über eine Behandlung anderer Körperstellen kann die Epidermisdicke der verschiedenen Körperbereiche berücksichtigt werden:
Durchschnittliche Epidermisdicke verschiedener Körperbereiche:
Körperbereich Durchschnittliche Dicke (Mikrometer)
|
Gesicht |
49,4 |
|
Stirn |
50,3 |
|
Obere Rumpf-Vorderseite (Hals-Brust-Bereich) |
42,2 |
|
Arme/Beine |
60,1 |
Quelle: Koehler et al. 2010 (Skin Res Technol 2010; 16:259-264); Sandby-Moller et al. 2003 (Acta Derm Venereol 2003; 83(6):410-3); Whitton et Everall 1973 (Br J Dermatol 1973; 89(5):467-76)
Die klinische Intensitätseinstufung der aktinischen Keratosen erfolgte gemäß der vierstufigen Skala nach
|
Olsen et al., 1991 (J |
Am Acad Dermatol 1991; 24: 738-743): | ||
|
Grad |
Klinische Beschreibung des Intensitätsgrades | ||
|
0 |
keine KA |
keine aktinische Keratose, weder sichtbar noch tastbar | |
|
I |
schwache KA |
flache, rosafarbene Flecken ohne Anzeichen von Hyperkeratosen und Erythemen, leichte Tastbarkeit, aktinische Keratose besser tastbar als | |
|
sichtbar | |||
|
II |
moderate KA |
rosafarbene bis rötliche Papeln und erythematöser |
Plaque mit |
|
hyperkeratotischer Oberfläche, moderat erhabene aktinische leicht sicht- und tastbar ist |
Keratose, die | ||
|
III |
schwere KA |
sehr dicke und/oder auffällige aktinische Keratose | |
|
5.2 |
Pharmakokinetische Eigenschaften | ||
In einer bei Schweinen durchgeführten Absorptionsstudie wurde nach kutaner Anwendung - auch bei großen Mengen - kein Fluorouracil im Serum festgestellt, d. h. der Wirkstoff wurde nicht in solchen Mengen resorbiert, die durch standardmäßige Analyseverfahren (HPLC) feststellbar sind.
Bei Patienten mit aktinischen Keratosen (n = 12) wurde keine Fluorouracilkonzentration über 0,05 pg/ml festgestellt.
Nach einer pharmakokinetischen Studie zur Analyse der Resorptionsrate von Fluorouracil beim Menschen liegt diese nach Anwendung in derselben Formulierung bei Warzen deutlich unter 0,1 %.
Nach Auftragen auf die Haut bildet Actikerall einen festen Film, der nach Verdunstung der Flüssigkeit weiß wird. Dies führt zu einem Verschlusseffekt, der das Eindringen der Wirkstoffe in die Läsionen der aktinischen Keratosen begünstigt.
Salicylsäure wurde dem Arzneimittel aufgrund der keratolytischen Eigenschaften hinzugefügt, um das Eindringen des Wirkstoffes zu verbessern, was bei hyperkeratotischen aktinischen Keratosen besonders erschwert ist. Dieselbe Wirkung wird durch den weiteren Bestandteil Dimethylsulfoxid erzielt, der für den Wirkstoff Fluorouracil einen solubilisierenden Effekt bewirkt.
Die keratolytische Wirkung von Salicylsäure basiert auf dem direkten Einwirken auf die intrazelluläre Zementsubstanz oder die Desmosomen, welche durch die stabile Verbindung von Keratinozyten den Verhornungsprozess fördern.
Tierexperimentelle Studien und pharmakokinetische Untersuchungen beim Menschen haben gezeigt, dass Salicylsäure die Hautoberfläche je nach Substrat und weiteren penetrationsbeeinflussenden Faktoren (wie Hautbeschaffenheit) rasch durchdringt.
Die Metabolisierung von Salicylsäure erfolgt durch Konjugation mit Glycin zu Salicylursäure, mit Glucuronsäure an der phenolischen OH-Gruppe zu Etherglucuronid und an der COOH-Gruppe zu Esterglucuronid oder durch Hydroxylierung zu Gentisinsäure und Dihydroxybenzoesäure. Im normalen Dosierungsbereich liegt die Halbwertzeit von Salicylsäure zwischen zwei und drei Stunden. Diese kann jedoch im Fall hoher Dosen auf 15 bis 30 Stunden erhöht sein, was auf die begrenzte Fähigkeit der Leber, die Salicylsäure zu konjugieren, zurückzuführen ist.
Im Allgemeinen sind bei topischer Anwendung von Salicylsäure keine toxischen Nebenwirkungen zu erwarten (vgl. aber Kontraindikationen), da praktisch nie ein Serumspiegel von über 5 mg/dl erreicht wird. Frühe Symptome einer Salicylatintoxikation können nur bei Serumwerten über 30 mg/dl auftreten.
5.3 Präklinische Daten zur Sicherheit
Es liegen keine experimentellen Daten zur akuten und subchronischen Toxizität von Fluorouracil (FU) nach topischer Anwendung vor. Eine dosisabhängige systemische Bioverfügbarkeit von FU tritt bei Ratten auf und führt aufgrund der antimetabolischen Wirkung von FU zu schwerwiegenden lokalen Reaktionen und tödlich verlaufenden systemischen Auswirkungen. Derartig hohe Dosen (bis zu 10.000-fach über der Dosierung zur Anwendung am Menschen) werden bei vorschriftsmäßiger Anwendung von Actikerall nicht erreicht.
In vitro war FU in einigen Teststämmen mutagen. Die Karzinogenität von FU wurde in mehreren Studien bei Nagetieren untersucht, wobei kein Effekt festgestellt wurde. Dennoch wurde in einer einzelnen Studie Karzinogenität von FU bei Mäusen nach i.p.-Applikation nachgewiesen. Mehrere Studien weisen darauf hin, dass FU bei systemischer Anwendung in hoher Dosierung möglicherweise teratogene oder embryotoxische Auswirkungen, jedoch geringere oder keine Auswirkungen auf die Fertilität oder die allgemeine Fortpflanzungsfähigkeit hat. Fertilitätsstudien mit systemisch angewendetem FU zeigten eine transiente Infertilität bei männlichen und reduzierte Trächtigkeitsrate bei weiblichen Nagetieren. Jedoch ist aufgrund der nur sehr geringen Resorption nach Anwendung auf der Haut eine derartige Auswirkung beim Menschen praktisch bedeutungslos.
Salicylsäure hat nur eine geringe akute Toxizität, kann jedoch nach topischer Anwendung in höheren Konzentrationen Hautreaktionen auslösen. Eine mutagene, genotoxische, karzinogene oder teratogene Wirkung von Salicylsäure ist nicht bekannt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Dimethylsulfoxid
Ethanol
Ethylacetat
Pyroxylin
Poly(butylmethacrylat-co-methylmethacrylat) (80:20)
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit
2 Jahre
Haltbarkeit nach Anbruch: 3 Monate
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25°C lagern.
Nicht im Kühlschrank lagern oder einfrieren.
Die Flasche fest verschlossen halten.
6.5 Art und Inhalt des Behältnisses
Das Arzneimittel wird in einer braunen Glasflasche mit kindersicherem Verschluss aus weißem Polypropylen und in einem Umkarton geliefert. Ein Pinsel zur Anwendung der Lösung befindet sich direkt am Flaschenverschluss. Der Pinselapplikator (CE-Kennzeichnung) besteht aus Polyethylen (HDPE und LDPE 1:1). Die Pinselhaare sind aus Nylon und mit korrosionsbeständigem Edelstahl (V2A) im Schaft befestigt.
Packungsgröße: 25 ml Lösung.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
Almirall Hermal GmbH Scholtzstraße 3 21465 Reinbek Deutschland
Tel.: +49 (0)40 7 27 04-0 Fax: +49 (0)40 7 22 92 96 info@almirall .de
8. ZULASSUNGSNUMMER
80136.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
21.06.2011
10. STAND DER INFORMATION 05/2014
11 VERKAUFSABGRENZUNG
Verschreibungspflichtig
Dieses Arzneimittel enthält eine Zubereitung aus Stoffen, deren Anwendungsgebiet in der medizinischen Wissenschaft noch nicht allgemein bekannt ist.
9