Adalat 5Mg/50Ml Pro Infusione
Gebrauchsinformation: Information für Patienten
Adalat® 5 mg/50 ml pro infusione, Infusionslösung
Nifedipin
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
1. Was ist Adalat 5 mg/50 ml pro infusione und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Adalat 5 mg/50 ml pro infusione beachten?
3. Wie ist Adalat 5 mg/50 ml pro infusione anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Adalat 5 mg/50 ml pro infusione aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist Adalat 5 mg/50 ml pro infusione und wofür wird es angewendet?
Adalat 5 mg/50 ml pro infusione enthält den Wirkstoff Nifedipin.
Adalat 5 mg/50 ml pro infusione ist ein Mittel zur Behandlung von Herzerkrankungen.
Es wird angewendet zur Behandlung
- der vasospastischen Angina (Prinzmetal-Angina, Variant-Angina)
- des hypertensiven Notfalls
2. Was sollten Sie vor der Anwendung von Adalat 5 mg/50 ml pro infusione beachten? Adalat 5 mg/50 ml pro infusione darf nicht angewendet werden,
- wenn Sie allergisch gegen Nifedipin oder einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels sind
- wenn Sie einen Herz-Kreislauf-Schock erlitten haben
- wenn Sie an einer Herzklappenverengung (Aortenstenose) leiden
- wenn Sie in Ruhe unter Beschwerden (z. B. Schmerzen oder Engegefühl im Brustbereich) von
Zuständen mit unzureichender Sauerstoffversorgung des Herzmuskels (instabile Angina pectoris) leiden
- wenn Sie innerhalb der letzten 4 Wochen einen akuten Herzinfarkt erlitten haben
- wenn Sie gleichzeitig Arzneimittel mit dem Wirkstoff Rifampicin (Arzneimittel gegen Tuberkulose) einnehmen
- wenn Sie schwanger sind, bis zur 20. Woche der Schwangerschaft
- wenn Sie stillen
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt oder dem medizinischen Fachpersonal, bevor Adalat 5 mg/50 ml pro infusione bei Ihnen angewendet wird.
Die Behandlung mit Adalat 5 mg/50 ml pro infusione bedarf der regelmäßigen ärztlichen Kontrolle,
- wenn Sie niedrigen Blutdruck (RR-Wert systolisch unter 90 mm Hg) haben
- wenn Sie unter einer nicht ausreichend behandelten Herzmuskelschwäche (dekompensierte Herzinsuffizienz) leiden
- wenn Sie schwanger sind (siehe Abschnitt 2 „Schwangerschaft, Stillzeit und Zeugungs-/Gebärfähigkeit“).
Adalat 5 mg/50 ml pro infusione sollte bei Ihnen nicht angewendet werden, wenn ein kausaler Zusammenhang zwischen ischämischem Schmerz und einer früheren Therapie mit Nifedipin vermutet wird.
Insbesondere zu Beginn der Behandlung kann es gelegentlich zum Auftreten von Angina pectoris-Anfällen bzw. bei Patienten mit bestehender Angina pectoris zu einer Zunahme von Häufigkeit, Dauer und Schweregrad der Anfälle kommen.
Sehr selten ist über das Auftreten von Herzinfarkten berichtet worden.
Der Wirkstoff in Adalat 5 mg/50 ml pro infusione, Nifedipin, wird unter Beteiligung eines bestimmten Enzymsystems (Cytochrom P450 3A4) abgebaut. Durch andere Arzneimittel kann dieses Enzymsystem gehemmt oder verstärkt werden. Hierdurch können die Wirkungen und Nebenwirkungen von Adalat 5 mg/50 ml pro infusione verändert werden (siehe Abschnitt 2 „Anwendung von Adalat 5 mg/50 ml pro infusione zusammen mit anderen Arzneimitteln“).
Wenn bei Ihnen Adalat 5 mg/50 ml pro infusione gleichzeitig mit anderen Arzneimitteln, die dieses Enzymsystem hemmen, angewendet wird, kann dies gesteigerte Wirkungen, aber auch verstärkt auftretende Nebenwirkungen von Adalat 5 mg/50 ml pro infusione zur Folge haben. Hierzu zählen z. B. folgende Arzneimittel:
- bestimmte Antibiotika (z. B. Erythromycin)
- bestimmte Anti-HIV-Arzneimittel (z. B. Ritonavir)
- bestimmte Arzneimittel gegen Pilzerkrankungen (z. B. Ketoconazol)
- Nefazodon und Fluoxetin (Mittel gegen krankhaft traurige Verstimmung, Antidepressiva)
- Chinupristin/Dalfopristin (Antibiotika)
- Valproinsäure (Mittel gegen Epilepsie)
- Cimetidin (Mittel zur Hemmung der Säureproduktion im Magen)
- Trizyklische Antidepressiva (Arzneimittel gegen Depression)
- Vasodilatatoren (gefäßerweiternde Arzneimittel)
- Cisaprid (Magen-Darm-Mittel)
Wenn Adalat 5 mg/50 ml pro infusione gleichzeitig mit einem dieser Arzneimittel angewendet wird,
sollte der Blutdruck überwacht werden und, falls erforderlich, eine Verringerung der Adalat 5 mg/50 ml pro infusione-Dosis in Betracht gezogen werden.
Bei Patienten mit eingeschränkter Leberfunktion kann der Abbau von Nifedipin verzögert sein. Der Arzt wird daher den Behandlungsverlauf sorgfältig überwachen und gegebenenfalls die Dosis verringern.
Kinder und Jugendliche
Adalat 5 mg/50 ml pro infusione wird nicht empfohlen für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren aufgrund der nur begrenzt vorliegenden Daten zur Sicherheit und Wirksamkeit in dieser Patientengruppe.
Anwendung von Adalat 5 mg/50 ml pro infusione zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt wenn Sie andere Arzneimittel einnehmen/anwenden, kürzlich andere Arzneimittel eingenommen/angewendet haben oder beabsichtigen andere Arzneimittel einzunehmen/anzuwenden.
Welche anderen Arzneimittel beeinflussen die Wirkung von Adalat 5 mg/50 ml pro infusione?
Nifedipin (Wirkstoff in Adalat 5 mg/50 ml pro infusione) wird unter Beteiligung eines bestimmten Enzymsystems (Cytochrom P450 3A4) abgebaut. Daher kann die gleichzeitige Anwendung von Arzneimitteln, die dieses Enzymsystem beeinflussen, zu Wechselwirkungen dieser Arzneimittel mit Adalat 5 mg/50 ml pro infusione führen.
Sowohl das Ausmaß wie auch die Dauer der Wechselwirkungen sollten in Betracht gezogen werden, wenn Adalat 5 mg/50 ml pro infusione zusammen mit den nachfolgend aufgeführten Arzneimitteln angewendet werden soll.
Verstärkung der Adalat 5 mg/50 ml pro infusione-Wirkungen und -Nebenwirkungen durch andere Arzneimittel
Wenn Sie gleichzeitig mit Adalat 5 mg/50 ml pro infusione folgende andere Arzneimittel anwenden, sollte der Blutdruck überwacht und, falls erforderlich, eine Verringerung der Adalat 5 mg/50 ml pro infusione-Dosis in Betracht gezogen werden (siehe auch „Warnhinweise und Vorsichtsmaßnahmen“):
- Bestimmte Antibiotika (z. B. Erythromycin)
- Bestimmte Anti-HIV-Arzneimittel (z. B. Ritonavir)
- Bestimmte Arzneimittel gegen Pilzerkrankungen (z. B. Ketoconazol)
- Fluoxetin und Nefazodon (Mittel gegen krankhaft-traurige Verstimmung, Antidepressiva)
- Chinupristin/Dalfopristin (Antibiotika)
- Valproinsäure (Mittel gegen Epilepsie)
- Cimetidin (Mittel gegen Magen- und Darmgeschwüre)
- trizyklische Antidepressiva (Arzneimittel gegen Depressionen)
- Vasodilatatoren (gefäßerweiternde Arzneimittel)
- Cisaprid (Magen-Darm-Mittel)
Abschwächung der Adalat 5 mg/50 ml pro infusione-Wirkung durch andere Arzneimittel
Rifampicin (Mittel gegen Tuberkulose):
Rifampicin führt zu einem beschleunigten Abbau von Nifedipin (Wirkstoff in Adalat 5 mg/50 ml pro infusione) im Körper. Bei einer Behandlung mit Adalat 5 mg/50 ml pro infusione darf Rifampicin nicht gleichzeitig angewendet werden, da keine wirksamen Blutspiegel von Nifedipin erreicht werden (siehe auch Abschnitt 2 ”Adalat 5 mg/50 ml pro infusione darf nicht angewendet werden”).
Phenytoin (Wirkstoff zur Behandlung von Herzrhythmusstörungen und Epilepsie):
Abschwächung der Wirksamkeit von Adalat 5 mg/50 ml pro infusione. Bei gleichzeitiger Einnahme beider Arzneimittel sollte die Reaktion auf Nifedipin (Wirkstoff in Adalat 5 mg/50 ml pro infusione) beobachtet und gegebenenfalls eine Steigerung der Dosis von Adalat 5 mg/50 ml pro infusione erwogen werden. Nach Beendigung der Anwendung von Phenytoin kann erneut eine Anpassung der Dosis von Adalat 5 mg/50 ml pro infusione erforderlich sein.
Carbamazepin und Phenobarbital (Wirkstoffe zur Behandlung der Epilepsie):
Die gleichzeitige Einnahme von Adalat 5 mg/50 ml pro infusione kann zu einer abgeschwächten Wirkung von Adalat 5 mg/50 ml pro infusione führen.
Wie beeinflusst Adalat 5 mg/50 ml pro infusione die Wirkung anderer Arzneimittel?
Blutdrucksenkende Arzneimittel:
Die blutdrucksenkende Wirkung anderer Arzneimittel verschiedener Wirkstoffgruppen kann durch Adalat 5 mg/50 ml pro infusione verstärkt werden, z. B. von:
- Diuretika (harntreibende Mittel)
- Beta-Rezeptorenblockern (Arzneimittel gegen Bluthochdruck)
- ACE-Hemmern (Arzneimittel gegen Bluthochdruck)
- Angiotensin-1-Rezeptor-Antagonisten (Arzneimittel gegen Bluthochdruck)
- anderen Calciumantagonisten (Arzneimittel gegen Bluthochdruck)
- Alpha-Rezeptorenblockem (Arzneimittel gegen Bluthochdruck und Herzleistungsschwäche)
- PDE-5-Inhibitoren (Arzneimittel zur Behandlung von Erektionsstörungen)
- Alpha-Methyldopa (Arzneimittel gegen Bluthochdruck)
Beta-Rezeptorenblocker (Wirkstoffgruppe von Blutdrucksenkern):
Bei gleichzeitiger Behandlung mit Beta-Rezeptorenblockern können in Einzelfällen Zeichen einer Herzleistungsschwäche auftreten. Ihr Arzt wird in diesen Fällen den Behandlungsverlauf sorgfältig überwachen.
Digoxin (Wirkstoff zur Stärkung der Herzkraft):
Die Konzentration dieses Arzneimittels im Blut kann ansteigen. Auf Anzeichen einer Digoxin-Überdosierung sollte geachtet werden und, falls notwendig, die Digoxin-Dosis vom Arzt reduziert werden (nach Bestimmung der Digoxin-Konzentration im Blut).
Theophyllin (Wirkstoff zur Erweiterung der Bronchien):
Die Konzentration dieses Arzneimittels im Blut kann ansteigen.
Vincristin (Wirkstoff zur Behandlung von Tumoren):
Die Ausscheidung von Vincristin wird vermindert, wodurch die Nebenwirkungen von Vincristin zunehmen können. Ihr Arzt wird evtl. eine Verringerung der Vincristin-Dosis verordnen.
Cephalosporine (Wirkstoffe zur Behandlung von Infektionen):
Die Cephalosporin-Konzentration im Blut kann erhöht sein.
Chinidin (Wirkstoff zur Behandlung von Herzrhythmusstörungen):
In Einzelfällen bewirkt Adalat 5 mg/50 mg pro infusione einen Abfall bzw. das Absetzen von Adalat 5 mg/50 mg pro infusione einen deutlichen Anstieg des Chinidingehaltes im Blut (Kontrolle des Chinidingehaltes im Blut!). In anderen Fällen wurde auch über einen Anstieg der NifedipinKonzentration im Blut durch Chinidin berichtet. Es wird deshalb empfohlen, den Blutdruck sorgfältig zu überwachen, wenn beide Arzneimittel gleichzeitig angewendet werden. Ggf. sollte die Dosis von Adalat 5 mg/50 mg pro infusione verringert werden.
Tacrolimus (Wirkstoff zur Vorbeugung der Transplantatabstoßung nach z. B. Leber- und Nierentransplantationen):
Bei gleichzeitiger Einnahme von Adalat 5 mg/50 mg pro infusione können erhöhte Tacrolimus-Blutspiegel auftreten, so dass die Tacrolimus-Dosis im Einzelfall reduziert werden sollte. Eine regelmäßige Kontrolle der Blutspiegel von Tacrolimus wird empfohlen.
Adalat 5 mg/50 ml pro infusione enthält 18,0 Vol.-% Alkohol. Daher können Interaktionen mit Arzneimitteln, die Alkohol-inkompatibel sind, auftreten.
Schwangerschaft, Stillzeit und Zeugungs-/ Gebärfähigkeit
Schwangerschaft
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt um Rat.
Adalat 5 mg/50 ml pro infusione darf bei Ihnen während der gesamten ersten 20 Wochen der Schwangerschaft nicht angewendet werden, da experimentelle Studien mit dem Wirkstoff Nifedipin Hinweise auf Fetusschädigungen ergeben haben. Ausreichende Erfahrungen beim Menschen liegen nicht vor. Wird unter der Behandlung mit Adalat 5 mg/50 ml pro infusione eine Schwangerschaft festgestellt, muss unter ärztlicher Beratung eine Umstellung der Behandlung erfolgen. Ab der 20. Schwangerschaftswoche kann Adalat 5 mg/50 ml pro infusione nach sorgfältiger Nutzen-RisikoAbwägung angewendet werden, wenn andere Behandlungsmöglichkeiten nicht in Frage kommen oder sich als unwirksam erwiesen haben.
Wenn Sie Nifedipin zusammen mit intravenös verabreichtem Magnesiumsulfat erhalten, muss Ihr Blutdruck sorgfältig überwacht werden, da ein übermäßiger Blutdruckabfall auftreten kann, der sowohl die Mutter wie auch den Fetus schädigen kann.
Stillzeit
Während der Stillzeit darf Adalat 5 mg/50 ml pro infusione nicht angewendet werden, da Nifedipin (Wirkstoff in Adalat 5 mg/50 ml pro infusione) in die Muttermilch übergeht und keine Erfahrungen über mögliche Auswirkungen auf den Säugling vorliegen. Ist während der Stillzeit eine Behandlung mit Adalat 5 mg/50 ml pro infusione notwendig, sollten Sie abstillen.
Zeugungs-/Gebärfähigkeit
In Einzelfällen wurde bei der künstlichen Befruchtung unter Rückübertragung der befruchteten Eizelle in die Gebärmutter eine Beeinträchtigung der Spermienfunktion mit der Anwendung von Nifedipin oder ähnlichen Wirkstoffen in Verbindung gebracht.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Der Alkoholgehalt in diesem Arzneimittel kann die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigen.
Adalat 5 mg/50 ml pro infusione enthält 18,0 Vol.-% Alkohol.
Bei Beachtung der Dosierungsanleitung werden bei einer täglichen Verabreichung von 300 ml bis zu 45 g Alkohol zugeführt. Vorsicht ist geboten. Dieses Arzneimittel darf nicht angewendet werden bei Leberkranken, Alkoholkranken, Epileptikern, Patienten mit organischen Erkrankungen des Gehirns, Schwangeren, Stillenden und Kindern. Die Wirkung anderer Arzneimittel kann beeinträchtigt oder verstärkt werden (siehe Abschnitt „Anwendung von Adalat 5 mg/50 ml pro infusione zusammen mit anderen Arzneimitteln“).
3. Wie ist Adalat 5 mg/50 ml pro infusione anzuwenden?
Die Behandlung soll möglichst individuell nach dem Schweregrad der Erkrankung und dem Ansprechen des Patienten unter Kontrolle von Blutdruck und Herzfrequenz durchgeführt werden.
Dosierung
Soweit nicht anders verordnet, gelten die folgenden Dosierungsangaben für Erwachsene:
50 ml Adalat 5 mg/50 ml pro infusione in ca. 4 - 8 Std. infundieren (das entspricht: 6,3 ml - 12,5 ml Adalat 5 mg/50 ml pro infusione pro Stunde oder 0,63 mg - 1,25 mg Nifedipin pro Stunde).
Eine maximale Infusion von 150 - 300 ml Adalat 5 mg/50 ml pro infusione (entsprechend 15 - 30 mg Nifedipin) in 24 Stunden und Wiederholungen an bis zu 3 Tagen sind möglich, sollten jedoch nicht überschritten werden.
Die Weiterbehandlung mit einer oralen Darreichungsform ist zu empfehlen.
Anwendung bei bestimmten Patientengruppen
Kinder und Jugendliche
Adalat 5 mg/50 ml pro infusione wird nicht empfohlen für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren aufgrund der begrenzt vorliegenden Daten zur Sicherheit und Wirksamkeit in dieser Patientengruppe.
Ältere Patienten (> 65 Jahre)
Bei älteren Menschen kann eine geringe Dosis erforderlich sein.
Patienten mit eingeschränkter Leberfunktion
Patienten mit eingeschränkter Leberfunktion sollten sorgfältig überwacht werden; ggf. kann in schweren Fällen eine Dosisreduktion erforderlich sein.
Patienten mit eingeschränkter Nierenfunktion
Eine Dosisanpassung ist bei diesen Patienten nicht erforderlich.
Art der Anwendung
Intravenöse Infusion
Die Infusion von Adalat 5 mg/50 ml pro infusione darf nur mit dem beiliegenden Infusionszubehör durchgeführt werden (Spritze passend zu Perfusor® der Firma Braun Melsungen AG).
Wegen der Lichtempfindlichkeit der gebrauchsfertigen Lösung ist auf Lichtschutz zu achten. Bei Verwendung des beiliegenden Infusionszubehörs ist kein Verlust von Nifedipin zu erwarten.
Bei Herstellung einer Mischinfusion im Nebenschluss/Bypass muss der Lichtschutz gewährleistet bleiben. Adalat 5 mg/50 ml pro infusione darf nur möglichst nahe an der Venenpunktionsstelle einer bereits laufenden Infusion im Nebenschluss zugesetzt werden. Adalat 5 mg/50 ml pro infusione darf keinesfalls in die Infusionslösung selbst eingespritzt werden.
Falls die Lösung im Kühlschrank gelagert wurde, sollte sie vor der intravenösen Infusion mindestens Raumtemperatur erreicht haben.
Dauer der Anwendung
Die Dauer der Einnahme bestimmt der behandelnde Arzt.
Wenn Sie eine größere Menge von Adalat 5 mg/50 ml pro infusione erhalten haben, als Sie sollten
Eine Überdosierung von Adalat 5 mg/50 ml pro infusione kann zu starkem Blutdruckabfall, verlangsamter oder beschleunigter Herzschlagfolge, Bewusstseinstrübung bis zu tiefer Bewusstlosigkeit, erhöhtem Blutzuckerspiegel (Hyperglykämie), Minderdurchblutung wichtiger Organe und durch Herzversagen ausgelöstem Schock mit Ansammlung von Flüssigkeit in der Lunge (Lungenödem) führen.
Verständigen Sie bei Verdacht auf eine Überdosierung sofort einen Arzt/Notarzt, damit dieser über das weitere Vorgehen entscheiden kann.
Wenn Sie die Anwendung von Adalat 5 mg/50 ml pro infusione abbrechen
Bitte unterbrechen oder beenden Sie die Behandlung mit Adalat 5 mg/50 ml pro infusione nicht, ohne dies vorher mit Ihrem Arzt abgesprochen zu haben.
Wenn Sie weitere Fragen zur Einnahme dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig: Kann mehr als 1 Behandelten von 10 betreffen
Häufig: Kann bis zu 1 von 10 Behandelten betreffen
Kann bis zu 1 von 100 Behandelten betreffen
Gelegentlich:
Selten:
Sehr selten: Nicht bekannt:
Kann bis zu 1 von 1.000 Behandelten betreffen
Kann bis zu 1 von 10.000 Behandelten betreffen
Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar
Mögliche Nebenwirkungen
Sehr häufig: Kopfschmerzen, Gewebeschwellung infolge Flüssigkeitsansammlungen (Ödeme).
Häufig: Schwindel, Benommenheit, Schwächegefühl, Herzklopfen, Erweiterung der Blutgefäße (z. B. Gesichtsrötung), Verstopfung, Übelkeit, schmerzhafte Schwellung und Rötung von Armen und Beinen (Erythromelalgie, insbesondere zu Beginn der Behandlung), Schwitzen, allgemeines Unwohlsein.
Gelegentlich: Allergische Reaktionen, allergisch bedingte Gewebeschwellung, Gesichts- und Schleimhautschwellung im Mund und Rachen (Angioödem) einschließlich Kehlkopfschwellung, die lebensbedrohlich verlaufen kann. Juckreiz, Hautausschlag, Angstreaktionen, Schlafstörungen,
Migräne, Muskelzittern, Missempfindungen (z. B. Kribbeln, pelziges Gefühl), unter Umständen auch schmerzhaft. Schläfrigkeit/Müdigkeit, Nervosität, Sehstörungen, Erhöhung der Pulsfrequenz, Blutdruckabfall, kurz andauernde Ohnmacht, Nasenbluten, verstopfte Nase, Atemnot, Schmerzen im Magen-Darm-Bereich, Bauchschmerzen, Verdauungsstörungen, Blähungen, Mundtrockenheit, vorübergehender Anstieg der Leberenzymwerte, Hautrötung mit Wärmegefühl, Muskelkrämpfe, geschwollene Gelenke, Muskelschmerzen, vermehrter Harndrang sowie eine vermehrte tägliche Urinausscheidung, schmerzhafter Harndrang mit Erschwernis des Wasserlassens. Bei Niereninsuffizienz vorübergehende Verschlechterung der Nierenfunktion möglich,
Erektionsstörungen, unspezifische Schmerzen, Schüttelfrost, Reaktionen an der Injektions- und Infusionsstelle, Entzündung der Venen an der Infusionsstelle (Thrombophlebitis).
Gelegentlich kann es insbesondere zu Beginn der Behandlung zum Auftreten von Angina pectoris-Anfällen bzw. bei Patienten mit bestehender Angina pectoris zu einer Zunahme von Häufigkeit, Dauer und Schweregrad der Anfälle kommen.
Selten: Blutbildveränderungen wie Verminderung der roten und weißen Blutkörperchen bzw. Blutplättchen (Anämie, Leukopenie, Thrombopenie), Haut- und Schleimhautblutungen bei verminderter Blutplättchenzahl (Thrombozytopenische Purpura), Nesselsucht, Erhöhung des Blutzuckerspiegels, Zahnfleischwucherung, Appetitlosigkeit, Völlegefühl, Aufstoßen, Gelbsucht, allergische Lichtempfindlichkeit der Haut, tastbare, kleinfleckige Einblutungen in Haut und Schleimhaut, Vergrößerung der männlichen Brust (Gynäkomastie), die sich nach Absetzen von Adalat 5 mg/50 ml pro infusione zurückbildet.
Sehr selten: Hochgradige Verminderung bestimmter weißer Blutkörperchen (Agranulozytose), Herzinfarkt, schuppenartige Hautentzündung (exfoliative Dermatitis).
Häufigkeit nicht bekannt: Akute allergische Allgemeinreaktionen, die unter Umständen lebensbedrohlich sein können (anaphylaktische/anaphylaktoide Reaktionen), herabgesetzte Empfindung von Berührungsreizen, Augenschmerzen, Erbrechen, Speiseröhrenentzündung, schwerwiegende und lebensbedrohliche Hautveränderungen mit Ablösung und Blasenbildung der Oberhaut (Syndrom der verbrühten Haut, toxische epidermale Nekrolyse), Gelenkschmerzen.
Unmittelbar nach Beginn der Infusion kann es häufig zu einem Anstieg der Herzfrequenz (Tachykardie) und zu Blutdrucksenkung unter die Norm (Hypotone Kreislaufreaktion) kommen, in der Regel 5-15 Minuten nach Infusionsende zur Ausgangslage zurückkehren.
Bei Dialysepatienten mit Bluthochdruck und verminderter Blutmenge kann ein deutlicher Blutdruckabfall auftreten.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist Adalat 5 mg/50 ml pro infusione aufzubewahren?
Nicht über 25 °C lagern.
Die Durchstechflaschen im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Die Infusionslösung ist sehr lichtempfindlich; deshalb sollte die mit einer Umhüllung versehene Flasche erst zum Gebrauch aus der Faltschachtel entnommen werden. Die Verpackung in Braunglasflaschen kombiniert mit gelber, lichtschützender Kunststoffumhüllung bietet genügend Lichtschutz für 1 Stunde.
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen dieses Arzneimittel nach dem auf dem Etikett/dem Umkarton nach "Verw. bis" bzw. nach "Verwendbar bis" angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats. Die Verfalldatumsangabe gilt nur für die ungeöffnete Originalpackung.
6. Inhalt der Packung und weitere Informationen Was Adalat 5 mg/50 ml pro infusione enthält
- Der Wirkstoff ist: Nifedipin
1 Durchstechflasche mit 50 ml enthält 5 mg Nifedipin.
- Die sonstigen Bestandteile sind: Ethanol 96 % (18,0 Vol.-%), Macrogol 400, Natriumhydroxid, Wasser für Injektionszwecke
Wie Adalat 5 mg/50 ml pro infusione aussieht und Inhalt der Packung
Klare, gelbliche Lösung.
Adalat 5 mg/50 ml pro infusione ist in Packungen mit 1 Spritze, 1 Infusionsleitung und 1 Durchstechflasche mit 50 ml Infusionslösung zu 5 mg Nifedipin erhältlich.
Pharmazeutischer Unternehmer
Bayer Vital GmbH
51368 Leverkusen
Tel.: 0214/30-5 13 48
Fax: 0214/30-5 16 03
E-Mail: bayer-vital@bayerhealthcare.com
Hersteller
Bayer Pharma AG Betrieb: 51368 Leverkusen
Diese Packungsbeilage wurde zuletzt überarbeitet im Mai 2014.
Die folgenden Informationen sind für medizinisches Fachpersonal bestimmt:
Die Verabreichung von Adalat 5 mg/50 ml pro infusione muss entsprechend den folgenden Anweisungen erfolgen.
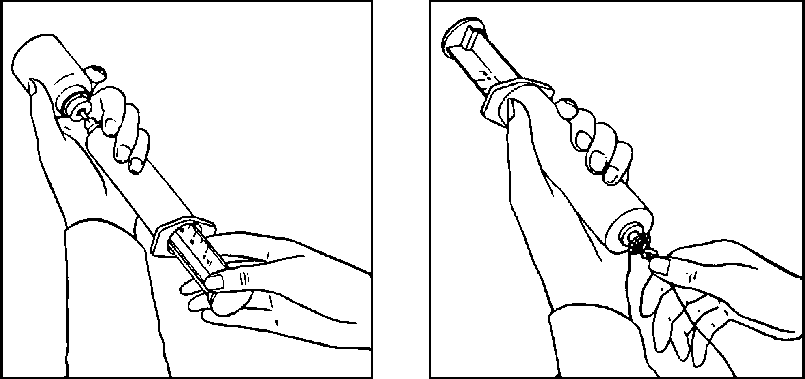
Abb. 1
Spritze aufziehen. Hierbei durch mehrmaliges Pumpen den Inhalt der Flasche unter Druck setzen.
Abb. 2
Kanüle entfernen und Infusionsleitung an der Spritze befestigen. Spritze und Leitung entlüften!


Abb. 3
Aufgezogene Spritze in den Perfusor® legen und die Infusionsgeschwindigkeit einstellen.
Abb. 4
Infusionsleitung und Infusionskanüle miteinander verbinden. Perfusor® einschalten. Bedienungsanleitung für den Perfusor® beachten!
9