Adalat 5Mg/50Ml Pro Infusione
F achinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Adalat® 5 mg/50 ml pro infusione, Infusionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Durchstechflasche mit 50 ml enthält 5 mg Nifedipin.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Infusionslösung: klare, gelbliche Lösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
- Zur Behandlung der vasospastischen Angina (Prinzmetal-Angina, Variant-Angina)
- Zur Behandlung des hypertensiven Notfalls
4.2 Dosierung und Art der Anwendung
Dosierung
Die Behandlung soll möglichst individuell nach dem Schweregrad der Erkrankung und dem Ansprechen des Patienten unter Kontrolle von Blutdruck und Herzfrequenz durchgeführt werden.
Soweit nicht anders verordnet, gelten die folgenden Dosierungsangaben für Erwachsene:
50 ml Adalat 5 mg/50 ml pro infusione in ca. 4 - 8 Std. infundieren (das entspricht: 6,3 ml - 12,5 ml Adalat 5 mg/50 ml pro infusione pro Stunde oder 0,63 mg - 1,25 mg Nifedipin pro Stunde).
Eine maximale Infusion von 150 - 300 ml Adalat 5 mg/50 ml pro infusione (entsprechend 15 - 30 mg Nifedipin) in 24 Stunden und Wiederholungen an bis zu 3 Tagen sind möglich, sollten jedoch nicht überschritten werden.
Die Weiterbehandlung mit einer oralen Darreichungsform ist zu empfehlen.
Zusätzliche Informationen zu bestimmten Patientengruppen
Kinder und Jugendliche
Adalat 5 mg/50 ml pro infusione wird nicht empfohlen für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren. Wirksamkeit und Unbedenklichkeit von Nifedipin bei Kindern und Jugendlichen unter 18 Jahren wurden nicht untersucht. Derzeit verfügbare Daten zur Anwendung von Nifedipin bei Hypertonie werden in Abschnitt 5.1 beschrieben.
Ältere Patienten (> 65 Jahre)
Die Pharmakokinetik von Adalat 5 mg/50 ml pro infusione ist bei älteren Menschen verändert, sodass geringere Erhaltungsdosen Nifedipin erforderlich sein können.
Patienten mit eingeschränkter Leberfunktion
Patienten mit eingeschränkter Leberfunktion sollten sorgfältig überwacht werden; ggf. kann in schweren Fällen eine Dosisreduktion erforderlich sein.
Patienten mit eingeschränkter Nierenfunktion
Ausgehend von den pharmakokinetischen Daten ist bei Patienten mit eingeschränkter Nierenfunktion keine Dosisanpassung notwendig (siehe Abschnitt 5.1).
Art der Anwendung
Intravenöse Infusion
Die Infusion von Adalat 5 mg/50 ml pro infusione darf nur mit dem beiliegenden Infusionszubehör durchgeführt werden (Spritze passend zu Perfusor® der Firma Braun Melsungen AG).
Wegen der Lichtempfindlichkeit der gebrauchsfertigen Lösung ist auf Lichtschutz zu achten. Bei Verwendung des beiliegenden Infusionszubehörs ist kein Verlust von Nifedipin zu erwarten.
Bei Herstellung einer Mischinfusion im Nebenschluss/Bypass muss der Lichtschutz gewährleistet bleiben. Adalat 5 mg/50 ml pro infusione darf nur möglichst nahe an der Venenpunktionsstelle einer bereits laufenden Infusion im Nebenschluss zugesetzt werden. Adalat 5 mg/50 ml pro infusione darf keinesfalls in die Infusionslösung selbst eingespritzt werden.
Falls die Lösung im Kühlschrank gelagert wurde, sollte sie vor der intravenösen Infusion mindestens Raumtemperatur erreicht haben.
Die Verabreichung von Adalat 5 mg/50 ml pro infusione muss entsprechend den folgenden Anweisungen erfolgen.
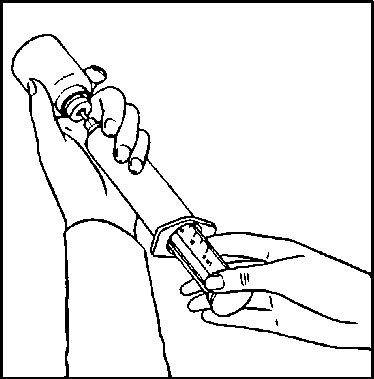
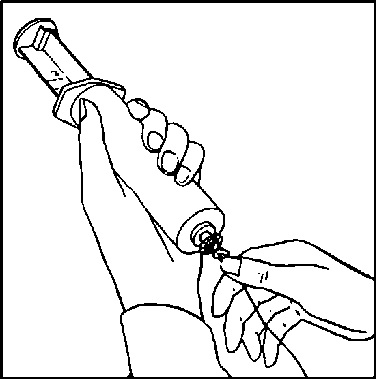
Abb. 1
Spritze aufziehen. Hierbei durch mehrmaliges Pumpen den Inhalt der Flasche unter Druck setzen.
Abb. 2
Kanüle entfernen und Infusionsleitung an der Spritze befestigen. Spritze und Leitung entlüften!


Abb. 4
Infusionsleitung und Infusionskanüle miteinander verbinden. Perfusor® einschalten. Bedienungsanleitung für den Perfusor® beachten!
4.3 Gegenanzeigen
Adalat 5 mg/50 ml pro infusione darf nicht angewendet werden
- bei Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
- bei Herz-Kreislauf-Schock
- bei höhergradiger Aortenstenose
- bei instabiler Angina pectoris
- bei akutem Myokardinfarkt (innerhalb der ersten 4 Wochen)
- bei gleichzeitiger Behandlung mit Rifampicin, da aufgrund der Enzyminduktion keine wirksamen Nifedipin-Plasmaspiegel erreicht werden (siehe Abschnitt 4.5)
- in der Schwangerschaft vor der 20. Woche und in der Stillzeit (siehe Abschnitt 4.6)
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Eine besonders sorgfältige ärztliche Überwachung ist erforderlich bei:
- schwerer Hypotension (RR-Wert weniger als 90 mm Hg systolisch)
- dekompensierter Herzinsuffizienz
Adalat 5 mg/50 ml pro infusione sollte nicht angewendet werden, wenn ein kausaler Zusammenhang zwischen ischämischem Schmerz und einer früheren Therapie mit Nifedipin vermutet wird.
Insbesondere zu Beginn der Behandlung kann es gelegentlich zum Auftreten von Angina pectoris-Anfällen bzw. bei Patienten mit bestehender Angina pectoris zu einer Zunahme von Häufigkeit, Dauer und Schweregrad der Anfälle kommen.
Sehr selten ist über das Auftreten von Myokardinfarkten berichtet worden.
Patienten mit eingeschränkter Leberfunktion sollten sorgfältig überwacht werden. In schweren Fällen kann eine Dosisverringerung erforderlich sein.
Nifedipin wird über das Cytochrom P450 3A4-System metabolisiert. Daher können Wirkstoffe, von denen bekannt ist, dass sie dieses Enzymsystem beeinflussen, den First-Pass-Metabolismus oder die Ausscheidung von Nifedipin verändern (siehe Abschnitt 4.5).
Die Plasmaspiegel von Nifedipin können z. B. durch folgende Arzneimittel, die als Inhibitoren dieses Enzymsystems bekannt sind, erhöht werden:
- Makrolid-Antibiotika (z. B. Erythromycin)
- Anti-HIV-Proteaseinhibitoren (z. B. Ritonavir)
- Antimykotika vom Azol-Typ (z. B. Ketoconazol)
- Antidepressiva: Nefazodon und Fluoxetin
- Chinupristin/Dalfopristin
- Valproinsäure
- Cimetidin
- Trizyklische Antidepressiva, Vasodilatatoren
- Cisaprid
Wenn Adalat 5 mg/50 ml pro infusione gleichzeitig mit einem dieser Arzneimittel angewendet wird, sollte der Blutdruck überwacht werden und, falls erforderlich, eine Verringerung der Nifedipin-Dosis in Betracht gezogen werden.
Nifedipin ist vor der 20. Schwangerschaftswoche kontraindiziert. Nifedipin sollte während der Schwangerschaft nicht angewendet werden, es sei denn der klinische Zustand der Frau erfordert eine Nifedipinbehandlung. Nifedipin sollte nur für Frauen mit schwerer Hypertonie in Betracht gezogen werden, bei denen eine Standardtherapie nicht wirksam ist (siehe Abschnitt 4.6).
Wenn Nifedipin zusammen mit intravenös verabreichtem Magnesiumsulfat angewendet wird, muss der Blutdruck sorgfältig überwacht werden, da ein übermäßiger Blutdruckabfall auftreten kann, der sowohl die Mutter wie auch den Fetus schädigen kann.
Dieses Arzneimittel enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro Dosiseinheit, d. h., es ist nahezu natriumfrei.
Dieses Arzneimittel enthält 18,0 Vol.-% Alkohol. Bei Beachtung der Dosierungsanleitung werden bei einer täglichen Verabreichung von 300 ml bis zu 45 g Alkohol zugeführt. Vorsicht ist geboten. Dieses Arzneimittel darf nicht angewendet werden bei Leberkranken, Alkoholkranken, Epileptikern, Patienten mit organischen Erkrankungen des Gehirns, Schwangeren, Stillenden und Kindern. Die Wirkung anderer Arzneimittel kann beeinträchtigt oder verstärkt werden (siehe Abschnitt 4.5). Im Straßenverkehr und bei der Bedienung von Maschinen kann das Reaktionsvermögen beeinträchtigt werden.
Zur Anwendung bei besonderen Patientengruppen, siehe Abschnitt 4.2.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Arzneimittel, die Nifedipin beeinflussen
Nifedipin wird über das Cytochrom P450 3A4-System metabolisiert, das sowohl in der Darmschleimhaut als auch in der Leber vorkommt. Daher kann die gleichzeitige Anwendung von Arzneimitteln, die dieses System induzieren oder hemmen, den First-Pass-Metabolismus (nach oraler Gabe) oder die Ausscheidung von Nifedipin beeinflussen (siehe Abschnitt 4.4).
Nifedipin wird hauptsächlich in der Leber inaktiviert. Die Metabolisierung wird deshalb im Wesentlichen durch den Pfortader-Blutfluss bestimmt. Die im Folgenden aufgeführten möglichen Interaktionen, die für Nifedipin bei oraler Gabe gelten, müssen somit nicht notwendigerweise auch für die intravenöse Verabreichung zutreffen.
Arzneimittel, die das Cytochrom P450 3A4-System hemmen
Bei gleichzeitiger Anwendung von Nifedipin und den nachfolgend aufgeführten Wirkstoffen. die als schwache oder moderate Inhibitoren dieses Enzymsystems bekannt sind. sollte der Blutdruck überwacht und ggf. die Nifedipin-Dosis angepasst werden (siehe Abschnitt 4.2).
Makrolid-Antibiotika (z. B. Erythromycin)
Es wurden keine Interaktionsstudien mit Nifedipin und Makrolid-Antibiotika durchgeführt. Da aber bekannt ist. dass bestimmte Makrolid-Antibiotika das CYP3A4-System hemmen. kann ein Anstieg der Plasmakonzentration von Nifedipin bei gleichzeitiger Anwendung nicht ausgeschlossen werden (siehe Abschnitt 4.4).
Azithromycin. obwohl strukturell verwandt mit den Makrolid-Antibiotika. ist kein Inhibitor von CYP3A4.
Anti-HIV- Proteaseinhibitoren (z. B. Ritonavir)
Es wurde keine klinische Interaktionsstudie mit Nifedipin und Protease-Inhibitoren durchgeführt. Protease-Inhibitoren sind als Hemmer des Cytochrom P450 3A4-Systems bekannt. Außerdem wurde gezeigt. dass Arzneimittel dieser Klasse in vitro den Cytochrom P450 3A4 vermittelten Metabolismus von Nifedipin hemmen. Wenn diese Arzneimittel zusammen mit Nifedipin angewendet werden. kann ein erheblicher Anstieg der Plasmakonzentration von Nifedipin aufgrund eines verringerten First-PassMetabolismus und einer verringerten Elimination nicht ausgeschlossen werden (siehe Abschnitt 4.4).
Antimykotika vom Azol-Typ (z. B. Ketoconazol)
Eine formale Interaktionsstudie mit Nifedipin und Antimykotika vom Azol-Typ wurde nicht durchgeführt. Wirkstoffe dieser Substanzklasse sind als Inhibitoren des Cytochrom P450 3A4-Systems bekannt. Daher kann die Möglichkeit der Erhöhung der systemischen Bioverfügbarkeit von Nifedipin aufgrund eines verminderten First-Pass-Metabolismus bei gleichzeitiger oraler Anwendung beider Arzneimittel nicht ausgeschlossen werden (siehe Abschnitt 4.4).
Fluoxetin
Es wurde keine klinische Interaktionsstudie mit Nifedipin und Fluoxetin durchgeführt. Es wurde gezeigt. dass Fluoxetin in vitro den Cytochrom P450 3A4 vermittelten Nifedipin-Stoffwechsel inhibiert. Daher kann die Möglichkeit der Erhöhung der Nifedipin-Plasmaspiegel bei gleichzeitiger Anwendung beider Arzneimittel nicht ausgeschlossen werden (siehe Abschnitt 4.4).
Nefazodon
Es wurde keine klinische Interaktionsstudie mit Nifedipin und Nefazodon durchgeführt. Nefazodon ist als Inhibitor des Cytochrom P450 3A4 vermittelten Stoffwechsels bekannt. Daher kann die Möglichkeit der Erhöhung der Nifedipin-Plasmaspiegel bei gleichzeitiger Anwendung beider Arzneimittel nicht ausgeschlossen werden (siehe Abschnitt 4.4).
Chinupristin/Dalfopristin
Die gleichzeitige Anwendung von Chinupristin/Dalfopristin und Nifedipin kann erhöhte Plasmakonzentrationen von Nifedipin bewirken (siehe Abschnitt 4.4).
Valproinsäure
Es wurden keine Interaktionsstudien mit Nifedipin und Valproinsäure durchgeführt. Da gezeigt wurde. dass Valproinsäure die Plasmakonzentration des strukturell ähnlichen Calciumantagonisten Nimodipin durch eine Enzymhemmung erhöht. kann eine Erhöhung der Plasmakonzentration und damit eine verstärkte Wirkung von Nifedipin nicht ausgeschlossen werden (siehe Abschnitt 4.4).
Cimetidin
Aufgrund der Hemmung von Cytochrom P450 3A4 kann Cimetidin zu einer Erhöhung des NifedipinPlasmaspiegels und somit zu einer verstärkten antihypertensiven Wirkung von Nifedipin führen (siehe Abschnitt 4.4).
Trizyklische Antidepressiva, Vasodilatatoren Der antihypertensive Effekt kann verstärkt werden.
Cisaprid
Die gleichzeitige Anwendung von Cisaprid und Nifedipin kann zu erhöhten Plasmaspiegeln von Nifedipin führen.
Arzneimittel, die das Cytochrom P450 3A4-System induzieren
Rifampicin
Rifampicin ist ein starker Cytochrom P450 3A4-Induktor. Bei gleichzeitiger Anwendung mit Rifampicin ist die Bioverfügbarkeit von Nifedipin deutlich reduziert und somit die Wirksamkeit vermindert. Die Anwendung von Nifedipin in Kombination mit Rifampicin ist daher kontraindiziert (siehe Abschnitt 4.3).
Antiepileptika (z. B. Phenytoin, Carbamazepin, Phenobarbital)
Phenytoin induziert das Cytochrom P450 3A4-System. Bei gleichzeitiger Anwendung von Phenytoin und Nifedipin wird die Bioverfügbarkeit von Nifedipin vermindert und so seine Wirksamkeit geschwächt. Wenn beide Präparate gleichzeitig angewendet werden, sollte die klinische Reaktion auf Nifedipin beobachtet und gegebenenfalls eine Steigerung der Nifedipin-Dosis erwogen werden. Wenn die Nifedipin-Dosis während der gleichzeitigen Anwendung beider Arzneimittel erhöht wird, sollte nach Beendigung der Phenytoin-Therapie eine Reduktion der Nifedipin-Dosis in Betracht gezogen werden.
Formale Studien zur Untersuchung möglicher Interaktionen zwischen Nifedipin und Carbamazepin oder Phenobarbital wurden nicht durchgeführt. Nach Erfahrungen mit dem strukturell ähnlichen Calciumantagonisten Nimodipin kann jedoch nicht ausgeschlossen werden, dass die gleichzeitige Anwendung von Carbamazepin oder Phenobarbital, aufgrund deren enzyminduzierender Wirkung, zu verringerten Plasmakonzentrationen und damit zu einer abgeschwächten Wirkung von Nifedipin führen kann.
Wirkungen von Nifedipin auf andere Arzneimittel
Blutdrucksenkende Arzneimittel
Durch Nifedipin kann der blutdrucksenkende Effekt von gleichzeitig verabreichten Antihypertensiva verstärkt werden, wie z. B.:
- Diuretika
- Beta-Rezeptorenblocker
- ACE-Inhibitoren
- Angiotensin-1 (AT1)-Rezeptorantagonisten
- andere Calciumantagonisten
- Alpha-Rezeptorenblocker
- PDE-5-Inhibitoren
- Alpha-Methyldopa
Beta-Rezeptorenblocker
Bei gleichzeitiger Behandlung mit Beta-Rezeptorenblockern wurde in Einzelfällen das Auftreten bzw. eine Verschlechterung einer Herzinsuffizienz beobachtet. Die Patienten sollten deshalb sorgfältig überwacht werden.
Digoxin
Die gleichzeitige Anwendung von Nifedipin und Digoxin kann zu einer reduzierten DigoxinAusscheidung und damit zu einer Erhöhung des Digoxin-Plasmaspiegels führen. Aus diesem Grund sollte der Patient vorsorglich auf Symptome einer Digoxin-Überdosierung überwacht und der Plasmaspiegel kontrolliert werden. Ggf. ist die Glykosiddosis zu verringern.
Theophyllin
Nifedipin kann eine Erhöhung des Theophyllin-Plasmaspiegels bewirken.
Vincristin
Nifedipin vermindert die Ausscheidung von Vincristin, wodurch die Nebenwirkungen von Vincristin zunehmen können. Eine Dosisverminderung von Vincristin sollte daher in Betracht gezogen werden.
Cephalosporine
Bei gleichzeitiger Gabe von Cephalosporinen (z. B. Cefixim) und Nifedipin wurden erhöhte Cephalosporin-Plasmaspiegel beobachtet.
Chinidin
In Einzelfällen bewirkt Nifedipin einen Abfall des Chinidin-Plasmaspiegels bzw. das Absetzen von Nifedipin einen deutlichen Anstieg des Chinidin-Plasmaspiegels, so dass bei kombinierter Therapie oder Absetzen von Nifedipin die Kontrolle des Chinidin-Plasmaspiegels und, falls erforderlich, eine Anpassung der Chinidin-Dosis empfohlen wird. In einigen Fällen wurde über einen Anstieg der Nifedipin-Plasmakonzentration infolge von Chinidin berichtet, während in anderen Fällen keine Veränderung in der Pharmakokinetik von Nifedipin beobachtet wurde. Wenn die Einnahme von Chinidin während einer Behandlung mit Nifedipin begonnen wird, wird deshalb empfohlen, den Blutdruck sorgfältig zu überwachen und ggf. die Nifedipin-Dosis zu verringern.
Tacrolimus
Tacrolimus wird über das Cytochrom P450 3A4-System metabolisiert. Die gleichzeitige Anwendung von Tacrolimus und Nifedipin kann zu erhöhten Tacrolimus-Plasmaspiegeln führen. Aus diesem Grund wird eine regelmäßige Plasmaspiegelkontrolle und, falls erforderlich, eine Reduzierung der Tacrolimus-Dosis empfohlen.
Interaktionen mit Nahrungsmitteln und Getränken
Adalat 5 mg/50 ml pro infusione enthält 18,0 Vol.-% Alkohol. Daher können Interaktionen mit Arzneimitteln, die Alkohol-inkompatibel sind, auftreten (siehe Abschnitt 4.4).
Andere Arten von Wechselwirkungen
Die spektrophotometrische Bestimmung von Vanillinmandelsäure im Urin kann unter Nifedipin zu falsch erhöhten Werten führen; die Bestimmung mittels HPLC bleibt unbeeinflusst.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Nifedipin ist vor der 20. Schwangerschaftswoche kontraindiziert. Nifedipin sollte während der Schwangerschaft nicht angewendet werden, es sei denn der klinische Zustand der Frau erfordert eine Nifedipinbehandlung. Nifedipin sollte nur für Frauen mit schwerer Hypertonie in Betracht gezogen werden, bei denen eine Standardtherapie nicht wirksam ist (siehe Abschnitt 4.4).
Erfahrungen aus geeigneten und kontrollierten klinischen Studien mit Schwangeren liegen nicht vor. Die verfügbaren Informationen sind nicht ausreichend, um negative Effekte auf das ungeborene und neugeborene Kind auszuschließen.
Tierexperimentelle Untersuchungen ergaben Hinweise auf eine embryotoxische, fetotoxische und teratogene Wirkung von Nifedipin (siehe Abschnitt 5.3).
Aus der klinischen Erfahrung ist kein spezifisches pränatales Risiko erkennbar, obwohl über eine Zunahme von Fällen mit perinataler Asphyxie, Kaiserschnittentbindung sowie Frühreife und intrauterine Wachstumsverzögerung berichtet wurde. Es ist unklar, ob diese Beobachtungen auf den zugrunde liegenden Bluthochdruck, seine Behandlung oder auf einen spezifischen Effekt des Wirkstoffs zurückzuführen sind.
Stillzeit
Während der Stillzeit darf Nifedipin nicht angewendet werden.
Nifedipin geht in die Muttermilch über. Die Nifedipinkonzentration in der Milch ist nahezu vergleichbar mit der Serumkonzentration der Mutter (siehe Abschnitt 4.3).
Fertilität
In Einzelfällen von in-vitro-Fertilisation wurden Calciumantagonisten wie Nifedipin mit reversiblen biochemischen Veränderungen in der Kopfregion von Spermatozoen in Verbindung gebracht, die zu einer Beeinträchtigung der Spermienfunktion führen können. In Fällen, bei denen wiederholte in-vitro-Fertilisationen erfolglos blieben, ohne dass eine andere Erklärung dafür gefunden werden kann, sollten Calciumantagonisten wie Nifedipin als mögliche Ursache in Betracht gezogen werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Der Alkoholgehalt in diesem Arzneimittel kann die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigen.
4.8 Nebenwirkungen
Nebenwirkungen, die in placebokontrollierten Studien mit Nifedipin beobachtet wurden, sind nachfolgend aufgelistet (sortiert nach CIOMS-III-Kategorien; Nifedipin n = 2.661; Placebo n = 1.486; Stand 22. Februar 2006 und ACTION-Studie: Nifedipin n = 3.825; Placebo n = 3.840).
Die Häufigkeit der unter Nifedipin gemeldeten unerwünschten Arzneimittelwirkungen ist in der nachstehenden Tabelle zusammengefasst. Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben. Die Häufigkeiten sind dabei folgendermaßen definiert: Sehr häufig (>1/10), häufig (>1/100 bis <1/10), gelegentlich (>1/1.000 bis <1/100), selten (>1/10.000 bis <1/1.000), sehr selten (<1/10.000). Nebenwirkungen, die nur in Post-Marketing-Studien auftraten und für die eine Häufigkeit nicht abgeschätzt werden kann, sind in der Kategorie „nicht bekannt“ aufgelistet.
|
Systemorgan klasse (MedDRA) |
Sehr häufig |
Häufig |
Gelegentlich |
Selten |
Sehr selten |
Nicht bekannt |
|
Erkrankungen des Blutes und des Lymphsystems |
Leukopenie Anämie Thrombopenie Thrombozyto penische Purpura |
Agranulo zytose | ||||
|
Erkrankungen des Immunsystems |
Allergische Reaktionen Allergisches Ödem/Angio- ödem (einschließlich Larynxödem1) Pruritus Exanthem |
Urtikaria |
Anaphylak- tische/anaphy- laktoide Reaktionen | |||
|
Stoffwechsel- und Ernährungs störungen |
Hyperglykämie | |||||
|
Psychiatrische Erkrankun gen |
Angstreaktio nen Schlafstö rungen |
|
Systemorgan klasse (MedDRA) |
Sehr häufig |
Häufig |
Gelegentlich |
Selten |
Sehr selten |
Nicht bekannt |
|
Erkrankungen des Nervensystems |
Kopfschmer zen |
Schwindel Benommenheit Schwäche gefühl |
Migräne Tremor Par-/Dysäs- thesie Schläfrigkeit/ Müdigkeit Nervosität |
Hypästhesie | ||
|
Augener krankungen |
Sehstörungen |
Augen schmerzen | ||||
|
Herzerkran kungen |
Palpitationen |
Tachykardie Schmerzen im Brustraum (Angina pectoris2) |
Myokard- infarkt2 | |||
|
Gefäßer krankungen |
Ödeme (inkl. periphere Ödeme) |
Vasodilatation (z. B. Flush) |
Hypotonie Synkope | |||
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Nasenbluten Verstopfte Nase Dyspnoe | |||||
|
Erkrankungen des Gastrointestinaltrakts |
Obstipation Nausea |
Gastrointesti nale Schmerzen und Bauchschmerzen Dyspepsie Flatulenz Mundtrockenheit |
Gingiva hyperplasie Anorexie Völlegefühl Aufstoßen |
Emesis Ösophagitis | ||
|
Leber- und Gallenerkran kungen |
Vorübergehender Anstieg der Leberenzym werte |
Ikterus | ||||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Erythromel- algie, insbesondere zu Beginn der Behandlung Schwitzen |
Erythem |
Allergische Photosensi- tivität Palpable Purpura |
Exfoliative Dermatitis |
Toxische epidermale Nekrolyse | |
|
Skelettmuskulatur-, Bindegewebs-und Knochenerkrankungen |
Muskel krämpfe geschwollene Gelenke Myalgie |
Arthralgie | ||||
|
Erkrankungen der Nieren und Harnwege |
Polyurie Dysurie bei Niereninsuffizienz vorübergehende Verschlechterung der Nierenfunktion möglich. |
|
Systemorgan klasse (MedDRA) |
Sehr häufig |
Häufig |
Gelegentlich |
Selten |
Sehr selten |
Nicht bekannt |
|
Erkrankunge n der Geschlechtsorgane und der Brustdrüse |
Erektile Dysfunktion |
Gynäkomastie, die nach Absetzen von Nifedipin reversibel ist. | ||||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Allgemeines Unwohlsein |
Unspezifische Schmerzen Schüttelfrost Reaktionen an der Injektionsund Infusionsstelle3 (Thrombo) Phlebitis an der [nfusionsstelle |
1 = kann zu lebensbedrohlichem Verlauf führen
2 = Gelegentlich kann es insbesondere zu Beginn der Behandlung zum Auftreten von Angina pectoris-Anfällen bzw. bei Patienten mit bestehender Angina pectoris zu einer Zunahme von Häufigkeit, Dauer und Schweregrad der Anfälle kommen.
Vereinzelt ist das Auftreten eines Herzinfarkts beschrieben worden.
3 = Bei Gabe von Adalat 5 mg/50 ml pro infusione wurden gelegentlich Schmerzen an der Venenpunktionsstelle beobachtet. Ein gelegentlich an der Einstichstelle empfundenes Brennen lässt sich durch eine langsamere Infusionsgeschwindigkeit vermeiden.
Unmittelbar nach Beginn der Infusion kann es häufig zu einem Anstieg der Herzfrequenz (Tachykardie) und zu Blutdrucksenkung unter die Norm (hypotone Kreislaufreaktion) kommen, die in der Regel 5 - 15 Minuten nach Infusionsende zur Ausgangslage zurückkehren.
Bei Dialysepatienten mit maligner Hypertonie und Hypovolämie kann infolge der Vasodilatation ein deutlicher Blutdruckabfall auftreten.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome der Intoxikation
Folgende Symptome werden bei einer schweren Vergiftung mit Nifedipin beobachtet: Bewusstseinstrübung bis zum Koma, Blutdruckabfall, tachykarde/bradykarde Herzrhythmusstörungen, Hyperglykämie, metabolische Azidose, Hypoxie, kardiogener Schock mit Lungenödem.
Therapie von Intoxikationen
Therapeutisch stehen die Nifedipinelimination und die Wiederherstellung stabiler Herz-KreislaufVerhältnisse im Vordergrund.
Nifedipin ist nicht dialysierbar, eine Plasmapherese (hohe Plasmaeiweißbindung, relativ kleines Verteilungsvolumen) wird jedoch empfohlen.
Bradykarde Herzrhythmusstörungen werden symptomatisch mit Atropin und/oder BetaSympathomimetika behandelt; bei bedrohlichen bradykarden Herzrhythmusstörungen ist eine temporäre Schrittmachertherapie erforderlich.
Die Hypotonie als Folge von kardiogenem Schock und arterieller Vasodilatation kann mit Calcium (10 - 20 ml einer 10%igen Calciumgluconat-Lösung, langsam intravenös injiziert und falls erforderlich wiederholt) therapiert werden. In der Folge kann der Calciumspiegel hochnormal oder leicht erhöht sein. Wenn mit Calcium keine ausreichende Erhöhung des Blutdrucks erreicht wird, werden zusätzlich vasokonstriktive Sympathomimetika wie Dopamin (bis 25 pg je kg Körpergewicht je Minute), Dobutamin (bis 15 pg je kg Körpergewicht je Minute) oder Noradrenalin, Epinephrin bzw. Norepinephrin verabreicht. Die Dosierung dieser Arzneimittel richtet sich allein nach der erzielten Wirkung.
Die zusätzliche Flüssigkeits- oder Volumenzufuhr sollte zurückhaltend und wegen der drohenden kardialen Überlastung unter hämodynamischer Kontrolle erfolgen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Calciumantagonist, 1,4-Dihydropyridin-Derivat, ATC-Code: C08 CA05
Wirkmechanismus
Nifedipin ist ein Calciumantagonist vom 1,4-Dihydropyridintyp. Calciumantagonisten hemmen den Calciumionen-Einstrom durch den langsamen Calciumkanal in der Zelle. Nifedipin wirkt vor allem an den glatten Muskelzellen der Koronararterien und an den peripheren Widerstandsgefäßen. Dieser Effekt hat eine Vasodilatation zur Folge. In therapeutischen Dosen hat Nifedipin praktisch keine direkte Wirkung auf das Myokard.
Am Herzen erweitert Nifedipin vor allem die großen Koronararterien durch Erniedrigung des Muskeltonus, wodurch die Durchblutung verbessert werden kann. Der periphere Widerstand wird gesenkt.
Zu Beginn der Behandlung mit dem Calciumantagonisten kann es reflektorisch zu einer Zunahme der Herzfrequenz und des Herzminutenvolumens kommen. Diese Zunahme ist jedoch nicht ausgeprägt genug, um die Vasodilatation zu kompensieren.
Bei Langzeitbehandlung mit Nifedipin (orale Anwendung) kehrt das anfangs erhöhte Herzminutenvolumen wieder auf den Ausgangswert zurück. Eine besonders deutliche Blutdruckabnahme nach Nifedipin ist beim Hypertoniker zu beobachten.
Die Wirkung setzt unmittelbar nach Beginn der i. v.-Gabe von Nifedipin ein und hält über die gesamte Infusionsdauer an.
Kinder und Jugendliche
Es liegen begrenzte Informationen zu Nifedipin in verschiedenen Darreichungsformen und Dosierungen sowohl für akute als auch für chronische Hypertonie im Vergleich zu anderen Antihypertensiva vor. Es wurden antihypertensive Wirkungen von Nifedipin gezeigt, aber Dosierungsempfehlungen, Langzeitdaten zur Unbedenklichkeit und zu Auswirkungen auf das kardiovaskuläre System wurden nicht untersucht. Pädiatrische Darreichungsformen fehlen.
5.2 Pharmakokinetische Eigenschaften
Resorption
Nifedipin wird zu ca. 95 % an Plasmaeiweiß (Albumin) gebunden.
Nach intravenöser Gabe wird Nifedipin rasch verteilt. Die Verteilungshalbwertzeit beträgt ca. 5 -6 Minuten.
Nifedipin wird in der Leber nahezu vollständig (hoher "First-pass-Effekt“) vor allem über oxidative Prozesse metabolisiert. Diese Metaboliten zeigen keine pharmakodynamischen Aktivitäten.
Elimination
Weder die unveränderte Substanz noch der Metabolit M-1 werden in nennenswertem Maße renal eliminiert (<0,1 % der Dosis). Die polaren Metaboliten M-2 und M-3 werden zu etwa 50 % der Dosis im Urin gefunden (zum Teil in konjugierter Form), wobei der überwiegende Teil innerhalb von 24 h ausgeschieden wird. Der Rest wird mit den Faeces ausgeschieden.
Die Eliminationshalbwertszeit liegt bei 1,7 Stunden.
Eine Kumulation der Substanz bei Dauertherapie nach üblicher Dosierung wurde nicht beschrieben.
Bei eingeschränkter Leberfunktion kommt es zu einer deutlichen Verlängerung der Eliminationshalbwertszeit und zu einer Verminderung der Gesamt-Clearance. Eine Dosisreduzierung kann gegebenenfalls erforderlich sein (siehe Abschnitt 4.4).
5.3 Präklinische Daten zur Sicherheit
Die präklinischen Daten, die auf konventionellen Studien zur akuten Toxizität, chronischen Toxizität und zum mutagenen und tumorerzeugenden Potential basieren, lassen keine besondere Gefährdung für den Menschen erkennen.
In-vivo- und in-vitro-Untersuchungen zur Mutagenität verliefen durchweg negativ, so dass eine mutagene Wirkung im Menschen hinreichend ausgeschlossen werden kann. Eine Langzeituntersuchung (2 Jahre) an der Ratte ergab keine Hinweise auf tumorerzeugende Effekte von Nifedipin.
Experimentelle Studien haben bei drei Tierspezies (Ratte, Kaninchen, Maus) Hinweise auf teratogene Effekte ergeben, einschließlich digitaler Anomalien, Fehlbildungen der Extremitäten, Gaumenspalten, Brustbeinspalten und Fehlbildungen der Rippen. Die digitalen Anomalien und die Fehlbildungen der Extremitäten sind möglicherweise auf die eingeschränkte uterine Durchblutung zurückzuführen; sie traten aber auch bei Tieren auf, die Nifedipin nur nach der Organogenese erhalten hatten.
Infolge der Nifedipingabe traten verschiedene embryotoxische, plazentotoxische und fetotoxische Effekte auf, einschließlich verkrüppelte Feten bei Ratten, Mäusen und Kaninchen, kleine Plazenten und unterentwickelte Chorionzotten bei Affen, Absterben von Embryonen und Feten bei Ratten, Mäusen und Kaninchen sowie verlängerte Trächtigkeiten und verringerte Überlebensraten bei neugeborenen Ratten (andere Tierarten wurden hierauf nicht untersucht). Alle Dosen, die in experimentellen Untersuchungen teratogene, embryotoxische und fetotoxische Effekte zur Folge hatten, wirkten auch toxisch auf die Muttertiere und waren um ein Mehrfaches höher als die empfohlene Höchstdosis für den Menschen (siehe Abschnitt 4.6).
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Ethanol 96 % (18,0 Vol.-%), Macrogol 400, Natriumhydroxid, Wasser für Injektionszwecke.
6.2 Inkompatibilitäten
Adalat 5 mg/50 ml pro infusione ist auf Kompatibilität mit folgenden Infusionslösungen geprüft und bei Anwendung im Bypass kompatibel:
- Isotonische Kochsalzlösung
- Glucoselösung 5%ig
Hierbei sind keine physikalisch-chemischen Unverträglichkeiten (Trübungen, Ausfällung, Verlust von Nifedipin) beobachtet worden.
6.3 Dauer der Haltbarkeit
2 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25°C lagern.
Die Durchstechflaschen im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Die Infusionslösung ist sehr lichtempfindlich; deshalb sollte die mit einer Umhüllung versehene Flasche erst zum Gebrauch aus der Faltschachtel entnommen werden. Die Verpackung in Braunglasflaschen kombiniert mit gelber, lichtschützender Kunststoffumhüllung bietet genügend Lichtschutz für 1 Stunde.
6.5 Art und Inhalt des Behältnisses
Durchstechflaschen aus Braunglas mit Chlorbutyl-Gummi-Stopfen und mit gelber Kunststoffumhüllung als Lichtschutz.
Packung mit 1 Spritze, 1 Infusionsleitung und 1 Durchstechflasche mit 50 ml Infusionslösung zu 5 mg Nifedipin.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Bayer Vital GmbH
51368 Leverkusen
Tel.: 0214/30-5 13 48
Fax: 0214/30-5 16 03
E-Mail: bayer-vital@bayerhealthcare.com
8. ZULASSUNGSNUMMER(N)
808.01.02
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 01. November 1984 Datum der Verlängerung der Zulassung: 09. September 2011
10. STAND DER INFORMATION
Mai 2014
11. VERKAUFSABGRENZUNG
V erschreibungspflichtig
14