Aerodur Turbohaler
Fachinformation
(Zusammenfassung der Merkmale des Arzneimittels/SmPC)
1. Bezeichnung des Arzneimittels
Aerodur® Turbohaler®
0,5 mg, Pulver zur Inhalation
2. Qualitative und quantitative Zusammensetzung
1 mg Pulver enthält:
1 mg Terbutalinsulfat (Ph.Eur.)
Eine Einzeldosis zu 0,5 mg Aerodur Turbohaler enthält 0,5 mg Terbutalinsulfat (Ph.Eur.). Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. Darreichungsform
Pulver zur Inhalation
4. Klinische Angaben
4.1 Anwendungsgebiete
Atemwegserkrankungen mit Verengung der Atemwege durch Krämpfe der Bronchialmuskulatur (obstruktive Atemwegserkrankungen), wie z. B. Asthma bronchiale, chronische Bronchitis und Blählunge (Lungenemphysem).
4.2 Dosierung und Art der Anwendung
Die Dosierung richtet sich nach Art und Schwere der Erkrankung.
Für Erwachsene und Kinder ab 5 Jahren gelten folgende Empfehlungen:
Zur Akutbehandlung plötzlich auftretender Bronchialkrämpfe und anfallsweise auftretender Atemnot wird eine Einzeldosis von 0,5 mg (entspr. 1 Hub) inhaliert.
Bei der Dauerbehandlung obstruktiver Atemwegserkrankungen sollten Zeitpunkt und Dosis der jeweiligen Einzelanwendung von Aerodur Turbohaler vorzugsweise entsprechend der Häufigkeit und Schwere der Atemnot (symptomorientiert) gewählt werden. Insbesondere bei Bronchialasthma sollte Aerodur Turbohaler in Ergänzung zu einer Dauertherapie mit entzündungshemmend wirkenden Substanzen (z. B. Kortikoiden) zur Inhalation gemäß folgender Dosierungsempfehlung angewendet werden:
Bei Auftreten von Atemnot wird 1 Hub inhaliert.
Zur gezielten Vorbeugung bei Anstrengungsasthma oder vorhersehbarem Allergenkontakt wird 1 Hub, wenn möglich 10 - 15 Minuten vorher, inhaliert.
Bei einem akuten Anfall von Luftnot führt in den meisten Fällen bereits das einmalige Inhalieren zu einer raschen Erleichterung der Atmung. Sollte sich die Atemnot 15 Minuten nach Inhalation des ersten Hubes nicht spürbar gebessert haben, kann ein weiterer Hub genommen werden. Kann ein schwerer Anfall von Luftnot auch durch eine zweite Anwendung nicht behoben werden, können weitere Hübe erforderlich werden. In diesen Fällen muss unverzüglich ärztliche Hilfe in Anspruch genommen werden.
Falls eine Dauerbehandlung mit Beta-2-Sympathomimetika für notwendig befunden wird, beträgt die Dosierung 1 Hub 3-mal/Tag. Sie sollte, insbesondere bei Asthma, von einer entzündungshemmenden Dauertherapie begleitet werden. Der Abstand der einzelnen Inhalationen soll mindestens 3 Stunden betragen.
Die Gesamttagesdosis soll 12 Hübe bei Erwachsenen und bei Kindern unter 12 Jahren 8 Hübe nicht überschreiten, da eine höhere Dosierung im Allgemeinen keinen zusätzlichen therapeutischen Nutzen erwarten lässt, aber die Wahrscheinlichkeit des Auftretens auch schwerwiegender Nebenwirkungen erhöht werden kann.
Spezielle Therapiehinweise:
Die Behandlung von Bronchialasthma sollte dem Schweregrad entsprechend stufenweise erfolgen. Der Erfolg der Therapie sollte durch regelmäßige ärztliche Untersuchungen überprüft werden.
Es ist für den Patienten möglicherweise gefährlich, ohne ärztliche Anweisung den Gebrauch von Beta-2-Sympathomimetika wie Aerodur Turbohaler von sich aus zu erhöhen.
Eine plötzliche und zunehmende Verschlechterung der Asthmabeschwerden kann lebensbedrohlich sein, deshalb muss unverzüglich ärztliche Hilfe in Anspruch genommen werden.
Ein ansteigender Bedarf von Beta-2-Sympathomimetika wie Aerodur Turbohaler ist ein Anzeichen für eine Verschlechterung der Erkrankung. In dieser Situation muss der Therapieplan durch den Arzt überdacht werden und gegebenenfalls durch eine Kombination mit entzündungshemmenden Arzneimitteln, eine Dosisanpassung einer bereits bestehenden entzündungshemmenden Therapie oder die zusätzliche Gabe weiterer Arzneimittel neu festgesetzt werden.
Zur ärztlichen Beurteilung des Krankheitsverlaufes sowie des Therapieerfolges der atemwegserweiternden und entzündungshemmenden Behandlung ist eine tägliche Selbstkontrolle nach ärztlicher Anleitung wichtig. Dies erfolgt z. B. durch die Aufzeichnung des mit dem Peak-flow-Meter gemessenen Atemstoßes.
Kinder sollten Aerodur Turbohaler nur unter Aufsicht eines Erwachsenen nach Vorschrift des Arztes anwenden.
Die Dauer der Anwendung bestimmt der Arzt.
Anwendungshinweise:
Aerodur Turbohaler ist ein Mehrfachdosis-Inhalator, der sehr geringe Mengen Pulver abgibt (Abb.
1). Wenn durch das Mundstück eingeatmet wird, wird das Pulver in die Lungen transportiert. Daher ist es wichtig, dass tief und kräftig durch das Mundstück eingeatmet wird.
Mundstück ^
Schutzkap

Dosierrad ^
Dosisanzeige ^ (Fenster)

(Abb. 1)
Wie ein neuer Inhalator zur Anwendung vorzubereiten ist:
Bevor ein Aerodur Turbohaler-Inhalator zum ersten Mal angewendet wird, muss er wie folgt
vorbereitet werden:
- Durchsichtige Schutzfolie vom Aerodur Turbohaler-Inhalator entfernen, indem diese an der dafür vorgesehenen Stelle (siehe rote Markierungen auf der Schutzfolie) eingerissen wird.
- Schutzkappe abschrauben und abnehmen.
- Inhalationsgerät aufrecht halten. Das blaue Dosierrad zeigt nach unten. Mundstück nicht festhalten, wenn das Dosierrad gedreht wird. Dosierrad jeweils bis zum Anschlag in die eine Richtung und dann in die andere Richtung (Abb. 2) drehen. In welche Richtung zuerst gedreht wird, ist nicht entscheidend. Dabei ist ein Klickgeräusch zu hören. Vorgang wiederholen, d. h. das blaue Dosierrad in beide Richtungen drehen.
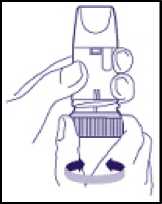
(Abb. 2)
Der Aerodur Turbohaler-Inhalator ist jetzt gebrauchsfertig. Um eine Dosis zu inhalieren, ist wie im Folgenden beschrieben fortzufahren.
Wie der Inhalator anzuwenden ist:
Bei jeder Inhalation ist zu beachten:
1. Schutzkappe abschrauben und abnehmen.
2. Inhalationsgerät aufrecht halten. Das blaue Dosierrad zeigt nach unten. Mundstück nicht festhalten, wenn das Dosierrad gedreht wird.
3. Vor jeder Inhalation muss aus dem Wirkstoffvorrat eine Einzeldosis bereitgestellt werden, die dann inhaliert werden kann. Dies erfolgt durch einmaliges Hin- und Herdrehen des Dosierrades jeweils bis zum Anschlag (Abb. 2). In welche Richtung zuerst gedreht wird, ist nicht entscheidend. Dabei ist ein Klickgeräusch zu hören. Eine Überdosierung ist auch bei versehentlicher Mehrfachbetätigung des Dosierrades nicht möglich.
4. Zunächst ohne das Gerät tief ausatmen, erst dann das Mundstück mit den Lippen umschließen und tief und kräftig durch das Gerät einatmen (Abb. 3). Nicht auf dem Mundstück kauen oder beißen, da die Möglichkeit besteht, dass sich das Mundstück lockert oder ablöst! Das Gerät darf nicht mehr benutzt werden, wenn es beschädigt ist oder sich das Mundstück von selbst abgelöst hat.
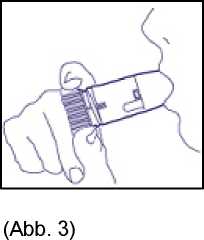
5. Das Gerät vom Mund absetzen und den Atem einige Sekunden anhalten. Nicht durch das Gerät ausatmen!
Falls mehr als eine Inhalation verordnet wurde, sind die Schritte 2. bis 5. zu wiederholen.
6. Schutzkappe unmittelbar nach Gebrauch wieder fest aufschrauben.
Wichtiger Hinweis:
Der Wirkstoff ist feuchtigkeitsempfindlich; daher niemals durch das Mundstück ausatmen und das Gerät stets nach Benutzung mit der Schutzkappe verschlossen halten.
Bei jeder Inhalation kann sich ein wenig Arzneimittel im Mund-Rachenraum absetzen. Da jede Dosis nur reinen Wirkstoff enthält und keine Hilfsstoffe, spürt man in den meisten Fällen das Auftreffen der Teilchen auf die Mundschleimhaut nicht. Nur selten tritt ein leicht bitterer Geschmack auf. Nach der Anwendung von Aerodur Turbohaler sollte, sofern möglich, der Mund mit Wasser ausgespült werden, um das Risiko für das Auftreten von Nebenwirkungen zu verringern. Auch wenn das Arzneimittel nach der Inhalation weder zu schmecken noch zu spüren ist, kann davon ausgegangen werden, dass die Dosis inhaliert wurde, wenn die Anweisungen befolgt wurden.
Reinigung des Mundstücks:
Mundstück einmal in der Woche äußerlich nur mit einem trockenen Tuch reinigen. Kein Wasser oder andere Flüssigkeiten benutzen, um das Mundstück zu reinigen.
Wann ist der Inhalt des Gerätes aufgebraucht?
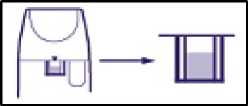
Beim Erscheinen einer roten Markierung in der Dosisanzeige (Fenster) unter dem Mundstück sind noch ca. 20 Inhalationen zulässig (Abb. 4).
Mundstück

noch 20 Inhalationen zulässig
(Abb. 4)
rote
Markierung
Erreicht die rote Markierung den unteren Fensterrand, sind diese ca. 20 Einzeldosen verbraucht (Abb. 5). Darüber hinaus sollte aus technischen Gründen nicht weiter inhaliert werden, obwohl noch eine Restmenge an Wirkstoff im Gerät enthalten ist.
Mundstück
rote
Markierung
leer leer
(Abb. 5)
Das Geräusch, das beim Schütteln des Turbohalers auftritt, wird durch das Trockenmittel verursacht und gibt keine Auskunft über den Füllstand des Turbohaler®.
4.3 Gegenanzeigen
Aerodur Turbohaler darf nicht angewendet werden bei
- Überempfindlichkeit gegen den Wirkstoff,
- Hyperthyreose/Thyreotoxikose,
- Tachykardie,
- idiopathischer hypertropher subvalvulärer Aortenstenose,
- Phäochromozytom.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Besondere Vorsicht ist geboten bei Patienten mit
- frischem Herzinfarkt,
- unausgeglichener diabetischer Stoffwechsellage,
- Myokarditis,
- WPW-Syndrom,
- Mitralvitium,
- Hypokaliämie,
- Arteriosklerose,
- Hypertonie,
- Aneurysmen,
- tachykarden Herzrhythmusstörungen,
- schwerer KHK.
Unter der Gabe von Sympathomimetika, einschließlich Terbutalinsulfat, können kardiovaskuläre Wirkungen beobachtet werden. Nach der Markteinführung erhobene sowie in der Literatur veröffentlichte Daten deuten darauf hin, dass im Zusammenhang mit Beta-Agonisten in seltenen Fällen eine Myokardischämie auftritt. Patienten mit einer schweren kardialen Grunderkrankung (z.
B. ischämische Herzkrankheit, Rhythmusstörungen oder schwere Herzinsuffizienz), die Aerodur Turbohaler anwenden, sollten angewiesen werden, sich bei Schmerzen in der Brust oder anderen Symptomen einer sich verschlechternden Herzerkrankung an einen Arzt zu wenden. Die Bewertung von Symptomen wie Dyspnoe und Schmerzen in der Brust sollte mit Sorgfalt erfolgen, da diese entweder eine respiratorische oder eine kardiale Ursache haben können.
Über paradoxe Bronchospasmen wurde berichtet. In diesem Fall soll die Therapie sofort abgesetzt werden.
Eine Therapie mit Beta-2-Sympathomimetika kann möglicherweise zu einer schweren Hypokaliämie führen. Das damit verbundene Risiko wird durch eine Hypoxie erhöht, daher ist bei akutem schwerem Asthma besondere Vorsicht erforderlich.
Hypokaliämische Wirkungen können durch Begleitbehandlungen erhöht werden (siehe Abschnitt 4.5). In solchen Fällen wird eine Überwachung des Serumkaliumspiegels empfohlen.
Aufgrund der hyperglykämischen Effekte von Beta-2-Agonisten werden bei Diabetikern zu Beginn der Therapie zusätzliche Blutzuckerkontrollen empfohlen.
Wichtiger Hinweis für die Weitergabe an den Patienten:
Kommt es trotz der verordneten Therapie zu keiner befriedigenden Besserung oder gar zu einer Verschlechterung der Beschwerden, ist ärztliche Beratung erforderlich, um die Behandlung ggf. durch eine Kombination mit anderen Arzneimitteln (Kortikoide, Theophyllin) oder eine Änderung der Dosierung neu festzulegen. Bei akuter oder sich rasch verschlimmernder Atemnot muss unverzüglich ärztliche Hilfe in Anspruch genommen werden. Eine erhebliche Überschreitung, insbesondere der vorgegebenen Einzeldosis beim akuten Anfall, aber auch der Tagesdosis, kann gefährlich sein wegen der Wirkungen auf das Herz (Herzrhythmusstörungen, Blutdruckanstieg) in Verbindung mit Veränderungen der Salzkonzentrationen in Körperflüssigkeiten (Elektrolytverschiebungen) und muss deshalb vermieden werden.
Es ist wiederholt über ein erhöhtes Risiko für schwere Komplikationen und Todesfälle bei der Behandlung des Asthma bronchiale mit Beta-2-Sympathomimetika zur Inhalation berichtet worden, ohne dass die ursächlichen Zusammenhänge bisher hinreichend geklärt werden konnten.
Bei jeder Inhalation setzt sich ein Anteil der über das Mundstück abgegebenen Dosis in der Mundhöhle ab. Um eine unnötige systemische Exposition mit Terbutalin zu minimieren, sollte dem Patienten geraten werden, den Mund nach jeder Anwendung, sofern möglich, mit Wasser auszuspülen.
Die Anwendung des Arzneimittels Aerodur Turbohaler kann bei Dopingkontrollen zu positiven Ergebnissen führen. Durch eine Anwendung von Aerodur Turbohaler als Dopingmittel können schwerwiegende Herzrhythmusstörungen ausgelöst werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die gleichzeitige Gabe von Aerodur Turbohaler mit anderen betasympathomimetisch wirkenden Substanzen oder Methylxanthinen (z. B. Theophyllin) kann die antiobstruktive Wirkung verstärken, es muss aber auch mit einer Zunahme unerwünschter Wirkungen, z. B. Herzrhythmusstörungen, gerechnet werden.
Die blutzuckersenkende Wirkung von Antidiabetika kann unter systemischer Gabe vermindert werden. Es soll überprüft werden, ob eine Dosisänderung des Antidiabetikums erforderlich ist.
Betarezeptorenblocker (einschließlich Augentropfen) können die Wirkung von Aerodur Turbohaler aufheben, sind aber bei Asthma kontraindiziert, weil sie einen Bronchospasmus auslösen können.
Die gleichzeitige Gabe von Aerodur Turbohaler und Digitalisglykosiden, Chinidin oder anderen Antiarrhythmika kann zu Herzrhythmusstörungen führen. Auch L-Dopa, L-Thyroxin, Oxytocin oder Alkohol können die kardialen und kreislaufregulatorischen sympathomimetischen Effekte von Aerodur Turbohaler verstärken.
Die gleichzeitige Gabe von Terbutalin und Methylxanthinen, Kortikoiden, Diuretika oder Digitalis kann zu einer verstärkten Hypokaliämie führen. Es wird empfohlen, in solchen Situationen den Serumkaliumspiegel zu bestimmen (siehe auch Abschnitt 4.4).
Die gleichzeitige Anwendung von Aerodur Turbohaler und Monoaminooxidasehemmstoffen oder trizyklischen Antidepressiva kann eine verstärkte Wirkung von Aerodur Turbohaler auf das HerzKreislauf-System auslösen (schwere Kopfschmerzen, Blutdruckkrisen, Arrhythmien bis hin zu Todesfällen).
Eine erhöhte Arrhythmiegefahr besteht bei gleichzeitiger Narkose mit halogenierten Kohlenwasserstoffen.
4.6 Schwangerschaft und Stillzeit
Zu einer Anwendung von Aerodur Turbohaler in den ersten drei Monaten der Schwangerschaft liegen keine Erfahrungen vor. Obwohl nach Anwendung in den letzten beiden Schwangerschaftsdritteln keine fruchtschädigenden Wirkungen bekannt geworden sind, sollte Aerodur Turbohaler aus grundsätzlichen Überlegungen während der Schwangerschaft nur nach sorgfältiger Nutzen-Risiko-Abwägung durch den Arzt angewendet werden.
Da eine wehenhemmende Wirkung von Aerodur Turbohaler bei inhalativer Aufnahme nicht völlig ausgeschlossen werden kann, sollte die Anwendung kurz vor der Geburt nicht mehr erfolgen.
Eine vorübergehende Hypoglykämie wurde bei Frühgeborenen, deren Mütter mit Beta-2-Agonisten behandelt wurden, beobachtet.
Aerodur Turbohaler geht in die Muttermilch über, daher sollte eine Behandlung stillender Frauen nur nach einer Nutzen-Risiko-Abwägung erfolgen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Durch individuell auftretende unterschiedliche Reaktionen kann auch bei bestimmungsgemäßem Gebrauch dieses Arzneimittels die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum
Bedienen von Maschinen beeinträchtigt werden. Dies gilt besonders bei Behandlungsbeginn sowie im Zusammenwirken mit Alkohol, Beruhigungs- oder Schlafmitteln.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: sehr häufig (> 1/10), häufig (> 1/100 bis < 1/10), gelegentlich (> 1/1000 bis < 1/100), selten (> 1/10 000 bis < 1/1000), sehr selten (< 1/10 000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Die meisten der beobachteten unerwünschten Arzneimittelreaktionen entsprechen den für sympathomimetische Amine charakteristischen Nebenwirkungen.
Störungen des Herz-Kreistauf-Systems:
Häufig Tachykardie, Palpitationen
Selten pektanginöse Beschwerden, Herzrhythmusstörungen wie z. B.
Vorhofflimmern, supraventrikuläre Tachykardie und Extrasystolen Nicht bekannt Myokardischämie
Störungen der Skelettmuskulatur und des Bindegewebes:
Häufig tonische Muskelkrämpfe
Störungen des Nervensystems:
Sehr häufig Tremor, Kopfschmerzen
Störungen des Verdauungstraktes:
Selten Übelkeit
Sehr selten Irritationen von Mund und Hals, Sodbrennen
Psychische Störungen:
Selten Schlafstörungen und Verhaltensstörungen wie Unruhe,
Hyperaktivität und Rastlosigkeit Sehr selten atypische Psychosen bei Kindern
Störungen im Bereich der Atemwege, des Thorax und des Brustraums:
Selten Bronchospasmus
Störungen der Haut und des Unterhautgewebes:
Selten Urtikaria und Exantheme
Störungen des Immunsystems:
Sehr selten Überempfindlichkeitsreaktionen (z. B. Anaphylaxie, Quincke-Ödem,
Blutdruckabfall)
Miktionsstörungen
Sehr selten
Stoffwechsel und Ernährungsstörungen:
Häufig
Nicht bekannt
Hypokaliämie
metabolische Veränderungen wie Hyperglykämie, Anstieg des Blutspiegels von Insulin, freien Fettsäuren, Glycerol und Ketonkörpern
Beschwerden wie Übelkeit, Tremor, Palpitationen, Kopfschmerzen, Unruhegefühl und Muskelkrämpfe nehmen bei Fortführung der Therapie nach 1 - 2 Wochen meistens wieder ab.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das nationale Meldesystem anzuzeigen:
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn
Website: http://www.bfarm.de
4.9 Überdosierung
Gegen Ende der Lebensdauer des Turbohalers besteht das Risiko einer progressiven Ansammlung des Pulvers im Bereich des Turbohaler-Mundstücks. Dieses könnte durch einen Fall (z. B. von einem Tisch) freigesetzt werden. Um die unnötige systemische Exposition von Terbutalin zu minimieren, sollte dem Patienten geraten werden, nach Möglichkeit den Mund nach jeder Anwendung mit Wasser auszuspülen.
Symptome der Intoxikation
Im Falle einer Überdosierung treten die bereits bekannten Nebenwirkungen sehr schnell und ggf. in verstärktem Umfang in Erscheinung.
Typische Symptome sind: Kopfschmerzen, Tachykardie, Palpitationen, Arrhythmien, Ruhelosigkeit, Angstzustände, tonische Muskelkrämpfe, Schlafstörungen, systolische Blutdrucksteigerung, Brustschmerzen und heftiger Tremor insbesondere an den Händen, aber auch am ganzen Körper. Ein Blutdruckabfall kann auftreten.
Vor allem nach oraler Intoxikation können gastrointestinale Beschwerden einschließlich Übelkeit und Erbrechen auftreten.
Laborbefunde
Hyperglykämie und Laktatazidose können auftreten. Beta-2-Agonisten können aufgrund einer Umverteilung des Kaliums eine Hypokaliämie verursachen.
Therapie von Intoxikationen
Die Behandlung nach betasympathomimetischer Überdosierung erfolgt hauptsächlich symptomatisch. Nachfolgend sind eine Reihe zu empfehlender Maßnahmen angeführt:
- Insbesondere bei oraler Überdosierung sollte eine Magenspülung erwogen werden, Aktivkohle und Abführmittel können die unerwünschte Resorption des Betamimetikums günstig beeinflussen.
- Die kardialen Symptome können mit einem selektiven Betablocker behandelt werden, jedoch beinhaltet dies bei Asthmatikern das Risiko der Auslösung eines Bronchialmuskelkrampfes.
- Zur Überwachung der Arrhythmien ist EKG-Monitoring angezeigt.
- In schweren Fällen ist eine Überwachung des Blutzuckerspiegels, der Elektrolyte (z. B. Serumkaliumkonzentration) und des Säure-Basen-Status ratsam. Bei ausgeprägtem Blutdruckabfall sollte ein Plasmaexpander gegeben werden.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: inhalative Sympathomimetika, Terbutalin
ATC-Code: R03A C03
Das 3,5-Dihydroxyphenyl-Derivat Terbutalin ist ein direkt wirkendes Betasympathomimetikum mit vorwiegender Beta-2-Selektivität; eine Stimulation der Beta-1-Rezeptoren kommt erst bei höheren Dosen zum Ausdruck.
Terbutalin verursacht eine Erschlaffung der glatten Muskulatur in den Bronchien und Blutgefäßen sowie eine Relaxation der Uterusmuskulatur. Terbutalin hemmt auch die Freisetzung von Mediatoren aus den Mastzellen.
Ferner ist eine Steigerung der mukoziliären Clearance im Bronchialsystem nachweisbar, wobei der Wirkmechanismus noch nicht eindeutig geklärt ist.
Diese Wirkungen werden über eine Aktivierung der Adenylatzyklase vermittelt, wobei es zu einer Anreicherung von zyklischem 3',5'-Adenosinmonophosphat (cAMP) kommt, welches seinerseits die kontraktilen Elemente der glatten Muskulatur hemmt.
Einfluss auf den Stoffwechsel von Lipiden und Zuckern (Lipolyse, Glykogenolyse und Hyperglykämie) sowie relative Hypokaliämie durch Erhöhung der K+-Aufnahme in die Skelettmuskulatur sind pharmakologische Effekte, die erst unter höheren Dosen zur Geltung kommen.
Die betasympathomimetische Wirkung von Terbutalin ist relativ stark bronchoselektiv, aber seine Wirkungen auf das Herz - wie Anstieg der Herzfrequenz, Steigerung der Kontraktilität (positiv inotroper und chronotroper Effekt) - sind durch direkte Wirkung auf Beta-1-Rezeptoren zu erklären.
Nach Inhalation von Terbutalin tritt die bronchodilatatorische Wirkung nach wenigen Minuten ein.
Nach langzeitiger Anwendung von Terbutalin kann ein Verlust der Wirksamkeit eintreten (Toleranzentwicklung).
5.2 Pharmakokinetische Eigenschaften
Die Resorption von Terbutalin aus dem Gastrointestinaltrakt ist unvollständig und beträgt etwa 50 %. Der First-pass-Effekt in der Darmwand und Leber (Sulfatierung, Glukuronidierung) ist hoch und liegt bei 70 - 80 %. Die orale Bioverfügbarkeit liegt im Vergleich zur i.v.-Applikation bei 10 - 15 %.
Die maximalen Plasmakonzentrationen werden nach ca. 2 Stunden erreicht und betragen 2 - 5 ng/ml, wobei oftmals 2 Peaks erscheinen. Der erste Peak tritt zwischen der 1. und 2. Stunde, der zweite Peak zwischen der 3. und 4. Stunde auf. Die Einnahme zu oder nach den Mahlzeiten reduziert die Peaks um etwa 40 %.
Die Wirkungsdauer beträgt ca. 4 - 6 Stunden, bei retardierten Präparaten bis zu 12 Stunden. Die Plasmahalbwertszeit liegt bei 3 - 4 Stunden.
Wirkungseintritt nach Inhalation: Innerhalb 5 Minuten, maximaler Effekt nach ca. 30 Minuten. Die Wirkdauer beträgt bis zu etwa 6 Stunden. Ein hoher Anteil der inhalierten Substanz wird mit dem Speichel verschluckt und so über den Gastrointestinaltrakt systemisch wirksam.
Die Plasmaproteinbindung ist gering und liegt bei 25 %. Eine Affinität gegenüber Erythrozyten ist beobachtet worden.
Nach oraler Applikation werden ca. 40 % der Dosis über die Niere - vorzugsweise als Sulfatkonjugat
- und 10 % als unverändertes Terbutalin ausgeschieden, etwa 1 % wird biliär eliminiert; ungefähr 50
- 60 % werden in unveränderter Form mit den Fäzes ausgeschieden.
Terbutalin ist gegenüber inaktivierenden Enzymen wie COMT (Catechol-O-Methyltransferase) und MAO (Monoaminooxidase) resistent.
Bioverfügbarkeit
In Depositionsuntersuchungen zu Aerodur Turbohaler mit 99mTc markiertem Terbutalin an gesunden Probanden fanden sich anhand szintigraphischer Messungen bei einem Inspirationsfluss von 60 l/min 27 % der Dosis in der Lunge wieder. Dieser Inspirationsfluss kann von nahezu allen Patienten mit obstruktiven Atemwegserkrankungen erreicht werden.
Selbst bei einem Inspirationsfluss von 30 l/min wurden mit dem Aerodur Turbohaler noch Depositionswerte im Bronchialbaum um 15 % gemessen, die mit einem Treibgas-Dosieraerosol nur bei optimaler Inhalationstechnik und einem für dieses System optimalen Inspirationsfluss von 30 l/min erreicht werden konnten. Ca. 60 - 80 % der Dosis werden verschluckt und zu ca. 50 % im Gastrointestinaltrakt resorbiert, so dass sich aus dem verschluckten Anteil nach dem First-Pass eine Bioverfügbarkeit von 10 % ergibt. Insgesamt kann daher nach Inhalation mit Aerodur Turbohaler mit einer Bioverfügbarkeit im Vergleich zur i.v.-Applikation von mindestens 30 % gerechnet werden.
In Bioäquivalenzuntersuchungen an Patienten mit Asthma bronchiale fanden sich hinsichtlich des bronchospasmolytischen Wirkeintritts und des Wirkmaximums bei gleicher Dosis keine signifikanten Unterschiede zum Treibgas-Dosieraerosol. Die Wirkung hielt jedoch bei Aerodur Turbohaler aufgrund der höheren Deposition in den Bronchien signifikant länger an.
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
In Untersuchungen zur akuten Toxizität an verschiedenen Tierspezies wurden für Terbutalin folgende LDöü-Werte ermittelt:
|
Tierart |
Verabreichungsart |
LD50 mg/kg (Vertrauensbereich 95 %) |
|
Maus |
i.v. |
56 |
|
s.c. |
295 (263 - 330) | |
|
i.p. |
263 (223 - 310) | |
|
p.o. |
3000 (2700 - 3400) | |
|
Ratte |
i.v. |
74 |
|
Kaninchen |
i.v. |
65 |
Nähere Angaben zur Symptomatik und Behandlung: Siehe Abschnitt 4.9.
Chronische Toxizität
Aus Langzeituntersuchungen an Maus, Ratte und Affe ergaben sich keine Hinweise auf toxische Effekte.
Reproduktionstoxizität
Terbutalin passiert die Plazenta und erreicht, während der Geburt appliziert, im fetalen Blut bis zu 55 % der maternalen Konzentration.
Unter Terbutalingabe kann es zu maternaler und fetaler Tachykardie kommen. Es kann zu einer Blutdruckerniedrigung bei der Mutter kommen, insbesondere bei Frauen mit Blutungen. Wie alle Betamimetika kann Terbutalin zu einer Hyperglykämie der Mutter mit folgendem Anstieg der Insulinkonzentration führen. In diesem Fall kann es zu einer neonatalen Hypoglykämie des Kindes kommen.
Terbutalin geht in die Muttermilch über. Milch/Plasma-Konzentrationen betrugen 1,4 - 2,9. Es wurden keine Symptome einer betaadrenergen Wirkung bei 4 exponierten Säuglingen beobachtet. Langzeituntersuchungen liegen nicht vor.
Im Tierversuch an Maus und Ratte ergaben sich keine Hinweise auf teratogene oder andere embryotoxische Wirkungen von Terbutalin.
Kanzerogenität
Unter Langzeitgabe von sehr hohen Dosen an Ratten und Mäuse kommt es - wie auch bei anderen Betasympathomimetika - zur Ausbildung von gutartigen Leiomyomen und Leiomyosarkomen in Mesovarium und Uterus. Nach vorherrschender Meinung ist eine Übertragbarkeit auf den Menschen jedoch nicht gegeben.
Mutagenität
Untersuchungen zur Mutagenität ergaben keinen Hinweis auf ein genotoxisches Potenzial.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Keine
6.2 Inkompatibilitäten
Bisher keine bekannt.
6.3
Dauer der Haltbarkeit
Die Dauer der Haltbarkeit von Aerodur Turbohaler beträgt 2 Jahre.
Dieses Arzneimittel soll nach Ablauf des Verfallsdatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Der Wirkstoff ist feuchtigkeitsempfindlich; daher das Gerät stets nach Benutzung mit der Schutzkappe verschlossen halten.
Nicht über 30 °C lagern.
6.5 Art und Inhalt des Behältnisses
Aerodur Turbohaler ist ein atemzuggesteuerter Mehrfachdosen-Pulverinhalator.
Der Pulverinhalator besteht aus Kunststoffteilen.
Packungsgrößen:
1 Pulverinhalator (enthält mindestens 100 Einzeldosen)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
AstraZeneca GmbH
22876 Wedel
Telefon: 0 41 03 / 70 80
Produktanfragen: 0800 22 88 660
Telefax: 0 41 03 / 708 32 93
E-Mail: azinfo@astrazeneca.com
8. Zulassungsnummer
13662.00.00
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung
22.12.1989/24.06.2004
10. Stand der Information
Juni 2013
11. Verkaufsabgrenzung
Verschreibungspflichtig