Aerodur Turbohaler
Gebrauchsinformation: Information für Anwender
Aerodur® Turbohaler®
0,5 mg, Pulver zur Inhalation Terbutalinsulfat (Ph.Eur.)
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn Sie enthält wichtige Informationen.
• Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
• Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
• Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
• Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
1. Was ist Aerodur Turbohaler und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Aerodur Turbohaler beachten?
3. Wie ist Aerodur Turbohaler anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Aerodur Turbohaler aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist Aerodur Turbohaler und wofür wird es angewendet?
1.1 Aerodur Turbohaler enthält einen Wirkstoff (Terbutalinsulfat) aus der Gruppe der Beta-2-Agonisten zur Erweiterung der Atemwege.
1.2 Aerodur Turbohaler wird angewendet bei
Atemwegserkrankungen mit Verengung der Atemwege durch Krämpfe der Bronchialmuskulatur (obstruktive Atemwegserkrankungen), wie z. B. Asthma bronchiale, chronische Bronchitis und Blählunge (Lungenemphysem).
2. Was sollten Sie vor der Anwendung von Aerodur Turbohaler beachten?
2.1 Aerodur Turbohaler darf nicht angewendet werden, wenn Sie
• allergisch gegen Terbutalin sind,
• eine Überfunktion der Schilddrüse (Hyperthyreose/Thyreotoxikose) haben,
• einen abnormen Anstieg der Herzfrequenz (Tachykardie) haben,
• eine muskuläre Einengung im Bereich der Herzklappen (idiopathische hypertrophe subvalvuläre Aortenstenose) haben,
• einen Tumor des Nebennierenmarks (Phäochromozytom) haben.
2.2 Warnhinweise und Vorsichtsmaßnahmen
Besondere Vorsicht bei der Anwendung von Aerodur Turbohaler ist erforderlich, wenn
• bei Ihnen ein frischer Herzinfarkt vorliegt,
• Sie Diabetiker sind oder bei unausgeglichener diabetischer Stoffwechsellage,
• bei Ihnen eine entzündliche Erkrankung des Herzmuskels vorliegt,
• bei Ihnen die Überleitungszeit im EKG verkürzt ist (sogenanntes WPW-Syndrom),
• bei Ihnen ein Mitralklappenfehler des Herzens (Mitralvitium) vorliegt,
• Sie einen Kaliummangel haben,
• Sie Gefäßerkrankungen mit Einengung der Blutgefäße, insbesondere Arteriosklerose, haben,
• Sie Bluthochdruck haben,
• Sie Ausweitungen der Wand eines arteriellen Blutgefäßes einschließlich des Herzens (Aneurysmen) haben,
• Sie Störungen der regelmäßigen Herzschlagfolge in Verbindung mit gesteigerter Herzfrequenz (tachykarde Arrhythmie) haben,
• Sie eine schwere koronare Herzkrankheit (KHK) haben.
Informieren Sie vor der Anwendung von Aerodur Turbohaler Ihren Arzt, wenn eine der obigen Angaben auf Sie zutrifft oder wenn Sie sich diesbezüglich nicht ganz sicher sind.
Wenden Sie sich an Ihren Arzt, wenn es trotz der verordneten Behandlung zu keiner befriedigenden Besserung oder gar zu einer Verschlechterung der Beschwerden kommt. Ihr Arzt wird dann gegebenenfalls eine Kombination mit anderen Arzneimitteln (Kortikosteroide, Theophyllin) oder eine Änderung der Dosierung verordnen.
Bei akuter oder sich rasch verschlimmernder Atemnot müssen Sie unverzüglich ärztliche Hilfe in Anspruch nehmen. Eine erhebliche Überschreitung der vorgegebenen Einzeldosis beim akuten Anfall oder auch der Tagesdosis kann wegen der Wirkungen auf das Herz gefährlich sein und muss deshalb vermieden werden (siehe Abschnitt 3.2 „ Falls vom Arzt nicht anders verordnet, ist die übliche Dosis“ ).
Es ist wiederholt über ein erhöhtes Risiko für schwere Komplikationen und Todesfälle bei der Behandlung des Asthma bronchiale mit Beta-2-Agonisten zur Inhalation berichtet worden. Die ursächlichen Zusammenhänge konnten bisher nicht hinreichend geklärt werden.
Eine Behandlung mit Beta-2-Agonisten kann möglicherweise zu einer schweren Kaliumverarmung des Organismus führen. Das damit verbundene Risiko wird durch Sauerstoffmangel erhöht. Bei akutem schwerem Asthma ist daher besondere Vorsicht geboten. Wenden Sie sich bitte an Ihren Arzt. Die kaliumverarmende Wirkung kann durch Begleitbehandlungen erhöht werden (siehe Abschnitt 2.3 „ Bei Anwendung von Aerodur Turbohaler mit anderen Arzneimitteln“ ). Ihr Arzt wird dann Ihren Blutkaliumspiegel regelmäßig überwachen.
Wenn Sie Diabetiker sind, wird Ihr Arzt zu Beginn der Behandlung möglicherweise zusätzliche Blutzuckerkontrollen durchführen.
Es gibt Hinweise, dass es unter der Anwendung von Beta-2-Sympathomimetika (der Substanzklasse, zu der auch der Wirkstoff in Aerodur Turbohaler gehört) in seltenen Fällen zu Durchblutungsstörungen des Herzmuskels (Myokardischämie) kommen kann. Wenn Sie Aerodur Turbohaler anwenden und an einer schweren Grunderkrankung des Herzens leiden (z. B. Mangeldurchblutung der Herzkranzgefäße, Herzrhythmusstörungen oder schwere Herzmuskelschwäche), wenden Sie sich bei Schmerzen in der Brust oder anderen Anzeichen einer sich verschlechternden Herzerkrankung bitte an Ihren Arzt.
Bei Auftreten eines plötzlichen, unerwarteten Anfalls von Atemnot (paradoxer Bronchospasmus) setzen Sie die Behandlung sofort ab und suchen Sie schnellstmöglich Ihren Arzt auf.
a) Kinder
Kinder sollten Aerodur Turbohaler nur unter Aufsicht eines Erwachsenen nach Vorschrift des Arztes anwenden (siehe Abschnitt 3.2 „ Falls vom Arzt nicht anders verordnet, ist die übliche Dosis“ ).
b) Auswirkungen bei Fehlgebrauch zu Dopingzwecken
Die Anwendung des Arzneimittels Aerodur Turbohaler kann bei Dopingkontrollen zu positiven Ergebnissen führen. Durch eine Anwendung von Aerodur Turbohaler als Dopingmittel können schwerwiegende Herzrhythmusstörungen ausgelöst werden.
2.3 Anwendung von Aerodur Turbohaler zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen/anwenden, kürzlich andere Arzneimittel eingenommen/angewendet haben oder beabsichtigen, andere Arzneimittel einzunehmen/anzuwenden.
Informieren Sie Ihren Arzt oder Apotheker vor der Anwendung von Aerodur Turbohaler insbesondere, wenn Sie folgende Arzneimittel einnehmen/anwenden:
• Betablocker zur Behandlung von Bluthochdruck, einschließlich betablockerhaltiger Augentropfen zur Behandlung eines Glaukoms.
• Arzneimittel, die Methylxanthine (z. B. Theophyllin) enthalten. Diese werden oft zur Behandlung von Asthma verwendet.
• L-Dopa zur Behandlung von Morbus Parkinson.
• Harntreibende Arzneimittel (Diuretika).
• Arzneimittel, die die Hormone L-Thyroxin oder Oxytocin enthalten.
• Arzneimittel mit vergleichbarer Wirkung wie Aerodur Turbohaler.
• Kortikosteroide.
• Trizyklische Antidepressiva oder Monoaminoxidase-Hemmstoffe. Bei gleichzeitiger Behandlung mit Aerodur Turbohaler kann es zu verstärkten Wirkungen auf das Herz-Kreislauf-System kommen (schwere Kopfschmerzen, Blutdruckkrisen, Herzrhythmusstörungen bis hin zu Todesfällen).
• Arzneimittel gegen Diabetes. Gegebenenfalls wird Ihr Arzt die Dosis Ihres Arzneimittels gegen Diabetes bei gleichzeitiger Behandlung mit Aerodur Turbohaler ändern.
• Arzneimittel, die Digitalisglykoside enthalten. Diese werden oft zur Behandlung von Herzleistungsschwäche verwendet.
• Arzneimittel gegen Herzrhythmusstörungen (z. B. Chinidin oder andere Antiarrhythmika).
Informieren Sie Ihren Arzt oder Apotheker ebenfalls, wenn bei Ihnen eine Narkose wegen einer Operation oder einer Zahn- bzw. Kieferbehandlung geplant ist.
Die Kaliumverarmung des Organismus kann bei gleichzeitiger Behandlung mit Methylxanthinen (z. B. Theophyllin), Kortikosteroiden, Diuretika oder Digitalisglykosiden verstärkt werden. Ihr Arzt wird dann gegebenenfalls Blutuntersuchungen zur Kaliumbestimmung durchführen (siehe auch Abschnitt 2.2 „ Besondere Vorsicht bei der Anwendung von Aerodur Turbohaler ist erforderlich“ ).
2.4 Anwendung von Aerodur Turbohaler zusammen mit Nahrungsmitteln und Getränken
Alkohol kann die Wirkungen von Aerodur Turbohaler auf Herz und Kreislauf verstärken.
2.5 Schwangerschaft und Stillzeit
Wenden Sie Aerodur Turbohaler während der Schwangerschaft grundsätzlich nur nach Rücksprache mit Ihrem Arzt an.
Sie sollten Aerodur Turbohaler kurz vor der Geburt nicht anwenden, da eine wehenhemmende Wirkung nicht völlig ausgeschlossen werden kann. Bei Frühgeborenen, deren Mütter mit Beta-2-Agonisten behandelt wurden, wurde eine vorübergehende Unterzuckerung (Hypoglykämie) beobachtet.
Der Wirkstoff von Aerodur Turbohaler geht in die Muttermilch über. Nehmen Sie Aerodur Turbohaler daher nur nach Rücksprache mit Ihrem Arzt ein, wenn Sie stillen.
2.6 Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Durch individuell auftretende, unterschiedliche Reaktionen kann auch bei bestimmungsgemäßem Gebrauch dieses Arzneimittels die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt werden. Dies gilt besonders bei Behandlungsbeginn sowie im Zusammenwirken mit Alkohol, Beruhigungs- oder Schlafmitteln.
3. Wie ist Aerodur Turbohaler anzuwenden?
Wenden Sie Aerodur Turbohaler immer genau nach Absprache mit Ihrem Arzt an. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind.
3.1 Art der Anwendung
Zur Inhalation.
3.2 Falls vom Arzt nicht anders verordnet, ist die übliche Dosis:
Die Dosierung richtet sich nach der Art und Schwere der Erkrankung und wird durch den Arzt dem Einzelfall angepasst.
Für Erwachsene und Kinder ab 5 Jahren gelten folgende Empfehlungen:
Zur Akutbehandlung plötzlich auftretender Bronchialkrämpfe und anfallsweise auftretender Atemnot wird eine Einzeldosis von 0,5 mg (entspr. 1 Hub) inhaliert.
Bei der Dauerbehandlung obstruktiver Atemwegserkrankungen wird Ihr Arzt Zeitpunkt und Dosis der jeweiligen Einzelanwendung von Aerodur Turbohaler vorzugsweise entsprechend der Häufigkeit und Schwere der Atemnot verordnen. Insbesondere bei Bronchialasthma wird Ihr Arzt Aerodur Turbohaler wahrscheinlich in Ergänzung zu einer Dauertherapie mit entzündungshemmend wirkenden Substanzen (z. B. Kortikoiden) zur Inhalation gemäß folgender Dosierungsempfehlung verordnen:
Bei Auftreten von Atemnot wird 1 Hub inhaliert.
Zur gezielten Vorbeugung bei Anstrengungsasthma oder vorhersehbarem Allergenkontakt wird 1 Hub, wenn möglich 10 bis 15 Minuten vorher, inhaliert.
Bei einem akuten Anfall von Luftnot führt in den meisten Fällen bereits das einmalige Inhalieren zu einer raschen Erleichterung der Atmung. Sollte sich die Atemnot 15 Minuten nach Inhalation des ersten Hubes nicht spürbar gebessert haben, kann ein weiterer Hub genommen werden. Kann ein schwerer Anfall von Luftnot auch durch eine zweite Anwendung nicht behoben werden, können weitere Hübe erforderlich werden. In diesen Fällen müssen Sie unverzüglich ärztliche Hilfe in Anspruch nehmen.
Falls Ihr Arzt eine Dauerbehandlung mit Beta-2-Agonisten für notwendig befindet, beträgt die Dosierung 1 Hub 3-mal/Tag. Sie sollte, insbesondere bei Asthma, von einer entzündungshemmenden Dauertherapie begleitet werden. Der Abstand der einzelnen Inhalationen soll mindestens 3 Stunden betragen.
Die Gesamttagesdosis soll bei Erwachsenen 12 Hübe und bei Kindern unter 12 Jahren 8 Hübe nicht überschreiten.
Ihr Arzt wird den Behandlungserfolg durch regelmäßige Untersuchungen überprüfen. Erhöhen Sie die Dosis von Aerodur Turbohaler nicht selbst, sondern nur auf ausdrückliche Anweisung Ihres Arztes.
Eine plötzliche und zunehmende Verschlechterung der Atembeschwerden kann lebensbedrohlich sein, deshalb müssen Sie dann unverzüglich ärztliche Hilfe in Anspruch nehmen.
Ein steigender Bedarf an Aerodur Turbohaler oder anderen Beta-2-Agonisten ist ein Anzeichen für eine Verschlechterung der Erkrankung. In dieser Situation wird Ihr Arzt den Therapieplan überdenken. Gegebenenfalls wird er eine Kombination mit entzündungshemmenden Arzneimitteln, eine Dosisanpassung einer bereits bestehenden entzündungshemmenden Behandlung oder die zusätzliche Gabe weiterer Arzneimittel verordnen.
Zur ärztlichen Beurteilung des Krankheitsverlaufes sowie des Behandlungserfolges ist eine tägliche Selbstkontrolle nach Anweisung Ihres Arztes wichtig. Diese erfolgt z. B. durch regelmäßige Messung der maximalen Atemstromstärke mittels eines Peak-flow-Meters.
Lesen Sie bitte alle Anwendungshinweise sorgfältig durch, bevor Sie mit der Anwendung von Aerodur Turbohaler beginnen.
Aerodur Turbohaler ist ein Mehrfachdosis-Inhalator, der sehr geringe Mengen Pulver abgibt (Abb. 1). Wenn Sie durch das Mundstück einatmen, wird das Pulver in Ihre Lungen transportiert. Daher ist es wichtig, dass Sie tief und kräftig durch das Mundstück einatmen.
Mundstück ^
Schutzkappe

Dosierrad ^
Dosisanzeige ^ (Fenster)

(Abb. 1)
Wie ihr neuer Inhalator zur Anwendung vorzubereiten ist:
Bevor Sie Ihren Aerodur Turbohaler-Inhalator zum ersten Mal anwenden, müssen Sie ihn wie folgt vorbereiten:
• Entfernen Sie die durchsichtige Schutzfolie von Ihrem Aerodur Turbohaler-Inhalator, indem Sie diese an der dafür vorgesehenen Stelle (siehe rote Markierungen auf der Schutzfolie) einreißen.
• Schutzkappe abschrauben und abnehmen.
• Inhalationsgerät aufrecht halten. Das blaue Dosierrad zeigt nach unten. Halten Sie das Mundstück nicht fest, wenn Sie das Dosierrad drehen. Drehen Sie das Dosierrad jeweils bis zum Anschlag in die eine Richtung und dann in die andere Richtung (Abb. 2). In welche Richtung zuerst gedreht wird, ist nicht entscheidend. Dabei werden Sie ein Klickgeräusch hören. Wiederholen Sie den Vorgang, d. h. drehen Sie das blaue Dosierrad in beide Richtungen.
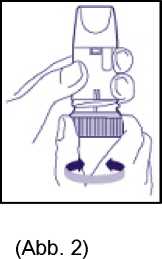
Ihr Aerodur Turbohaler-Inhalator ist jetzt gebrauchsfertig. Um eine Dosis zu inhalieren, fahren Sie bitte wie im Folgenden beschrieben fort.
Wie der Inhalator anzu wenden ist:
Bei jeder Inhalation ist zu beachten:
1. Schutzkappe abschrauben und abnehmen.
2. Inhalationsgerät aufrecht halten. Das blaue Dosierrad zeigt nach unten. Halten Sie das Mundstück nicht fest, wenn Sie das Dosierrad drehen.
3. Vor jeder Inhalation muss aus dem Wirkstoffvorrat eine Einzeldosis bereitgestellt werden, die dann inhaliert werden kann. Dies erfolgt durch einmaliges Hin- und Herdrehen des Dosierrades jeweils bis zum Anschlag (Abb. 2). In welche Richtung zuerst gedreht wird, ist nicht entscheidend. Dabei werden Sie ein Klickgeräusch hören. Eine Überdosierung ist auch bei versehentlicher Mehrfachbetätigung des Dosierrades nicht möglich.
4. Zunächst ohne das Gerät tief ausatmen, erst dann das Mundstück mit den Lippen umschließen und tief und kräftig durch das Gerät einatmen (Abb. 3).
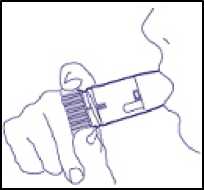
(Abb. 3)
Nicht auf dem Mundstück kauen oder beißen, da die Möglichkeit besteht, dass sich das Mundstück lockert oder ablöst! Das Gerät darf nicht mehr benutzt werden, wenn es beschädigt ist oder sich das Mundstück von selbst abgelöst hat.
5. Das Gerät vom Mund absetzen und den Atem einige Sekunden anhalten. Nicht durch das Gerät ausatmen!
Falls mehr als eine Inhalation verordnet wurde, sind die Schritte 2 bis 5 zu wiederholen.
6. Schutzkappe unmittelbar nach Gebrauch wieder fest aufschrauben.
Hinweise:
Der Wirkstoff ist feuchtigkeitsempfindlich. Daher niemals durch das Mundstück ausatmen und das Gerät stets nach Benutzung mit der Schutzkappe verschließen.
Bei jeder Inhalation kann sich ein wenig Arzneimittel in Ihrem Mund-Rachen-Raum absetzen. Da jede Dosis nur reinen Wirkstoff enthält und keine Hilfsstoffe, spürt man in den meisten Fällen das Auftreffen der Teilchen auf die Mundschleimhaut nicht. Nur selten tritt ein leicht bitterer Geschmack auf. Sie sollten, sofern möglich, Ihren Mund nach der Anwendung von Aerodur Turbohaler mit Wasser ausspülen, um das Risiko für das Auftreten von Nebenwirkungen zu verringern. Auch wenn Sie das Arzneimittel nach der Inhalation möglicherweise weder schmecken noch spüren, können Sie davon ausgehen, dass Sie die Dosis inhaliert haben, wenn Sie die Anweisungen befolgt haben.
Reinigung des Mundstücks:
Reinigen Sie das Mundstück einmal in der Woche äußerlich nur mit einem trockenen Tuch. Benutzen Sie kein Wasser oder andere Flüssigkeiten, um das Mundstück zu reinigen.
Wann ist der Inhalt des Gerätes abgebraucht?
Beim Erscheinen einer roten Markierung in der Dosisanzeige (Fenster) unter dem Mundstück sind noch ca. 20 Inhalationen zulässig (Abb. 4).
Mundstück

rote Markierung
noch 20 Inhalationen zulässig
(Abb. 4)
Erreicht die rote Markierung den unteren Fensterrand, sind diese ca. 20 Einzeldosen verbraucht (Abb. 5). Darüber hinaus sollte aus technischen Gründen nicht weiter inhaliert werden, obwohl noch eine Restmenge an Wirkstoff im Gerät enthalten ist.
Mundstück

leer leer
(Abb. 5)
Das Geräusch, das beim Schütteln des Turbohalers auftritt, wird durch das Trockenmittel verursacht und gibt keine Auskunft über den Füllstand des Turbohaler®.
3.3 Wenn Sie eine größere Menge von Aerodur Turbohaler angewendet haben, als Sie sollten,
können die im Abschnitt 4 „ Welche Nebenwirkungen sind möglich” genannten Wirkungen schnell und gegebenenfalls verstärkt eintreten. Typische Zeichen einer Überdosierung sind Kopfschmerzen, beschleunigter Puls, Herzklopfen und Blutdrucksteigerung, aber auch Blutdruckabfall bis hin zum Schock. Hinzu kommen Herzrhythmusstörungen, Ruhelosigkeit, Angstzustände, Schlafstörungen, Brustschmerzen, Muskelkrämpfe und heftiges Zittern, insbesondere an den Händen, aber auch am ganzen Körper. Ferner können Magen-Darm-Beschwerden, einschließlich Übelkeit und Erbrechen, auftreten.
Gegen Ende der Lebensdauer des Turbohalers besteht das Risiko einer fortschreitenden Ansammlung des Pulvers im Bereich des Turbohaler-Mundstücks. Dieses könnte durch einen Fall (z. B. von einem Tisch) freigesetzt werden. Sie sollten, sofern möglich, Ihren Mund nach der Anwendung von Aerodur Turbohaler mit Wasser ausspülen, um das Risiko für das Auftreten von Nebenwirkungen zu verringern.
Verständigen Sie bei Verdacht auf eine Überdosierung bitte umgehend einen Arzt.
3.4 Wenn Sie die Anwendung von Aerodur Turbohaler vergessen haben
Wenden Sie nicht die doppelte Menge an, wenn Sie die vorherige Anwendung vergessen haben.
Wenn Sie die Anwendung von Aerodur Turbohaler abbrechen,
wenden Sie sich vorher an Ihren Arzt.
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig: mehr als 1 Behandelter von 10
Häufig: 1 bis 10 Behandelte von 100
Gelegentlich: 1 bis 10 Behandelte von 1000
Selten: 1 bis 10 Behandelte von 10 000
Sehr selten: weniger als 1 Behandelter von 10 000
Nicht bekannt: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar Mögliche Nebenwirkungen:
Die meisten der beobachteten Nebenwirkungen entsprechen den für diese Art von Arzneimittel typischen Nebenwirkungen.
Störungen des Herz-Kreis/auf-Systems
Häufig Erhöhung der Herzschlagfolge (Tachykardie), Herzklopfen
Selten Engegefühl in der Brust (pektanginöse Beschwerden), Herzrhythmusstörungen
wie z. B. Vorhofflimmern, supraventrikuläre Tachykardie und unregelmäßige Herzschläge (Extrasystolen)
Nicht bekannt Durchblutungsstörungen des Herzmuskels (Myokardischämie)
Störungen der Skelettmuskulatur und des Bindegewebes Häufig Lang anhaltende Muskelkrämpfe
Störungen des Nervensystems
Sehr häufig feinschlägiges Hände- und Fingerzittern, Kopfschmerzen
Störungen des Verdauungstraktes Selten Übelkeit
Sehr selten Reizungen von Mund und Hals, Sodbrennen
Psychische Störungen
Selten Schlafstörungen und Verhaltensstörungen wie Unruhe, Hyperaktivität und
Rastlosigkeit
Sehr selten atypische Psychosen bei Kindern
Störungen im Bereich der Atemwege und des Brustraums Selten Bronchialkrampf
Störungen der Haut und des Unterhautgewebes
Selten Nesselsucht (Urtikaria) und Hautausschlag
Störungen des Immunsystems
Sehr selten Überempfindlichkeitsreaktionen (z. B. Anaphylaxie, Quincke-Ödem,
Blutdruckabfall)
Störungen der Nieren und der Harn wege
Sehr selten Störungen beim Wasserlassen
Stoffwechsel- und Ernährungsstörungen
Häufig Kaliumverarmung (Hypokaliämie)
Nicht bekannt Stoffwechselbedingte Veränderungen wie Anstieg des Blutzuckerspiegels; ein
Anstieg des Blutspiegels von Insulin, freien Fettsäuren, Glycerol und Ketonkörpern ist möglich.
Beschwerden wie Übelkeit, feinschlägiges Hände- und Fingerzittern, Herzklopfen, Kopfschmerzen und Unruhegefühl sowie Muskelkrämpfe nehmen bei Fortführung der Therapie nach 1 bis 2 Wochen meistens wieder ab.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt über das nationale Meldesystem anzeigen:
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn
Website: http://www.bfarm.de
Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist Aerodur Turbohaler aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen dieses Arzneimittel nach dem auf dem Etikett und dem Umkarton angegebenen Verfalldatum nicht mehr verwenden.
Aufbewahrungsbedingungen:
Nicht über 30 °C lagern.
Das Gerät stets nach Benutzung mit der Schutzkappe verschließen, da der Wirkstoff feuchtigkeitsempfindlich ist.
6. Inhalt der Packung und weitere Informationen
6.1 Was Aerodur Turbohaler enthält
• Der Wirkstoff ist: Terbutalinsulfat (Ph.Eur.).
1 Einzeldosis zu 0,5 mg Aerodur Turbohaler enthält 0,5 mg Terbutalinsulfat (Ph.Eur.).
• Die sonstigen Bestandteile sind: Keine.
6.2 Wie Aerodur Turbohaler aussieht und Inhalt der Packung
Aerodur Turbohaler ist ein Mehrfachdosen-Pulverinhalator. Der Pulverinhalator besteht aus Kunststoffteilen.
Aerodur Turbohaler ist in Packungen mit 1 Pulverinhalator (entsprechend mindestens 100 Einzeldosen) erhältlich.
6.3 Pharmazeutischer Unternehmer und Hersteller
Pharmazeutischer Unternehmer:
AstraZeneca GmbH, 22876 Wedel Telefon: 0 41 03 / 70 80 Telefax: 0 41 03 / 708 32 93 E-Mail: azinfo@astrazeneca.com
Hersteller:
AstraZeneca Dunkerque Production 224, Avenue de la Dordogne BP 41 F-59944 Dunkerque Cedex 2 Frankreich