Almirid-Cripar 40 Mg
Almirid-Cripar® 20 mg
Almirid-Cripar® 40 mg
TAURUS PHARMA GmbH
Fachinformation
Almirid-Cripar® 20 mg
Almirid-Cripar® 40 mg
TAURUS PHARMA GmbH
Fachinformation
Stand: Mai 2014
1. Bezeichnung der Arzneimittel
Almirid-Cripar® 20 mg, Tabletten Almirid-Cripar® 40 mg, Tabletten
Wirkstoff:
a-Dihydroergocryptinmethansulfonat
2. Qualitative und quantitative Zusammensetzung
Almirid-Cripar 20 mg 1 Tablette enthält 20 mg a-Dihydroergocryptinmethansulfonat.
Almirid-Cripar 40 mg 1 Tablette enthält 40 mg a-Dihydroergocryptinmethansulfonat.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Almirid-Cripar 20 mg: Tabletten Almirid-Cripar 40 mg: Tabletten
4. Klinische Angaben
4.1 Anwendungsgebiete
Zur Behandlung der Schüttellähmung (idiopathischer Morbus Parkinson) bei Patienten ohne Fluktuationen im Krankheitsbild als Monotherapie oder in Kombination mit Levodopa (mit oder ohne Decarboxylasehemmer).
4.2 Dosierung und Art der Anwendung
Almirid-Cripar 20 mg (viertelbare Tabletten mit je 20 mg Wirkstoff) ist besonders für die Aufdosierung und die niedrige Erhaltungstherapie geeignet. Almirid-Cripar 40 mg (viertelbare Tabletten mit je 40 mg Wirkstoff) wird für höhere Dosierungen und die Dauertherapie angewendet. Dies gilt für die Mono- und Kombinationstherapie.
Folgendes Dosierungsschema wird für die Monotherapie mit Almirid-Cripar empfohlen:
Es wird eine Anfangsdosis von 2-mal täglich 5 mg Wirkstoff (morgens und abends) eingenommen (Tagesdosis 10 mg). Hierfür stehen die viertelbaren Almirid-Cripar 20 mg Tabletten zur Verfügung. Nach zwei Wochen werden 2-mal täglich 10 mg Wirkstoff (morgens und abends) eingenommen (Tagesdosis 20 mg), nach weiteren zwei Wochen werden 2-mal täglich 20 mg Wirkstoff (morgens und abends) eingenommen (Tagesdosis 40 mg). Die Tagesdosis wird stufenweise in etwa zweiwöchigem Abstand um jeweils 20 mg Wirkstoff erhöht, bis die therapeutisch erforderliche Erhaltungsdosis erreicht ist, wobei die Dosierung generell individuell angepasst werden sollte. Die Erhaltungsdosis kann in der Monotherapie bei 30 bis 120 mg Wirkstoff/Tag liegen.
Folgendes Dosierungsschema wird für die Kombinationstherapie mit Levodopa (mit oder ohne Decarboxylasehemmer) empfohlen:
Es wird eine Anfangsdosis von 2-mal täglich 5 mg Wirkstoff (morgens und abends) eingenommen (Tagesdosis 10 mg). Hierfür stehen die viertelbaren Almirid-Cripar 20 mg Tabletten zur Verfügung. Nach zwei Wochen werden 2-mal täglich 10 mg Wirkstoff (morgens und abends) eingenommen (Tagesdosis 20 mg), nach weiteren zwei Wochen 2-mal täglich 15 mg Wirkstoff (morgens und abends) oder 3-mal täglich 10 mg (morgens, mittags und abends) (Tagesdosis 30 mg). Die Tagesdosis wird stufenweise in etwa zweiwöchigem Abstand um jeweils 10 mg Wirkstoff erhöht, bis die therapeutisch erforderliche Erhaltungsdosis erreicht ist, wobei die Dosierung generell individuell angepasst werden sollte. Die Erhaltungsdosis liegt im Allgemeinen bei etwa 60 mg Wirkstoff/Tag, verteilt auf je 20 mg morgens, mittags und abends. Bei einigen Patienten können auch Dosen bis zu 120 mg Wirkstoff/Tag erforderlich sein, verteilt auf je 40 mg morgens, mittags und abends.
Eine Dosisverringerung von Levodopa sollte stufenweise vorgenommen werden bis zum Erreichen der optimalen therapeutischen Wirkung. Mit einer Nieren- oder Leberinsuffizienz kann ein Anstieg der Plasmaspiegel verbunden sein. Daher sollte die schrittweise Dosiserhöhung bei diesen Patienten besonders vorsichtig erfolgen.
Die jeweilige Tagesdosis sollte gleichmäßig aufgeteilt morgens und abends (niedrige Tagesdosis) bzw. morgens, mittags und abends (höhere Tagesdosis) eingenommen werden.
Die Tabletten werden unzerkaut zu den Mahlzeiten oder kurz danach mit ausreichend (z. B. ein Glas) Wasser eingenommen.
Über die Dauer der Anwendung entscheidet der behandelnde Arzt. Üblicherweise wird Almirid-Cripar langfristig über mehrere Wochen und Monate, zum Teil sogar Jahre, eingenommen.
Die Almirid-Cripar 20 mg Tablette kann geviertelt werden: % Tablette entspricht 5 mg Wirkstoff.
Die Almirid-Cripar 40 mg Tablette kann ebenfalls durch Druck mit dem Daumen auf die gekerbte Tablettenoberseite geviertelt werden. % Tablette entspricht 10 mg Wirkstoff.
4.3 Gegenanzeigen
Almirid-Cripar darf nicht bei bestätigter oder vermuteter Schwangerschaft und in der Stillzeit angewendet werden.
Almirid-Cripar darf ebenfalls nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff, andere Mutterkornalkaloide, sonstige Bestandteile des Arzneimittels sowie im Kindesalter. Wegen möglicher Wechselwirkungen (Wirkungspotenzierung) ist die gleichzeitige Einnahme von anderen Mutterkornalkaloiden kontraindiziert (siehe auch Punkt 4.5).
Bei Langzeitbehandlung: Echokardiogra-phischer Nachweis einer Herzklappenerkrankung vor der Behandlung.
Besondere Vorsicht ist geboten bei Patienten mit Leberinsuffizienz, nicht körperlich begründbaren Psychosen sowie bestehender Hypotonie oder bei gleichzeitiger Behandlung mit Antihypertensiva.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Da Almirid-Cripar auch bei bestimmungsgemäßem Gebrauch sehr selten Tagesmüdigkeit verursachen kann, müssen Patienten darauf hingewiesen werden, im Straßenverkehr, beim Bedienen von Maschinen sowie bei Arbeiten ohne sicheren Halt besonders vorsichtig zu sein. Patienten, bei denen Tagesmüdigkeit aufgetreten ist, sollten kein Fahrzeug führen und keine Maschinen bedienen, durch die sie selbst oder andere dem Risiko schwerwiegender Verletzungen ausgesetzt sein könnten. In derartigen Fällen sollte eine Dosisreduktion oder eine Beendigung der Therapie erwogen werden.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Almirid-Cripar nicht einnehmen.
Impulskontrollstörungen Die Patienten sollten regelmäßig hinsichtlich der Entwicklung von Impulskontrollstö-rungen überwacht werden. Patienten und Betreuer sollten darauf aufmerksam gemacht werden, dass bei Patienten, die mit Dopaminagonisten, einschließlich Almirid-Cripar, behandelt werden Verhaltensauffälligkeiten in Sinne von Impulskontrollstörun-gen auftreten können, einschließlich pathologischer Spielsucht, Libidosteigerung, Hypersexualität, zwanghaftes Geldausgeben oder Einkaufen, Essattacken und Esszwang. Wenn sich solche Symptome entwickeln, sollte eine Dosisreduktion bzw. eine ausschleichende Behandlung in Erwägung gezogen werden.
Während einer Langzeittherapie (> 6 Monate) mit Dosen über 60 mg Wirkstoff/Tag wird empfohlen, die Leberfunktion in bestimmten Abständen zu kontrollieren.
Bei mit Dihydroergocryptin behandelten Patienten, vor allem unter langfristiger und hochdosierter Therapie, wurde gelegentlich über Pleura- und Perikardergüsse sowie Pleura- und Lungenfibrose und konstriktive Perikarditis berichtet. Patienten mit ungeklärten pleuropulmonalen Erkrankungen müssen gründlich untersucht werden, und es ist ein Abbruch der Dihy-droergocryptin-Therapie zu erwägen.
Insbesondere unter einer langfristigen und hochdosierten Therapie wurde in seltenen Fällen über eine Retroperitonealfibrose berichtet. Um die Erkennung der Retroperitonealfibrose in einem frühen reversiblen Stadium sicherzustellen, wird empfohlen, deren Manifestationen (z. B. Rückenschmerzen, Ödeme an den unteren Extremitäten, Nierenfunktionseinschränkung) in dieser Patienten-Gruppe zu überwachen.
Stand: Mai 2014
Die Dihydroergocryptin-Therapie muss abgesetzt werden, wenn fibrotische Veränderungen im Retroperitoneum diagnostiziert oder vermutet werden.
Bei Patienten, die gleichzeitig die Blutgerinnung beeinflussende Arzneimittel erhalten, sollten häufigere Kontrollen der Gerinnung vorgenommen werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Eine Pharmakokinetik-Studie bei Parkinson-Patienten zeigte keinen klinisch relevanten Einfluss von Almirid-Cripar auf die Kinetik von Levodopa. Eine Dosisanpassung von Digoxin ist nicht erforderlich. Almirid-Cripar zeigte in einer Pharmakokinetik-Studie keinen klinisch relevanten Einfluss auf die Kinetik von Digoxin. Bei gleichzeitiger Anwendung von Levodopa kann es zu häufigerem Auftreten von Magenschmerzen, niedrigem Blutdruck und Kopfschmerzen kommen; beobachtet wurde auch die Bildung von Ödemen.
Almirid-Cripar soll bei gleichzeitiger Therapie mit anderen Mutterkornalkaloiden nicht verordnet werden (Gefahr von additiven Effekten; Ergotismus). Die Wirkung von Antihypotonika kann abgeschwächt werden, während möglicherweise die von Antihypertonika verstärkt werden kann. Die gleichzeitige Einnahme von Nitropräparaten kann gegebenenfalls die Wirkung von Almirid-Cripar verstärken.
Eine potenzierende Wirkung von Almirid-Cripar mit Medikamenten, die auf die Psyche wirken, kann nicht ausgeschlossen werden.
a-Dihydroergocryptinmethansulfonat kann die Thrombozytenaggregation beeinträchtigen und die Blutviskosität vermindern.
Bei Patienten, die gleichzeitig die Blutgerinnung beeinflussende Arzneimittel erhalten, sollten häufigere Kontrollen der Gerinnung vorgenommen werden.
Wechselwirkungen mit Alkohol wurden nicht untersucht. Die gleichzeitige Einnahme von Alkohol kann die Verträglichkeit von Almirid-Cripar verschlechtern.
a-Dihydroergocryptinmethansulfonat wird in erster Linie durch das Cytochrom-P450-Isoenzym CYP3A4 metabolisiert. Eine Pharmakokinetik-Studie an Gesunden zeigte, dass bei gleichzeitiger Gabe von Erythromycin die Plasmakonzentrationen an Dihydroergocryptin und seiner Metaboliten deutlich erhöht waren. Daraus ergibt sich ein potentielles Risiko für Nebenwirkungen. Daher muss bei gleichzeitiger Verabreichung mit Arzneimitteln, die CYP3A4 hemmen, gegebenenfalls die Dosis von Almirid-Cripar angepasst werden. Dies gilt auch, wenn diese Arzneimittel wieder abgesetzt werden. Makrolidantibiotika (z. B. Erythromycin) sollten auf Grund der Ausprägung des Effektes nicht zusammen mit Almirid-Cripar gegeben werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Almirid-Cripar darf nicht bei vermuteter oder bestätigter Schwangerschaft oder während der Stillzeit eingenommen werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Möglicherweise treten Nebenwirkungen wie z. B. Kreislaufbeschwerden, Schwindel, Kopfschmerzen, Tagesmüdigkeit oder Verwirrtheitszustände auf, wodurch das Seh- und Reaktionsvermögen sowie die Urteilskraft vermindert werden. Almirid-Cripar kann deshalb auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen soweit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr und zum Bedienen von Maschinen beeinträchtigt wird. Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol oder anderen zentralwirksamen Medikamenten. Daher sollten das Führen von Kraftfahrzeugen, die Bedienung von elektrischen oder motorgetriebenen Werkzeugen und Maschinen oder sonstige gefahrvolle Tätigkeiten zumindest während der ersten Tage der Behandlung unterbleiben.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
|
Sehr häufig |
> 1/10 |
|
Häufig |
> 1/100 bis < 1/10 |
|
Gelegentlich |
> 1/1.000 bis < 1/100 |
|
Selten |
> 1/10.000 bis < 1/1.000 |
|
Sehr selten |
< 1/10.000 |
|
Nicht bekannt |
Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar |
In den klinischen Prüfungen traten insbesondere während der ersten Tage der Behandlung mit Almirid-Cripar folgende Nebenwirkungen auf:
Sehr häufig: Übelkeit und Magenschmerzen.
Häufig: Schwächegefühl, Kopfschmerzen, Schwindel, Erbrechen, Sodbrennen bzw. Magenkrämpfe, Blutdruckerniedrigung um bis zu 5 mm Hg, orthostatische Kreislaufbeschwerden, Tachykardie, Unruhe, Ödeme, depressive Verstimmung, Schlaflosigkeit, Exantheme, Gewichtsveränderung und trockener Mund.
Gelegentlich: Unwohlsein, Rast- bzw. Ruhelosigkeit, Angst, Gefühllosigkeit, Kribbeln und Kältegefühl in Armen und Beinen, Gefühl der verstopften Nase, Libidoverlust, Bewegungsstörungen, Verwirrtheitszustände, Muskelkrämpfe, Hyper-hidrosis (übermäßige Schweißabsonderung), Zittern, Appetitlosigkeit, Agitiertheit, Tinnitus (Ohrensausen), Herzbeklemmung, Obstipation (Verstopfung), Alpträume, Halluzinationen.
Sehr selten: Herzklappenveränderungen (einschließlich Regurgitation) und damit verbundene Erkrankungen (Perikarditis und Perikarderguss). Nach Einnahme von Almirid-Cripar wurde sehr selten Müdigkeit beobachtet.
Die oben aufgeführten Nebenwirkungen traten überwiegend dosisabhängig auf; sie waren reversibel und ließen sich durch Reduktion der Dosis verringern.
Impulskontrollstörungen Patholgische Spielsucht, Libidosteigerung, Hypersexualität, zwanghaftes Geld ausgeben oder Einkaufen, Essattacken und Esszwang können bei Patienten auftreten, die mit Dopaminagonisten, einschließlich Almirid-Cripar, behandelt werden (siehe Abschnitt 4.4).
Während einer Langzeitbehandlung mit Medikamenten, die sich in der Struktur von Mutterkornalkaloiden ableiten, wurden in Einzelfällen Pleuraergüsse und pleuropul-monale Fibrosen beobachtet. Ein Zusammenhang zwischen a-Dihydroergocryptin und einem derartigen Befund ist nicht gesichert. Patienten mit unklaren pleuropul-monalen Symptomen (Dyspnoe, Reizhusten) sollten sorgfältig überwacht werden.
Hinweise auf das Reaktionsverhalten beim Führen von Kraftfahrzeugen und dem Bedienen von Maschinen siehe Punkt 4.7.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des NutzenRisiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt- Georg-Kiesinger Allee 3, D-53175 Bonn. Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Über eine Überdosierung wurde bislang nicht berichtet. Individuell unterschiedlich können die unter Nebenwirkungen aufgeführten Symptome verstärkt auftreten, sowie Sehstörungen, Angstgefühl, Erregungszustände, Verwirrtheit, Krämpfe, Brady-oder Tachykardie bis hin zum Kreislaufkollaps. Je nach Ausgangslage des Gefäßsystems sind auch Gefäßspasmen mit Blutdrucksteigerung und nachfolgendem Kältegefühl, Parästhesien sowie Schmerzen in den Extremitäten möglich.
Aufgrund der schnellen Resorption des Wirkstoffs sollten umgehend neben adsorbierenden Maßnahmen (z. B. Aktivkohle) auch solche zu einer raschen Elimination aus dem Körper getroffen werden (Erbrechen induzieren und/oder Gabe von Laxanzien). Als Gegenmittel können auch Dopaminantagonisten, wie z. B. Sulpirid oder Metoclopramid, parenteral verabreicht werden.
Zur Behandlung der symptomatischen Hypotension sind indirekte
Stand: Mai 2014
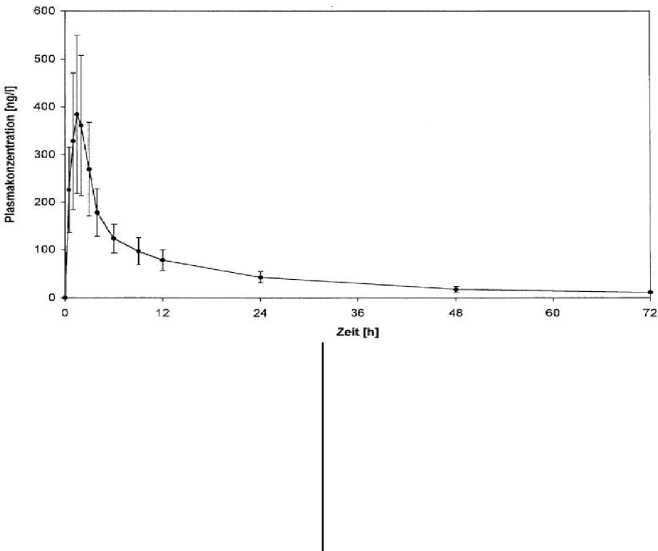
tration-Zeit-Kurve ersichtlich.
Dosis Wirkstoff oral [mg] 20 tmax [h] 1,62 ± 0,30
d) Reproduktionstoxizität
Weder bei der Ratte noch beim Kaninchen
bewirkte a-Dihydroergocryptinmethansul-
Sympathomimetika, gegebenenfalls auch direkte a-Sympathomimetika und Angiotensin, zu empfehlen. Im Falle von Gefäßspasmen sind gefäßerweiternde Mittel (Calcium- Antagonisten, Nitroverbindungen, Papaverin,
Theophyllin) angezeigt.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe:
Dopaminagonist, Parkinsonpräparat
ATC-Code: N04BC03
Almirid-Cripar enthält als Wirkstoff das hydrierte Mutterkornalkaloid a-Dihydroergo-cryptinmethansulfonat, das eine hohe Affinität zu Dopaminrezeptoren besitzt. a-Dihydroergocryptinmethansulfonat wirkt selektiv agonistisch auf D2-Rezeptoren und ist ein partieller D1-Rezeptoragonist, ohne in-vivo eine Aktivität auf serotoninerge oder adrenerge Rezeptoren zu besitzen.
5.2 Pharmakokinetische Eigenschaften
Der Wirkstoff a-Dihydroergocryptinmethan-sulfonat wird nach oraler Applikation von Almirid-Cripar rasch resorbiert. Maximale Plasmakonzentrationen werden bereits nach 1 Stunde erreicht. Die Proteinbindung liegt zwischen 45 - 64%. Die Eliminationshalbwertszeit aus dem Plasma liegt zwischen 9,9 und 15 Stunden. Ein steady-state wird bei 2-mal täglicher Applikation von Almirid-Cripar nach 3 Tagen erreicht. Eine Kumulation oder Interaktion mit Levodopa wurde in den klinischen Studien nicht beobachtet. Der Wirkstoff vermag die Blut-Hirn-Schranke zu überwinden und reichert sich in therapeutischen Konzentrationen im Gehirn an. Die mittleren Plasmakonzentrationen von a-Dihydroergo-cryptin bei je 12 männlichen und weiblichen Probanden nach einmaliger Verabreichung einer Tablette Almirid-Cripar 20 mg (20 mg a-Dihydroergocryptinme-thansulfonat) sind aus der Plasmakonzen-
Die pharmakokinetischen Parameter aus dieser 1993 durchgeführten Studie können der nachfolgenden Tabelle entnommen werden. Angegeben sind jeweils die Mittelwerte (n=24) mit ihren Standardabweichungen.
Cmax [ng/l] 406,2 ± 164,2
AUCn^ [ng x h/l] 3878,5 ± 1238,4 tt/2 el [h] 16,07 ± 3,20
Eine 1994 durchgeführte in-vitro-Studie mit radioaktiv markiertem a-Dihydroergo-cryptinmethansulfonat zeigte, dass 94 bis 97% der applizierten Dosis mit einer Rate von 4,5 ng/min/mg Protein durch Lebermikrosomen metabolisiert wurden, wobei 93% auf 2 von 8 Metaboliten entfielen.
Nach oraler Verabreichung von radioaktiv markiertem a-Dihydroergocryptinmethansul-fonat an 6 Probanden erfolgte die Ausscheidung über eine Sammelperiode von 168 Stunden überwiegend fäkal (82,8 ± 6,4%) und nur zu einem geringen Prozentsatz (3,0 ± 0,65%) renal (Studie von 1994).
5.3 Präklinische Daten zur Sicherheit
a) Akute Toxizität
Die LD50 von a-Dihydroergocryptinme-thansulfonat lag nach oraler Gabe bei der Ratte über 5000 mg/kg KG und bei der Maus bei 4384 mg/kg KG. Nach i.v.-Appli-kation wurde eine LD50 von 50,7 mg/kg (Ratte) und 193,2 mg/kg (Maus) ermittelt.
Folgende Intoxikationssymptome traten auf: Ptosis, Tremor, periphere Vasodilatation, tonisch-klonische Krämpfe und Cyanosis.
b) Subchronische/chronische Toxizität Subchronische (4 Wochen) und chronische Toxizitätsstudien (52 Wochen) wurden an Ratten und Affen durchgeführt.
Nach Dosen, die ein Vielfaches der therapeutischen Dosis am Menschen betragen, traten Plasmaspiegelanstiege der Leberenzyme sowie von Glucose und Harnstoff auf. Histologisch wurden Veränderungen der Leber sowie Ulcera der Magenschleimhaut beobachtet.
c) Mutagenes und kanzerogenes Potential
Eine umfangreiche Mutagenitätsprüfung mit in-vitro- und in-vivo-Untersuchungen verlief negativ. Langzeituntersuchungen zur Kanzerogenität wurden mit a-Dihydroergocryptinmethansulfonat nicht durchgeführt.
fonat, das während der Organogenese verabreicht wurde, fetale Anomalien. Fertilitätsstudien an Ratten zeigten keine Beeinträchtigung der Fruchtbarkeit nach Dosen bis zu 6 mg/kg/Tag. Bei Verabreichung während der Peri- und Postnatalentwicklung konnte kein Effekt im maternal nicht toxischen Bereich festgestellt werden.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Almirid-Cripar 20 mg: Lactose-Monohydrat, mikrokristalline Cellulose, Croscarmellose-Natrium, Magnesi-umstearat (Ph. Eur.) [pflanzlich], Povidon (K25).
Almirid-Cripar 40 mg:
Lactose-Monohydrat, mikrokristalline Cellulose, Croscarmellose-Natrium, Magnesi-umstearat (Ph. Eur.) [pflanzlich], Povidon (K25).
6.2 Inkompatibilitäten
Bisher keine bekannt.
6.3 Dauer der Haltbarkeit
Die Dauer der Haltbarkeit für Almirid-Cripar 20 mg und 40 mg beträgt 4 Jahre. .
Die Arzneimittel sollen nach Ablauf des Verfalldatums nicht mehr angewendet werden (siehe Faltschachtel).
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Es sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Blister aus PVC und Aluminiumfolie.
Almirid-Cripar 20 mg:
Packung mit 30 [N1], 60 [N2], 100 und 200 Tabletten [N3]
Almirid-Cripar 40 mg:
Packung mit 100 und 200 Tabletten [N3]
Klinikpackungen Almirid-Cripar 20 mg:
Packung mit 30 Tabletten
Es werden möglicherweise nicht alle Packungsgrößen in den Handel gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
Taurus Pharma GmbH Benzstr. 11
D-61352 Bad Homburg Telefon: 06172/139683 Telefax: 06172/171550 info@tauruspharma.de
8. Zulassungsnummern
Almirid-Cripar 20 mg: 27755.00.00 Almirid-Cripar 40 mg: 57777.00.00
Stand: Mai 2014
|
~ .... Almirid-Cripar® 20 mg TAURUS PHARMA GmbH Almirid-Cripar® 40 mg | ||
|
9. Datum der Erteilung der Zulassung/ Verlängerung der Zulassung Almirid-Cripar 20 mg: Zulassung erteilt: 16.05.1995 Zulassung verlängert: 28.11.2002 Almirid-Cripar 40 mg: Zulassung erteilt: 21.09.2005 10. Stand der Information Mai 2014 11. Verkaufsabgrenzung Verschreibungspflichtig | ||
Seite 4 von 4