Alopexy 5 % Lösung Zur Anwendung Auf Der Haut
palde-apx-14a.doc 1 von 6
Gebrauchsinformation: Information für Anwender ALOPEXY 5 % Lösung zur Anwendung auf der Haut
Minoxidil
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der
Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
Wenden Sie dieses Arzneimittel immer genau wie in dieser Packungsbeilage beschrieben
bzw. genau nach Anweisung Ihres Apothekers an.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Fragen Sie Ihren Apotheker, wenn Sie weitere Informationen oder einen Rat benötigen.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packunsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
1. Was ist ALOPEXY 5 % und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von ALOPEXY 5 % beachten?
3. Wie ist ALOPEXY 5 % anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist ALOPEXY 5 % aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist ALOPEXY 5 % und wofür wird es angewendet?
Dieses Arzneimittel wird bei bestimmten, mittelschweren Fällen der so genannten androgenetischen Alopezie (übermäßigem Haarausfall) bei Männern angewendet.
Dieses Arzneimittel wird für die Anwendung bei Frauen nicht empfohlen, da häufig ein abnormales Haarwachstum (Hypertrichose) zu erwarten ist.
2. Was sollten Sie vor der Anwendung von ALOPEXY 5 % beachten?
ALOPEXY 5 % darf nicht angewendet werden,
- wenn Sie allergisch gegen Minoxidil oder einen der in Abschnitt 6. genannten sonstigen Bestandteile von ALOPEXY 5 % sind.
- wenn es bei Ihnen bereits gegenüber der 2 %igen Minoxidil-Lösung zu einer Unverträglichkeitsreaktion gekommen ist.
- wenn Sie eine Erkrankung oder Verletzung an der Kopfhaut haben.
Kinder und ältere Menschen:
Daten zur Unbedenklichkeit und Wirksamkeit für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren und über 65 Jahre liegen nicht vor.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, bevor Sie ALOPEXY 5 % anwenden. Besondere Vorsicht bei der Anwendung von ALOPEXY 5 % ist erforderlich
- Wenn Sie an einer Herz-Kreislauf-Erkrankung leiden oder gelitten haben, sollten Sie vor der Anwendung von ALOPEXY 5 % einen Arzt aufsuchen
- Die Empfehlung, dass dieses Arzneimittel von Frauen nicht angewendet werden sollte, begründet sich durch das Risiko eines abnormen Haarwachstums (Hypertrichose).
In folgenden Fällen sollten Sie dieses Arzneimittel nicht anwenden:
- wenn kein Haarausfall in der Familiengeschichte vorliegt, bei plötzlich auftretendem und/oder ungleichmäßigem Haarausfall, schwangerschaftsbedingtem Haarausfall oder Haarausfall unbekannter Ursache. In diesen Fällen sollten Sie vor der Anwendung von ALOPEXY 5 % einen Arzt um Rat fragen, da die Behandlung bei diesen Arten des Haarausfalls möglicherweise unwirksam ist.
- wenn Ihre Kopfhaut gerötet, entzündet, infiziert, gereizt oder schmerzhaft ist. Dieses Arzneimittel sollte nur auf gesunder Kopfhaut angewendet werden (siehe „Wie ist ALOPEXY 5 % anzuwenden?“). Bei geschädigter Kopfhaut kann der Wirkstoff (Minoxidil) verstärkt in das Blut übergehen (siehe „ALOPEXY 5 % darf nicht angewendet werden").
- Wenden Sie dieses Arzneimittel nicht gleichzeitig mit anderen Hautpräparaten auf der Kopfhaut an.
Während der Anwendung
- Die Lösung kann wegen des Alkoholgehalts bei versehentlichem Kontakt mit den Augen, Wunden, gereizter Haut oder Schleimhäuten Brennen oder Reizungen verursachen. Betroffene Stelle mit reichlich kaltem Leitungswasser spülen. Bei anhaltenden Beschwerden einen Arzt aufsuchen.
- Die behandelte Kopfhaut sollte nicht der Sonneneinstrahlung ausgesetzt werden: Tragen Sie einen Kopfschutz (Hut).
- Nicht verschlucken. Eine versehentliche Einnahme kann aufgrund der Wirkungen von Minoxidil auf das Herz-Kreislauf-System zu unerwünschten Wirkungen führen. Bewahren Sie dieses Arzneimittel daher für Kinder unzugänglich auf. SUCHEN SIE SOFORT EINEN ARZT AUF!
- Nicht einatmen.
- Bei manchen Patienten traten Veränderungen der Haarfarbe und/oder der Haarbeschaffenheit auf.
Diese Behandlung erfordert insbesondere zu Beginn der Therapie regelmäßige ärztliche Kontrollen.
Brechen Sie die Anwendung bei folgenden Symptomen sofort ab und suchen Sie einen Arzt auf:
- niedriger Blutdruck, Schmerzen im Brustraum, erhöhte Pulsfrequenz,
- Schwächeanfälle oder Schwindel,
- plötzliche unerklärbare Gewichtszunahme, geschwollene Hände oder Füße (Ödem),
- anhaltende Rötung oder Reizung der Kopfhaut.
Anwendung von ALOPEXY 5 % zusammen mit anderen Arzneimitteln
Wenden Sie dieses Arzneimittel nicht gleichzeitig mit anderen Hautpräparaten wie Tretinoin, Anthralin oder Betamethasondipropionat an, da diese Produkte die Menge von Minoxidil im Blut verändern können.
Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel anwenden bzw. vor kurzem angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
Anwendung von ALOPEXY 5 % zusammen mit Nahrungsmitteln und Getränken
Nicht zutreffend
Schwangerschaft, Stillzeit und Zeugungs-/Gebärfähigkeit
Dieses Arzneimittel wird nicht für Frauen empfohlen.
Vermeiden Sie die Anwendung von ALOPEXY 5% während Schwangerschaft oder Stillzeit. Fragen Sie vor der Anwendung von allen Arzneimitteln Ihren Arzt oder Apotheker um Rat.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Eine Beeinträchtigung ist unwahrscheinlich.
ALOPEXY 5 % enthält Propylenglycol und kann Hautreizungen hervorrufen.
Dieses Arzneimittel enthält Ethanol (Alkohol) und ist daher brennbar.
3. Wie ist ALOPEXY 5 % anzuwenden ?
Wenden Sie dieses Arzneimittel immer genau wie in dieser Packungsbeilage beschrieben bzw. genau nach der mit Ihrem Arzt oder Apotheker getroffenen Absprache an. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind.
Als übliche Dosis wird 2-mal täglich je 1 ml auf die zu behandelnde Kopfhautfläche aufgetragen.
Die täglich angewandte Menge sollte 2 ml nicht überschreiten, unabhängig von der Größe der zu behandelnden Fläche.
Häufigkeit der Anwendung
Wenden Sie morgens und abends je 1 ml ALOPEXY 5 % an.
Die Anwendungsmenge und die Häufigkeit der Anwendungen dürfen nicht erhöht werden. Die empfohlene Dosis dürfen Sie auf keinen Fall eigenmächtig ändern.
Dauer der Anwendung
Ein Behandlungsergebnis ist nicht sofort sichtbar. Ein Stopp des Haarausfalls und/oder neues Haarwachstum sind erst eine gewisse Zeit nach Behandlungsbeginn zu erwarten. Möglicherweise ist eine 2-mal tägliche Behandlung über 2 Monate erforderlich, bevor eine Anregung des Haarwachstums sichtbar wird. Der Zeitpunkt des Einsetzens und das Ausmaß des Ansprechens auf die Behandlung sind individuell verschieden.
Einige Berichte lassen vermuten, dass nach Absetzen der Behandlung der Ausgangszustand nach 3 oder 4 Monaten wieder erreicht werden könnte.
Art der Anwendung
Zur Anwendung auf der Haut. Zur äußerlichen Anwendung.
Vor und nach dem Auftragen der Lösung sind die Hände gründlich zu waschen.
Vor dem Auftragen müssen Haare und Kopfhaut völlig trocken sein.
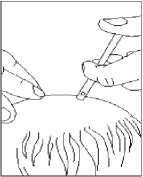
Verteilen Sie das Arzneimittel mit den Fingerspitzen über die gesamte zu behandelnde Kopfhautfläche. Beginnen Sie dabei in der Mitte der zu behandelnden Fläche.
Sie dürfen das Arzneimittel nicht auf anderen Körperteilen anwenden.
Hinweise zur Anwendung
Die Anwendung hängt vom jeweiligen Applikationssystem ab: Dosier-Tropfpipette oder Dosierpumpe mit Applikator.
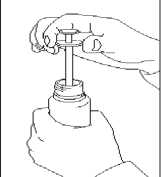
Dosier-Tropfpipette
Mit der Dosier-Tropfpipette lässt sich 1 ml Lösung genau abmessen und auf die gesamte zu behandelnde Fläche auftragen.
Dosierpumpe mit Applikator
Dieses Applikationssystem ist zur Anwendung auf kleinen Kopfhautflächen oder unter dem Haar geeignet.
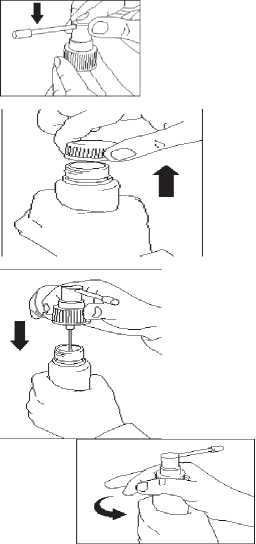
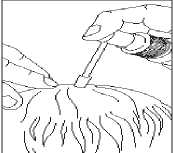
1. Applikator auf die Pumpe aufsetzen. Dazu Pumpe unten gut festhalten und gleichzeitig oben auf den Applikator drücken.
2. Verschlusskappe von der Flasche ganz abschrauben. Der weiße Originalitätsring soll dabei auf der Flasche bleiben.
3. Sprayvorrichtung mit aufgesetztem Applikator in die Flasche einführen und gut festschrauben.
4. Vor der ersten Anwendung Pumpe mehrmals betätigen, bis Flüssigkeit austritt. Das Applikationssystem ist nun einsatzbereit.
5. Anwendung: Applikatorspitze auf die Mitte der zu behandelnden Stelle oder unter das Haar richten, Pumpe einmal betätigen und die Lösung mit den Fingerspitzen verteilen.
Zur Applikation einer Dosis von 1 ml diesen Vorgang insgesamt 6-mal wiederholen.
Applikator nach jeder Anwendung mit warmem Wasser spülen.
Wenn Sie eine größere Menge von ALOPEXY 5 % angewendet haben, als Sie sollten
Bei bestimmungsgemäßem Gebrauch ist eine Überdosierung unwahrscheinlich. Bei einer Anwendung auf geschädigter Kopfhaut kann die Resorption des Wirkstoffes erhöht sein und es können Nebenwirkungen auftreten (siehe Abschnitt 2 Was sollten Sie vor der Anwendung von ALOPEXY 5 % beachten?).
Wenn Sie die Anwendung von ALOPEXY 5 % vergessen haben
Wenden Sie nicht die doppelte Dosis an, wenn Sie die vorherige Anwendung vergessen haben.
Setzen Sie die normale Anwendung fort: 1 Anwendung morgens, 1 Anwendung abends.
Wenn Sie die Anwendung von ALOPEXY 5 % abbrechen
Nicht zutreffend.
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann Alopexy 5 % Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Sehr häufig: kann mehr als 1 von 10 Behandelten betreffen:
Abnormes Haarwachstum (Hypertrichose) über die Anwendungsstelle hinaus, vor allem wenn das Arzneimittel von Frauen angewendet wird.
Kopfschmerzen.
Häufig: kann bis zu 1 von 10 Behandelten betreffen:
Lokale Hautreaktionen an der Anwendungsstelle, z. B. Reizungen mit Abschuppung toter Hautzellen (Desquamation), Juckreiz, Hautrötung, Hautentzündung, Hauttrockenheit, allergische Hautreaktion bedingt durch den Gehalt an Propylenglycol, entzündliche Hauterkrankungen, akneähnliche Pusteln, Schmerzen des Bewegungsapparates, Flüssigkeitsansammlungen im Gewebe (periphere Ödeme), Atembeschwerden und Depressionen.
Nicht bekannt: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar
Ohrinfektionen, Entzündung des Außenohrs, Entzündung der Nasenschleimhaut, Überempfindlichkeit, Nervenentzündung, Kribbelgefühl, gestörte Geschmacksempfindung, Brennen auf der Haut, Sehstörungen, Augenreizungen, Schwindel, Blutdruckabfall, erhöhte Pulsfrequenz, Schmerzen im Brustraum, Schwäche, Schwellungen im Gesichtsbereich (Gesichtsödem), Hautrötung (Erythem), Hautausschlag, Haarausfall, unregelmäßige Behaarung, Veränderung der Haarfarbe, Veränderung der Haarbeschaffenheit, Leberentzündung (Hepatitis) und Nierensteine.
In allen genannten Fällen ist die Behandlung abzubrechen und umgehend Ihr Arzt zu verständigen.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Sie können Nebenwirkungen auch direkt über das Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
anzeigen . Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist ALOPEXY 5 % aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Entflammbares Produkt
Sie dürfen ALOPEXY 5% nach dem auf der Flasche angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag im Monat.
Nach dem ersten Öffnen innerhalb von einem Monat verbrauchen.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
6. Inhalt der Packung und weitere Informationen
Was ALOPEXY 5 % enthält
Der Wirkstoff ist: Minoxidil Die sonstigen Bestandteile sind:
Propylenglycol, Ethanol (96%), gereinigtes Wasser.
Wie ALOPEXY 5 % aussieht und Inhalt der Packung
Bei diesem Arzneimittel handelt es sich um eine Lösung zum Anwenden auf der Haut. 60 ml Flasche mit Dosier-Tropfpipette. Umkarton mit 3 Flaschen.
60 ml Flasche mit Dosier-Tropfpipette und Dosierpumpe mit Applikator.
Umkarton mit 3 Flaschen.
Pharmazeutischer Unternehmer
Pierre Fabre Dermo-Kosmetik GmbH Jechtinger Str. 13 D-79111 Freiburg
Hersteller
PIERRE FABRE MEDICAMENT PRODUCTION 45 place Abel Gance F-92100 BOULOGNE Frankreich
Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:_
|
Belgien, Deutschland, Frankreich, Griechenland, Luxemburg, Österreich, Polen, Rumänien, Spanien: |
Alopexy |
|
Italien: |
Trefostil |
|
Portugal: |
Alorexyl |
Diese Packungsbeilage wurde zuletzt überarbeitet im Februar 2014
6