Atg-Fresenius S
alt informationen1.
BEZEICHNUNG DES ARZNEIMITTELS
ATG-Fresenius S 20 mg/ml Konzentrat zur Herstellung einer Infusionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 ml Konzentrat enthält 20 mg Anti-Human-T-Lymphozyten-Immunglobulin vom Kaninchen. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Konzentrat zur Herstellung einer Infusionslösung. Klares bis opaleszent gelbes Konzentrat.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
ATG-Fresenius S ist indiziert in Kombination mit anderen Immunsuppressiva zur Unterdrückung immunkompetenter Zellen, die eine akute Abstoßung oder eine Graft-versus-Host-Erkrankung (GVHD) verursachen. Das Arzneimittel wird in der Regel in folgenden Anwendungsgebieten eingesetzt:
Prävention einer akuten Transplantatabstoßung bei Empfängern allogener Organtransplantate ATG-Fresenius S ist indiziert in Kombination mit anderen Immunsuppressiva (z. B. Glukokortikosteroide, Purinantagonisten, Calcineurin-Inhibitoren oder mTOR-Hemmer) zur Verstärkung der Immunsuppression nach allogenen Organtransplantationen.
Behandlung einer akuten steroidresistenten Abstoßung nach allogener Organtransplantation ATG-Fresenius S ist indiziert zur Behandlung akuter steroidresistenter Abstoßungsepisoden nach allogener Organtransplantation, wenn sich die therapeutische Wirkung einer Behandlung mit Methylprednisolon als unzureichend erwiesen hat.
Prävention der Graft-versus-Host-Erkrankung (GVHD) bei Stammzelltransplantation (SCT) bei Erwachsenen
ATG-Fresenius S ist indiziert zur Prävention der Graft-versus-Host-Erkrankung (GVHD) in Kombination mit Standardprophylaxe Cyclosporin A / Methotrexat bei SCT mit HLA-kompatiblen, nicht-verwandten Spendern bei Erwachsenen mit hämatologischen Erkrankungen.
4.2 Dosierung und Art der Anwendung
ATG-Fresenius S soll ausschließlich von Ärzten verordnet werden, die über entsprechende Erfahrungen in der Anwendung von Immunsuppressiva verfügen. ATG-Fresenius S muss unter entsprechend qualifizierter ärztlicher Aufsicht verabreicht werden.
Dosierung
Die Dosis von ATG-Fresenius S ist indikationsabhängig. Die Dosierungsempfehlungen sind auf das Körpergewicht (KG) bezogen.
Prävention einer akuten Transplantatabstoßung bei Empfängern allogener Organtransplantate Der empfohlene Dosisbereich beträgt 2 bis 5 mg/kg KG/Tag ATG-Fresenius S. Am häufigsten werden Dosierungen zwischen 3 und 4 mg/kg KG/Tag eingesetzt. Mit der Therapie ist am Transplantationstag prä-, intra- oder unmittelbar postoperativ zu beginnen. In Abhängigkeit vom Zustand des Patienten, der gewählten
Tagesdosis und der gleichzeitig eingesetzten weiteren Immunsuppressiva liegt die empfohlene Dauer der Anwendung zwischen 5 und 14 Tagen.
Behandlung einer akuten steroidresistenten Abstoßung nach allogener Organtransplantation Der empfohlene Dosisbereich beträgt 3 bis 5 mg/kg KG/Tag ATG-Fresenius S. Am häufigsten werden Dosierungen zwischen 3 und 4 mg/kg KG/Tag eingesetzt. Die Dauer der Anwendung richtet sich nach dem Zustand des transplantierten Organs und dem klinischen Ansprechen und liegt in der Regel zwischen 5 und 14 Tagen.
Prävention der Graft-versus-Host-Erkrankung (GVHD) bei Stammzelltransplantation bei Erwachsenen Im Rahmen eines myeloablativen Konditionierungsschemas bei SCT beträgt die empfohlene Dosierung 20 mg/kg KG/Tag ATG-Fresenius S, üblicherweise von Tag -3 bis Tag -1 vor SCT.
Art der Anwendung
Bei ATG-Fresenius S handelt es sich um ein hypotones Konzentrat zur Herstellung einer Infusionslösung mit einem pH-Wert von 3,7 ± 0,3, das nicht direkt appliziert werden kann. Bevor das Arzneimittel dem Patienten intravenös verabreicht werden kann, muss das Konzentrat in 9 mg/ml (0,9 %iger) Kochsalzlösung verdünnt werden. Ein Verdünnungsverhältnis von 1:7 wird empfohlen (pro 1 ml ATG-Fresenius S sollte 6 ml Kochsalzlösung zugegeben werden) um die erforderliche Osmolalität zu gewährleisten. Bei größeren Verdünnungen und dadurch höherem pH-Wert der Infusionslösung kann es zu Partikelbildung kommen. Lösungen, die sichtbare Partikel enthalten, dürfen nicht verwendet werden.
Bei Organtransplantationen liegt die Standard-Infusionsdauer bei 4 Stunden. Bei intraoperativer Verabreichung wird in der Regel über 0,5 bis 2 Stunden infundiert. In der Stammzelltransplantation wird eine Infusionsdauer von 4 bis 12 Stunden empfohlen.
Während der Verabreichung ist der Patient engmaschig auf Symptome einer Überempfindlichkeitsreaktion oder Anaphylaxie zu überwachen. Die erste Gabe von ATG-Fresenius S ist in den ersten 30 Minuten mit einer reduzierten Infusionsgeschwindigkeit zu verabreichen. Wenn es zu keinen Unverträglichkeitserscheinungen kommt, kann die Infusionsrate erhöht werden. Für den Fall einer anaphylaktischen oder anaphylaktoiden Reaktion muss der zuständige Arzt umgehend auf das Ereignis reagieren können, und es muss ggf. unverzüglich eine entsprechende Therapie eingeleitet werden.
Alternativ zur Infusion über einen zentralen Venenkatheter kann für die Verabreichung auch eine großkalibrige periphere Vene mit hoher Flussrate gewählt werden. Zur Verbesserung der systemischen und lokalen Verträglichkeit empfiehlt sich vor der Infusion die Gabe von Methylprednisolon und/oder Antihistaminika. Neben Beachtung der üblichen hygienischen Kautelen an der Injektionsstelle ist ggf. auch eine Verminderung der Infusionsgeschwindigkeit und/oder der Wechsel des venösen Gefäßzugangs in Erwägung zu ziehen.
Heparin-Natrium darf weder der ATG-Fresenius S Infusionslösung zugemischt noch über dasselbe Infusionsbesteck verabreicht werden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
ATG-Fresenius S ist kontraindiziert bei Patienten mit therapeutisch nicht ausreichend beherrschten bakteriellen, viralen, parasitären oder mykotischen Infektionen.
ATG-Fresenius S ist kontraindiziert bei Empfängern von Organtransplantaten mit schwerer Thrombozytopenie, d. h. weniger als 50.000 Thrombozyten/pl, weil das Arzneimittel eine Thrombozytopenie weiter verstärken und so das Blutungsrisiko erhöhen kann.
ATG-Fresenius S ist kontraindiziert bei Patienten mit malignen Tumoren, außer wenn im Rahmen der Behandlung eine Stammzelltransplantation durchgeführt wird.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Behandlung mit ATG-Fresenius S darf nur in Einrichtungen erfolgen, die über die für die Notfallbehandlung erforderliche apparative und personelle Ausstattung einschließlich entsprechender unterstützender medizinischer Ressourcen verfügen. ATG-Fresenius S muss unter entsprechend qualifizierter ärztlicher Aufsicht verabreicht und überwacht werden.
Überempfindlichkeitsreaktionen
Bei der Verabreichung von ATG-Fresenius S wurde über Überempfindlichkeitsreaktionen berichtet.
Vor der Erstanwendung von ATG-Fresenius S empfiehlt es sich, abzuklären, ob bei dem Patienten eine anamnestisch bekannte allergische Disposition, insbesondere gegenüber Kaninchenproteinen, vorliegt.
Bei erneuter Exposition in Form einer erneuten Therapie mit ATG-Fresenius S oder einer Behandlung mit Kaninchen-Immunglobulinpräparaten anderer Hersteller ist infolge einer möglichen Sensibilisierung während der früheren Therapie das Risiko der Entwicklung einer anaphylaktischen Reaktion erhöht.
Schwere Thrombozytopenie
Bei Empfängern von Organtransplantaten, bei denen sich eine schwere Thrombozytopenie (d. h. weniger als 50.000 Thrombozyten/^l) entwickelt, ist die Behandlung mit ATG-Fresenius S zu unterbrechen oder abzusetzen, weil das Arzneimittel eine Thrombozytopenie weiter verstärken und so das Blutungsrisiko erhöhen kann. Notfallbereitschaft seitens der Klinikmitarbeiter muss gegeben sein.
Lebererkrankungen
Bei Patienten mit Lebererkrankungen ist bei der Anwendung von ATG-Fresenius S besondere Vorsicht geboten. Vorbestehende Gerinnungsstörungen können sich verschlechtern. Es empfiehlt sich eine sorgfältige Überwachung der Thrombozytenzahl und Gerinnungsparameter.
Herz-Kreislauf-Erkrankungen
Bei Patienten mit bekannten Herz-Kreislauf-Erkrankungen oder Verdacht darauf ist bei der Anwendung von ATG-Fresenius S besondere Vorsicht geboten. Bei Patienten mit Hypotonie oder kardialer Dekompensation mit orthostatischen Symptomen (z. B. Bewusstseinsverlust, Schwäche, Erbrechen, Übelkeit) ist eine Verlangsamung/Unterbrechung der Infusion in Erwägung zu ziehen.
Infektionen
Unter einer immunsuppressiven Therapie ist das Infektionsrisiko generell erhöht. Bei mit ATG-Fresenius S behandelten Patienten besteht ein erhöhtes Risiko für die Entwicklung bakterieller, viraler, parasitärer und/oder mykotischer Infektionen. Entsprechende Überwachungs- und Therapiemaßnahmen sind indiziert. Bei Patienten, die sich einer Stammzelltransplantation unterziehen, werden eine Überwachung des CMV-und EBV-Status sowie eine entsprechende präemptive Therapie empfohlen.
Impfungen
Die Patienten sind darüber zu informieren, dass Impfungen mit Totvakzinen während der Behandlung mit ATG-Fresenius S unter Umständen weniger wirksam sind. Eine Impfung mit attenuierten Lebendviren ist bei immunsupprimierten Patienten kontraindiziert.
Warnhinweis zu übertragbaren Erregern
Zu den Standardmaßnahmen zur Verhinderung von Infektionen infolge der Anwendung von Arzneimitteln, bei deren Herstellung humane Komponenten eingesetzt werden, gehört neben einer sorgfältigen Spenderauswahl und der Untersuchung der einzelnen Spenden auf bestimmte Infektionsmarker auch eine Reihe effektiver Herstellungsschritte zur Inaktivierung bzw. Abreicherung von Viren. Dennoch kann bei Verabreichung von Arzneimitteln, bei deren Herstellung humane Komponenten eingesetzt werden, die Möglichkeit einer Übertragung infektiöser Erreger nie völlig ausgeschlossen werden. Dies gilt auch für bislang nicht bekannte oder gerade erst neu entdeckte Viren und andere Erreger. Die bei ATG-Fresenius S durchgeführten Maßnahmen gelten gegen umhüllte Viren wie das Humane Immundefizienzvirus (HIV), das Hepatitis B-Virus (HBV) und das Hepatitis C-Virus (HCV) sowie gegen nicht umhüllte Viren wie das Hepatitis A-Virus und Parvovirus B19 als wirksam.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt.
Immunsuppressiva
Neben ATG-Fresenius S werden routinemäßig weitere Immunsuppressiva gleichzeitig verabreicht. Zwischen ATG-Fresenius S und Kortikosteroiden, Purinantagonisten, Calcineurin-Inhibitoren oder mTOR-Hemmern wurden keine direkten Wechselwirkungen beobachtet. Allerdings kann die gleichzeitige Verabreichung dieser Arzneimittel das Risiko für Infektionen, Thrombozytopenie und Anämie erhöhen. Daher sind Patienten unter einer kombinierten immunsuppressiven Therapie sorgfältig zu überwachen; zudem empfiehlt sich eine entsprechende Anpassung des Therapieschemas.
Impfungen
Eine Impfung mit attenuierten Lebendviren ist bei immunsupprimierten Patienten kontraindiziert. Die Antikörperantwort auf andere Impfungen kann vermindert sein (siehe Abschnitt 4.4).
4.6 Fertilität, Schwangerschaft und Stillzeit
Tierexperimentelle Daten sind nicht verfügbar. Klinische Daten bei Schwangeren und Stillenden liegen ebenfalls nicht vor.
Schwangerschaft
Das potentielle Risiko für den Fötus ist nicht bekannt. Bei der Anwendung in der Schwangerschaft ist Vorsicht geboten.
Stillzeit
Zumindest humanes Immunglobulin ist potentiell plazentagängig und kann beim Menschen außerdem in die Muttermilch übergehen. Daher ist die Entscheidung zur Behandlung Schwangerer und stillender Mütter vom behandelnden Arzt auf der Grundlage einer Nutzen-Risiko-Beurteilung zu treffen.
Fertilität
Daten zur Fertilität sind nicht verfügbar.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nicht zutreffend.
4.8 Nebenwirkungen
ATG-Fresenius S ist ein Immunglobulinpräparat mit immunsupprimierenden Eigenschaften. Zu den gut bekannten klassenbedingten Nebenwirkungen gehören auf die Zytokinfreisetzung zurückzuführende Symptome, Überempfindlichkeitsreaktionen wie Anaphylaxie und weitere allergische Erscheinungen, erhöhte Infektionsanfälligkeit und das Auftreten von Malignomen.
Art und Häufigkeit der in diesem Abschnitt beschriebenen unerwünschten Wirkungen wurden in einer integrierten Sicherheitsanalyse zu 6 klinischen Studien mit insgesamt 242 Patienten in den Indikationen Prävention einer Abstoßung bei Nierentransplantatempfängern (136 Patienten) und Konditionierung vor allogener Stammzelltransplantation (106 Patienten) ausgewertet. Bei ca. 94 % der ausgewerteten Patienten kam es zumindest zu einer unerwünschten Wirkung. Das Muster der unerwünschten Wirkungen spiegelt in Teilen die typischerweise nach dem jeweiligen Eingriff - Nierentransplantation (Harnwegsinfekt, Nierenversagen) und Stammzelltransplantation (Panzytopenie, Mukositis) - häufig auftretenden Komplikationen wider.
In der nachfolgenden Tabelle sind die unter ATG-Fresenius S berichteten unerwünschten Wirkungen nach Häufigkeit und Organsystemklasse aufgeführt und klassifiziert. Die Häufigkeitsangaben sind nach folgender Konvention definiert:
sehr häufig (> 1/10), häufig (> 1/100, < 1/10), gelegentlich (> 1/1.000, < 1/100).
Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Unter ATG-Fresenius S aufgetretene unerwünschte Wirkungen
|
Erkrankungen des Blutes und des Lymphsystems | |
|
Häufig |
Panzytopenie**, Thrombozytopenie, Anämie, Leukopenie |
|
Gelegentlich |
Polyzythämie |
|
Herzerkrankungen | |
|
Häufig |
Tachykardie |
|
Augenerkrankungen | |
|
Häufig |
Photophobie |
|
Erkrankungen des Gastrointestinaltrakts | |
|
Sehr häufig |
Erbrechen, Übelkeit, Durchfall, Bauchschmerzen |
|
Häufig |
Stomatitis |
|
Gelegentlich |
Refluxösophagitis, Dyspepsie |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |
|
Sehr häufig |
Fieber**, Schüttelfrost |
|
Häufig |
Asthenie, Schmerzen in der Brustgegend, Hyperthermie, Schleimhautentzündung, peripheres Ödem |
|
Gelegentlich |
Ödem |
|
Leber- und Gallenerkrankungen | |
|
Häufig |
Hyperbilirubinämie |
|
Erkrankungen des Immunsystems | |
|
Häufig |
Anaphylaktischer Schock**, anaphylaktische Reaktion, Überempfindlichkeit |
|
Infektionen und parasitäre Erkrankungen | |
|
Sehr häufig |
CMV-Infektion*, Harnwegsinfektion* |
|
Häufig |
Bakterielle Sepsis**, Pneumonie**, Pyelonephritis*, Herpesinfektion, Grippe, orale Candidose, Bronchitis, Rhinitis, Sinusitis, Nasopharyngitis, Hautinfektion |
|
Gelegentlich |
Infektion an der Kathetereinführungsstelle, Epstein-Barr-Virus-Infektion, Infektion des Gastrointestinaltrakts, Erysipel, Wundinfektion |
|
Untersuchungen | |
|
Häufig |
Anstieg der Kreatininkonzentration im Blut*, positiver Cytomegalievirus-Antigennachweis, Anstieg des C-reaktiven Proteins |
|
Gelegentlich |
Anstieg der Leberenzyme |
|
Stoffwechsel- und Ernährungsstörungen | |
|
Häufig |
Hyperlipidämie |
|
Gelegentlich |
Flüssigkeitsretention, Hypercholesterinämie |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | |
|
Häufig |
Myalgie, Arthralgie, Rückenschmerzen, Muskelsteifheit |
|
Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen) | |
|
Häufig |
Lymphoproliferative Erkrankung* |
|
Erkrankungen des Nervensystems | |
|
Sehr häufig |
Kopfschmerzen, Tremor |
|
Häufig |
Parästhesien |
|
Erkrankungen der Nieren und Harnwege | |
|
Häufig |
Nierentubulusnekrose*, Hämaturie |
|
Gelegentlich |
Nierenversagen**, Nierennekrose* |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums | |
|
Sehr häufig |
Dyspnoe |
|
Häufig |
Husten, Epistaxis |
|
Erkrankungen der Haut und des Unterhautzellgewebes | |
|
Häufig |
Erythem, Pruritus, Rash |
|
Gelegentlich |
Arzneimittelexanthem |
|
Gefäßerkrankungen | |
|
Sehr häufig |
Flush |
|
Häufig |
Blutdruckabfall*, Venenverschlusskrankheit, Blutdruckanstieg |
|
Gelegentlich |
Schock**, Lymphozele |
* schwerwiegende Reaktion
** schwerwiegende Reaktion, in Einzelfällen mit tödlichem Verlauf
Unerwünschte Wirkungen von besonderem Interesse Mit der Zytokinfreisetzung zusammenhängende Symptome
Zu den auf die Freisetzung von Zytokinen zurückzuführenden Reaktionen gehören Fieber, Schüttelfrost, Kopfschmerzen, Übelkeit, Erbrechen, Tachykardie und Veränderungen der Kreislaufregulation. Diese Reaktionen können klinisch unter dem Begriff Zytokinfreisetzungssyndrom zusammengefasst werden. Sie werden unter oder nach der Verabreichung von ATG-Fresenius S häufig beobachtet. Die Symptome sind in der Regel gut handhabbar. Eventuell kann zur Linderung der Symptome eine vorbeugende Medikation verabreicht werden.
Überempfindlichkeitsreaktionen
Reaktionen wie Flush, Hautausschlag, Erythem, Ödem, Dyspnoe mit oder ohne Bronchospasmus und Husten werden unter und nach der Verabreichung häufig beobachtet. Diese Reaktionen sprechen in der Regel gut auf eine Behandlung an. Durch Gabe einer entsprechenden prophylaktischen Medikation lassen sich diese Symptome abschwächen. Das Auftreten einer Anaphylaxie/eines anaphylaktischen Schocks erfordert den sofortigen Abbruch der Infusion. Die bei langer Behandlungsdauer und niedrigerer Dosierung von ATG-Fresenius S zu beobachtende Serumkrankheit ist nur selten schwer und spricht in der Regel auf eine symptomatische Behandlung gut an.
Blutbildveränderungen
Vorübergehende Veränderungen der Thrombozyten- und Leukozytenzahl - auch als Thrombozytopenie bzw. Leukopenie bekannt - werden nach ATG-Fresenius S Gabe häufig beobachtet. Auch eine Anämie wird nach Verabreichung von ATG-Fresenius S häufig beobachtet.
Infektionen
Bei den mit immunsupprimierenden Regimen behandelten Patienten besteht eine erhöhte Infektionsanfälligkeit. Im ersten Jahr nach einer Organtransplantation kam es bei den meisten Patienten, die ATG-Fresenius S erhielten, zu bakteriell, viral oder mykotisch bedingten Infektionen. Bakterielle Infektionen manifestieren sich sehr häufig als Harnwegsinfekte; virale Infektionen werden sehr häufig vom Cytomegalievirus (CMV) verursacht. Zu den häufig berichteten Infektionen gehören bakterielle Sepsis, bakterielle Pneumonie, Pyelonephritis, Herpesvirus-Infektionen und orale Candidosen. EBV-Infektionen, CMV-Pneumonie und CMV-Gastroenteritis sind gelegentlich berichtete virale Infektionen. Bei der systemischen Candidose handelt es sich um eine gelegentlich beobachtete mykotische Infektion. Die meisten Infektionen lassen sich mit einer entsprechenden Behandlung in der Regel beherrschen. Es liegen Einzelfallmeldungen über lebensbedrohliche oder sogar tödlich verlaufene Infektionen vor. Durch eine entsprechende Überwachung und vorbeugende Behandlung kann die Infektionsrate gesenkt werden.
Malignome
Die Inzidenz der nach der Behandlung mit ATG-Fresenius S aufgetretenen malignen Erkrankungen ist in allen Studien und Publikationen generell gering und mit der Häufigkeit vergleichbar, die unter anderer Kombinationstherapie mit Immunsuppressiva beobachtet wird. Lymphoproliferative Erkrankungen nach Transplantation wurden ausschließlich bei Patienten beobachtet, die allogen stammzelltransplantiert worden waren (1,7 %).
Weitere medizinisch bedeutsame Reaktion
Selten (bei weniger als 1 von 1.000 Patienten) wurde im Zusammenhang mit der ATG-Fresenius S Gabe über Hämolyse berichtet, die in Einzelfällen zum Tode führten.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung beim
Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Str. 5159, 63225 Langen, Tel: +49 6103 77 0, Fax: +49 6103 77 1234, Website: www.pei.de, anzuzeigen.
4.9 Überdosierung
Bei einer Überdosierung empfiehlt sich die sofortige Gabe von Breitbandantibiotika, Antimykotika und Virostatika. Die Behandlung mit ATG-Fresenius S muss abgesetzt werden, und die Dosierung aller übrigen gleichzeitig eingesetzten Immunsuppressiva ist entsprechend dem Blutbild (insbesondere der Leukozyten- und Lymphozytenzahl) anzupassen. Die Thrombozytenzahl muss engmaschig kontrolliert werden; ggf. ist eine Substitutionstherapie einzuleiten.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: spezifische Immunsuppressiva, ATC-Code: L04AA04.
Bei ATG-Fresenius S handelt es sich um ein polyklonales Anti-Human-T-Lymphozyten-Immunglobulin, das aus Kaninchen gewonnen wird, die mit Jurkat-Zellen, einer humanen lymphoblastoiden Zelllinie, immunisiert werden. Die Expression von T-Zellmarkern auf Jurkat-Zellen entspricht den Wirkungen von ATG-Fresenius S auf Lymphozyten. In ATG-Fresenius S wurden Antikörper gegen weitere Oberflächenantigene der Jurkat-Zellen nachgewiesen.
Bei einer Analyse von Lymphozytenuntergruppen bei Patienten, die ATG-Fresenius S erhielten, zeigte sich eine Abnahme derjenigen Lymphozytenuntergruppen, die von der Jurkat-Zelllinie exprimierte Oberflächenproteine tragen.
ATG-Fresenius S wirkt gegen menschliche Lymphozyten zytotoxisch. Nach vorliegenden Daten sind aktivierte Lymphozyten hierfür anfälliger.
ATG-Fresenius S bewirkte keine Aktivierung von T-Zellen (über CD3) oder Lymphozyten, sondern hemmte die Aktivierung von T-Zellen durch einen gegen CD3 gerichteten Antikörper.
ATG-Fresenius S verminderte die Migration humaner Melanomzellen durch Bindung an Adhäsionsmoleküle.
Antiadhäsive Eigenschaften (Anti-LFA-1- und Anti-ICAM-1-Aktivität) könnten die Feststellung erklären, dass bei Zugabe von ATG-Fresenius S der renale Gefäßwiderstand gesenkt und die Lymphozytenretention in der Niere vermindert wurden, wenn Schweinenieren mit humanen Lymphozyten perfundiert wurden, die mit bzw. ohne ATG-Fresenius S inkubiert worden waren.
Bei Rhesusaffen verlängerte ATG-Fresenius S die Überlebenszeit von Hauttransplantaten. In diesem Modell lag offenkundig eine Immunsuppression vor, und es wurden eine Leukopenie und Lymphopenie beobachtet. Bei Cynomolgusaffen entfaltete ATG-Fresenius S durch Hemmung der Adhäsion von Lymphozyten und neutrophilen Granulozyten eine günstige Wirkung auf die Ischämie-/Reperfusionsschädigung.
Bei nierentransplantierten Patienten, die mit ATG-Fresenius S nach dem Standardtherapieschema behandelt wurden, nahmen die Leukozyten- und Thrombozytenzahlen zwar ab, kehrten aber innerhalb von 10 Tagen nach der Transplantation wieder auf Normalwerte zurück. Auch die Zahl der Lymphozyten sowie die Zahlen von Lymphozyten-Unterpopulationen gingen signifikant zurück. So wurden Abnahmen der CD2-, CD3-, CD4- und CD8-Zahlen beobachtet. Während die CD8-Zahl innerhalb der ersten 20 postoperativen Tage in den Normalbereich zurückkehrte, war dies bei den CD2-, CD3- und CD4-Zahlen nicht der Fall.
Die beschriebene Wirkung der Standardtherapie mit ATG-Fresenius S auf die LymphozytenUnterpopulationen sowie eine bis zu 66 Monate lang anhaltende Umkehr des CD4/CD8-Quotienten wurden bei Nierentransplantierten berichtet.
Nach Gabe einer hohen Einzeldosis von 9 mg/kg KG ATG-Fresenius S stiegen TNF-a und IL-10 an, während IL12p40 geringfügig abnahm und IL-12p70 nicht stimuliert wurde.
Studie in Stammzelltransplantation
In einer Studie zur Stammzelltransplantation mit HLA-kompatiblen, nicht-verwandten Spendern konnte gezeigt werden, dass die Inzidenz der akuten GVHD (aGVHD), der chronischen GVHD (cGVHD) und der Sterblichkeit aufgrund von GVHD in Patienten, die ATG-Fresenius S zusätzlich zur Standardprophylaxe erhielten, niedriger war im Vergleich zu Patienten, die nur GVHD-Standardprophylaxe erhielten. Die vorliegenden Ergebnisse wurden in einem Beobachtungszeitraum von zwei Jahren nach Transplantation erhoben.
Methoden
Die Studie war eine prospektive, offene, randomisierte, multizentrische Phase-III-Studie, die an 31 Zentren in 10 europäischen Ländern durchgeführt wurde und in die 202 erwachsene Patienten mit hämatologischen Erkrankungen eingeschlossen wurden. Eine Gruppe (98 Patienten) erhielt Standardprophylaxe mit Cyclosporin und Methotrexat, die andere Gruppe (103 Patienten) erhielt darüber hinaus an drei Tagen direkt vor der Stammzelltransplantation jeweils 20 mg/kg ATG-Fresenius S. Die Transplantation erfolgte nach myeloablativer Konditionierung der Patienten. Die Transplantate stammten von HLA-kompatiblen, nichtverwandten Spendern. Die Transplantate wurden in 18% (37 Patienten) aus dem Knochenmark und in 82% (164 Patienten) aus dem peripheren Blut der Spender gewonnen. Als primärer Endpunkt war „frühes Versagen der Behandlung“ gewählt worden, definiert als aGVHD Grad III-IV oder Versterben des Patienten innerhalb von 100 Tage nach der Transplantation.
Ergebnisse
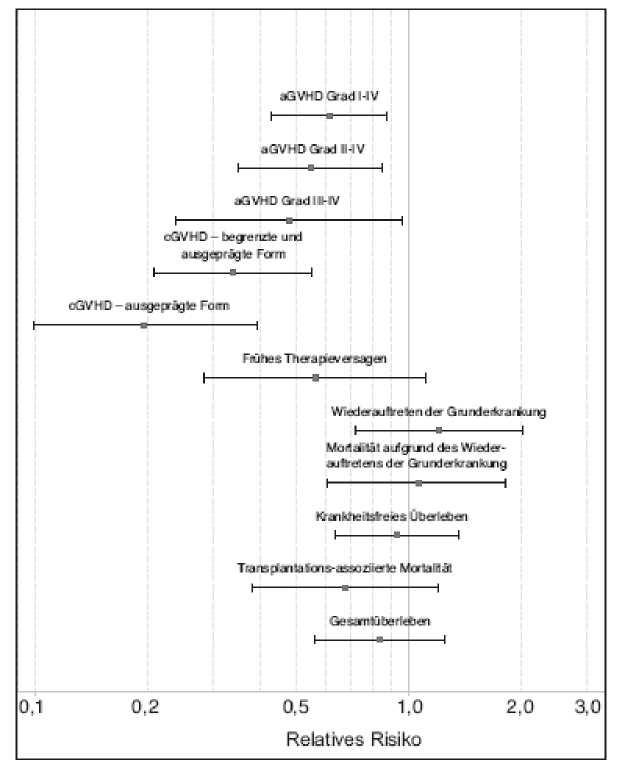
Die zusätzliche Gabe von ATG-Fresenius S zur Standardprophylaxe führte zu einer erniedrigten Inzidenz aller Formen der GVHD: aGVHD (Grad I-IV, II-IV und III-IV) sowie chronische GVHD (begrenzte und ausgeprägte Form). Keine Unterschiede ergaben sich zwischen den Behandlungsgruppen bzgl. Wiederauftreten der Grunderkrankung, transplantationsassoziierter Mortalität oder Gesamtüberleben.
Primärer Endpunkt: Die Inzidenz für das frühe Therapieversagen war 21,4% im Vergleich zu 34,7% in der Kontrollgruppe (adjusted odds ratio 0.56, CI [0.28-1.11]; p= 0.0983). Die kumulierte Inzidenz von aGVHD (Grad III-IV) war 11,7% in der ATG-Fresenius S - Gruppe im Vergleich zu 25,5% in der Kontrollgruppe (adjusted hazard ratio [HR] 0.48, CI [0.24-0.96]; p=0.0392), von aGVHD Grad II-IV war 33,0% in der ATG-Fresenius S - Gruppe im Vergleich zu 52,0% (adjusted HR 0.55, CI [0.35-0.85]; p=0.0077) in der Kontrollgruppe.
Im Nachbeobachtungszeitraum von 2 Jahren nach Transplantation wurde für die ausgeprägte Form der cGVHD mit ATG-Fresenius S eine Inzidenz von 12,2% gefunden im Vergleich zu 45,0%; (adjusted HR 0.196, CI [0.10-0.39]; p<0.0001) in der Kontrollgruppe ohne ATG-Fresenius S - Prophylaxe.
Bild 1 Darstellung des relativen Risikos der ATG-Fresenius S - Prophylaxe im Vergleich zur
Kontrollgruppe ohne ATG-Fresenius S bzgl. der primären und sekundären Wirksamkeitsparameter (Punktschätzer und 95% CI)
5.2 Pharmakokinetische Eigenschaften
ATG-Fresenius S wird intravenös verabreicht und ist daher zu 100 % bioverfügbar.
ATG-Fresenius S unterliegt - wie andere körpereigene Proteine - dem Proteinmetabolismus.
Die Halbwertszeit von ATG-Fresenius S beträgt ca. 14 Tage (bei einer Dosierung von 4 mg/kg KG/Tag über 7 Tage). Sie schwankt je nach Dosis und Dauer der Anwendung zwischen 4 und 45 Tagen.
Nach literaturbekannten Untersuchungen wurden T-Zell-spezifische Antikörper rascher als die Kaninchen-Gesamt-IgG-Fraktion eliminiert.
Daten zur Pharmakokinetik liegen aus den toxikokinetischen Abschnitten der toxikologischen Untersuchungen vor. ATG-Fresenius S wird rasch resorbiert und langsam eliminiert. Die systemische Exposition war in allen Dosisstufen dosisproportional, nahm bei wiederholter Verabreichung zu und wies dabei keine Unterschiede zwischen den Geschlechtern auf. Mit Prednisolon wurden keine Arzneimittelwechselwirkungen beobachtet.
5.3 Präklinische Daten zur Sicherheit
Im Rahmen vorklinischer toxikologischer Untersuchungen wurde ATG-Fresenius S in Einzeldosisstudien bei Kaninchen, Cynomolgus- und Rhesusaffen sowie in Studien mit wiederholter Verabreichung bei Rhesusaffen geprüft. ATG-Fresenius S wurde gut vertragen. Einige der beobachteten Wirkungen sind auf die spezifische pharmakodynamische Aktivität von ATG-Fresenius S zurückzuführen; diese bewirkt eine Immunsuppression und eine ausgeprägte Abnahme der Lymphozytenzahl, vor allem der T-Lymphozyten. In hohen Dosen (250 bis 300 mg/kg KG) wurden bei Rhesusaffen anaphylaktische Reaktionen beobachtet. Bei gleichzeitiger Prednisolon-Gabe verminderte sich die Toxizität von ATG-Fresenius S. So wurde keine Serumkrankheit beobachtet, und es kam im Vergleich zur alleinigen Gabe von ATG-Fresenius S zu einer deutlichen Verbesserung der klinischen Zeichen.
In einer sicherheitspharmakologischen Untersuchung an Katzen wurden keine Wirkungen auf das ZNS, Herz-Kreislauf- oder Atmungssystem beobachtet.
Es wurden weder eine genotoxische Aktivität noch lokale Reizungen noch gegen die glomeruläre Basalmembran gerichtete Antikörper beobachtet. Kanzerogenitäts- oder reproduktionstoxikologische Untersuchungen wurden nicht durchgeführt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Natriumdihydrogenphosphat-Dihydrat Phosphorsäure (85 %) (zur Einstellung des pH-Werts)
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
ATG-Fresenius S Konzentrat zur Herstellung einer Infusionslösung darf nicht mit Glukose, Blut, Blutderivaten, lipidhaltigen Lösungen oder Heparin-Natrium gemischt werden.
6.3 Dauer der Haltbarkeit
2 Jahre
Bei Raumtemperatur konnte eine chemische und physikalische Gebrauchsstabilität der verdünnten Lösung von 24 Stunden nachgewiesen werden. Aus mikrobiologischer Sicht jedoch sollte das verdünnte Produkt unverzüglich verwendet werden. Falls dieses nicht sofort verwendet wird, ist der Anwender für die Dauer und die Bedingungen der Aufbewahrung bis hin zur Anwendung verantwortlich.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (2 - 8 °C). Durchstechflasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Aufbewahrungsbedingungen nach Verdünnung des Arzneimittels, siehe Abschnitt 6.3.
Anleitung zur Herstellung und Verabreichung der gebrauchsfertig verdünnten Infusionslösung siehe Abschnitt 4.2.
6.5 Art und Inhalt des Behältnisses
Packung mit 1 oder 10 Durchstechflaschen mit jeweils 5 ml Lösung
Packung mit 1 oder 10 Durchstechflaschen mit jeweils 10 ml Lösung
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Fresenius Biotech GmbH Am Haag 6-7 82166 Gräfelfing Tel.: +49 (0)6172 608-2240
8. ZULASSUNGSNUMMER(N)
452a/87
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Zulassungserteilung: 02.02.1988
Datum der letzten Verlängerung der Zulassung: 13.08.2008
10. STAND DER INFORMATION
10/2013
Page 11 of11