Atropinsulfat Aguettant 1 Mg/5 Ml Injektionslösung In Einer Fertigspritze
Gebrauchsinformation: Information für Anwender
ATROPINSULFAT AGUETTANT 200 Mikrogramm/ml Injektionslösung in einer
Fertigspritze
Atropinsulfat (Ph. Eur.)
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
1. Was ist ATROPINSULFAT AGUETTANT und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von ATROPINSULFAT AGUETTANT beachten?
3. Wie ist ATROPINSULFAT AGUETTANT anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist ATROPINSULFAT AGUETTANT aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist ATROPINSULFAT AGUETTANT und wofür wird es angewendet?
Atropin gehört zu einer Gruppe von Arzneimitteln, die Anticholinergika genannt werden. Ein Anticholinergikum ist eine Substanz, die den Neurotransmitter Acetylcholin im zentralen und peripheren Nervensystem blockiert. Es wird in Notfallsituationen, wenn das Herz zu langsam schlägt, als Gegenmittel beispielsweise bei Vergiftungen mit phosphororganischen Insektiziden und bei Pilzvergiftungen angewendet.
Es kann als Teil einer Prämedikation vor einer Vollnarkose angewendet werden. Es kann auch angewendet werden, um den Nebenwirkungen anderer Arzneimittel vorzubeugen, die angewendet werden, um die Wirkungen von Muskelrelaxanzien nach einer Operation aufzuheben.
ATROPINSULFAT AGUETTANT 200 Mikrogramm/ml Injektionslösung in einer Fertigspritze ist nur für Erwachsene angezeigt.
2. Was sollten Sie vor der Anwendung von ATROPINSULFAT AGUETTANT beachten?
ATROPINSULFAT AGUETTANT darf nicht angewendet werden,
- wenn Sie allergisch gegen Atropin oder einen der in Abschnitt 6 genannten sonstigen Bestandteile dieses Arzneimittels sind,
- wenn Sie unter Harnwegsbeschwerden leiden,
- wenn bei Ihnen der Augeninnendruck erhöht ist (Glaukom),
- wenn Sie an einer Erkrankung der Speiseröhre (Achalasie der Speiseröhre), einem Darmverschluss (paralytischer Ileus) oder einer akuten Form von Dickdarmdehnung (toxisches Megakolon) leiden.
Diese Gegenanzeigen gelten nicht in lebensbedrohlichen Notfällen.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt, bevor ATROPINSULFAT AGUETTANT angewendet wird, wenn bei Ihnen eines der folgenden Krankheitsbilder vorliegt:
- Schilddrüsenüberfunktion,
- Prostataerkrankung,
- Herzinsuffizienz,
- Leber- oder Nierenerkrankung,
- bei einigen Herzerkrankungen,
- Magenerkrankungen, wie z. B. Pylorusstenose,
- chronische Bronchitis,
- Fieber,
- wenn Sie ein älterer Patient sind,
- eine spezielle schwere Muskelschwäche (Myasthenia gravis),
- Sodbrennen (Reflux).
Anwendung von ATROPINSULFAT AGUETTANT zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker wenn Sie andere Arzneimittel einnehmen, kürzlich andere Arzneimittel eingenommen haben oder beabsichtigen andere Arzneimittel einzunehmen:
- trizyklische Antidepressiva
- bestimmte Antihistaminika
- Arzneimittel zur Behandlung der Parkinson-Erkrankung
- Phenothiazine, Clozapin, Neuroleptika (Arzneimittel zur Behandlung psychischer Erkrankungen)
- Chinidin oder Disopyramid (zur Behandlung von Herzerkrankungen)
- Spasmolytika (krampflösende Arzneimittel zur Behandlung des Reizdarmsyndroms).
Schwangerschaft und Stillzeit
Wenn Sie schwanger sind oder stillen oder wenn Sie vermuten, schwanger zu sein, oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker um Rat.
Schwangerschaft
Begrenzte Daten zur Anwendung von Atropin bei schwangeren Frauen ergeben keine Hinweise auf unerwünschte Wirkungen auf die Schwangerschaft oder die Gesundheit des Fetus. Atropin passiert die Plazenta. Die intravenöse Anwendung von Atropin während der Schwangerschaft oder unter der Geburt kann zu einer schnelleren Herzfrequenz beim Fetus und bei der Mutter führen. Dieses Arzneimittel sollte während der Schwangerschaft nur nach sorgfältiger Abwägung von Nutzen und Risiken der Behandlung angewendet werden.
Stillzeit
Atropin kann in kleinen Mengen in die Muttermilch übergehen und Auswirkungen auf den Säugling haben. Atropin kann die Produktion der Muttermilch hemmen. Ihr Arzt wird den Nutzen des Stillens gegen den Nutzen der Behandlung abwägen. Das Stillen sollte unterbrochen werden, wenn die Entscheidung zu einer Anwendung der Behandlung beibehalten wird. Wenn jedoch entschieden wird, das Stillen während der Behandlung fortzusetzen, wird Ihr Arzt zusätzliche Untersuchungen beim Kind durchführen.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Atropin kann Verwirrtheit oder verschwommenes Sehen verursachen. Nach Erhalt einer Injektion dürfen Sie kein Fahrzeug führen oder Maschinen bedienen.
ATROPINSULFAT AGUETTANT enthält Natrium
aber weniger als 1 mmol (23 mg) Natrium pro Fertigspritze, d.h., es ist nahezu „natriumfrei“.
3. Wie ist ATROPINSULFAT AGUETTANT anzuwenden?
Ihr Arzt entscheidet über die für Sie richtige Dosierung und auch, wie und wann Sie die Injektion erhalten.
Die übliche Dosis beträgt:
Als Prämedikation vor einer Narkose
Erwachsene: 0,3-0,6 mg intravenös (i.v.) Anwendung unmittelbar vor der Operation; falls erforderlich, ist eine intramuskuläre Anwendung 30-60 Minuten vor der Operation möglich.
Zur Aufhebung der Wirkung von Muskelrelaxanzien:
Erwachsene: 0,6-1,2 mg intravenös mit Neostigmin.
Bei langsamem Herzschlag, Herzblock oder Herzstillstand:
Erwachsene:
- Sinusbradykardie (langsamer Puls): 0,5 mg intravenös, alle 2-5 Minuten bis die gewünschte Herzfrequenz erreicht ist.
- AV-Block (Blockade der Erregungsleitung zwischen Herzvorhof und Herzkammer): 0,5 mg intravenös, alle 3-5 Minuten (maximal 3 mg)
Als Gegenmittel zu Organophosphaten (Insektizide, Nervengas), zu Cholinesterase-Hemmern und bei Vergiftung mit muskarinergen Pilzen:
Erwachsene: 0,5-2 mg intravenös in Abhängigkeit von den Eigenschaften und dem Ansprechen des Patienten, dies kann nach 5 Minuten wiederholt werden und anschließend je nach Bedarf.
Diese Injektionslösung wird Ihnen von einem Arzt oder von medizinischem Fachpersonal verabreicht. Es ist unwahrscheinlich, dass Sie zu viel Atropin erhalten. Wenn Sie der Meinung sind, dass Sie zu viel Atropin erhalten haben, Ihr Herz sehr schnell schlägt, wenn
Sie schnell atmen, erhöhte Temperatur haben, sich unruhig oder verwirrt fühlen, Halluzinationen haben oder Ihr Koordinationsvermögen verlieren, müssen Sie dies der jeweiligen Person mitteilen, die Ihnen die Injektion verabreicht.
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Die Nebenwirkungen sind abhängig von der Dosis, die Sie erhalten, und verschwinden in der Regel, wenn die Behandlung eingestellt wird.
In seltenen Fällen kann sich eine allergische Reaktion entwickeln. Diese kann Hautausschläge, starken Juckreiz, Abschälen der Haut, Schwellungen im Gesicht (vor allem rund um die Lippen und Augen), die Verengung der Kehle und Atem- oder Schluckbeschwerden, Fieber, Flüssigkeitsverlust, Schock und Ohnmacht verursachen. Dies sind alles sehr schwere Nebenwirkungen.
Wenn bei Ihnen eine dieser Nebenwirkungen auftritt, informieren Sie unverzüglich Ihren Arzt. Sie benötigen eventuell dringend ärztliche Hilfe.
Sehr häufig auftretende Nebenwirkungen (kann mehr als 1 von 10 Behandelten betreffen):
- Sehstörungen (Erweiterung der Pupillen, Augenanpassungsschwierigkeiten,
verschwommenes Sehen, Lichtunverträglichkeit),
- vermindertes Bronchialsekret,
- Mundtrockenheit (Schwierigkeiten beim Schlucken und Sprechen, Durst)
- Verstopfung und Sodbrennen (Reflux),
- verminderte Sekretion von Magensäure,
- Geschmacksverlust,
- Übelkeit,
- Erbrechen,
- aufgeblähtes Gefühl,
- mangelndes Schwitzen,
- Hauttrockenheit,
- Nesselausschlag,
- Hautausschlag.
Häufig auftretende Nebenwirkungen (kann bis zu 1 von 10 Behandelten betreffen)
- Erregtheit (insbesondere bei höheren Dosierungen),
- Verlust der Koordination (insbesondere bei höheren Dosierungen),
- Verwirrtheit (insbesondere bei höheren Dosierungen),
- Halluzinationen (insbesondere bei höheren Dosierungen),
- überhitzter Körper,
- bestimmte Herzerkrankungen (Herzrasen, unregelmäßiger Herzschlag, vorübergehende
weitere Verlangsamung des Herzschlags),
- Hitzewallung (Flush),
- Schwierigkeiten beim Wasserlassen.
Gelegentlich auftretende Nebenwirkungen (kann bis zu 1 von 100 Behandelten betreffen)
- psychotische Reaktionen.
Selten auftretende Nebenwirkungen (kann bis zu 1 von 1.000 Behandelten betreffen)
- allergische Reaktionen,
- Krämpfe (Anfälle),
- Benommenheit.
Sehr selten auftretende Nebenwirkungen (kann bis zu 1 von 10.000 Behandelten betreffen)
- schwere Überempfindlichkeitsreaktion,
- unregelmäßiger Herzschlag, einschließlich Kammerflimmern,
- Schmerzen in der Brust,
- Blutdruckanstieg.
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
- Kopfschmerzen,
- Ruhelosigkeit,
- unsicheres Gehen und Gleichgewichtsstörungen,
- Schlaflosigkeit.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzeigen.
Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist ATROPINSULFAT AGUETTANT aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen dieses Arzneimittel nach dem auf dem Umkarton, der Spritze und der Blisterpackung angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats.
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Sie dürfen dieses Arzneimittel nicht verwenden, wenn Sie sichtbare Anzeichen von Zersetzung feststellen.
Entsorgen Sie Arzneimittel nicht im Abwasser. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr benötigen. Sie tragen damit zum Schutz der Umwelt bei.
6. Inhalt der Packung und weitere Informationen
Was ATROPINSULFAT AGUETTANT enthält - Der Wirkstoff ist Atropinsulfat (Ph.Eur.).
1 ml Injektionslösung enthält 0,2 mg Atropinsulfat-Monohydrat (Ph.Eur.), entsprechend 0,17 mg Atropin.
Eine 5 ml Fertigspritze enthält 1 mg Atropinsulfat-Monohydrat (Ph.Eur.), entsprechend 0,83 mg Atropin.
- Die sonstigen Bestandteile sind
Natriumchlorid, Salzsäure 36% (zur pH-Wert Einstellung), Wasser für Injektionszwecke.
Wie ATROPINSULFAT AGUETTANT aussieht und Inhalt der Packung
Dieses Arzneimittel ist eine klare und farblose Injektionslösung in einer sterilen 5-ml-Polypropylen-Fertigspritze.
Packungen mit 1, 5, 10, 12 oder 20 Fertigspritzen.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Pharmazeutischer Unternehmer
Laboratoire AGUETTANT 1, Rue Alexander Fleming 69007 Lyon Frankreich
Mitvertrieb:
AGUETTANT Deutschland GmbH Hans-Böckler-Str. 24 40764 Langenfeld
Hersteller
Laboratoire AGUETTANT 1, Rue Alexander Fleming 69007 Lyon Frankreich
Diese Packungsbeilage wurde zuletzt überarbeitet im 05/2016.
<-------------------------------------------------------------------------------------------------------------->
Die folgenden Informationen sind für medizinisches Fachpersonal bestimmt:
Die Fertigspritze ist nur für einen einzelnen Patienten bestimmt.
Die Fertigspritze nach der Anwendung entsorgen. Nicht wiederverwenden.
Der Inhalt der ungeöffneten und unbeschädigten Blisterpackung ist steril.
Die Blisterpackung darf bis zur Anwendung nicht geöffnet werden.
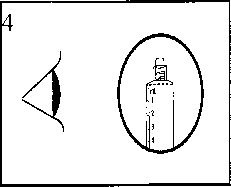
Das Arzneimittel muss vor der Anwendung visuell auf Partikel und Verfärbung überprüft werden. Nur klare, farblose Lösungen, die frei von Partikeln und Niederschlägen sind, dürfen verwendet werden.
Das Arzneimittel darf nicht verwendet werden, wenn der Originalitätsverschluss der Fertigspritze (Kunststoffabdeckung der Verschlusskappe) beschädigt ist.
Die Außenfläche der Spritze ist steril, bis die Blisterpackung geöffnet wird.
1) Die Fertigspritze aus der sterilen Blisterpackung entnehmen.
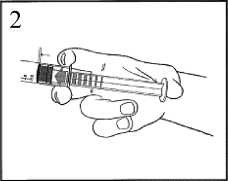
2) Auf den Kolben drücken, um den Stopfen zu entsichern.
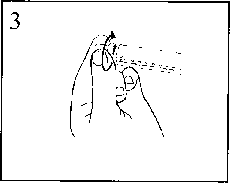
3) Die Verschlusskappe abdrehen, um die Dichtung zu brechen.
4) Überprüfen, dass der Verschluss (Kunststoffabdeckung der Verschlusskappe und Dichtung unter der Verschlusskappe) vollständig entfernt wurde. Andernfalls den Verschluss aufsetzen und erneut drehen.
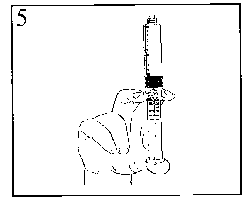
5) Die Luft mit einem leichten Druck auf den Kolben entleeren.
6) Die Spritze mit dem intravenösen Zugang oder mit einer Kanüle verbinden. Den Kolben herunterdrücken, um die erforderliche Menge zu injizieren.
Für eine intravenöse Anwendung der Fertigspritze eine Kanüle von 23 bis 20 Gauge verwenden. Für eine intramuskuläre Anwendung der Fertigspritze eine Kanüle von 23 bis 21 Gauge verwenden.