Atropinsulfat Aguettant 1 Mg/5 Ml Injektionslösung In Einer Fertigspritze
1.
BEZEICHNUNG DES ARZNEIMITTELS
ATROPINSULFAT AGUETTANT 200 Mikrogramm/ml Injektionslösung in einer Fertigspritze
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 ml Injektionslösung enthält 0,2 mg Atropinsulfat-Monohydrat (Ph.Eur.), entsprechend 0,17 mg Atropin.
Eine 5 ml Fertigspritze enthält 1 mg Atropinsulfat-Monohydrat (Ph.Eur.), entsprechend 0,83 mg Atropin.
Sonstiger Bestandteil mit bekannter Wirkung: Natrium 1 ml Injektionslösung enthält 3,5 mg Natrium (entsprechend 0,154 mmol).
Eine 5 ml Fertigspritze enthält 17,7 mg Natrium (entsprechend 0,770 mmol).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionslösung in einer Fertigspritze Klare und farblose Lösung. pH-Wert 3,2-4,0
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
ATROPINSULFAT AGUETTANT ist nur für Erwachsene angezeigt.
- Als Narkoseprämedikation zur Verhinderung vagaler Reaktionen in Verbindung mit Intubation und chirurgischer Manipulation
- Zur Begrenzung der muskarinischen Effekte von postoperativ verabreichtem Neostigmin, das nicht depolarisierenden Muskelrelaxanzien entgegenwirkt
- Für die Notfallbehandlung einer hämodynamisch wirksamen Bradykardie und/oder eines AV-Blocks durch einen übermäßigen Vagotonus
- Kardiopulmonale Reanimation: für die Behandlung von symptomatischer Bradykardie und AV-Block
- Als Gegenmittel nach einer Überdosierung oder Vergiftung mit Acetylcholinesterase-Inhibitoren wie z. B. Cholinesterasehemmern, Organophosphor, Carbamaten und muskarinergen Pilzen
4.2 Dosierung und Art der Anwendung
ATROPINSULFAT AGUETTANT muss unter ärztlicher Aufsicht angewendet werden.
Dosierung:
Narkoseprämedikation
Intravenöse Anwendung unmittelbar vor der Operation; falls erforderlich, ist eine intramuskuläre Anwendung 30-60 Minuten vor der Operation möglich.
Erwachsene:
0,3-0,6 mg i.v. oder i.m. (1,5-3 ml)
In Kombination mit Neostigmin, um dessen muskarinische Effekte einzuschränken:
Erwachsene:
0,6-1,2 mg i.v. (3-6 ml)
Bei der Behandlung von hämodynamisch wirksamer Bradykardie, AV-Block, kardiopulmonaler Reanimation:
Erwachsene:
- Sinus Bradykardie: 0,5 mg i.v. (2,5 ml), alle 2-5 Minuten, bis die gewünschte Herzfrequenz erreicht ist.
- AV-Block: 0,5 mg i.v. (2,5 ml), alle 3-5 Minuten (maximal 3 mg)
Als Gegenmittel zu Organophosphaten (Pestizide, Nervengase), zu Cholinesteraseinhibitoren und bei Vergiftung mit muskarinergen Pilzen:
Intravenöse Anwendung.
Erwachsene:
0,5-2 mg Atropinsulfat (2,5-10 ml) in Abhängigkeit von den Eigenschaften und dem Ansprechen des Patienten, dies kann nach 5 Minuten wiederholt werden und anschließend je nach Bedarf, bis die Symptome verschwinden (diese Dosis kann mehrfach überschritten werden).
Dosisanpassungen
Die Dosis sollte in der Regel je nach Ansprechen und Verträglichkeit des Patienten angepasst werden.
Die Dosierung wird in der Regel bis zu einer maximalen Gesamtdosis von 3 mg bei Erwachsenen gesteigert, bis die Nebenwirkungen nicht mehr tolerabel sind; anschließend ergibt eine leichte Dosisreduktion im Allgemeinen die von dem Patienten tolerierte Höchstdosis.
Besondere Patientengruppen
Bei Patienten mit Nieren- oder Leberfunktionsstörung und bei älteren Patienten ist Vorsicht geboten (siehe Abschnitt 4.4).
Art der Anwendung
ATROPINSULFAT AGUETTANT wird als intravenöse oder intramuskuläre Injektion angewendet. Kinder und Jugendliche:
Die Fertigspritze ist nicht für die Verabreichung an Kinder geeignet; da die Graduierung keine genaue Messung erlaubt.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile
- Engwinkelglaukom
- Risiko einer Harnretention aufgrund einer Prostata- oder Harnröhrenerkrankung
- Achalasie der Speiseröhre, paralytischer Ileus und toxisches Megakolon
Alle diese Gegenanzeigen sind jedoch bei lebensbedrohlichen Notfällen (wie Bradyarrhythmie, Vergiftungen) nicht relevant.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Mit Vorsicht anzuwenden bei:
- Prostatavergrößerung
- Nieren- oder Leberinsuffizienz
- Herzinsuffizienz, Herzrhythmusstörungen, Hyperthyreose
- Chronisch obstruktiver Lungenerkrankung (COPD), da eine Verminderung des Bronchialsekrets zur Bildung von Bronchialpfropfen führen kann
- Darmatonie bei älteren Patienten
- Pylorusstenose
- Fieber oder bei hoher Umgebungstemperatur
- älteren Patienten, die anfälliger für die Nebenwirkungen des Arzneimittels sein können
- Refluxösophagitis, da Atropin die Magenentleerung verzögern, die Motilität des Magens verringern und den Ösophagussphinkter entspannen kann
Atropin sollte nicht bei Patienten mit Myasthenia gravis angewendet werden, es sei denn in Verbindung mit Anticholinesterase.
Die Anwendung von Atropin sollte die Durchführung der externen Stimulation bei instabilen Patienten nicht verzögern, insbesondere bei Patienten mit einem AV-Block hohen Grades (Mobitz Typ II zweiten Grades oder dritten Grades).
Antimuskarinika blockieren die vagale Hemmung des Sinusknotenschrittmachers und sollten daher mit Vorsicht bei Patienten mit Tachyarrhythmien, Herzinsuffizienz oder koronarer Herzkrankheit angewendet werden.
Dieses Arzneimittel enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro Fertigspritze.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Zu berücksichtigende Kombinationen
Andere Arzneimittel mit anticholinerger Wirkung, wie trizyklische Antidepressiva, einige H1-Antihistaminika, Arzneimittel gegen Parkinson, Disopyramid, Mequitazin, Phenothiazine, Neuroleptika, atropine Spasmolytika, Clozapin und Chinidin wegen der Gefahr der Potenzierung atropiner Nebenwirkungen (Harnretention, Verstopfung, Mundtrockenheit).
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Daten über eine begrenzte Anzahl exponierter Schwangerschaften ergeben keine Hinweise auf unerwünschte Wirkungen von Atropin auf die Schwangerschaft oder die Gesundheit des Fetus/Neugeborenen.
Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf eine Reproduktionstoxizität (siehe Abschnitt 5.3).
Studien zur Pharmakokinetik von Atropin bei Mutter und Fetus in der späten Schwangerschaft zeigten, dass Atropin die Plazentaschranke schnell passiert. Die intravenöse Anwendung von Atropin während der Schwangerschaft oder unter der Geburt kann eine Tachykardie bei Fetus und Mutter auslösen.
Atropin sollte während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich.
Stillzeit
Atropin kann in geringen Mengen in die Muttermilch übergehen. Kleinkinder haben eine erhöhte Empfindlichkeit gegenüber den anticholinergen Wirkungen von Atropin. Atropin kann die Produktion der Muttermilch hemmen, insbesondere bei wiederholter Anwendung. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob die Behandlung mit Atropin abzubrechen ist / auf die Behandlung mit Atropin verzichtet werden soll. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau zu berücksichtigen. Wenn während der Behandlung entschieden wird, das Stillen fortzusetzen, sollte das Kind auf anticholinerge Wirkungen überwacht werden.
Fertilität
Es liegen keine Daten zu Auswirkungen von Atropinsulfat auf die Fertilität beim Menschen vor. Atropinsulfat reduzierte die Fertilität bei männlichen Ratten, vermutlich als Folge einer inhibitorischen Wirkung auf den Transport der Spermien und der Samenflüssigkeit während des Ausstoßprozesses.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Atropin kann Verwirrtheit oder verschwommenes Sehen verursachen, hierüber sollten die Patienten informiert werden.
4.8 Nebenwirkungen
Das Muster der mit Atropin beobachteten Nebenwirkungen kann meist mit deren pharmakologischen Wirkungen auf die Muskarin- und, bei hohen Dosierungen, auf die Nikotinrezeptoren in Verbindung gebracht werden. Die Nebenwirkungen sind dosisabhängig und in der Regel reversibel, sobald die Therapie abgesetzt wird. Die häufigsten bei relativ kleinen Dosen auftretenden Nebenwirkungen sind Sehstörungen, vermindertes Bronchialsekret, Mundtrockenheit, Obstipation, Reflux, Flush, Miktionsschwierigkeiten und Hauttrockenheit. Es kann sich eine vorübergehende Bradykardie, gefolgt von einer Tachykardie mit Herzklopfen und Herzrhythmusstörungen, entwickeln.
Zur Beurteilung der Nebenwirkungen werden die folgenden Häufigkeitsangaben zu Grunde gelegt: Sehr häufig: > 1/10;
Häufig: > 1/100, < 1/10 Gelegentlich: > 1/1.000, < 1/100;
Selten: > 1/10.000, < 1/1.000;
Sehr selten: < 1/10.000;
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Häufigkeit System organklasse |
Sehr häufig |
Häufig |
Gelegen t-lich |
Selten |
Sehr selten |
Nicht bekannt |
|
Erkrankungen des Immunsystem s |
Allergisch e Reaktione n |
Ana- phylaxi e | ||||
|
Erkrankungen des Nervensystem s |
Erregtheit, Koordination s-störungen, Verwirrtheit und/oder Halluzinatio nen (insbesonder e bei höheren Dosierungen) 5 Hyperthermi e |
Psycho tische Reaktio -nen |
Anfall, Benomme n-heit |
Kopf schmer zen, Unruhe, Ataxie, Schlaf störung | ||
|
Augen erkrankungen |
Sehstörunge n (Mydriasis, Akkommod a-tionsshem-mung, ver-schwomme-nes Sehen, Photophobie) | |||||
|
Herz erkrankungen |
Tachykardie (Herzrhyth musstörunge n, vorübergehe n-de Exazerbation der Bradykardie) |
Atriale Arrhyth -mien, Kamme r-flim-mern, Angina pectoris , hypertensive Krise | ||||
|
Gefäß erkrankungen |
Flush |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Verminderte Bronchialse kretion | |||||
|
Erkrankungen des Gastrointestin al-trakts |
Mundtrocke n-heit (Schwierigkeiten beim Schlucken und Sprechen, Durst) parasympath i-sche Hemmung des MagenDarm-Trakts (Obstipation und Reflux), Hemmung der Magensäure -Sekretion, Geschmacks -verlust, Übel-keit, Erbrechen, Völlegefühl | |||||
|
Erkrankungen der Haut und des Unterhautzell gewebes |
Anhidrose, Urtikaria, Hautaus schlag | |||||
|
Erkrankungen der Nieren und Harnwege |
Hemmung der parasympathi -schen Steuerung der Harnblase, Harnretentio n |
Besondere Patientengruppen
Atropin kann Erregung, Koordinationsstörungen, Verwirrtheit und/oder Halluzinationen insbesondere bei älteren Patienten verursachen. Eine epidemiologische Studie berichtete in ähnlicher
Weise eine geringere kognitive Leistungsfähigkeit bei älteren Patienten, die Antimuskarinika erhielten.
Patienten mit Down-Syndrom können anfälliger für antimuskarinische Wirkungen sein.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome:
Flush und Hauttrockenheit, erweiterte Pupillen mit Photophobie, Trockenheit von Mund und Zunge mit einem brennenden Gefühl, Schluckbeschwerden, Herzrasen, schnelle Atmung, Hyperpyrexie, Übelkeit, Erbrechen, Hypertonie, Hautausschlag und Erregung. Symptome einer ZNS-Stimulation umfassen Unruhe, Verwirrtheit, Halluzinationen, paranoide und psychotische Reaktionen, Koordinationsstörungen, Delirium und gelegentlich Krämpfe. Bei schwerer Überdosierung können Schläfrigkeit, Stupor und ZNS-Depression mit Koma, Kreislauf- und Atemstillstand und Tod auftreten.
Behandlung:
Die Behandlung sollte unterstützend sein. Die Atemwege müssen offengehalten werden. Diazepam kann zur Kontrolle von Erregung und Krampfanfällen verabreicht werden. Es muss jedoch das Risiko einer ZNS-Depression in Betracht gezogen werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Belladonna-Alkaloide, tertiäre Amine.
ATC-Code: A03BA01.
Atropin ist ein Antimuskarinikum, das kompetitiv Acetylcholin an postganglionären Nervenend(igung)en antagonisiert, wodurch Rezeptoren in den exokrinen Drüsen, der glatten Muskulatur, dem Herzmuskel und dem zentralen Nervensystem beeinflusst werden.
Periphere Auswirkungen sind eine verminderte Produktion von Speichel, Schweiß, Nasen-, Tränen-und Magensekret, verminderte Darmmotilität und Miktionshemmung.
Atropin steigert die Sinusfrequenz und die Sinusknoten- und AV-Überleitung. Gewöhnlich ist die Herzfrequenz erhöht, es kann jedoch eine anfängliche Bradykardie bestehen.
Atropin hemmt die Sekretion im gesamten Respirationstrakt, entspannt die glatte Bronchialmuskulatur und erzeugt eine Bronchodilatation.
5.2 Pharmakokinetische Eigenschaften
Resorption
Nach intravenöser Anwendung erfolgt der stärkste Anstieg der Herzfrequenz innerhalb von zwei bis vier Minuten. Die Spitzenplasmakonzentrationen von Atropin nach intramuskulärer Anwendung werden innerhalb von 30 Minuten erreicht, auch wenn die stärksten Auswirkungen auf Herz, Schwitzen und Speichelfluss eine Stunde nach der intramuskulären Anwendung auftreten können.
Verteilung
Die Plasmaspiegel nach intramuskulärer bzw. intravenöser Injektion sind nach einer Stunde vergleichbar. Atropin verteilt sich im gesamten Körper und passiert die Blut-Hirn-Schranke und die Plazentaschranke.
Biotransformation
Atropin wird nicht vollständig in der Leber abgebaut und als unveränderte Substanz und Metaboliten in den Urin ausgeschieden. Etwa 50 % der Dosis wird innerhalb von 4 Stunden und 90 % innerhalb von 24 Stunden ausgeschieden.
Elimination
Die Eliminationshalbwertszeit beträgt etwa 2 bis 5 Stunden. Bis zu 50 % der Dosis ist an Protein gebunden.
Kinder und Jugendliche
Kinder, insbesondere unter zwei Jahren, sind möglicherweise anfälliger für die Wirkungen von Atropin. Die Eliminationshalbwertzeit ist bei Kindern unter zwei Jahren im Vergleich zu Erwachsenen mehr als verdoppelt. Die Fertigspritze ist nicht für die Verabreichung an Kinder geeignet; da die Graduierung keine genaue Messung erlaubt (siehe Abschnitt 4.2).
Ältere Patienten
Die Eliminationshalbwertzeit von Atropin ist bei älteren Patienten (> 65 Jahre) im Vergleich zu Erwachsenen mehr als verdoppelt.
5.3 Präklinische Daten zur Sicherheit
Präklinische Effekte wurden nur nach Expositionen beobachtet, die ausreichend über der maximalen humantherapeutischen Exposition lagen. Die Relevanz für den Menschen wird als gering bewertet. Atropinsulfat reduzierte die Fertilität bei männlichen Ratten, vermutlich als Folge einer inhibitorischen Wirkung auf den Transport der Spermien und der Samenflüssigkeit während des Ausstoßprozesses.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Natriumchlorid
Salzsäure 36% (zur pH-Wert Einstellung)
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Das Arzneimittel darf nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
Ungeöffnete Blisterpackung: 3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
5 ml Lösung in einer Fertigspritze (Polypropylen) ohne Kanüle, einzeln verpackt in einer durchsichtigen Blisterpackung,
Packungen mit 1, 5, 10, 12 oder 20 Fertigspritzen.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Hinweise zur Handhabung:
Das Protokoll für die Anwendung der Spritze ist strikt einzuhalten.
Die Fertigspritze ist nur für einen einzelnen Patienten bestimmt.
Die Fertigspritze nach der Anwendung entsorgen. Nicht wiederverwenden.
Der Inhalt der ungeöffneten und unbeschädigten Blisterpackung ist steril.
Die Blisterpackung darf bis zur Anwendung nicht geöffnet werden.
Das Arzneimittel muss vor der Anwendung visuell auf Partikel und Verfärbung überprüft werden. Nur klare, farblose Lösungen, die frei von Partikeln und Niederschlägen sind, dürfen verwendet werden.
Das Arzneimittel darf nicht verwendet werden, wenn der Originalitätsverschluss der Fertigspritze (Kunststoffabdeckung der Verschlusskappe) beschädigt ist.
Die Außenfläche der Spritze ist steril, bis die Blisterpackung geöffnet wird.
1) Die Fertigspritze aus der sterilen Blisterpackung entnehmen.
2) Auf den Kolben drücken, um den Stopfen zu entsichern.
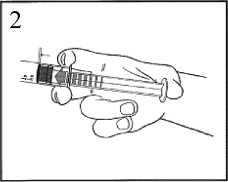

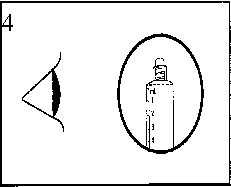

3) Die Verschlusskappe abdrehen, um die Dichtung zu brechen.
4) Überprüfen, dass der Verschluss (Kunststoffabdeckung der Verschlusskappe und Dichtung unter der Verschlusskappe) vollständig entfernt wurde. Andernfalls den Verschluss aufsetzen und erneut drehen.
5) Die Luft mit einem leichten Druck auf den Kolben entleeren.
6) Die Spritze mit dem intravenösen Zugang oder mit einer Kanüle verbinden.
Den Kolben herunterdrücken, um die erforderliche Menge zu injizieren.
Für eine intravenöse Anwendung der Fertigspritze eine Kanüle von 23 bis 20 Gauge verwenden. Für eine intramuskuläre Anwendung der Fertigspritze eine Kanüle von 23 bis 21 Gauge verwenden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Laboratoire AGUETTANT 1, Rue Alexander Fleming 69007 Lyon Frankreich
Mitvertrieb:
AGUETTANT Deutschland GmbH Hans-Böckler-Str. 24 40764 Langenfeld Deutschland
8. ZULASSUNGSNUMMER
94371.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
10. STAND DER INFORMATION
05/2016