Bicalutamid-Ct 150 Mg Filmtabletten
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
/FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS Bicalutamid-CT 150 mg Filmtabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Eine Filmtablette enthält 150 mg Bicalutamid.
Sonstiger Bestandteil mit bekannter Wirkung: Eine Filmtablette enthält 181 mg LactoseMonohydrat.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Filmtablette
Weiße, runde, bikonvexe Filmtablette mit der Prägung BCM 150 auf einer Seite.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Bicalutamid-CT 150 mg ist angezeigt entweder als alleinige Therapie oder adjuvant zu radikaler Prostatektomie oder Strahlentherapie bei Patienten mit lokal fortgeschrittenem Prostatakarzinom und hohem Progressionsrisiko (siehe Abschnitt 5.1).
4.2 Dosierung, Art und Dauer der Anwendung
Erwachsene Männer einschließlich älteren Patienten
Dosierung
Einmal täglich 150 mg (1 Filmtablette) immer zur gleichen Zeit (im Allgemeinen morgens oder abends).
Nierenfunktionsstörung
Bei Patienten mit Nierenfunktionsstörung ist keine Dosisanpassung erforderlich. Es liegen keine Erfahrungen mit der Anwendung von Bicalutamid bei Patienten mit schwerer Nierenfunktionsstörung vor (Kreatinin-Clearance < 30 ml/min) (siehe Abschnitt 4.4).
Leberfunktionsstörung
Bei Patienten mit leichter Leberfunktionsstörung ist keine Dosisanpassung erforderlich. Bei Patienten mit mittelschwerer bis schwerer Einschränkung der Leberfunktion kann es zu einer Kumulation des Wirkstoffs kommen (siehe Abschnitt 4.4).
Kinder und Jugendliche
Bicalutamid ist bei Kindern und Jugendlichen nicht indiziert.
Art der Anwendung
Zum Einnehmen
Die Filmtablette sollte im Ganzen mit Flüssigkeit eingenommen werden.
Die Einnahme kann unabhängig von den Mahlzeiten erfolgen.Sie sollte wegen der besseren Compliance stets zur gleichen Tageszeit erfolgen.
Dauer der Anwendung
Bicalutamid 150 mg sollte ohne Unterbrechung mindestens 2 Jahre oder bis zum Auftreten einer Progression der Erkrankung angewendet werden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen Bicalutamid oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Bicalutamid ist bei Frauen und Kindern kontraindiziert (siehe Abschnitt 4.6).
Die gleichzeitige Anwendung von Terfenadin, Astemizol oder Cisaprid mit Bicalutamid ist kontraindiziert (siehe Abschnitt 4.5).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Bicalutamid wird extensiv in der Leber verstoffwechselt. Bisherige Untersuchungen weisen darauf hin, dass es bei Patienten mit schwerer Leberfunktionsstörung zu einer verlangsamten Elimination und dadurch zu einer vermehrten Akkumulation von Bicalutamid kommen kann. Daher sollte Bicalutamid bei Patienten mit mittelschwerer bis schwerer Leberfunktionsstörung mit Vorsicht angewendet werden.
Wegen möglicher Leberveränderungen sollten regelmäßige Leberfunktionstests in Erwägung gezogen werden. Die Mehrheit der Fälle ist in den ersten 6 Monaten der Behandlung mit Bicalutamid zu erwarten.
Unter Bicalutamid wurde in seltenen Fällen schwerwiegende Leberveränderungen und Leberinsuffizienz beobachtet, bei denen auch tödliche Ausgänge berichtet wurden (siehe Abschnitt 4.8). Bei schwerwiegenden Veränderungen sollte die Behandlung mit Bicalutamid abgebrochen werden.
Es wurde gezeigt, dass Bicalutamid Cytochrom P450 (CYP 3A4) hemmt, daher sollte bei gleichzeitiger Verabreichung mit Arzneimitteln, die vorwiegend durch CYP 3A4 metabolisiert werden, Vorsicht geübt werden (siehe Abschnitte 4.3 und 4.5).
Da keine Erfahrungen zur Anwendung von Bicalutamid bei Patienten mit stark eingeschränkter Nierenfunktion vorliegen (Kreatinin-Clearance < 30 ml/min), sollte Bicalutamid bei diesen Patienten mit Vorsicht angewendet werden.
Bei Patienten mit Herzerkrankung ist eine regelmäßige Kontrolle der Herzfunktion ratsam.
Bei Patienten mit einer objektiven Progression der Erkrankung und einem erhöhten PSA-Wert sollte ein Abbruch der Bicalutamid-Therapie in Betracht gezogen werden.
Das Arzneimittel enthält Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
In-vitro-Studien zeigten, dass R-Bicalutamid ein CYP 3A4-Inhibitor ist und auch in geringerem Ausmaß CYP 2C9, 2C19 und 2D6 hemmt.
In klinischen Studien in Kombination mit Phenazon als Marker für die Cytochrom-P450-(CYP)-Aktivität konnte ein Arzneimittelwechselwirkungspotential mit Bicalutamid nicht nachgewiesen werden. Die mittlere Midazolam-Exposition (AUC) war jedoch nach einer 28-tägigen gleichzeitigen Verabreichung mit Bicalutamid um bis zu 80 % erhöht. Für Arzneimittel mit enger therapeutischer Breite könnte eine solche Erhöhung relevant sein. Daher ist die gleichzeitige Verwendung von Terfenadin, Astemizol und Cisaprid kontraindiziert (siehe Abschnitt 4.3), und bei der gemeinsamen Gabe von Bicalutamid mit Verbindungen wie Cyclosporin und Kalziumkanal-Blockern sollte Vorsicht geübt werden.
Eine Dosisreduktion kann für diese Arzneimittel vor allem dann erforderlich sein, wenn Beweise für eine Wirkungssteigerung oder eine unerwünschte Arzneimittelwirkung vorliegen. Für Cyclosporin wird empfohlen, dass zu Beginn oder nach Absetzen der Bicalutamid-Therapie Plasmakonzentrationen und klinischer Zustand genau überwacht werden.
Bei der Verschreibung von Bicalutamid mit anderen Mitteln, die die Arzneimitteloxidation hemmen können (wie Cimetidin und Ketoconazol), ist Vorsicht geboten. Es könnte theoretisch zu erhöhten Plasmakonzentrationen von Bicalutamid und somit zu einem vermehrten Auftreten von Nebenwirkungen kommen.
In-vitro-Studien zeigten, dass Bicalutamid Warfarin, ein Antikoagulans vom Cumarin-Typ, aus seiner Proteinbindung verdrängen kann. Daher wird empfohlen, zu Beginn einer Behandlung mit Bicalutamid bei Patienten, die bereits Antikoagulantien vom Cumarin-Typ erhalten, die Prothrombinzeit engmaschig zu überwachen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Bicalutamid ist bei Frauen kontraindiziert und darf Schwangeren oder stillenden Müttern nicht verabreicht werden.
Fertilität
In Tierstudien wurden reversible Beeinträchtigungen der männlichen Fruchtbarkeit beobachtet (siehe Abschnitt 5.3). Es ist mit einem Zeitraum verminderter Fruchtbarkeit bzw. Unfruchtbarkeit beim Mann zu rechnen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es ist unwahrscheinlich, dass Bicalutamid die Verkehrstüchtigkeit von Patienten und ihre Fähigkeit zum Bedienen von Maschinen beeinträchtigt. Allerdings sollte beachtet werden, dass es gelegentlich zu Schwindel oder Somnolenz (Schläfrigkeit) kommen kann. Alle davon betroffenen Patienten sollten vorsichtig sein.
4.8 Nebenwirkungen
In diesem Abschnitt sind die Nebenwirkungen wie folgt definiert:
Sehr häufig: > 1/10 Häufig: > 1/100 bis < 1/10 Gelegentlich: > 1/1.000 bis < 1/100 Selten: > 1/10.000 bis < 1/1.000 Sehr selten: < 1/10.000
Nicht bebekannt: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar
Erkrankungen des Blutes und des Lymphsystems Häufig: Anämie
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeit, Angioödem und Urtikaria Stoffwechsel- und Ernährungsstörungen
Häufig: Anorexie, Diabetes mellitus, verminderter Appetit
Gelegentlich: Hyperglykämie
Psychiatrische Störungen:
Häufig: Abnahme der Libido, Depression
Erkrankungen des Nervensystems Häufig: Schwindel, Somnolenz
Gefäßerkrankungen
Häufig: Hitzewallungen
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Dyspnoe, Interstitielle Lungenkrankheite (tödliche Ausgänge wurden berichtet) Erkrankungen des Gastrointestinaltrakts
Häufig: Abdominale Schmerzen, Obstipation/Verstopfung, Diarrhoe, Dyspepsie, Blähungen,
Übelkeit
Selten: Erbrechen
Leber- und Gallenerkrankungen
Häufig: Lebertoxizität, Ikterus, Cholestase, Hypertransaminasämiea
Selten: Leberinsuffizienzb (tödliche Ausgänge wurden berichtet). Eine regelmäßige Kontrolle
der Leberwerte sollte daher in Betracht gezogen werden (siehe Abschnitt 4.4).
Erkrankungen der Haut und des Unterhautzellgewebes Sehr häufig: Ausschlag
Häufig: Alopezie, Hirsutismus/Haarnachwuchs, trockene Hautd , Juckreiz, Schwitzen
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen Häufig: Schmerzen des Muskel- und Skelettsystems
Erkrankungen der Nieren und Harnwege Häufig: Hämaturie
Erkrankungen der Geschlechtsorgane und der Brustdrüse Sehr häufig: Gynäkomastie und Spannungsgefühl in der Brustc
Häufig: Erektionsstörung
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Sehr häufig: Asthenie
Häufig: Schmerzen im Brustkorb, Ödem
Untersuchungen
Häufig: Gewichtszunahme
a Leberfunktionsstörungen sind selten schwerwiegend und waren oft vorübergehend, verschwanden oder besserten sich unter fortgesetzter Therapie oder nach Absetzen der Behandlung.
b Aufgelistet als unerwünschte Arzneimittelwirkung aufgrund ausgewerteter Daten nach Markteinführung. Die Häufigkeit der Leberinsuffizienz wurde aufgrund der Inzidenz berichteter unerwünschter Ereignisse bei Patienten bestimmt, die im unverblindeten Bicalutamid-Arm der 150 mg EPC-Studien behandelt wurden.
c
Beim Großteil der Patienten, die 150 mg Bicalutamid als Monotherapie erhalten, treten Gynäkomastie und/oder Brustschmerzen auf. In Studien wurden diese Symptome bei bis zu 5 % der Patienten als schwer angesehen. Eine spontane Rückbildung der Gynäkomastie kann nach Absetzen der Therapie ausbleiben,
besonders nach einer Langzeitbehandlung.
Aufgrund der in den EPC-Studien angewandten Kodierungsmethode wurde das unerwünschte Ereignis 'trockene Haut' unter der COSTART-Bezeichnung 'Hautausschlag' aufgeführt. Deswegen gibt es keine separate Häufigkeitsbewertung für die 150-mg-Dosis Bicalutamid, aber es wird die gleiche Häufigkeit angenommen wie für die 50-mg-Dosis.
e Aufgelistet als unerwünschte Arzneimittelwirkung aufgrund ausgewerteter Daten nach Markteinführung. Die Häufigkeit der interstitiellen Pneumonie wurde aufgrund der Inzidenz berichteter unerwünschter Ereignisse bestimmt, die im randomisierten Behandlungszeitraum der 150 mg EPC-Studien auftraten.
Hinweis: Die Kombinationstherapie von Bicalutamid 50 mg und einem LHRH-Analogon wurde mit dem Auftreten von Herzinsuffizienz und Herzinfarkten in Zusammenhang gebracht.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Es wurden keine Fälle von Überdosierung beim Menschen berichtet. Es gibt kein spezifisches Antidot. Die Behandlung sollte symptomatisch erfolgen. Da Bicalutamid in hohem Maße an Proteine gebunden wird und nicht in unveränderter Weise im Urin nachweisbar ist, dürfte eine Dialyse nicht hilfreich sein. Es sind allgemeine supportive Maßnahmen einschließlich einer engmaschigen Kontrolle der Vitalfunktionen angezeigt.
Bei Patienten mit ungetrübter Bewusstseinslage sollte man Erbrechen auslösen, falls es nicht spontan auftritt.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Hormon-Antagonisten und verwandte Mittel, Antiandrogene ATC-Code: L02BB03
Bicalutamid ist ein nichtsteroidales Antiandrogen ohne andere endokrine Aktivität und liegt als Racemat vor. Die antiandrogene Aktivität geht nahezu ausschließlich vom R-Enantiomer aus. Bicalutamid bindet kompetitiv an den normalen („wild type“) zellulären Androgen-Rezeptor, ohne die Genexpression zu aktivieren und unterbindet den Androgen-Stimulus auf die Prostata- bzw. Prostatakarzinomzelle. Die Rückbildung von Prostatatumoren ist eine Folge dieser Hemmung.
Klinisch kann das Absetzen von Bicalutamid bei einem Teil der Patienten zu einem AntiandrogenEntzugssyndrom führen.
Bicalutamid 150 mg wurde untersucht bei Patienten mit lokal begrenztem (T1-T2, N0 oder NX, M0) oder lokal fortgeschrittenem (T3-T4, alle N, M0; T1-T2, N+, M0) nicht-metastasiertem Prostatakrebs in einer kombinierten Analyse von 3 Placebo-kontrollierten, doppelblinden Studien an 8113 Patienten, in denen Bicalutamid als unmittelbare Hormontherapie oder adjuvant zu radikaler Prostatektomie oder Strahlentherapie (vor allem externe Strahlentherapie) verabreicht wurde. Bei einer medianen Nachbeobachtungsdauer von 9,7 Jahren trat bei 36,6 % und 38,17 % aller mit Bicalutamid bzw. mit Placebo behandelten Patienten eine objektive Progression der Erkrankung auf.
Eine Verminderung des Risikos einer objektiven Progression der Erkrankung wurde bei den meisten Patientengruppen beobachtet, jedoch war diese bei den Patientengruppen mit dem höchsten Progressionsrisiko am deutlichsten. Deshalb könnte der behandelnde Arzt entscheiden, dass für einen Patienten mit geringem Progressionsrisiko, insbesondere in der adjuvanten Situation nach einer radikalen Prostatektomie, ein Aufschieben der hormonalen Therapie bis zum Auftreten von Anzeichen einer Krankheitsprogression die optimale Behandlungsstrategie ist.
Bei einer Mortalität von 31,4 % (HR = 1,01; 95 % CI 0,94 bis 1,09) wurde nach einer medianen Nachbeobachtungsdauer von 9,7 Jahren kein Unterschied hinsichtlich Gesamtüberleben beobachtet. Dennoch waren in exploratorischen Subgruppen-Analysen einige Tendenzen ersichtlich.
Die Daten hinsichtlich des progressionsfreien Überlebens und des Gesamtüberlebens im Zeitverlauf basierend auf einer Kaplan-Meier-Schätzung bei Patienten mit lokal fortgeschrittener Erkrankung sind in den folgenden Tabellen zusammengefasst:
Tabelle 1: Anteil lokal fortgeschrittener Patienten mit Progression der Erkrankung im Zeitverlauf nach Therapie-Subgruppen
|
Analyse Population |
Behandlungs arm |
Ereignisse (%) nach 3 Jahren |
Ereignisse (%) nach 5 Jahren |
Ereignisse (%) nach 7 Jahren |
Ereignisse (%) nach 10 Jahren |
|
Watchful |
Bicalutamid |
19,7% |
36,3% |
52,1% |
73,2% |
|
Waiting |
150 mg | ||||
|
(Beobachtendes | |||||
|
Abwarten) |
Placebo |
39,8% |
59,7% |
70,7% |
79,1% |
|
(n=657) | |||||
|
Strahlentherapie |
Bicalutamid |
13,9% |
33,0% |
42,1% |
62,7% |
|
(n=305) |
150 mg | ||||
|
Placebo |
30,7% |
49,4% |
58,6% |
72,2% | |
|
Radikale |
Bicalutamid |
7,5% |
14,4% |
19,8% |
29,9% |
|
Prostatektomie |
150 mg | ||||
|
(n=1719) | |||||
|
Placebo |
11,7% |
19,4% |
23,2% |
30,9% |
Tabelle 2: Gesamtüberleben bei lokal fortgeschrittener Erkrankung nach Therapie-Subgruppen
|
Analyse Population |
Behandlungs arm |
Ereignisse (%) nach 3 Jahren |
Ereignisse (%) nach 5 Jahren |
Ereignisse (%) nach 7 Jahren |
Ereignisse (%) nach 10 Jahren |
|
Watchful Waiting (Beobachtendes |
Bicalutamid 150 mg |
14,2% |
29,4% |
42,2% |
65,0% |
|
Abwarten) (n=657) |
Placebo |
17,0% |
36,4% |
53,7 |
67,5% |
|
Strahlentherapie (n=305) |
Bicalutamid 150 mg |
8,2% |
20,9% |
30,0% |
48,5% |
|
Placebo |
12,6% |
23,1% |
38,1% |
53,3% |
Radikale Bicalutamid
Prostatektomie 150 mg
(n=1719)
Placebo
4,6%
4,2%
8,7%
14,6%
22,4%
Bei Patienten mit lokal begrenzter Erkrankung, die Bicalutamid alleine erhielten, konnte kein signifikanter Unterschied im progressionsfreien Überleben nachgewiesen werden. Bei diesen Patienten, für die ansonsten beobachtendes Abwarten angewendet worden wäre, gab es einen Trend zu verminderter Überlebensdauer im Vergleich zu mit Placebo behandelten Patienten (HR = 1,15; 95 % CI 1,00 bis 1,32). Vor diesem Hintergrund wird das Nutzen-Risiko-Profil für die Anwendung von Bicalutamid bei Patienten mit lokal begrenzter Erkrankung als unvorteilhaft erachtet.
Bicalutamid liegt als Racemat vor. Die antiandrogene Aktivität geht nahezu ausschließlich vom (R)-Enantiomer aus.
5.2 Pharmakokinetische Eigenschaften
Bicalutamid wird nach oraler Gabe gut resorbiert. Es gibt keine Hinweise auf einen klinisch relevanten Effekt der Nahrung auf die Bioverfügbarkeit.
Bicalutamid liegt als Racemat, d. h. als Gemisch aus (R)- bzw. (S)-Enantiomer vor. Beide Enantiomere unterscheiden sich deutlich in ihrer Pharmakokinetik:
Das (S)-Enantiomer wird in Relation zum (R)-Enantiomer schnell eliminiert. Letzteres hat eine Plasmaeliminationshalbwertszeit von ungefähr einer Woche.
Bei täglicher Verabreichung von Bicalutamid 150 mg akkumuliert das (R)-Enantiomer wegen seiner langen Halbwertszeit im Plasma um etwa das Zehnfache.
Bei täglicher Verabreichung von Bicalutamid 150 mg wurden Steady-state-Plasmaspiegel des (R)-Enantiomers von etwa 22 Mikrogramm/ml beobachtet. Im Steady-state liegen ca. 99 % der Substanz in Form des hauptsächlich wirksamen (R)-Enantiomers im Plasma vor.
Die pharmakokinetischen Eigenschaften des (R)-Enantiomers werden weder durch das Alter der Patienten noch durch Nierenfunktionsstörungen oder leichte bis mittelschwere Leberfunktionsstörungen beeinflusst. Es gibt Hinweise, dass bei Patienten mit schwerer Leberfunktionsstörung das (R)-Enantiomer langsamer eliminiert wird.
Bicalutamid wird stark an Proteine gebunden (Racemat 96 %, (R)-Enantiomer > 99 %) und extensiv verstoffwechselt (Oxidation und Glukuronidierung). Die Metaboliten werden zu annähernd gleichen Teilen über Niere und Galle ausgeschieden.
In einer klinischen Studie betrug bei einer Tagesdosis von 150 mg Bicalutamid die durchschnittliche Konzentration von R-Bicalutamid im Sperma des Mannes 4,9 Mikrogramm/ml. Die Menge an Bicalutamid, die der weiblichen Partnerin beim Sexualverkehr potentiell übertragen werden kann, ist gering und entspricht ungefähr 0,3 Mikrogramm/kg. Dies liegt unter dem Wert, der erforderlich ist, um bei Labortieren Effekte bei der Nachkommenschaft auszulösen.
5.3 Präklinische Daten zur Sicherheit
Bicalutamid ist ein wirksames Antiandrogen und im Tierversuch ein Induktor mischfunktioneller Oxidasen. Veränderungen am Zielorgan, einschließlich einer Tumorinduktion (Leydig-Zellen, Schilddrüse, Leber) bei Tieren, werden auf diese Wirkung zurückgeführt. Eine Enzyminduktion wurde beim Menschen nicht beobachtet, und keiner dieser Befunde wird für die Behandlung von
Patienten mit Prostatakarzinom als relevant erachtet. Eine Atrophie der Hodenkanälchen ist ein vorhersehbarer Klasseneffekt der Antiandrogene und wurde bei allen untersuchten Spezies beobachtet. Hodenatrophien waren 24 Wochen nach einer 12-monatigen Toxizitätsuntersuchung bei wiederholter Verabreichung an Ratten vollständig reversibel, wobei die Wiederherstellung der Funktion in Reproduktionsstudien 7 Wochen nach 11-wöchiger Behandlungsdauer offensichtlich war. Ein Zeitraum verminderter Fruchtbarkeit bzw. Unfruchtbarkeit beim Mann ist anzunehmen.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Tablettenkern:
Lactose-Monohydrat Povidon K-29/32 Crospovidon (Typ A)
Natriumdodecylsulfat Magnesiumstearat (Ph. Eur.) [pflanzlich]
Filmüberzug:
Lactose-Monohydrat Hypromellose Titandioxid (E 171)
Macrogol 4000
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
4 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
PVC/PE/PVDC/Aluminium-Blisterpackung, Schachtel.
Packung mit 30 Filmtabletten Packung mit 90 Filmtabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur
Handhabung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
AbZ-Pharma GmbH Graf-Arco-Str. 3 89079 Ulm
8. ZULASSUNGSNUMMER 74169.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 25. Februar 2009 Datum der Verlängerung der Zulassung: 21. Januar 2014
10. STAND DER INFORMATION
Februar 2014
11. VERKAUFSABGRENZUNG
V erschreibungspflichtig
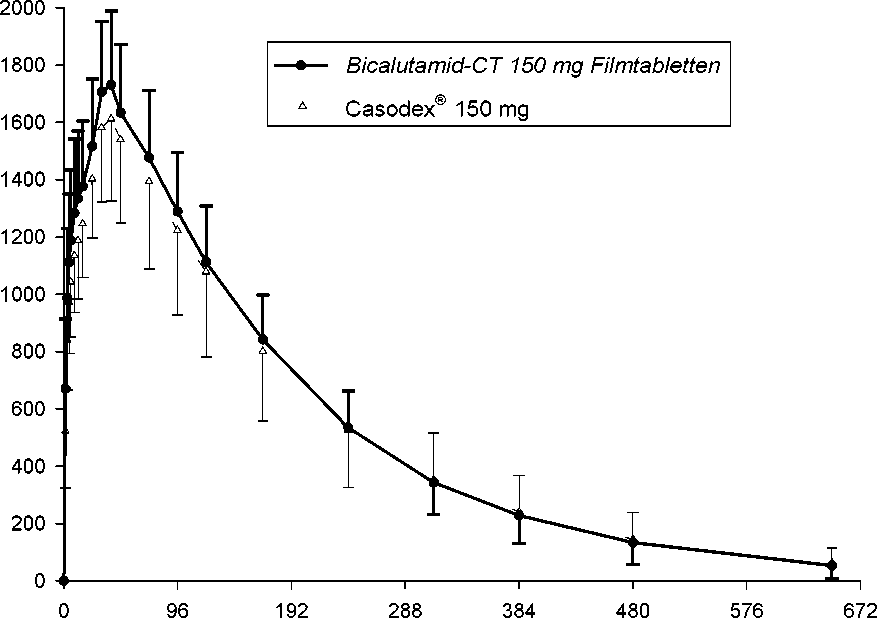
Zusätzliche Angaben der Firma CT Arzneimittel GmbH zur Bioverfügbarkeit von Bicalutamid-CT 150 mg Filmtabletten
Für Bicalutamid-CT 150 mg Filmtabletten wurde im Jahr 2004 eine Bioverfügbarkeitsstudie an 72 Probanden im Vergleich zum Referenzpräparat Casodex® 150 mg durchgeführt. Die Studie brachte folgende Ergebnisse:
Ergebnisse
Pharmakokinetische Parameter von R-Bicalutamid nach Einmalgabe von 1 Filmtablette Bicalutamid-CT 150 mg Filmtabletten bzw. 1 Filmtablette Casodex® 150 mg (geometrische Mittelwerte):
|
Bicalutamid-CT 150 mg Filmtabletten (MW) |
Casodex® 150 mg (MW) | |
|
Cmax [ng/ml] |
1748,0 |
1625,7 |
|
AUC0-» [h x ng/ml] |
355347,8 |
339225,6 |
Cmax maximale Plasmakonzentration
AUC0-ot Fläche unter der Konzentrations-Zeit-Kurve
MW Mittelwert
Konzentration (ng/ml)
Zeit (h)
Abb.: Mittelwerte und Standardabweichungen der Plasmakonzentration von R-Bicalutamid nach Einmalgabe von 1 Filmtablette Bicalutamid-CT 150 mg Filmtabletten bzw. Casodex® 150 mg.
Bioverfügbarkeit/Bioäquivalenzentscheid
Die mittlere relative Bioverfügbarkeit von Bicalutamid-CT 150 mg Filmtabletten im Vergleich zum Referenzpräparat beträgt 104,7 % (berechnet aus den geometrischen Mittelwerten s. o.).
Die statistische Bewertung der pharmakokinetischen Zielgrößen AUC und Cmax dieser Studie beweist Bioäquivalenz zum Referenzpräparat Casodex® 150 mg.
11