Bondiol 0,25 Μg Weichkapseln
F achinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Bondiol® 0,25 pg Weichkapseln Bondiol® 0,5 pg Weichkapseln Bondiol® 1 pg Weichkapseln
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Weichkapsel Bondiol 0,25 pg enthält: 0,25 pg Alfacalcidol.
1 Weichkapsel Bondiol 0,5 pg enthält: 0,5 pg Alfacalcidol.
1 Weichkapsel Bondiol 1 pg enthält: 1 pg Alfacalcidol.
Sonstige Bestandteile: Erdnussöl, Sorbitol.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Weichkapsel
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Postmenopausale Osteoporose, Osteoporose bei Glukokortikoid-Behandlung.
Knochenerweichungen im Erwachsenenalter (Osteomalazie) infolge unzureichender Resorption wie beim Malabsorptions- und Postgastrektomie-Syndrom.
Eine signifikante Verminderung der Sturzrate bei Älteren wurde nachgewiesen.
Bei Hypoparathyroidismus oder hypophosphatämischer (Vitamin D-resistenter) Rachitis/Osteomalazie kann eine Zusatztherapie mit Bondiol dann indiziert sein, wenn ein Calcium-Plasmaspiegel kleiner als 2,2 mmol/l vorliegt.
Erkrankungen, bei denen im Vitamin D-Metabolismus die 1-alpha-Hydroxylierung in der Niere beeinträchtigt ist wie renale Osteodystrophie mit verminderter Calciumresorption und einem Calcium-Plasmaspiegel kleiner als 2,2 mmol/l (kleiner als 8,8 mg/100 ml) wie sie als Folge von Nierenfunktionsstörungen ohne oder mit Dialysebehandlung sowie anfangs bei Zustand nach Nierentransplantationen auftreten kann.
Dosierung
Soweit nicht anders verordnet, beträgt die Anfangsdosis für Erwachsene und Kinder von mehr als 20 kg Körpergewicht 1 pg Alfacalcidol (4 Weichkapseln Bondiol 0,25 pg bzw. 2 Weichkapseln Bondiol 0,5 pg bzw. 1 Weichkapsel Bondiol 1 pg) täglich.
Für Kinder mit einem Körpergewicht von weniger als 20 kg beträgt die Tagesdosis 0,05 pg Alfacalcidol/kg KG/Tag.
Bei fortlaufender Behandlung ist die Dosis entsprechend dem Heilungsverlauf und zur Vermeidung erhöhter Blutcalciumspiegel oder Calcium x Phosphat-Produkte zu verringern.
Patienten mit stärker ausgeprägten Knochenerkrankungen benötigen und tolerieren höhere Dosen:
1-3 pg Alfacalcidol (4-12 Weichkapseln Bondiol 0,25 pg bzw. 2-6 Weichkapseln Bondiol 0,5 pg bzw. 1-3 Weichkapseln Bondiol 1 pg) täglich.
Bei Patienten mit Unterfunktion der Nebenschilddrüsen (Hypoparathyroidismus) muss die Dosis bei Erreichen normaler Blutcalciumwerte (2,2-2,6 mmol/l; 8,8-10,4 mg/100 ml) oder eines Calcium x Phosphat-Produktes von 3,5-3,7 (mmol/l)2 vermindert werden.
Art und Dauer der Anwendung
Bondiol 0,25 pg:
Die Tagesdosis (0,5 bzw. 1 pg) ist geteilt zur Hälfte am Morgen und zur Hälfte am Abend einzunehmen.
Bondiol 0,5 pg:
Die Tagesdosis von 0,5 pg Alfacalcidol (1 Weichkapsel Bondiol 0,5 pg) ist am Abend einzunehmen.
Bei einer Dosierung von 1-3 pg Alfacalcidol (2-6 Weichkapseln Bondiol 0,5 pg) ist die Tagesdosis geteilt zur Hälfte am Morgen und zur Hälfte am Abend einzunehmen.
Bondiol 1 pg:
Bei einer Dosierung von 1 pg Alfacalcidol täglich 1 Weichkapsel Bondiol 1 pg am Abend einnehmen. Bei Dosierung bis 3 pg Alfacalcidol täglich 1 Weichkapsel Bondiol 1 pg am Morgen und 1-2 Weichkapseln Bondiol 1 pg am Abend einnehmen.
Die Weichkapseln sollten unzerkaut mit reichlich Flüssigkeit eingenommen werden.
Die Dauer der Anwendung wird individuell vom Arzt bestimmt.
4.3 Gegenanzeigen
Bondiol darf nicht angewendet werden bei Überempfindlichkeit (Allergie) gegenüber Alfacalcidol, Erdnuss oder Soja oder einem der sonstigen Bestandteile.
Ebenso ist Bondiol kontraindiziert bei bekannter Vitamin D-Überempfindlichkeit und bei manifester Vitamin D-Intoxikation.
Bei einem Calcium-Spiegel im Plasma über 2,6 mmol/l, einem Calcium x Phosphat-Produkt über 3,7 (mmol/l)2 und einer Alkalose mit venösen Blut-pH-Werten über 7,44 (Milch-AlkaliSyndrom, Burnett-Syndrom) darf Bondiol nicht angewendet werden.
Bei Hypercalcämie oder Hypermagnesiämie darf Bondiol nicht angewendet werden.
Bei Dialyse-Patienten muss ein eventueller Calciumeinstrom aus der Dialyseflüssigkeit ausgeschlossen werden. Bei Nierensteinanamnese und Sarkoidose besteht ein erhöhtes Risiko.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Erdnussöl kann selten schwere allergische Reaktionen hervorrufen.
Patienten mit der seltenen hereditären Fructose-Intoleranz sollten Bondiol nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Vitamin D und seine Derivate dürfen nicht gleichzeitig mit Alfacalcidol verabreicht werden.
Da es sich bei Alfacalcidol um ein sehr wirksames Derivat handelt, ist bei gleichzeitiger Gabe mit einem additiven Effekt und einem erhöhten Risiko einer Hypercalcämie zu rechnen.
Eine Hypercalcämie kann bei Patienten unter Digitalistherapie Herzrhythmusstörungen hervorrufen.
Bei gleichzeitiger Einnahme von Digitalis und Bondiol müssen diese Patienten daher streng überwacht werden.
Bei gleichzeitiger Behandlung mit Bondiol und Barbituraten oder enzyminduzierenden Antikonvulsiva sind höhere Dosen von Bondiol erforderlich, um die gewünschte Wirkung zu erzielen. Ebenso kann Diphenylhydantoin die Wirkung von Alfacalcidol hemmen.
Auch Glukokortikoide können möglicherweise die Alfacalcidol-Wirkung beeinträchtigen.
Da die Gallensalze für die Resorption von Alfacalcidol von Bedeutung sind, kann auch eine längere Behandlung mit gallensäurebindenden Mitteln (Colestyramin, Colestipol) oder Sucralfat und stark aluminiumhaltigen Antacida nachteilig sein.
Bondiol und aluminiumhaltige Antacida sollten daher nicht gleichzeitig, sondern im Abstand von 2 Stunden eingenommen werden.
Magnesiumhaltige Antacida oder Laxantien sollten bei Therapie mit Bondiol bei DialysePatienten wegen der Gefahr einer Hypermagnesiämie nur mit Vorsicht eingesetzt werden.
Verstärkt dagegen wird die Alfacalcidol-Wirkung durch die gleichzeitige Gabe von östrogenen Hormonen in der Peri- und Postmenopause.
Bei gleichzeitiger Gabe von calciumhaltigen Präparaten, Thiaziden oder anderen Arzneimitteln, die den Blutcalciumspiegel erhöhen, ist das Hypercalcämie-Risiko erhöht.
4.6 Schwangerschaft und Stillzeit
Obwohl bis heute keine Beobachtungen über eine fruchtschädigende Wirkung vorliegen, sollte Bondiol während der Schwangerschaft und Stillzeit nur bei strenger Indikationsstellung angewendet werden.
Überdosierungen von Vitamin D-Derivaten in der Schwangerschaft müssen vermieden werden, da eine lang anhaltende Hypercalcämie zu körperlicher und geistiger Retardierung, supravalvulärer Aortenstenose und Retinopathie des Kindes führen kann.
Die Gabe von Bondiol in der Stillzeit dürfte den Calcitriol-Gehalt der Muttermilch erhöhen.
Dies ist zu beachten, wenn das Kind zusätzlich Vitamin D erhält.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Bondiol hat keinen oder vemachlässigbaren Einfluss auf die Verkehrstüchtigkeit und das Bedienen von Maschinen.
4.8 Nebenwirkungen
Während der Behandlung mit Bondiol wurden folgende Nebenwirkungen beobachtet, wobei folgende Häufigkeiten zu Grunde gelegt wurden:
sehr häufig (> 1/10) häufig (> 1/100 bis < 1/10) gelegentlich (> 1/1000 bis < 1/100) selten (> 1/10 000 bis < 1/1000) sehr selten (< 1/10 000)
nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Von allergischen Hautreaktionen und anaphylaktischem Schock, letzterer ausgelöst durch Erdnussöl, einem der Bestandteile von Bondiol, wurde berichtet.
Bei unangepasster Dosierung von Bondiol können erhöhte Blutcalciumspiegel auftreten, die sich durch Dosisverminderung oder zeitweiliges Absetzen des Präparates korrigieren lassen. Als Anzeichen einer eventuellen Erhöhung der Blutcalciumspiegel gelten Müdigkeit, gastrointestinale Beschwerden, Durstgefühl oder Juckreiz.
Heterotope Calcifizierungen (Cornea und Gefäße) sind unter Alfacalcidol bisher äußerst selten aufgetreten und waren reversibel.
Nach bisherigen Erfahrungen ist es unter Alfacalcidol nur selten zu leichten und passageren Phosphaterhöhungen gekommen. Einem eventuellen Phosphatanstieg ist durch Gabe von Phosphatresorptionshemmern (wie Aluminiumderivaten) zu begegnen.
Während der Behandlung mit Bondiol sind regelmäßige Kontrollen des Blutcalcium- und Phosphatspiegels sowie Blutgasanalysen vorzunehmen. Diese Kontrollen sollten in wöchentlichen bis monatlichen Abständen durchgeführt werden. Zu Beginn der Behandlung können häufigere Bestimmungen notwendig sein.
Erdnussöl kann selten schwere allergische Reaktionen hervorrufen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Bei versehentlicher einmaliger Einnahme einer Überdosis (25-30 ^g Alfacalcidol) wurden keine Schäden beobachtet.
Bei längerer Überdosierung von Bondiol kann es zu einer unter Umständen lebensbedrohlichen Hypercalcämie kommen.
Das klinische Bild des Hypercalcämiesyndroms ist uncharakteristisch: Schwäche, Müdigkeit, Abgespanntheit, Kopfschmerzen, gastrointestinale Beschwerden (Übelkeit, Erbrechen, Obstipation oder Diarrhö, Sodbrennen), Mundtrockenheit, Muskel-, Knochen- und Gelenkschmerzen, Juckreiz oder Palpitationen.
Bei verminderter Konzentrationsfähigkeit der Niere ferner Polyurie, Polydipsie, Nykturie und Proteinurie. Abgestuft nach dem Ausmaß der Hypercalcämie können neben einer Dosisreduktion oder zeitweiligem Absetzen von Bondiol calciumarme bzw. calciumfreie Ernährung, Flüssigkeitszufuhr, Dialyse, Schleifendiuretika, Glukokortikoide und Calcitonin eingesetzt werden.
Bei akuter Überdosierung kann eine frühzeitige Magenspülung und/oder die Gabe von Paraffinöl die Resorption vermindern und die Ausscheidung mit dem Stuhl beschleunigen.
Ein spezielles Antidot existiert nicht.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Vitamin D3-Derivat, ATC-Code: A11CC03
Alfacalcidol (1-alpha-Hydroxycolecalciferol) wird in der Leber sehr schnell zu Calcitriol (1,25-Dihydroxycolecalciferol) umgewandelt. Calcitriol gilt als wirksamster Metabolit des Colecalciferols (Vitamin D3) bei der Aufrechterhaltung der Calcium- und Phosphathomöostase. Der Hauptwirkmechanismus basiert auf der Erhöhung der zirkulierenden 1,25-Dihydroxycolecalciferol-Spiegel und darüber wird die intestinale Resorption von Calcium und Phosphat erhöht. Die Knochenmineralisation wird gefördert, der Parathormonspiegel gesenkt und die Knochenresorption gehemmt.
Bei gestörter 1-alpha-Hydroxylierung in der Niere wird durch die Gabe von Alfacalcidol eine ausreichende Calcitriol-Bildung ermöglicht und damit einem D-Hormon-Mangel entgegengewirkt.
5.2 Pharmakokinetische Eigenschaften
Alfacalcidol, der Wirkstoff von Bondiol, ist als Prodrug für 1-alpha-25-Dihydroxycolecalciferol im Tierexperiment und beim Menschen mit radioaktiv markierter Substanz geprüft worden.
Die rasche hepatische 25-Hydroxylierung konnte von DE LUCA an einem Patienten mit Niereninsuffizienz nachgewiesen werden.
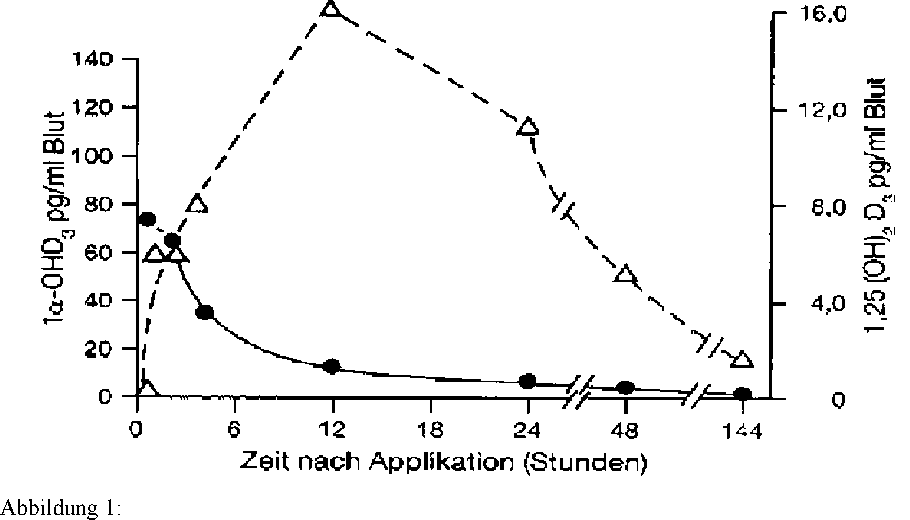
Siehe Abbildung 1
Das Verschwinden von 1-alpha-OH-[6-3H]-D3 (—) und das rasche Auftreten von 1,25-(OH)2 [6-3H] D3 (—) bei einem Patienten mit Niereninsuffizienz. De Luca, H.: Clin. Endocrinol. 7, Suppl., 1-17 (1977)
Bioverfügbarkeit
Eine im Jahr 1990 durchgeführte Bioverfügbarkeitsuntersuchung an 16 Probanden mit Bondiol 1 pg ergab im Vergleich zum Referenzpräparat:
|
Testpräparat |
Referenzpräparat | |
|
maximale Plasmakonzentration (Cmax): |
61,6 ± 13,6 pg/m |
60,5 ± 9,9 pg/ml |
|
Zeitpunkt der maximalen Plasmakonzentrationen (tmax): |
8 h (6-16 h) |
8 h (4-12 h) |
|
Fläche unter der Konzentrations-Zeitkurve (AUC) (72 h): |
2271,45 ± 450,64 pgx h/ml |
2206,20 ± 261,50 pg x h/ml |
Angabe der Werte als Mittelwert (Median bei tmax) und Standardabweichung (Streubreite bei
tmax).
In einer randomisierten, doppelblinden Crossover-Bioäquivalenzstudie erhielten 16 Probanden eine einmalige orale Dosis von 4 x Bondiol 1 pg oder 4 x 1 pg des Referenzpräparates.
Siehe Abbildung 2
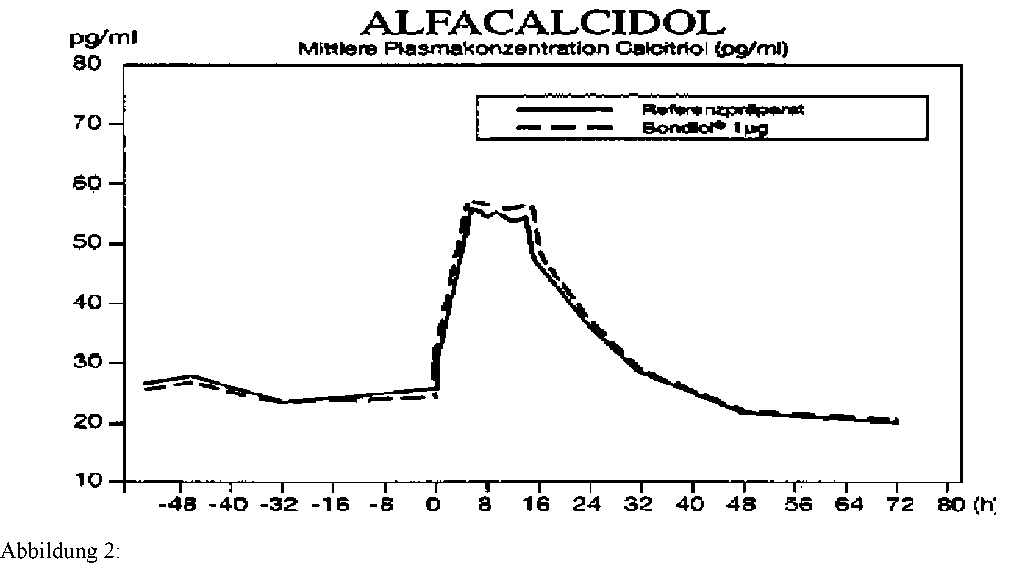
Mittlere Plasmaspiegelverläufe von Calcitriol im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm (n = 16):
5.3 Präklinische Daten zur Sicherheit
a) Akute Toxizität
Im Vergleich zur therapeutischen Dosierung wird Alfacalcidol nur eine geringe akute Toxizität zugeschrieben. Nach oraler Einmalgabe von Alfacalcidol an Ratten und Mäusen werden LD50-Werte um 500 pg/kg KG genannt.
b) Chronische Toxizität
Die Ergebnisse der chronischen Toxizitätsprüfung wurden als Folge der pharmakologischen Wirkung von Alfacalcidol auf den Calcium-Stoffwechsel gewertet und bestanden vor allem in Hypercalcämie sowie Gewebscalcinosen.
c) Reproduktionstoxizität
Aus Embryotoxizitätsstudien an Ratten und Kaninchen mit maximal 0,9 pg Alfacalcidol/kg KG/Tag wurden keine teratogenen Wirkungen berichtet. Bei Kaninchenfeten traten ab 0,3 pg Alfacalcidol/kg KG/Tag intrauterine Wachstumsretardierungen auf. Bei Fertilitätsstudien an Ratten ergab sich bei einer Dosis von 0,9 pg Alfacalcidol/kg KG/Tag eine geringere Trächtigkeitsrate und eine Verminderung der Wurfgröße.
Zu Alfacalcidol liegen keine Erfahrungen beim Menschen mit der Anwendung in der Schwangerschaft und Stillzeit vor. Es ist nicht bekannt, ob Alfacalcidol in die Muttermilch übergeht. Hohe Vitamin D-Dosen während der Schwangerschaft sind beim Menschen mit dem Auftreten eines Aortenstenosen-Syndroms und idiopathischer Hypercalcämie in Verbindung gebracht worden. Es liegen jedoch auch mehrere Fallberichte vor, wo nach Verabreichung sehr hoher Dosen normale Kinder geboren wurden. Vitamin D geht in geringen Mengen in die Muttermilch über.
d) Mutagenes Potential
Alfacalcidol ist hinsichtlich mutagener Wirkungen als unbedenklich anzusehen.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Citronensäure (Ph.Eur.), Propylgallat (Ph.Eur.), alpha-Tocopherol (Ph.Eur.), Ethanol 99 %, Erdnussöl, Gelatine, Glycerol 85 %, Mannitol-Sorbitol-Sorbitan-höhere Polyole-Gemisch, Eisen(III)-oxid (E 172) (Bondiol 0,25 pg/-0,5 pg) bzw. Eisen(III)-hydroxid-oxid (E 172) und Titandioxid (E 171) (Bondiol 1 pg).
Drucktinte: Schellack, Eisen(II,III)-oxid (E 172), Butan-1-ol, Propylenglycol.
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
Das Behältnis fest verschlossen halten.
6.5 Art und Inhalt des Behältnisses
Packung mit 17, 18, 20, 47, 48, 50, 97, 98 und 100 Weichkapseln
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
TEVA GmbH Graf-Arco-Str. 3 89079 Ulm
8. ZULASSUNGSNUMMER(N)
Bondiol 0,25 pg 28710.01.00
Bondiol 0,5 pg
57420.00. 00
Bondiol 1 pg
28710.00. 00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER
ZULASSUNG
Bondiol 0,25 pg / - 1 pg
20.01.2005
Bondiol 0,5 pg 02.03.2006
10. STAND DER INFORMATION
Oktober 2013
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
9