Budesonid Mylan Clickhaler 0,2 Mg Pulver Zur Inhalation
alt informationenWortlaut der für die Fachinformation vorgesehenen Angaben
1. Bezeichnung des Arzneimittels
Budesonid Mylan Clickhaler 0,2 mg Pulver zur Inhalation
2. Qualitative und quantitative Zusammensetzung Wirkstoff: Budesonid
Glukokortikoid zur Inhalation/Antiasthmatikum Arzneilich wirksame Bestandteile
Eine Einzeldosis enthält 0,2 mg Budesonid, entsprechend einer aus dem Mundstück abgegebenen Dosis von 0,18 mg Budesonid.
Sonstiger Bestandteil: Lactose-Monohydrat (enthält geringe Mengen an Milchproteinen. Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1
3. Darreichungsform Pulver zur Inhalation
4. Klinische Angaben
4.1 Anwendungsgebiete
Zur Behandlung von Atemwegserkrankungen, wenn die Anwendung von Glukokortikoiden erforderlich ist, wie z. B. bei
- Asthma bronchiale
- chronisch obstruktiver Bronchitis
Hinweis:
Budesonid Mylan Clickhaler 0,2 mg ist nicht zur Behandlung des akuten Asthmaanfalls geeignet.
4.2 Dosierung, Art und Dauer der Anwendung
Es ist notwendig, Budesonid Mylan Clickhaler 0,2 mg regelmäßig anzuwenden, um den vollen Therapieeffekt zu erreichen. Die Wirkung von Budesonid Mylan Clickhaler 0,2 mg setzt nach wenigen Tagen ein. Der volle Therapieeffekt wird nach 2-4 Wochen kontinuierlicher Behandlung erreicht.
Dosierung:
Die Tagesdosis sollte in 2 Gaben (morgens und abends) aufgeteilt werden. In besonderen Fällen (mangelnde Wirksamkeit im Intervall), kann sie auf 3 - 4 Einzelgaben verteilt werden. Bei manchen Patienten ist die einmal tägliche Gabe möglich.
Asthma bronchiale:
Die Dosis sollte sich nach den Erfordernissen des einzelnen Patienten (z.B. Schweregrad der Erkrankung) richten. In der Regel ist bei Kindern von 6 Jahren bis zu 12 Jahren eine Dosis von 200-400 Mikrogramm pro Tag ausreichend. Erwachsene und Kinder über 12 Jahren kommen in der Regel mit 400 bis 800 Mikrogramm Budesonid aus. Die Dosis sollte zunächst solange angepasst werden, bis eine gute Krankheitskontrolle erreicht ist. Nach Stabilisierung der Symptome sollte dann auf die niedrigste Dosis, mit der eine effektive Kontrolle der Erkrankung aufrechterhalten werden kann, eingestellt werden.
In der Regel sollte die Tageshöchstdosis bei Kindern unter 12 Jahren 0,8 mg und bei Jugendlichen und Erwachsenen 1,6 mg Budesonid nicht überschreiten. Tagesdosen oberhalb 400 Mikrogramm bei Kindern bzw. 800 Mikrogramm bei Erwachsenen und Jugendlichen sollten nach Möglichkeit nicht längerfristig eingesetzt werden.
Bei der Erhaltungstherapie von Asthma können orale Glukokortikoide möglicherweise durch Budesonid Mylan ersetzt werden bzw. deren Dosis signifikant reduziert werden. Bei Beginn der Umstellung von oralen Steroiden zu Budesonid Mylan sollte sich der Patient in einer relativ stabilen Phase befinden. Eine hohe Dosis Budesonid Mylan wird dann in Kombination mit dem vorher eingenommenem Steroid über ungefähr 10 Tage gegeben. Danach sollte die orale Steroiddosis schrittweise (z. B. um 2,5 mg Prednisolon oder dessen Äquivalent jeden Monat) bis zur niedrigsten möglichen Dosis reduziert werden. In vielen Fällen ist es möglich, die orale Steroidgabe komplett durch Budesonid Mylan zu ersetzen. Für weitere Informationen zum Absetzen von Kortikoiden siehe Abschnitt 4.4.
Die folgenden Dosierungsangaben können als Richtlinie gelten.
Erwachsene und Jugendliche über 12 Jahre:
2 x täglich 1 - 2 Pulverinhalationen entsprechend 400 bis 800 Mikrogramm (0,4 mg - 0,8 mg) Budesonid pro Tag.
Kinder von 6 Jahren bis 12 Jahren:
2 x täglich 1 Pulverinhalation entsprechend 400 Mikrogramm (0,4 mg) Budesonid pro Tag.
Hinweis:
Budesonid Mylan Clickhaler 0,2 mg soll angewendet werden, wenn sich niedriger dosierte Budesonid-haltige Arzneimittel als nicht ausreichend oder praktikabel erwiesen haben.
Art und Dauer der Anwendung
Budesonid Mylan Clickhaler 0,2 mg darf nur zur Inhalation verwendet werden.
Der Patient sollte durch eine/n Ärztin/Arzt oder Apotheker in die Handhabung von Budesonid Mylan Clickhaler 0,2 mg eingewiesen werden. Kinder sollten unter der Aufsicht eines Erwachsenen inhalieren.
Budesonid Mylan Clickhaler 0,2 mg sollte regelmäßig in den empfohlenen Zeitabständen eingesetzt werden. Nach der Stabilisierung der Krankheitssymptome sollte die tägliche Dosis von Budesonid Mylan Clickhaler 0,2 mg bis zur kleinsten möglichen Erhaltungsdosis reduziert werden. Grundsätzlich ist Budesonid Mylan Clickhaler 0,2 mg ein Arzneimittel zur Langzeitbehandlung.
Budesonid Mylan Clickhaler 0,2 mg sollte vor einer Mahlzeit angewendet werden, wenn dieses nicht möglich ist, sollten nach der Inhalation die Zähne geputzt oder der Mund ausgespült werden.
Bedienungsanleitung:
Die Anwendung sollte möglichst im Sitzen oder Stehen erfolgen.
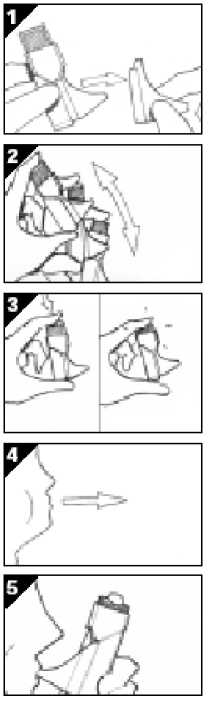
1. Schutzkappe auf dem Mundstück entfernen.
2. Clickhaler gut schütteln
3. Clickhaler aufrecht zwischen Daumen und zwei Fingern halten, Finger auf dem Auslöserknopf, Daumen unter dem Clickhaler.
Auslöserknopf einmal kräftig herunterdrücken. Clickhaler weiterhin aufrecht halten.
4. Tief ausatmen, dabei darauf achten, dass nicht in das Mundstück geblasen wird.
5. Mundstück eng anliegend zwischen die Lippen nehmen und tief einatmen. Das Arzneimittel wird durch den Atemstrom in die Lunge gesogen.
6. Atem mindestens 5 Sekunden anhalten, währenddessen Mundstück zwischen den Lippen hervorziehen.
7. Falls eine zweite Inhalation erforderlich ist, Clickhaler weiterhin in der aufrechten Position halten und Schritte
2. - 6. wiederholen.
8. Schutzkappe wieder aufsetzen.
Auf der Rückseite des Clickhalers ist ein Zählwerk, das die entnommenen Dosen zählt.
rnr6

bedeutet zum Beispiel, dass 116 Dosen entnommen wurden.
Wenn der Clickhaler nur noch 10 Dosen enthält, erscheinen rote Streifen im linken Feld.
Danach werden die letzten 10 Dosen gezählt. Nach Entnahme der letzten Dosis rastet der Auslöserknopf in gedrückter Position ein. Der Clickhaler ist jetzt leer.
Pflege des Clickhalers:
Der Clickhaler darf nicht mit Wasser in Berührung kommen, da dies die Funktion beeinträchtigen würde.
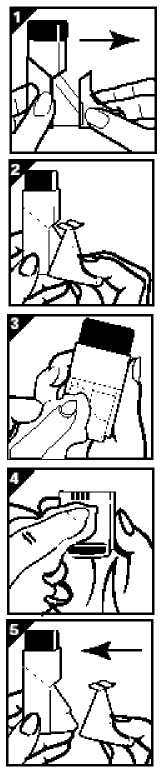
1. Schutzkappe entfernen.
2. Durch Drücken des Mundstücks kann dieses entfernt werden.
3. Clickhaler mit einem trockenen Tuch abreiben; bitte kein Wasser benutzen.
4. Mundstück mit einem trockenen Tuch abreiben; bitte keine Wasser benutzen.
5. Mundstück und Schutzkappe wieder aufsetzen.
4.3
4.4
Gegenanzeigen
Budesonid Mylan Clickhaler 0,2 mg darf nicht angewendet werden bei Überempfindlichkeit (Allergie) gegen Budesonid, Milchprotein oder den sonstigen Bestandteil.
Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Budesonid Mylan Clickhaler 0,2 mg ist nicht geeignet zur Behandlung der akuten Dyspnoe oder des Status asthmaticus. Hierzu sollten schnell-wirkende ß-Sympathomimetika oder vergleichbare Medikamente zur Anwendung kommen.
Falls die Erkrankung auch mit hohen Dosen von Budesonid nicht kontrolliert werden kann, ist eventuell die kurzzeitige Gabe systemischer Glukokortikoide notwendig. Die inhalative Behandlung sollte währenddessen weitergeführt werden.
Sollte die Exazerbation durch eine bakterielle Infektion verursacht sein, sollte ein geeignetes Antibiotikum verabreicht werden.
Bei Lungentuberkulose, Mykosen oder anderen Infektionen im Bereich der Atemwege soll Budesonid Mylan Clickhaler 0,2 mg nur eingesetzt werden, wenn diese angemessen behandelt werden.
Um das Risiko einer Candida-Infektion im Mund-Rachenbereich zu verringern, sollte Budesonid Mylan Clickhaler 0,2 mg vor den Mahlzeiten angewendet, der Mund nach jeder Inhalation ausgespült oder die Zähne geputzt werden. Gegebenfalls kann eine antimykotische Lokaltherapie der Candidose erforderlich sein. Die Behandlung mit Budesonid Mylan Clickhaler 0,2 mg muss dabei nicht unterbrochen werden.
Inhalativ anzuwendende Glukokortikoide können systemische Effekte verursachen, insbesondere wenn hohe Dosen über lange Zeiträume gegeben werden. Solche Reaktionen treten deutlich seltener auf als bei oraler Glukokortikoidgabe. Mögliche systemische Effekte sind Cushing-Syndrom, cushingoide Symtpome, Suppression der Nebennierenrinde, die Verminderung der Knochendichte, Wachstumsverzögerungen bei Kindern und Jugendlichen sowie Katarakt und Glaukom. Deshalb ist es wichtig, dass die niedrigste Dosis, mit der eine effektive Kontrolle der Erkrankung aufrechterhalten werden kann, verabreicht wird.
Einfluss auf das Wachstum
Es wird empfohlen, das Wachstum von Kindern, die eine Langzeittherapie mit inhalativ anzuwendenden Glukokortikoiden erhalten, regelmäßig zu kontrollieren. Bei Wachstumsverzögerungen sollte die Therapie überdacht werden mit dem Ziel, die Dosis des inhalativ anzuwendenden Glukokortikoids auf die niedrigste Dosis zu verringern, mit der eine effektive Kontrolle des Asthmas aufrecht erhalten werden kann. Der Nutzen der Kortikoidtherapie ist gegen das mögliche Risiko einer Wachstumshemmung sorgfältig abzuwägen. Zusätzlich sollte die Überweisung des Kindes bzw. Jugendlichen an einen Spezialisten für pädiatrische Pneumologie in Betracht gezogen werden.
Bei der Behandlung mit hohen Dosen, insbesondere bei Überschreitung der empfohlenen Dosierung, kann eine klinisch relevante Funktionsminderung der Nebennierenrinde mit einer verminderten Produktion bzw. einer bei gesteigertem Bedarf (Stresssituationen) nicht mehr ausreichend steigerbaren Produktion körpereigener Glukokortikoide auftreten. In solchen Fällen sollte in Stresssituationen oder Notfällen (z.B. schwere Infektionen und Verletzungen, vor Operationen) eine vorübergehende zusätzliche Glukokortikoidgabe zum Ausgleich der verminderten natürlichen Glukokortikoidproduktion erwogen werden.
Bei schweren Leberfunktionsstörungen kann die Metabolisierung von Budesonid verzögert sein, was zu erhöhten Plasmaspiegeln führen kann.
Durch die Anwendung von Budesonid Mylan Clickhaler 0,2 mg kann ein paradoxer Bronchospasmus ausgelöst werden. Dieser äußert sich mit Symptomen wie Atemnot und Giemen, die direkt nach der Inhalation auftreten. In diesem Fall sollte sofort ein Bronchodilatator mit schnellem Wirkungseintritt inhaliert werden. Die Behandlung mit Budesonid Mylan Clickhaler 0,2 mg sollte unverzüglich abgebrochen und ein Arzt konsultiert werden.
Sonstige Hinweise • Hinweise für nicht mit Glukokortikoiden vorbehandelte Patienten:
Bei Patienten, die zuvor keine oder nur gelegentlich eine kurzzeitige Glukokortikoidbehandlung erhalten haben, sollte die vorschriftsmäßige, regelmäßige
Anwendung von Budesonid Mylan Clickhaler 0,2 mg nach ca. 10 Tagen zu einer Verbesserung der Atmung führen. Starke Verschleimung und entzündliche Veränderungen können allerdings die Bronchien soweit verstopfen, dass Budesonid lokal nicht voll wirksam werden kann. In diesen Fällen sollte die Einleitung der Therapie mit systemischen Glukokortikoiden (beginnend mit 40 - 60 mg Prednisonäquivalent pro Tag) ergänzt werden. Die Inhalationen werden auch nach schrittweisem Abbau der systemischen Glukokortikoidgabe fortgesetzt.
• Hinweise für die Umstellung einer systemischen auf eine inhalative Glukokortikoidtherapie:
Patienten, die systemisch mit Glukokortikoiden behandelt werden, sollten bei vollständiger Kontrolle der Beschwerden auf eine inhalative Therapie mit Budesonid Mylan Clickhaler 0,2 mg umgestellt werden. Bei Patienten, die über längere Zeit systemische Glukokortikoide erhalten haben, ist die Nebennierenrindenfunktion gewöhnlich eingeschränkt. Daher muss die systemische Glukokortikoidgabe allmählich beendet werden. Zunächst sollte eine hohe Dosis an Budesonid als 2-mal tägliche Gabe verabreicht werden. Nach etwa 10 Tagen kann mit der Reduzierung der systemisch verabreichten Glukokortikoide begonnen werden (z. B. Reduktion um 2,5 mg Prednisolonäquivalent pro 1 - 2 Wochen).
Kommt es innerhalb der ersten Monate nach Umstellung von der systemischen Glukokortikoidgabe auf die Inhalationsbehandlung zu besonderen Stresssituationen oder Notfällen (z. B. schwere Infektionen, Verletzungen, Operationen), kann eine erneute systemische Glukokortikoidgabe notwendig werden, da aufgrund einer noch bestehenden Nebennierenrindeninsuffizienz die körpereigene Kortisolproduktion nicht ausreichend ist. Dies gilt auch für Patienten, die über längere Zeit hohe Dosen inhalativer Glukokortikoide erhalten haben.
Nach Umstellung auf inhalative Glukokortikoide können Symptome auftreten, die durch die vorhergehende systemische Gabe von Glukokortikoiden unterdrückt waren. Hierzu gehören z. B. Symptome einer allergischen Rhinitis, eines allergischen Ekzems, oder rheumatoide Beschwerden. Diese Symptome sollten zusätzlich mit geeigneten Arzneimitteln behandelt werden.
Manche Patienten leiden während der Umstellung unter unspezifischen Entzugssymptomen, obwohl sich ihre Lungenfunktion stabilisiert oder sogar verbessert hat. Diese Patienten sollten dazu angehalten werden, die Reduzierung des systemischen Glukokortikoides fortzusetzen, außer wenn klinische Zeichen, z. B. einer Nebennierenrindeninsuffizienz dem entgegenstehen.
4.5
Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Budesonid Mylan Clickhaler 0,2 mg kann die Wirksamkeit von ß2-Sympathomimetika zur Inhalation verstärken.
Die Metabolisierung von Budesonid wird durch Inhibitoren des Cytochrom-P450-3A4-Systems (u.a. Ketoconazol, Itraconazol, Clotrimazol, Ritonavir, Ciclosporin,
Ethinylestradiol und Troleandomycin) gehemmt, wodurch es zu einem Anstieg der systemischen Budesonidkonzentration kommen kann. Dies hat eine geringe klinische Bedeutung bei einer Kurzzeitbehandlung (1 - 2 Wochen), sollte aber bei Langzeitbehandlungen beachtet werden.
4.6 Schwangerschaft und Stillzeit
Schwangerschaft:
Erfahrungen mit der inhalativen Anwendung von Budesonid im ersten Trimenon an ca. 2500 Schwangeren haben keine Hinweise auf ein erhöhtes Risiko für teratogene Effekte ergeben. Ebenso wurden keine Hinweise auf eine Erhöhung der Rate an Früh- oder Totgeburten und auf eine Erniedrigung des Geburtsgewichtes nach einer in utero Exposition während des ersten Trimenons (basierend auf ca. 3000 Schwangerschaften) bzw. während der gesamten Schwangerschaft (basierend auf ca. 200 Schwangerschaften) gefunden.
Eine Anwendung von Budesonid Mylan Clickhaler 0,2 mg während der Schwangerschaft sollte aufgrund der in tierexperimentellen Studien beobachteten Nebenwirkungen (siehe 5.3) und der nicht abschließend beurteilten klinischen Relevanz für den Menschen nur nach sorgfältiger Nutzen-Risiko-Abwägung und so kurz wie möglich erfolgen. Es ist die zur Aufrechterhaltung einer Asthmakontrolle erforderliche geringste wirksame Dosis an Budesonid einzusetzen.
Stillzeit:
Es ist nicht bekannt, ob Budesonid wie andere Glukokortikoide in die Muttermilch übertritt. Obwohl die systemische Exposition mit Budesonid nach einer Inhalationstherapie gering ist (siehe 5.2), sollte eine Gabe von Budesonid Mylan Clickhaler 0,2 mg während der Stillzeit nur erwogen werden, wenn der für die Mutter erwartete Nutzen größer ist als ein mögliches Risiko für das Kind.
4.7 Auswirkung auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Keine bekannt
4.8 N ebenwirkungen
Folgende Nebenwirkungen können unter der Behandlung mit Budesonid Mylan Clickhaler 0,2 mg auftreten:
|
Sehr häufig (>1/10) |
häufig (>1/100- <1/10) |
gelegentlic h (>1/1000- <1/100) |
selten (>1/10 000-<1/1000) |
sehr selten (<1/10 000, einschließlich Einzelfällen) | |
|
Infektionen und parasitäre Erkrankungen |
oro pharyngeale Candidiasis | ||||
|
Erkrankungen des Immunsystems |
Überempfind lich- keitsreaktion en, anaphylaktis cher Schock | ||||
|
Erkrankungen des Endokriniums |
Hypo- und Hyperkortizis mus |
adrenale Suppression | |||
|
Psychiatrische Erkrankungen |
depressive Verstimmung en, Aggressivität , Reizbarkeit Ängstlichkeit , Psychosen, Verhaltensau f-fälligkeiten bei Kindern, Ruhelosigkeit , Nervosität |
|
Augenerkrankungen |
Katarakt, Glaukom | ||||
|
Erkrankungen der Atemwege und des Mediastinums |
Heiserkeit Husten Irritationen des Mund- und Rachenraumes |
Bronchospas men (s. 4.4), Dysphonie | |||
|
Erkrankungen der Haut und des Unterhautgewebes |
Exantheme, Urtikaria, Pruritus, Erythem, Angioödem | ||||
|
Erkrankungen der Muskulatur, des Skelettes und des Bindegewebes |
Wachstums verzögerung |
Minderung der Knochendichte |
Inhalativ anzuwendende Glukokortikoide können systemische Nebenwirkungen verursachen, insbesondere wenn hohe Dosen über lange Zeiträume gegeben werden. Mögliche Nebenwirkungen schließen die adrenale Suppression, die Verminderung der Knochendichte, Wachstumsverzögerungen bei Kindern und Jugendlichen sowie Katarakt und Glaukom mit ein.
Lactose, der nicht-wirksame Bestandteil von Budesonid Mylan Clickhaler 0,2 mg enthält geringe Mengen Milchprotein und kann Allergien hervorrufen.
4.9 Überdosierung
a) Symptome einer Überdosierung
Akute Intoxikationen mit Budesonid Mylan Clickhaler 0,2 mg sind nicht bekannt. Bei chronischer Überdosierung können systemische Glukokortikoideffekte, wie z. B. eine erhöhte Infektanfälligkeit, ein Hyperkortizismus und eine Nebennierenrindeninsuffizienz auftreten.
b) Therapiemaßnahmen bei Überdosierung
Bei kurzfristiger Überdosierung ist keine spezielle Notfallbehandlung erforderlich. Die Inhalationsbehandlung sollte in der vorgeschriebenen Dosierung fortgesetzt werden. Die Nebennierenrindenfunktion erholt sich innerhalb weniger Tage.
In Stresssituationen kann eine "Kortikoidschutzbehandlung" (z. B. hochdosierte Gabe von Hydrocortison) erforderlich sein.
Bei einer chronischen Überdosierung kann eine Nebennierenrindenatrophie auftreten. Diese Patienten sind Glukokortkoidabhängig und müssen bis zur Stabilisierung des Zustandes auf die entsprechende Erhaltungsdosis eines systemischen Glukokortikoids eingestellt werden.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
ATC-Code: R03 B A 02
Pharmakotherapeutische Gruppe: Topisches Glukokortikoid
Budesonid ist ein synthetisches Glukokortikoid. Nach oraler Inhalation hat es einen lokalen entzündungshemmenden Effekt auf die Bronchialschleimhaut. Der Wirkungsmechanismus der Glukokortikoide ist noch nicht vollständig aufgeklärt. Glukokortikoide wirken sowohl auf T-Zellen, Eosinophile, Neutrophile, Makrophagen als auch auf Mastzellen. Wichtige antientzündliche Effekte sind zum Beispiel die Hemmung der Ausschüttung von Entzündungsmediatoren und die Zytokin-vermittelte Immunantwort. Klinisch macht sich dieser Effekt zum Beispiel durch eine Reduktion krankheitsbezogener Symptome, (z.B. Atemnot) bemerkbar. Die Hyperreagibilität des Bronchialsystems auf exogene Reize wird reduziert.
Die Affinität von Budesonid zum Glukokortikoidrezeptor ist etwa 15-mal stärker als die von Prednisolon.
Einfluss auf die Plasmakortisolkonzentration
Studien, in denen gesunde Probanden mit Budesonid zur Inhalation behandelt wurden, haben eine dosisabhängige Wirkung auf die Plasma- und Urinkortisolwerte gezeigt. ACTH-Tests beweisen, dass Budesonid zur Inhalation in den empfohlenen Dosierungen einen signifikant geringeren Einfluss auf die Nebennierenfunktion hat als Prednison 10 mg.
Kinder und Jugendliche
Spaltlampenuntersuchungen wurden bei 157 Kindern (im Alter von 5 bis 16 Jahren) durchgeführt, die 3 bis 6 Jahre mit einer durchschnittlichen Tagesdosis von 504 Mikrogramm Budesonid zur Inhalation behandelt wurden. Die Ergebnisse wurden mit 111 gleichaltrigen asthmatischen Kindern verglichen. Budesonid zur Inhalation war nicht mit einem erhöhten Auftreten einer Cataracta subcapsularis posterior verbunden.
5.2Pharmakokinetische Eigenschaften
Resorption:
Nach oraler Inhalation werden Spitzenplasmakonzentrationen von Budesonid innerhalb von 30 Minuten erreicht. Die maximale Plasmakonzentration nach wiederholter zweimal täglicher Inhalation einer Dosis von 800 Mikrogramm Budesonid beträgt ca. 4 nmol/l.
Die maximale Plasmakonzentration und das Profil der Fläche unter der KonzentrationsZeit-Kurve erhöht sich linear zur Dosis, ist aber nach wiederholter Dosis (3 Wochen Behandlungsdauer) im Vergleich zur Einmaldosis leicht erhöht (20-30 %). Die Deposition in der Lunge gesunder Probanden wurde auf 34 % ± 10 % der abgemessenen Dosis (arithmetisches Mittel ± SD) geschätzt, während 22 % im Mundstück verblieben und der Rest (ungefähr 45 % der abgemessenen Dosis) verschluckt wurde.
Verteilung:
Das Verteilungsvolumen von Budesonid bei Erwachsenen beträgt etwa 3 l/kg.
Die Plasmaproteinbindung beträgt 85 - 90%.
Biotransformation:
Budesonid wird in sehr hohem Maße (ca. 90 %) bei der ersten Leberpassage zu Metaboliten mit niedrigerer Glukokortikosteroidaktivität metabolisiert. Die Glukokortikosteroidaktivität der Hauptmetaboliten 6-beta-Hydroxybudesonid und 16-alpha-Hydroxyprednisolon beträgt weniger als 1 % der Budesonid-Aktivität. Damit sind systemische Bioverfügbarkeit und Toxizität begrenzt. Budesonid wird hauptsächlich über CYP3A4, eine Untergruppe des Cytochrom-P-450-Systems, metabolisiert.Damit sind die systemische Bioverfügbarkeit und Toxizität begrenzt.
Elimination:
Die Metaboliten werden unverändert oder in konjugierter Form hauptsächlich über die Nieren ausgeschieden. Unverändertes Budesonid ist im Urin nicht nachgewiesen worden. Die systemische Clearance von Budesonid ist bei gesunden Erwachsenen hoch (ungefähr
1,2 l/min) und die terminale Plasmahalbwertszeit beträgt nach i.v.-Dosierung bei Erwachsenen durchschnittlich 2-3 Stunden.
Linearität
Bei klinisch relevanten Dosen ist die Pharmakokinetik von Budesonid dosisproportional.
Kinder und Jugendliche
Budesonid hat eine systemische Clearance von ungefähr 0,5 l/min bei asthmatischen Kindern im Alter von 4 bis 6 Jahren. Pro kg Körpergewicht haben Kinder eine Clearance, die ungefähr 50 % größer ist als die bei Erwachsenen. Die terminale Halbwertszeit von Budesonid nach Inhalation beträgt bei asthmatischen Kindern ungefähr 2,3 Stunden. Diese entspricht ungefähr der von gesunden Erwachsenen. Die Plasmakonzentration erreicht den Cmax-Wert (4,85 nmol/l) bei asthmatischen Kindern, die mit Budesonid zur Inhalation behandelt werden (800 Mikrogramm als Einzeldosis), 13,8 Minuten nach Inhalation, wonach sie dann rapide abfällt. Die Fläche unter der Konzentrations-ZeitKurve (AUC) betrug 10,3 nmol/l. Der AUC-Wert ist generell vergleichbar mit dem, der bei gleicher Dosis bei Erwachsenen beobachtet wurde, allerdings tendiert der Cmax-Wert bei Kindern zu höheren Werten. Die Deposition in der Lunge bei Kindern (31 % der abgemessenen Dosis) ist ähnlich der, die bei gesunden Erwachsenen gemessen wurde (34 % der abgemessenen Dosis).
5.3 Präklinische Daten zur Sicherheit
Toxikologische Eigenschaften a) Akute Toxizität
Die akute Toxizität von Budesonid wurde bei verschiedenen Applikationsarten bei Ratten und Mäusen untersucht. Die nachfolgende Tabelle gibt die Ergebnisse
|
wieder: | ||
|
Spezies |
Applikationsart |
LD50(m§/kg) |
|
Maus |
oral |
> 800 |
|
Ratte |
subkutan |
20 |
|
Ratte |
oral |
400 |
b) Subakute und chronische Toxizität
Budesonid wurde inhalativ über 12 Monate bei Hunden und Ratten verabreicht. Selbst bei 10 - 40fach - im Vergleich zum klinischen Gebrauch - höheren Dosen wurden keine Zeichen lokaler toxischer Effekte in den Atemwegen beobachtet.
c) Mutagenes und Tumorerzeugendes Potential
Die mutagenen Eigenschaften von Budesonid wurden in sechs unterschiedlichen Testmodellen überprüft. Budesonid zeigte in keinem dieser Tests mutagene oder klastogene Eigenschaften.
In einer Kanzerogenitätsstudie wurde eine erhöhte Inzidenz von Gliomen im Gehirn männlicher Ratten gefunden, die in einer Wiederholungsstudie nicht verifiziert werden konnte. In dieser Studie unterschied sich die Inzidenz der mit Verum behandelten Gruppen (Budesonid, Prednisolon, Triamcinolonacetonid) und der Kontrollgruppe nicht.
Leberveränderungen (vornehmlich hepatozelluläre Neoplasmen), die sowohl in der ersten Kanzerogenitätsstudie als auch in der Wiederholungsstudie für Budesonid gefunden wurden, traten in gleichem Maße auch bei den Referenz-Glukokortikoiden auf. Diese Effekte sind höchstwahrscheinlich als Rezeptoreffekt zu interpretieren und stellen somit einen Klasseneffekt dar.
d) Reproduktionstoxizität
Glukokortikoide zeigten in Tierversuchen teratogene Aktivitäten (z. B. Gaumenspalte, skelettale Anomalien). Die klinische Relevanz dieser Eigenschaften ist bisher nicht geklärt. Budesonid zeigte bei Nagern nach subkutaner Gabe die schon von anderen Glukokortikoiden bekannten Veränderungen; diese waren bei Budesonid im Vergleich zu anderen topischen Glukokortikoiden jedoch oft weniger ausgeprägt.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Lactose-Monohydrat (enthält geringe Mengen an Milchproteinen).
6.2 Inkompatibilitäten
Keine bekannt.
6.3 Dauer der Haltbarkeit
Die Dauer der Haltbarkeit beträgt im unversehrten Behältnis 2 Jahre.
Nach Öffnen der Folienverpackung ist Budesonid Mylan Clickhaler 0,2 mg innerhalb von 6 Monaten aufzubrauchen.
Dieses Arzneimittel soll nach Ablauf des Verfallsdatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Wie ist aufzubewahren?
Den Inhalator stets mit geschlossener Schutzkappe und vor Feuchtigkeit geschützt aufbewahren.
6.5 Art und Inhalt des Behältnisses
Packung mit 1 Pulverinhalator zu 1,8 g Pulver zur Inhalation (entsprechend mind. 200 Einzeldosen), Bündelpackung mit 2 Pulverinhalatoren mit jeweils 1,8 g Pulver zur Inhalation (entsprechend mind. 200 Einzeldosen je Pulverinhalator).
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
8.
9.
10.
Mylan dura GmbH Postfach 10 06 35 64206 Darmstadt
Zulassungsnummer
26068.00.00
Datum der Erteilung der Zulassung
05.11.1996
Stand der Information
Mai 2014
Verkaufsabgrenzung
Verschreibungspflichtig
11.