Canesten Extra Spray
1
Fachinformation
1

1. BEZEICHNUNG DER ARZNEIMITTEL
Canesten® Extra Spray Wirkstoff: Bifonazol
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: 1 g Lösung (des Sprays) enthält 10 mg Bifonazol.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1
3. DARREICHUNGSFORMEN
Spray (Lösung) zur Anwendung auf der Haut
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Mykosen der Haut, verursacht durch Dermatophyten, Hefen, Schimmelpilze und andere Pilze wie Malassezia furfur. Dies können sein z. B. Tinea pedis, Tinea manuum, Tinea corporis, Tinea inguinalis, Pityriasis versicolor, oberflächliche Candidiasis sowie Erythrasma (Erkrankung durch Corynebacterium minutissimum).
4.2 Dosierung und Art der Anwendung Dosierung
Canesten Extra Spray wird 1 mal täglich, am besten abends vor dem Zubettgehen, auf die befallenen Hautpartien dünn aufgetragen und eingerieben. Meist genügt 1 - 2 maliges Niederdrücken des Sprühkopfes zum Auftragen und Einreiben einer etwa handtellergroßen Fläche.
Um eine dauerhafte Ausheilung zu erreichen, sollte die Behandlung mit Canesten Extra Spray auch dann über folgende Behandlungszeiten durchgeführt werden, wenn die Beschwerden bereits abgeklungen sind.
Die Behandlungsdauer beträgt im Allgemeinen bei:
|
Tinea pedis, Tinea pedum interdigitalis |
3 Wochen |
|
Tinea corporis, Tinea manuum, Tinea inguinalis |
2 - 3 Wochen |
|
Pityriasis versicolor |
2 Wochen |
|
Erythrasma |
2 Wochen |
|
oberflächlichen Candidiasis der Haut |
2 - 4 Wochen |
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Patienten, die Überempfindlichkeitsreaktionen gegenüber anderen Imidazol-Antimykotika (z.B. Econazol, Clotrimazol, Miconazol) in der Vorgeschichte aufweisen, dürfen Bifonazol-haltige Arzneimittel nur mit Vorsicht anwenden.
Canesten Extra Spray nicht in die Augen bringen. Nicht einnehmen.
Canesten Extra Spray sollte bei Säuglingen und Kleinkindern nur unter ärztlicher Aufsicht angewendet werden. Eine orale Aufnahme sollte verhindert werden.
Canesten Extra Spray nicht in Flammen oder auf glühende Gegenstände sprühen. Von Zündquellen fernhalten - nicht rauchen. Die Spraylösung ist aufgrund des Ethanolgehaltes leichtentzündlich.
Patienten sollten ihren Arzt informieren, wenn keine Besserung eintritt.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Limitierte Daten deuten darauf hin, dass eine Wechselwirkung zwischen topisch appliziertem Bifonazol und Warfarin möglich ist, unter Anstieg des INR-Wertes. Bei gleichzeitiger Anwendung von Bifonazol und Warfarin sollte bei den Patienten daher eine entsprechende Kontrolle erfolgen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Es liegen keine hinreichenden Daten für die Anwendung von Bifonazol bei Schwangeren vor. Tierexperimentelle Studien haben bei oraler Anwendung eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3.). Das potentielle Risiko für den Menschen ist nicht bekannt. Da es sich bei Bifonazol um einen ausschließlich topisch angewendeten Wirkstoff handelt, ist ein Risiko jedoch nicht zu erwarten. Trotzdem sollte aus Vorsichtsgründen die Anwendung von Bifonazol während der Schwangerschaft nur nach sorgfältiger NutzenRisiko-Abschätzung erfolgen. Die Anwendung von Bifonazol während des 1. Trimenon der Schwangerschaft sollte vermieden werden.
Es ist nicht bekannt, ob Bifonazol beim Menschen in die Muttermilch übergeht. Die zur Verfügung stehenden pharmakodynamischen / toxikologischen Daten vom Tier zeigten, dass Bifonazol / Metabolite in die Milch übergehen (für Details siehe Abschnitt 5.3). Aus Vorsichtsgründen sollte während der Behandlung mit Bifonazol das Stillen unterbrochen werden.
Präklinische Studien geben keinen Hinweis, dass Bifonazol die männliche oder weibliche Fertilität beeinträchtigt (siehe Abschnitt 5.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Canesten Extra Spray hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
|
Sehr häufig: |
> 1/10 |
|
Häufig: |
> 1/100 bis 1/10 |
|
Gelegentlich: |
> 1/1.000 bis 1/100 |
|
Selten: |
> 1/10.000 bis 1/1.000 |
|
Sehr selten: |
< 1/10.000 |
|
Nicht bekannt: |
Häufigkeit aufgrund der verfügbaren Datenlage nicht abschätzbar |
Im Rahmen der Anwendung von Bifonazol nach der Zulassung wurden die folgenden Nebenwirkungen identifiziert. Da diese freiwillig von Patientengruppen unbekannter Größe gemeldet wurden, ist eine Angabe der Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort (Häufigkeit nicht bekannt):
Schmerzen am Verabreichungsort, periphere Ödeme (am Verabreichungsort)
Erkrankungen der Haut und des Unterhautzellgewebes (Häufigkeit nicht bekannt): trockene Haut, Hautirritation, Hautaufweichung, Hautabschuppung, Rötung, Brennen, Juckreiz, Ausschlag, Ekzem, Bläschen, Nesselsucht, Kontaktdermatitis, allergische Dermatitis
Diese Nebenwirkungen sind nach Beendigung der Behandlung reversibel.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Es wird kein akutes Intoxikationsrisiko gesehen, da eine Intoxikation nach einmaliger Applikation einer Überdosis auf die Haut (Anwendung auf einer großen Fläche unter resorptionsfördernden Bedingungen) oder versehentlicher oraler Einnahme unwahrscheinlich ist.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe:
Antimykotika zur topischen Anwendung, Imidazol- und Triazol-Derivate ATC-Code: D01AC10
Bifonazol ist ein Breitspektrum-Antimykotikum aus der Gruppe der Imidazol-Derivate mit Wirkung auf Dermatophyten, Hefen, Schimmelpilze und andere Pilze, wie Malassezia furfur; ferner wirkt es gegen Corynebacterium minutissimum.
Bifonazol hemmt die Ergosterol-Biosynthese an zwei verschiedenen Teilschritten der Synthesekette. Dieser doppelte Wirkansatz unterscheidet Bifonazol von anderen Azol-Derivaten und anderen Antimykotika. Die Hemmung der Ergosterol-Biosynthese führt so zu Störungen im Aufbau und in der Funktion der Zytoplasmamembran. Ergosterol ist ein essentieller Bestandteil der Zellmembran von Pilzen (siehe Abbildung).
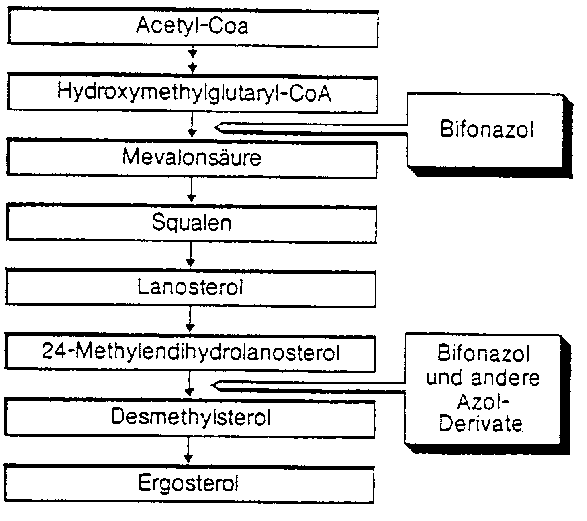
Bifonazol zeigt ausgeprägte fungizide Effekte auf Dermatophyten, dies bereits bei Konzentrationen von 5 pg/ml und einer Einwirkungszeit von 6 Stunden. Gegenüber Hefen, wie z. B. Candida-Arten, wirkt Bifonazol in Konzentrationen von 20 pg/ml fungizid.
Darüber hinaus zeigt der Wirkstoff Hemmwirkung in Konzentrationen, die um den Faktor 2 bis 10 unter den MHK-Werten (minimale Hemmkonzentration) liegen. Bereits mit 3 pg/ml Substrat wird rasch proliferierendes Myzel von Trichophyton mentagrophytes gehemmt.
Bifonazol zeigt eine günstige Resistenzlage. Primär resistente Varianten empfindlicher Pilzspezies sind selten. Untersuchungen ergaben bisher keinen Hinweis auf eine Entwicklung sekundärer Resistenz bei ursprünglich empfindlichen Pilzstämmen.
5.2 Pharmakokinetische Eigenschaften Absorption
Bifonazol penetriert gut in die von der Infektion betroffenen Hautschichten. 6 Stunden nach Applikation werden Konzentrationen gemessen, die die MHK-Werte für die bei Dermatomykosen wichtigen Pilze erreichen oder um ein Vielfaches überschreiten: zwischen 1000 pg/cm3 in der obersten Schicht der Epidermis (Stratum corneum) und 5 pg/cm3 im Stratum papillare.
Die Hautverweildauer, gemessen als infektprotektive Wirkung am Meerschweinchen, beträgt für Canesten Extra Spray mindestens 36 bis 48 Stunden.
Die lange Hautverweildauer von Canesten Extra Spray in antimykotischen wirksamen Konzentrationen und die Berücksichtigung des fungiziden Wirkungstyps sind die Basis für die Einmal-Applikation in der lokalen Therapie.
Bei Resorptionsuntersuchungen nach topischer Applikation an intakter menschlicher Haut lagen die Konzentrationen im Serum stets unter der Nachweisgrenze (< 1 ng/ml), nur bei entzündeter Haut ließ sich eine geringe Resorption nachweisen. Diese äußerst geringen Wirkstoffkonzentrationen (im Allgemeinen weniger als 5 ng/ml) lassen eine systemische Wirkung nicht erwarten.
5.3 Präklinische Daten zur Sicherheit
Die präklinischen Daten zeigen keine besonderen Gefahren für den Menschen basierend auf konventionellen Studien zur Toxizität bei einmaliger Verabreichung und zur Genotoxizität (Mutagenität).
Auswirkungen auf die Leber (Enzyminduktion, Leberverfettung) wurden in Toxizitätstudien bei wiederholter oraler Verabreichung, die über der maximalen Exposition beim Menschen lagen, beobachtet und haben damit geringe Relevanz für die klinische Anwendung.
Mit Bifonazol wurden keine Karzinogenitätsstudien durchgeführt.
In Reproduktionstoxikologischen Studien an Kaninchen führten orale Dosen von 30 mg/kg Körpergewicht zu Embryotoxizität einschließlich Letalität. An Ratten zeigten orale Dosen von bis zu 100 mg/kg Körpergewicht keine Embryotoxizität, jedoch führten solche oralen Dosen zu einer verzögerten Skelettentwicklung der Feten. Dieser fetale Effekt auf die Skelettentwicklung kann als ein sekundärer Effekt, aus der mütterlichen Toxizität (Reduktion des Körpergewichts) resultierend, betrachtet werden.
Aufgrund der geringen Absorption des Wirkstoffs über die Haut haben diese Ergebnisse wenig Relevanz für die klinische Anwendung.
Bifonazol passiert die Plazentaschranke bei Ratten. Eine Studie mit säugenden Ratten, die Bifonazol intravenös erhielten, zeigte, dass das Arzneimittel in die Milch abgeschieden wurde.
In oralen Dosen von bis zu 40 mg/kg Körpergewicht wurde keine Beeinträchtigung der männlichen oder weiblichen Fertilität bei Ratten beobachtet.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Ethanol 96%, Isopropylmyristat (Ph. Eur.).
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
5 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für diese Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Glasflasche und Pumpzerstäuber in Faltschachteln mit 25 ml Lösung.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und besondere Hinweise zur Handhabung
Vor der erstmaligen Anwendung muss der Sprühkopf einige Male betätigt werden, bevor die Lösung versprüht werden kann.
7. INHABER DER ZUZLASSUNG
Bayer Vital GmbH 51368 Leverkusen Deutschland
Telefon: (0214) 301
Telefax: (0214) 30 57 209
E-Mail-Adresse: baver-vital@bayerhealthcare.com
8. ZULASSUNGSNUMMERN
27249.00.02
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
20.08.1993 / 19.09.2003
10. STAND DER INFORMATION
März 2014
11. VERKAUFSABGRENZUNG
Apothekenpflichtig