Clivarin 1.750
Gebrauchsinformation: Information für den Anwender
Clivarin 1.750
1432 I.E. (Ph. Eur., entsprechend 1750 I.E. 1. Int. Standard) anti-Xa/0,25 ml, Injektionslösung
Wirkstoff: Reviparin-Natrium
Zur Anwendung bei Erwachsenen
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung
dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt oder Apotheker.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich bitte Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind (siehe Abschnitt 4).
Was in dieser Packungsbeilage steht:
1. Was ist Clivarin 1.750 und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Clivarin 1.750 beachten?
3. Wie ist Clivarin 1.750 anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Clivarin 1.750 aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. WAS IST CLIVARIN 1.750 UND WOFÜR WIRD ES ANGEWENDET?
Der Wirkstoff von Clivarin 1.750, Reviparin-Natrium, wird aus Heparin der
Schweinedarmmukosa hergestellt und besteht aus fraktioniertem, niedermolekularem
Heparin.
Clivarin 1.750 ist ein Antikoagulans, das die Blutgerinnung hemmt.
Clivarin 1.750 wird angewendet:
- zur Verhütung von Gefäßverschlüssen durch Blutgerinnsel (tiefe Venenthrombosen) bei und nach operativen Eingriffen bei Patienten mit einem niedrigen oder mittleren Thromboserisiko (z. B. Allgemeinchirurgie).
- zur Verhütung von Gefäßverschlüssen durch Blutgerinnsel (tiefe Venenthrombosen) bei verletzten, ruhiggestellten Patienten mit einem mittleren Thromboserisiko (ruhigstellende Verbände, z. B. nach Knochenbrüchen, Achillessehnenriss).
Hinweis:
Bewährte zusätzliche nicht-medikamentöse postoperative gerinnungshemmende Maßnahmen
sind weiterhin zu fördern.
2. WAS SOLLTEN SIE VOR DER ANWENDUNG VON CLIVARIN 1.750 BEACHTEN?
Clivarin 1.750 darf nicht angewendet werden,
- wenn Sie überempfindlich (allergisch) gegen Reviparin-Natrium oder andere niedermolekulare Heparin-Zubereitungen oder einen der sonstigen Bestandteile von Clivarin sind.
Dazu gehört auch eine durch Heparin verursachte (bekannte oder vermutete), allergisch bedingte verminderte Zahl der Blutplättchen (Thrombozytopenie Typ II).
- Wenn bei Ihnen eine erhöhte Blutungsgefahr oder eine Blutung vorliegt, darf Reviparin-Natrium wie auch andere Antikoagulantien nicht angewendet werden, wie z. B. akute Blutung, Krankheitszustände mit Blutungsneigung (hämorrhagische Diathese), Mangel an Gerinnungsfaktoren, stark verminderte Zahl der Blutplättchen (schwere Thrombozytopenie), unkontrollierter Bluthochdruck (Hypertonie), bakterielle Entzündung der Herzinnenhaut (bakterielle Endokarditis) einschließlich derjenigen mit verzögerter Verlaufsform (subakute Endokarditis), akutes Magen- und/oder Darmgeschwür oder akute Magenblutung, Gehirnblutung und Gefäßerweiterung im Gehirn (zerebrales Aneurysma), chirurgischer Eingriff am Rückenmark oder am zentralen Nervensystem oder am Ohr oder an den Augen, Blutungen im Auge oder entsprechende Verletzungen.
- wenn Sie eine schwere Einschränkung der Leberfunktion haben.
- wenn Sie eine schwere Einschränkung der Nierenfunktion (Kreatinin-Clearance < 30 ml/min) haben.
- wenn Sie eine schwere Einschränkung der Funktion der Bauchspeicheldrüse haben.
- wenn Reviparin in therapeutischer Dosierung angewendet wird und wenn bei Ihnen mittels Einstichs einer Hohlnadel Rückenmarksflüssigkeit zu Untersuchungszwecken entnommen wird (Lumbalpunktion).
- wenn Reviparin in therapeutischer Dosierung angewendet wird und wenn bei Ihnen eine rückenmarknahe Narkose (spinale oder epidurale Anästhesie) durchgeführt wird.
- wenn Sie Netzhauterkrankungen im Auge (Retinopathien) haben.
- wenn bei Ihnen eine Fehlgeburt droht (Abortus imminens).
Besondere Vorsicht bei der Anwendung von Clivarin 1.750 ist erforderlich,
- wenn bei Ihnen der Verdacht auf eine bösartige Erkrankung (Malignom) mit Blutungsneigung besteht.
- wenn bei Ihnen ein Nieren- und/oder Harnleiterstein diagnostiziert wurde.
- wenn Sie gleichzeitig Medikamente einnehmen/anwenden, die den Kaliumspiegel im Blut erhöhen, sowie bei gleichzeitiger Einnahme von Gerinnungshemmern (oralen Antikoagulantien oder Plättchenaggregationshemmern [z. B. Acetylsalicylsäure]), Cephalosporin-Antibiotika.
- Blutung: Wenn Sie bereits mit anderen blutgerinnungshemmenden Arzneimitteln (Antikoagulantien) oder solchen, die innerhalb eines Blutgefäßes die Zusammenballung von Blutplättchen hemmen (Thrombozytenaggregationshemmer), behandelt werden, sollte Clivarin 1.750 wie auch andere Antikoagulantien nur mit äußerster Vorsicht angewendet werden.
- wenn bei Ihnen eine Hirnblutung (zerebraler Insult), die Ausweitung eines arteriellen Blutgefäßes im Gehirn (zerebrales Aneurysma) oder ein Tumor im Gehirn (zerebrales Neoplasma) vorliegt.
- Wenn bei Ihnen eine rückenmarknahe Narkose (epidurale oder spinale Anästhesie) oder Lumbalpunktion durchgeführt wird, kann die vorbeugende Anwendung von Heparin (die Blutgerinnung hemmender Wirkstoff) sehr selten mit rückenmarknahen Hämatomen verbunden sein, die verlängerte oder dauernde Lähmungen zur Folge haben. Das Risiko ist erhöht bei gleichzeitiger Einnahme von Arzneimitteln, die die Blutgerinnung beeinflussen, wie z. B. bestimmte Arzneimittel gegen Schmerzen (nichtsteroidale Antirheumatika), Thrombozytenaggregationshemmer oder Antikoagulantien, sowie bei verletzungsbedingter oder wiederholter Punktion und bei der Anwendung eines rückenmarknahen Katheters zur Narkose. Clivarin 1.750 sollte in einem angemessenen Zeitintervall von 12 Stunden (Minimum 6 - 8 Stunden) vor und nach der Einführung oder der Entfernung des rückenmarknahen Katheters angewendet werden. Informieren Sie unverzüglich Ihren Arzt oder eine Krankenschwester bei Anzeichen und Symptomen neurologischer Beeinträchtigung, wie z. B. Rückenschmerzen, sensorischen und motorischen Ausfällen (Taubheit und Schwäche in den Unterschenkeln) sowie Darm- oder Blasenfunktionsstörungen.
- Wenn bei Ihnen Clivarin 1.750 oder andere niedermolekulare Heparine (LMWHs) angewendet werden, kann die Absonderung eines Nebennierenhormons (adrenale Sekretion von Aldosteron) unterdrückt werden, was zu einer Erhöhung der Kaliumkonzentration im Blut führen kann, besonders bei Erkrankungen wie z. B. Diabetes mellitus, chronischer Nierenfunktionsstörung, vorbestehender Störung im Säure-BasenHaushalt (metabolischer Azidose) oder wenn Sie Kalium-sparende Arzneimittel einnehmen. Bei verlängerter Einnahme von Kalium-sparenden Arzneimitteln besteht ein verstärktes Risiko für eine Erhöhung der Kaliumkonzentration im Blut. Vor Beginn der Therapie mit Clivarin 1.750 sollen bei Risikopatienten bestimmte Substanzen im Blut (Serumelektrolyte) gemessen und danach regelmäßig kontrolliert werden, besonders wenn die Behandlung mit Clivarin 1.750 über 7 Tage hinaus verlängert ist.
- Gelegentlich wurde zu Beginn einer Heparin-Behandlung eine leichte, vorübergehende Abnahme der Blutplättchen (Thrombozytopenie Typ I) beobachtet, die auf einer vorübergehenden Aktivierung der Blutplättchen basiert. In der Regel treten keine Komplikationen auf, sodass die Behandlung fortgesetzt werden kann.
- In seltenen Fällen wurde bei Anwendung von niedermolekularen Heparinen (LMWHs) eine durch Antikörper vermittelte schwere Abnahme der Blutplättchen (Thrombozytopenie Typ II) beobachtet. Diese Wirkung tritt meist innerhalb von 5 bis 21 Tagen nach Behandlungsbeginn auf. Bei Patienten, bei denen eine durch Heparin hervorgerufene Abnahme der Blutplättchen bekannt ist, kann dies früher auftreten.
- Wenn Sie von Clivarin 1.750 auf andere Heparine (unfraktioniertes Heparin oder andere niedermolekulare Heparine) umgestellt werden sollten, ist zu beachten, dass Clivarin 1.750 nicht eins zu eins (Einheit für Einheit) ersetzt werden kann, da sich die Wirkstoffe im Herstellungsprozess, in der Molekulargewichtsverteilung, in der Hemmung der Blutgerinnung (Anti-Xa- und Anti-IIa-Aktivitäten), in den Einheiten und in der Dosierung unterscheiden. Daher sind bei der Anwendung jedes dieser Arzneimittel besondere Vorsicht und Einhaltung der Gebrauchsinformation erforderlich.
- Clivarin 1.750 darf nicht intramuskulär angewendet werden. Intramuskuläre Injektionen anderer Arzneimittel sollten während der Behandlung mit Clivarin 1.750 wegen des erhöhten Risikos, Hämatome zu induzieren, vermieden werden.
Vorsichtsmaßnahmen
Clivarin 1.750 sollte nur unter strenger medizinischer Überwachung angewendet werden. Allgemein
Clivarin 1.750 darf nicht mit anderen Injektions- oder Infusionslösungen gemischt werden. Laboruntersuchungen
Während des Behandlungsverlaufs mit Clivarin 1.750 sind wiederholte Kontrollen der Blutplättchen angeraten.
Begleitmedikation
Vorsicht ist geboten bei Begleitmedikation mit Arzneimitteln, die den Serum-Kaliumspiegel erhöhen, die die Blutgerinnung hemmen (orale Antikoagulantien) und Acetylsalicylsäure (ASS).
Kinder
Daten zur Sicherheit und Wirksamkeit von Clivarin bei Kindern sind nur begrenzt verfügbar. Ältere Menschen
Bei älteren Patienten liegt oft eine eingeschränkte Nierenfunktion vor, die die Ausscheidung von Clivarin 1.750 reduziert. Daher sollte Clivarin 1.750 bei diesen Patienten mit Vorsicht angewendet werden.
Netzhautveränderungen im Auge bei bestehender Zuckererkrankung sind möglich (diabetische Retinopathie). Daher sollte Clivarin bei diesen Patienten nur mit Vorsicht angewendet werden.
Hinweis:
Wie durch Heparin können auch durch Reviparin-Natrium folgende klinisch-chemische Untersuchungsergebnisse verfälscht werden: Vortäuschung niedriger Cholesterinwerte im Serum, falsch hohe T3- und T4-Werte bei nicht nüchternen Patienten, falsch hohe Blutzuckerwerte (erhöht um bis zu 30 mg%), Verfälschung des Bromsulphthalein-Testes (Leberfunktionstest).
Weitere wichtige Informationen über Clivarin
Dieses Arzneimittel enthält 80 mg Natrium pro Milliliter. Wenn Sie eine kochsalzarme Diät einhalten müssen, sollten Sie dies berücksichtigen.
Bei Anwendung von Clivarin 1.750 mit anderen Arzneimitteln:
Bitte informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen/anwenden bzw. vor kurzem eingenommen/angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
Clivarin kann bei gleichzeitiger Behandlung die Wirkung nachfolgend genannter Arzneistoffe bzw. Präparategruppen beeinflussen und/oder durch diese in seiner Wirkung beeinflusst werden:
- Arzneimittel zur Hemmung der Blutgerinnung (Antikoagulantien, z. B. Dicumarole, Fibrinolytika) oder Arzneimittel, die den Serum-Kaliumspiegel erhöhen. Eine gleichzeitige Behandlung mit den Serum-Kaliumspiegel erhöhenden Medikamenten und Clivarin 1.750 soll nur mit besonders sorgfältiger ärztlicher Überwachung erfolgen.
- Wirkungsverstärkung durch bestimmte Arzneimittel gegen Schmerzen (nicht-steroidale Antirheumatika, z. B. Phenylbutazon, Indometacin), Arzneimittel zur Beeinflussung der Blutplättchenfunktion (Salicylate, Acetylsalicylsäure [ASS], Dipyridamol), bestimmte Lösungen zur Erhöhung des Blutvolumens (Plasmaexpander: Dextran), Sulfinpyrazon, Zytostatika (Arzneimittel zur Behandlung von Tumoren), hochdosiertes i.v.-Penicillin (Antibiotikum), Cephalosporine (Breitband-Antibiotika): Es besteht erhöhtes Blutungsrisiko.
- Infusion mit einem Arzneimittel zur Gefäßerweiterung (Nitroglycerin-Infusion): Die Heparinwirkung wird vermindert.
Verdrängung aus der Plasma-Eiweißbindung, z. B. Propranolol (Betablocker). Bindung basischer Medikamente, z. B. Chinin (Arzneimittel zur Behandlung von Malaria), und Abschwächung ihrer Wirkung.
Zusätzlich zeigt Heparin zahlreiche Wechselwirkungen mit anderen Mitteln, deren klinische Bedeutung unterschiedlich beurteilt wird.
Bitte beachten Sie, dass diese Angaben auch für vor kurzem angewandte Arzneimittel gelten können.
Schwangerschaft und Stillzeit
Fragen Sie vor der Einnahme/Anwendung von allen Arzneimitteln Ihren Arzt oder Apotheker um Rat.
Schwangerschaft:
Clivarin sollte Schwangeren nur mit Vorsicht verschrieben werden.
Stillzeit:
Die Anwendung von Clivarin während der Stillzeit wird nicht empfohlen.
Verkehrstüchtigkeit und das Bedienen von Maschinen
Es wurden keine Untersuchungen zu Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt.
3. WIE IST CLIVARIN 1.750 ANZUWENDEN?
Wenden Sie Clivarin 1.750 immer genau nach der Anweisung des Arztes an. Bitte fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht ganz sicher sind.
Falls vom Arzt nicht anders verordnet, ist die übliche Dosis:
- Zur Verhütung von Gefäßverschlüssen durch Blutgerinnsel (tiefe Venenthrombosen) bei und nach operativen Eingriffen bei Patienten mit einem niedrigen oder mittleren Thromboserisiko (z. B. Allgemeinchirurgie):
Soweit nicht anders verordnet, ist am Operationstag die erste Fertigspritze mit 0,25 ml Injektionslösung von Clivarin 1.750 etwa 2 Stunden vor Operationsbeginn zu verabreichen. Anschließend wird ab dem ersten Tag nach der Operation 1-mal täglich im 24-Stunden-Rhythmus jeweils eine Fertigspritze mit 0,25 ml Injektionslösung verabreicht.
- Zur Verhütung von Gefäßverschlüssen durch Blutgerinnsel (tiefe Venenthrombosen) bei verletzten, ruhiggestellten Patienten mit einem mittleren Thromboserisiko (ruhigstellende Verbände, z. B. nach Knochenbrüchen, Achillessehnenriss):
Soweit nicht anders verordnet, ist die erste Injektion von Clivarin 1.750 am Tag der Ruhigstellung der verletzten Extremität zu verabreichen. Anschließend wird ab dem darauffolgenden Tag 1-mal täglich im 24-Stunden-Rhythmus jeweils eine Fertigspritze mit 0,25 ml Injektionslösung verabreicht.
Wie und wann sollten Sie Clivarin 1.750 anwenden?
Nur zur subkutanen Anwendung! Die Fertigspritzen sind nur für die einmalige Anwendung bestimmt.
Nach dem Entfernen des Nadelschutzes ist die Fertigspritze gebrauchsfertig. Die subkutane Injektion soll in eine von zwei Fingern geformte Hautfalte der Bauchwand (zwischen Nabel und Beckenkamm) oder der Vorderseite des Oberschenkels erfolgen. Die Kanüle ist senkrecht einzustechen und genauso wieder zu entfernen.
Bitte lesen Sie die Bedienungsanleitung der Fertigspritze (mit Abbildungen), die Sie ausführlich mit deren Handhabung vertraut macht.
Wie lange sollten Sie Clivarin 1.750 anwenden?
Die Dauer der Anwendung wird vom behandelnden Arzt bestimmt. Die Therapiedauer richtet sich im Wesentlichen nach der Art der Erkrankung und der Risikodauer für den Patienten (Immobilisierung). Bei unkomplizierten Operationen kann man im Allgemeinen von einer Behandlungsdauer von 7 - 10 Tagen ausgehen. Bei nicht operierten immobilisierten Patienten erstreckt sich die Therapiedauer bis zur vollständigen Mobilisation, bei Patienten mit Gipsverbänden liegt sie zum Beispiel im Mittel bei 41 Tagen.
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, wenn Sie den Eindruck haben, dass die Wirkung von Clivarin 1.750 zu stark oder zu schwach ist.
Anwendung bei Kindern:
Clivarin ist zur Behandlung von Kindern nicht geeignet.
Anwendung bei eingeschränkter Nierenfunktion:
Bei Patienten mit leicht bis mäßig eingeschränkter Nierenfunktion sollte Clivarin mit Vorsicht angewendet werden (siehe Abschnitt 2 „Besondere Vorsicht ...“). Bei Patienten mit schwer eingeschränkter Nierenfunktion (Kreatinin-Clearance < 30 ml/min) ist die Anwendung von Reviparin kontraindiziert (siehe Abschnitt 2 „Clivarin 1.750 darf nicht angewendet werden ...“).
Anwendung bei eingeschränkter Leberfunktion:
Die Anwendung von Clivarin bei Patienten mit eingeschränkter Leberfunktion wurde nicht untersucht.
Wenn Sie eine größere Menge Clivarin 1.750 angewendet haben, als Sie sollten
Als Folge akuter Überdosierung können Blutungen in verschiedenen Körperregionen auftreten, z. B. in Haut und Schleimhäuten (Blutergüsse, flohstichartige Blutungen unter der Haut, Nasenbluten), aus Wunden, dem Magen-Darm-Trakt (Teerstuhl) und den ableitenden Harnwegen (Blut im Urin). Blutdruckabfall, Abfall des Hämatokrits oder andere Symptome können Zeichen einer verborgenen Blutung sein. Kleinere Blutungen oder Hämatome an der Injektionsstelle können auch bei normaler Dosierung auftreten und sollten normalerweise nicht zum Abbruch der Behandlung führen.
Bei dringendem Verdacht einer Überdosierung benötigen Sie ärztliche Hilfe!
Gegenmaßnahmen bei Überdosierung: Falls erforderlich kann als Gegenmittel (Antidot) bei Blutungen Protamin, 1250 I.E., langsam intravenös verabreicht werden. Dabei wird die Anti-IIa-Wirkung von Reviparin-Natrium (Verlängerung von aPTT und Thrombinzeit) rasch und komplett aufgehoben, die Anti-Xa-Wirkung jedoch nur zum Teil neutralisiert. Die intravenöse Protamin-Dosis sollte dabei der injizierten Dosis Clivarin 1.750 entsprechen: 1 mg Protamin neutralisiert 82 Anti-Xa-Einheiten (BRS) von Reviparin-Natrium. Die Bolusinjektion von Protamin sollte 50 mg nicht überschreiten (es wird auf die Fachinformation der Hersteller von Protamin verwiesen).
Wenn Sie die Anwendung von Clivarin 1.750 vergessen haben
Wenn Sie eine Injektion von Clivarin 1.750 vergessen haben, so sollten Sie die tägliche Verabreichung wie verordnet fortführen. Auf keinen Fall dürfen Sie deshalb zwei Injektionen unmittelbar hintereinander verabreichen.
Wenn Sie die Anwendung von Clivarin 1.750 abbrechen
Um einen zuverlässigen Effekt zur Prophylaxe der venösen Thromboembolie zu gewährleisten, ist es notwendig, die Injektionen für die vom Arzt angegebene Therapiedauer einzuhalten. Ein eigenmächtiges Absetzen oder Unterbrechen der Therapie kann nachteilige Folgen für Sie haben. Sprechen Sie bitte vorher mit Ihrem Arzt.
4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Wie alle Arzneimittel kann Clivarin Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt:
Häufig: weniger als 1 von 10, aber mehr als 1 von 100 Behandelten
Nicht bekannt Häufigkeit auf Grundlage der vorhandenen Daten nicht abschätzbar
Folgende Nebenwirkungen wurden unter Clivarin in klinischen Studien sowie in Beobachtungsstudien nach Markteinführung beobachtet:
|
Organsystem |
häufig (> 1/100, < 1/10) |
unbekannt (Häufigkeit auf Grundlage der vorhandenen Daten nicht abschätzbar) |
|
Erkrankungen des Blutes und des Lymphsystems |
Abfall der Blutplättchen (Thrombozytopenie)1 Disseminierte intravasale Koagulation1 | |
|
Erkrankungen des Immunsystems |
Überempfindlichkeitsreaktionen2 schwere allergische (anaphylaktische) Reaktionen2 | |
|
Endokrine Erkrankungen |
Hypoaldosteronismus3 | |
|
Erkrankungen des Nervensystems |
Kopfschmerzen | |
|
Gefäßerkrankungen |
Bluterguss (subkutanes Hämatom) Thrombose |
Thromobembolismus1 niedriger Blutdruck (Hypotonie)2 Blutung (Hämorrhagie)4 Bluterguss (subkutanes Hämatom)4, |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Nasenbluten |
Atemnot (Dyspnoe)2 Krampf der Bronchialmuskeln (Bronchospasmus)2 |
|
Erkrankungen des Gastrointestinaltraktes |
Verstopfung |
Erbrechen2 Übelkeit2 |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Hautnekrosen1 2 Nesselsucht (Urtikaria) 2 Juckreiz (Pruritus) Rötung (Erythem)6 Hautverfärbung6 | |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Schmerzen in den Beinen |
Osteoporose5 |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Fieber Blutung an der Injektionsstelle |
Verhärtung6 |
|
Untersuchungen |
auffälliger Leberfunktionstest |
auffälliger Leberfunktionstest7 Anstieg LDH7 Anstieg Lipase7 |
1
Ein leichter Abfall der Blutplättchen (Thrombozytopenie) kann auftreten. Schwere Thrombozytopenie kann auftreten, begleitet von einer disseminierten intravasalen Koagulation und/oder Thromboembolismus und/oder Hautnekrose an der subkutanen Injektionsstelle.
2
Überempfindlichkeitsreaktionen mit Symptomen wie Übelkeit, Nesselsucht (Urtikaria), Erbrechen, Juckreiz (Pruritus), Atemnot (Dyspnoe), Krampf der Bronchialmuskeln (Bronchospasmus) und niedrigem Blutdruck (Hypotonie) können auftreten. Überempfindlichkeits- und schwere allergische (anaphylaktische) Reaktionen unter Reviparin sind selten. Patienten, die schon einmal mit Reviparin und/oder Heparin behandelt wurden, sollten besonders genau beobachtet werden.
3
Krankheitszustände mit erhöhter Ausschüttung von Aldosteron (Hypoaldosteronismus; Aldosteron ist ein Hormon der Nebennierenrinde) verbunden mit einer Erhöhung des
Kaliumspiegels im Blut (Hyperkaliämie) und Störungen im Säure-Base-Haushalt (metabolische Azidose) können auftreten, insbesondere bei Patienten mit Einschränkung der Nierenfunktion und Zuckerkrankheit (Diabetes mellitus),
4Dosisabhängige Nebenwirkungen beinhalten eine erhöhte Blutungsneigung, besonders aus Haut, Schleimhaut, Wunden, Gastrointestinal- und Urogenital-Trakt. Bei normaler Dosierung kann eine leichte Blutung an der Injektionsstelle auftreten.
5
Nach einer ziemlich langen Behandlungsdauer (Monate) mit Standard-Heparin kann sich, besonders bei prädisponierten Patienten, eine Verminderung der Knochensubstanz und erhöhte Frakturanfälligkeit (Osteoporose) entwickeln. Diese Nebenwirkung kann für Reviparin nicht ausgeschlossen werden. Klinische Studien, sowohl mit anderen niedermolekularen Heparinen als auch mit Reviparin, haben gezeigt, dass das Osteoporose-Risiko deutlich (fünf-bis siebenmal) geringer ist als unter Standard-Heparin.
6An der Injektionsstelle wurden lokale Gewebsreaktionen (Verhärtungen, Rötungen, Verfärbungen und kleinere Hämatome) beobachtet.
7Erhöhungen bestimmter Enzyme im Blut (Lebertransaminasen (Alanin-Aminotransferase/ALT; Aspartat-Aminotransferase/AST; Gamma-Glutamyltransferase/Gamma-GT) sowie der LDH und Lipase) wurden beobachtet.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt über das nationale Meldesystem anzeigen.
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: http://www.bfarm.de/DE/Pharmakovigilanz/form/functions/formpv-node.html
Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. WIE IST CLIVARIN 1.750 AUFZUBEWAHREN?
Arzneimittel für Kinder unzugänglich aufbewahren.
Sie dürfen das Arzneimittel nach dem auf der Fertigspritze und der Faltschachtel unter „Verwendbar bis“ angegebenen Verfallsdatum nicht mehr verwenden.
Aufbewahrungsbedingungen:
In der Originalverpackung aufbewahren.
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Hinweis auf Haltbarkeit nach Anbruch oder Zubereitung
Das Arzneimittel darf nicht im Abwasser oder Haushaltsabfall entsorgt werden.
Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr benötigen. Diese Maßnahme hilft, die Umwelt zu schützen.
6. INHALT DER PACKUNG UND WEITERE INFORMATIONEN Was Clivarin 1.750 enthält:
Der Wirkstoff ist: Reviparin-Natrium.
1 Fertigspritze mit 0,25 ml Injektionslösung von Clivarin 1.750 enthält: Reviparin-Natrium, in der Anti-Xa-Wirksamkeit entsprechend 13,8 mg niedermolekularem Heparin zur Wertbestimmung BRS (entspricht 11,3 - 17,9 mg Heparinfragment).
Heparinfragment aus Heparin aus Schweinedarmmukosa durch Nitritspaltung (mittlere Molmasse 3150 - 5150).
Die sonstigen Bestandteile sind: Natriumchlorid, Natriumhydroxid, Wasser für Injektionszwecke.
Wie Clivarin 1.750 aussieht und Inhalt der Packung
Fertigspritze mit klarer, farbloser bis leicht gelblicher, wässriger, geruchsloser Lösung.
Originalpackung mit Originalpackung mit Originalpackung mit Originalpackung mit Originalpackung mit
2 Fertigspritzen zu je 0,25 ml Injektionslösung 5 Fertigspritzen zu je 0,25 ml Injektionslösung 10 Fertigspritzen zu je 0,25 ml Injektionslösung 20 Fertigspritzen zu je 0,25 ml Injektionslösung 50 Fertigspritzen zu je 0,25 ml Injektionslösung
Pharmazeutischer Unternehmer
Mylan Healthcare GmbH
Freundallee 9A
30173 Hannover
Telefon: 0511 / 6750-2400
Telefax: 0511 / 6750-3120
E-Mail: mylan.healthcare@mylan.com
Hersteller*
AbbVie Deutschland GmbH & Co. KG
Knollstraße
67061 Ludwigshafen
Alfa Wassermann S.P.A.
Via Enrico Fermi, 1 65020 Alanno (PE)
Italien
<* In der gedruckten Version wird nur der tatsächlich für die entsprechende Charge freigebende Hersteller angegeben.>
Diese Gebrauchsinformation wurde zuletzt im Januar 2016 überarbeitet.
Clivarin® 1.750, Injektionslösung in Fertigspritzen
Liebe Patientin, lieber Patient,
Ihr Arzt hat Ihnen zur Verhütung von Gefäßverschlüssen durch Blutgerinnsel der tiefen Beinvenen Clivarin 1.750 verordnet.
Die Heilbehandlung durch Ihren Arzt und die tägliche Anwendung der Clivarin 1.750 Fertigspritze können Sie vor dieser Komplikation schützen bzw. ein mögliches Risiko verringern. Es kommt dabei entscheidend auf Ihre aktive Mitarbeit an.
Sie schützen Ihre Gesundheit, indem Sie Clivarin 1.750 einmal täglich für die von Ihrem Arzt verordnete Dauer anwenden.
Der Arzt ist für Ihre Gesundheit der beste Ratgeber. Sollte Ihnen etwas unklar sein, so wenden Sie sich zuerst an ihn.
Informieren Sie bitte sofort Ihren Arzt bei akuten Beschwerden wie Schmerzen und Schweregefühl in den Beinen oder aber plötzlicher Atemnot, besonders wenn diese nach einer Operation oder nach Anlage eines Gipsverbandes auftreten.
Mit der richtigen Anwendung ein zuverlässiger Schutz
Clivarin 1.750 kann schnell und zuverlässig seine Wirkung entfalten, wenn es in das Unterhautgewebe der seitlichen Bauchregion gespritzt wird.
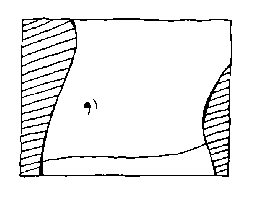
Das Hautgewebe ist an dieser Stelle dick genug, so dass Sie kaum Gefahr durch den kleinen Nadeleinstich zu befürchten haben. Suchen Sie sich Ihre schönste Bauchfalte aus, die seitlich genügend vom Bauchnabel entfernt ist.
Wenn eine Operationswunde besteht, wählen Sie bitte die andere Bauchseite.
Der Einstich ist eine saubere Sache
Für die Reinigung der Einstichstelle nehmen Sie einen Alkoholtupfer, den Sie in Ihrer Apotheke erhalten. Streichen Sie dabei aber immer nur in eine Richtung. Die ausgewählte Stelle ist jetzt medizinisch sauber.
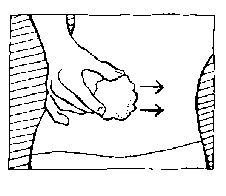
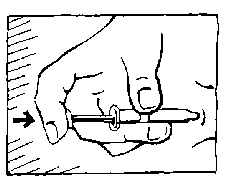
Ein Kniff und dann ein Pieks - mit dieser Reihenfolge liegen Sie richtig
Seitlich der sauberen Hautstelle heben Sie das Bauchgewebe jetzt mit Zeigefinger und Daumen leicht an, sodass Sie für die Nadel eine entsprechend große Bauchfalte in der Hand halten.
Nach diesem Kniff setzen Sie die Nadel senkrecht in der Mitte der gereinigten Stelle an.
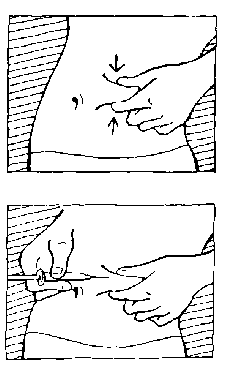
Wenn sich an der Nadelspitze ein Tropfen gebildet hat, so schütteln Sie ihn vorsichtig ab. Die Nadelspitze darf nicht berührt oder abgewischt werden. Eine Luftblase in der Spritze ist völlig ungefährlich und für die Anwendung ohne Bedeutung. Sie sollten daher auf keinen Fall versuchen, diese Luftblase aus der Spritze herauszudrücken, da sonst die genaue Dosierung beeinträchtigt wird.
Halten Sie mit Ihrer freien Hand den Kolben wie einen Füllfederhalter, und drücken Sie die
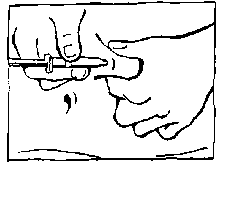
Nadel vollständig in das Gewebe.
Mit dem Zeigefinger dieser Hand drücken Sie jetzt den Spritzenstempel ganz durch. Behalten Sie dabei die Bauchfalte weiterhin fest in der Hand.
Clivarin 1.750 kann jetzt in Ihrem Körper schützend wirken.
Einfach, leicht und zuverlässig
Nachdem Sie die Nadel herausgezogen haben, halten Sie die Bauchfalte noch einen Moment fest und lassen sie dann langsam zurückgleiten. Wie Sie sehen werden, ist ein Pflasterverband in den meisten Fällen nicht erforderlich. An der Einstichstelle kann sich später eventuell ein kleiner blauer Fleck bilden. Dies ist normal und völlig harmlos.
Fragen Sie Ihren Arzt!

Beachten Sie die Angaben in der Gebrauchsinformation, und befolgen Sie den Rat Ihres Arztes. Wenden Sie Clivarin 1.750 einmal täglich für die vom Arzt verordnete Dauer an. Wenn Sie im Gebrauch unsicher sind, fragen Sie Ihren Arzt, und lassen Sie sich die genaue Handhabung noch einmal von ihm zeigen.
Jeder Tag ohne die schützende Wirkung von Clivarin 1.750 erhöht während der Heilbehandlung das Risiko eines Gefäßverschlusses.
Schützen Sie also aktiv Ihre Gesundheit!
Wir wünschen Ihnen gute Besserung!