Clomifen Ferring 50 Mg Tabletten
FACHINFORMATION
1. Bezeichnung des Arzneimittels
Clomifen FERRING 50 mg Tabletten
2. Qualitative und quantitative Zusammensetzung
Jede Tablette enthält 50 mg Clomifencitrat entsprechend 33,94 mg Clomifen Sonstiger Bestandteil: Jede Tablette enthält 67,5 mg Lactose-Monohydrat Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Runde, beigefarbene, biplane Tabletten mit Facette.
4. Klinische Angaben
4.1 Anwendungsgebiete
Bei Frauen mit Kinderwunsch und funktioneller weiblicher Sterilität als Folge einer nor-moprolaktinämischen hypothalamisch-hypophysären Dysfunktion wie Lutealinsuffizienz, anovulatorische Zyklen und Amenorrhoe mit nachweisbarer endogener Estrogenproduktion und normalen oder niedrigen FSH-Spiegeln.
4.2 Dosierung und Art der Anwendung
Dosierung
Die Behandlung mit Clomifen FERRING darf nur unter Kontrolle eines Arztes durchgeführt werden. Dosierung sowie Beginn und Dauer der Therapie werden vom behandelnden Arzt festgelegt und dürfen keinesfalls überschritten werden.
Die empfohlene Dosis für den ersten Zyklus der Behandlung mit Clomifen FERRING ist 50 mg (1 Tablette) täglich über 5 Tage. In der Regel wird die Behandlung am 5. Tag nach einer spontanen oder induzierten Blutung begonnen. Die Therapie kann bei Patientinnen, die längere Zeit keine Menstruation hatten, zu jedem beliebigen Zeitpunkt beginnen. Wenn die Ovulation mit dieser Dosis ausgelöst werden kann, ist eine Dosiserhöhung in den folgenden Zyklen der Behandlung nicht notwendig.
Wird mit dieser Dosis keine Ovulation ausgelöst, sollte ein zweiter Zyklus mit einer Dosis von 100 mg pro Tag (2 Tabletten Clomifen FERRING, als Einzeldosis gegeben) über 5 Tage folgen. Dieser Zyklus sollte ca. 30 Tage nach dem ersten beginnen. Die Dosis sollte 100 mg pro Tag nicht überschreiten und die Therapie nicht länger als 5 Tage andauern.
Wenn eine Dosiserhöhung geplant ist, sollten die besonderen Warnhinweise und Vorsichtsmaßnahmen für die Anwendung (Abschnitt 4.4) beachtet werden und bedacht werden, dass Nebenwirkungen häufiger auftreten können.
Besondere Sorgfalt durch eine niedrigere Dosierung oder kürzere Dauer eines Behandlungszyklus wird für Patientinnen mit einer übermäßigen Empfindlichkeit gegenüber Gonadotropin, wie z. B. bei Patientinnen mit polyzystischem Ovar, empfohlen.
Art und Dauer der Anwendung
Die Tablette soll unzerkaut mit reichlich Flüssigkeit nach einer Mahlzeit eingenommen werden.
Die Dauer eines Behandlungszyklus sollte 5 Tage nicht überschreiten. Die adäquate Dauer der Behandlung liegt bei 3 Zyklen, in denen Ovulationen ausgelöst wurden. Bei Patientinnen, bei denen nach 3 Zyklen keine Ovulation aufgetreten ist, wird eine Fortsetzung der Behandlung nicht empfohlen. Die Höchstdauer von 6 Behandlungszyklen sollte nicht überschritten werden (siehe Abschnitt 5.3 und Abschnitt 4.4), da erfahrungsgemäß dann nicht mehr mit einer Schwangerschaftsauslösung zu rechnen ist.
Die Patientin sollte auf die Bedeutung der zeitlich abgestimmten Kohabitation hingewiesen werden. Nach erfolgreicher Ovulationsauslösung sollte jeder weitere Behandlungszyklus mit Clomifen ungefähr am 5. Zyklustag beginnen, damit regelmäßige ovulatorische Zyklen erreicht werden.
4.3 Gegenanzeigen
• Überempfindlichkeit gegen Clomifencitrat, Lactose oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
• Patientinnen mit bereits eingetretener Konzeption
• bestehende Lebererkrankung oder bekannte Leberfunktionsstörung
• Blutungsanomalien ungeklärter Ursache
• neoplastische Veränderungen
• Frauen, bei denen eine Schwangerschaft kontraindiziert ist
• hypergonadotrope Ovarialinsuffizienz
• Eierstockzysten, wegen der Gefahr einer Vergrößerung
• Sehstörungen nach vorangegangener Clomifen-Behandlung
Bei Patientinnen mit hyperprolaktinämischer Ovarialinsuffizienz sollte nach Ausschluss eines Hypophysentumors eine Therapie mit Prolaktinhemmern durchgeführt werden, da eine Anwendung von Clomifen FERRING weniger erfolgversprechend ist.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Vor, während und nach der Clomifen-Behandlung sollte eine sorgfältige Überwachung (gynäkologische Untersuchungen, Estradiol-Bestimmung und Ultraschall) der Patientinnen vorgenommen werden, da es während der Behandlung potenziell zu einer Überstimulierung oder Vergrößerung der Ovarien kommen kann.
Clomifen FERRING darf nur dann angewendet werden, wenn mit Sicherheit eine bereits erfolgte Konzeption ausgeschlossen werden kann.
Da die relative Unbedenklichkeit einer zyklischen Langzeittherapie noch nicht endgültig feststeht und die Mehrzahl der Patientinnen innerhalb der ersten 3 Zyklen Ovulationen hat, wird eine Langzeittherapie, die 6 Monate übersteigt, nicht empfohlen.
• Diagnostik vor der Behandlung
Clomifen FERRING ist nur bei Frauen mit Ovarialinsuffizienz bzw. ovarieller Dysfunktion indiziert, wie in dieser Fachinformation in Abschnitt 4.1 beschrieben.
Vor Beginn der Behandlung sollten andere Ursachen für Sterilität wie z. B. anatomische Tubenveränderungen oder primäre Ovarialinsuffizienz sowie männliche Sterilitätsfaktoren ausgeschlossen bzw. adäquat behandelt werden.
Clomifen FERRING ist bei Patientinnen mit primärer Hypophysen- oder Ovarialstörung und anderen Ursachen ovulatorischer Störungen wie Schilddrüsen- oder Nebennierenerkrankungen nicht wirksam.
Adäquate Östrogenspiegel, sind Hinweis für eine günstige Prognose bezüglich des Auslösens von Ovulationen durch Clomifen FERRING. Ein niedriger Östrogenspiegel, obwohl prognostisch weniger günstig, schließt aber eine erfolgreiche Anwendung von Clomifen FERRING nicht aus.
Frauen mit niedrigen oder nicht messbaren Gonadotropinspiegeln und fehlender endogener Östrogenaktivität (WHO-Gruppe 1) sprechen normalerweise auf eine Therapie mit Clomifen FERRING nicht an.
• Hinweise für gynäkologische Untersuchungen
Eine gynäkologische Untersuchung soll vor Beginn und vor jedem folgenden Therapiezyklus mit Clomifen FERRING durchgeführt werden.
Beim Vorliegen einer Ovarialzyste einschließlich einer ovariellen Endometriose sollte Clomifen FERRING nicht verwendet werden, da durch die Stimulation der Ovarien eine abnorme Vergrößerung der Eierstöcke durch Überstimulierung eintreten kann. Grundsätzlich, vor allem aber bei Patientinnen mit polyzystischem Ovar, sollte die niedrigste Dosis, mit der noch günstige Ergebnisse zu erwarten sind, verordnet werden. Es ist zu beachten, dass Patientinnen mit polyzystischem Ovar verstärkt auf normale Dosen von Clomifen reagieren können.
Es ist zu bedenken, dass eine maximale Vergrößerung des Ovars erst einige Tage nach Beendigung des Behandlungszyklus auftreten und einige Tage anhalten kann. Die Patientinnen sollten aufgeklärt werden, ihren Arzt bei abdominellen oder Beckenschmerzen, Spannungszuständen und Gewichtszunahme nach Einnahme von Clomifen FERRING zu informieren, und es sollte eine sorgfältige Untersuchung erfolgen.
Falls eine Ovarvergrößerung auftritt, sollen weitere Behandlungszyklen mit Clomifen FERRING solange ausgesetzt werden, bis die Ovarien ihre Größe wie vor der Therapie erreicht haben. Danach sollte ein kürzerer Behandlungszyklus oder eine niedrigere Dosis verabreicht werden. Eine gelegentliche mit der Anwendung von Clomifen FERRING einhergehende Ovarvergrößerung und Zystenbildung geht spontan innerhalb weniger Tage oder Wochen nach Absetzen der Therapie zurück. Falls keine chirurgische Indikation zur Laparotomie gegeben ist, sollte eine derartige zystische Vergrößerung konservativ behandelt werden.
• Mehrlingsschwangerschaft
Mehrlingsschwangerschaften treten häufiger auf, wenn die Konzeption während eines Zyklus nach Einnahme von Clomifen FERRING erfolgt ist. Das mögliche Auftreten und die Komplikationen von Mehrlingsschwangerschaften sollten mit der Patientin besprochen werden (siehe Abschnitt 5.1).
• Hinweise zur Aufklärung der Patientin über Aborthäufigkeit und Anomalien
Die Häufigkeit von Anomalien bei Patientinnen mit Schwangerschaften durch Clomifen FERRING lag in den klinischen Studien innerhalb der publizierten Angaben für den Durchschnitt der Bevölkerung (siehe Abschnitt 5.1).
• Sehstörungen
Die Patientinnen sollten darauf hingewiesen werden, dass während der Therapie mit Clomifen FERRING gelegentlich verschwommenes Sehen oder andere Sehstörungen auftreten können. Die Bedeutung dieser Symptome ist noch nicht völlig abgeklärt. Wenn sie auftreten, sollte Clomifen FERRING abgesetzt und eine eingehende ophthalmologische Untersuchung durchgeführt werden. Es sollten dann keine weiteren Behandlungszyklen mit Clomifen FERRING vorgenommen werden.
Die Anwendung von Clomifen FERRING kann bei Dopingkontrollen zu positiven Ergebnissen führen.
Die Anwendung von Clomifen FERRING als Dopingmittel kann zu einer Gefährdung der Gesundheit führen.
Patientinnen mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glu-cose-Galactose-Malabsorption sollten Clomifen FERRING nicht einnehmen. Auch Patientinnen mit der seltenen hereditären Fructose-Intoleranz oder Saccharase-Isomaltase-Mangel sollten Clomifen FERRING nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Wechselwirkungen mit anderen Mitteln sind bisher nicht bekannt.
4.6 Fertilität, Schwangerschaft und Stillzeit
Die Anwendung von Clomifen FERRING ist in der Schwangerschaft kontraindiziert.
Obgleich ein teratogenes Potential von Clomifen bisher nicht bewiesen wurde, sollte Clomifen FERRING während einer Schwangerschaft nicht verabreicht werden. Daher sollte der Behandlung mit Clomifen FERRING eine spontane oder durch Gestagen induzierte Menstruation vorangehen.
Zur Vermeidung einer unbeabsichtigten Anwendung von Clomifen FERRING in der Frühgravidität sollte die Basaltemperatur durch sämtliche Behandlungszyklen hindurch aufgezeichnet und die Patientin einer sorgfältigen Beobachtung unterzogen werden, um festzustellen, ob eine Ovulation erfolgt ist. Wenn nach Clomifen FERRING die Basaltemperatur biphasisch verläuft und keine Menstruation eintritt, sollte die Patientin eingehend untersucht und ein Schwangerschaftstest vorgenommen werden, bevor ein neuer Behandlungszyklus begonnen wird.
Bei stillenden Frauen sollte auf Abnahme von Brustgröße oder Laktation geachtet werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Die Patientinnen sollten darüber aufgeklärt sein, dass nach dem Auftreten visueller Symptome das Reaktionsvermögen z. B. im Straßenverkehr oder beim Bedienen von Maschinen, besonders unter variablen Lichtverhältnissen, beeinträchtigt werden kann.
4.8 Nebenwirkungen
Die während einer Therapie mit Clomifen FERRING möglichen Nebenwirkungen sind üblicherweise abhängig von der Höhe der Dosierung und der Dauer der Therapie.
Beim Auftreten von Nebenwirkungen (insbesondere allergische Reaktionen, Sehstörungen und Unterleibsschmerzen) ist das Arzneimittel sofort abzusetzen.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig: Häufig: Gelegentlich: Selten:
Sehr selten: Nicht bekannt
(> 1/10)
(> 1/100 bis <1/10)
(> 1/1.000 bis < 1/100)
(> 1/10.000 bis < 1/1.000)
(< 1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
MeDRA- Systemor ganklassen |
Sehr Häufig |
Häufig |
Gelegentlich |
Sehr selten |
Nicht bekannt |
|
Psychiatrische Erkrankungen |
Verschlimmerung von psychotischen Störungen bei prädisponierten Patienten | ||||
|
Erkrankungen des Nervensystems |
Kopfschmer zen |
Benommenheit, Schlaflosigkeit, Schwindel, Depressionen, Nervosität |
In Einzelfällen: Krampfanfälle | ||
|
Augenerkran kungen |
Sehstörungen |
Manifestation der Sehstörungen in Au-genflimmern, verschwommenem Sehen und entopti-schen Erscheinungen wie Fleckensehen oder Lichtblitzen. Nach bisher vorliegenden Beobachtungen handelt es sich dabei um vorübergehende Erscheinungen, die nach Absetzen von Clomifen FERRING verschwinden. |
|
Gefäßerkran kungen |
Vasomotorischer Flush und Hitzewallungen (sofort reversibel nach der Therapie) | ||||
|
Erkrankungen des Gastrointestinaltrakts |
Unterbauchbeschwerden wie Spannungsgefühl und Blähungen (oft in Zusammenhang mit Mittelschmerz, prämenstruellem Syndrom oder Vergrößerung der Ovarien), Übelkeit und Erbrechen | ||||
|
Leber- und Gallenerkrankungen |
Beeinträchtigung der Leberfunktion, Bromsulphal-ein (BSP)-Retention von mehr als 5%, cholestatischer Ikterus | ||||
|
Erkrankungen der Haut und des Unter-hautzellgewebes |
Hautreaktionen (Dermatitis, Ekchymo-sen, Erythema exsudativum multiforme, allergische Hauterscheinungen, angi-oneurotisches Ödem und Urtikaria), Lichtempfindlichkeit, pas-sagerer Haarausfall | ||||
|
Erkrankungen der Nieren und Harnwege |
häufige Miktion | ||||
|
Erkrankungen |
Vergrößerung |
Brustspannen |
verstärkte |
Überstimulati- |
Heranreifung |
|
der Ge-schlechtsor-gane und der Brustdrüse |
der Ovarien |
Menstruation |
on der Ovarien |
mehrerer Follikel | |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Gewichtszu nahme, Müdigkeit |
Beschreibung einzelner Symptome
• Eierstockvergrößerung
In empfohlenen Dosen ist eine abnorme Eierstockvergrößerung selten, obwohl die übliche zyklische Variation der Eierstockgröße verstärkt werden kann. Ähnlich kann der zyklische ovarielle Schmerz (Mittelschmerz) etwas verstärkt werden. Mit höheren oder länger verabreichten Dosen kann die Eierstockvergrößerung etwas häufiger auftreten, und Zystenbildung könnte möglich sein. Die luteale Phase des Zyklus kann verlängert sein.
In seltenen Fällen wurden erhebliche Ovarvergrößerungen beschrieben. Es liegt der Bericht über eine Patientin mit einem polyzystischen ovariellen Syndrom vor, die täglich über 14 Tage mit 100 mg Clomifen FERRING behandelt worden war. Extrem selten kann ein Überstimulationssyndrom mit deutlicher Vergrößerung der Eierstöcke sowie Auftreten von Wasser im Bauchraum und auch im Brustraum mit schmerzhaften Beschwerden im Bauchraum auftreten. Eine bereits bestehende Bluteindickung (Hämokonzentration), Salzrückhalt (Elektrolytretention) und vermehrte Verklumpbarkeit der Blutplättchen (Thrombozytenaggregation) erhöhen die Gefahr thromboembolischer Ereignisse bei schwerer Überstimulation der Eierstöcke.
Abnorme Ovarvergrößerungen gehen üblicherweise spontan zurück. Die meisten Patienten mit dieser Störung sollen konservativ behandelt werden.
• Visussymptome
Sie werden gewöhnlich als „verschwommenes Sehen", als „Pünktchen" oder „Flackern" (Flimmerskotome) beschrieben, nehmen mit steigender Gesamtdosis an Häufigkeit zu und verschwinden innerhalb weniger Tage oder Wochen nach Absetzen von Clomifen FERRING. Diese Symptome scheinen auf einer Intensivierung und Verlängerung von Nachbildern zu beruhen. Nachbilder als solche wurden ebenfalls berichtet. Oft treten die Symptome erst dann in Erscheinung oder verstärken sich, wenn die Patientin einer heller erleuchteten Umgebung ausgesetzt ist. Obgleich allgemein die Sehschärfe nicht beeinflusst wird, entwickelte eine Patientin bei Einnahme von 200 mg Clomifen täglich am 7. Behandlungstag verschwommenes Sehen, das bis zu deutlicher Verminderung der Sehschärfe am 10. Tag fortschritt. Es fand sich keine weitere Abnormalität. Am 3. Tag nach Absetzen der Therapie war die Sehschärfe wieder normal.
Ferner wurde über ophthalmologisch abgrenzbare Skotome und funktionelle Veränderungen der Retinazellen (elektroretinographisch) berichtet. Eine Patientin, die während einer klinischen Studie behandelt wurde, entwickelte nach längerer Anwendung von Clomifen FERRING Skotome, die am 32. Tag nach Beendigung der Therapie verschwanden. Bei einer 34jährigen Patientin, die 3 Behandlungszyklen mit Clomifen FERRING erhalten hatte, zeigte die mikroskopische Untersuchung mit der Spaltlampe eine geringgradige subkap-suläre Opaleszenz in den hinteren Linsenrinden beider Augen; die ophthalmoskopische Untersuchung ergab normale Befunde. Die ophthalmologische Diagnose lautete Cataracta senilis polaris posterior.
• Leberfunktion
Eine Bromsulphalein(BSP)-Retention von mehr als 5 % wurde bei 32 von 141 Patientinnen, bei denen die Messung durchgeführt wurde, berichtet. Insgesamt 5 von 43 Patientinnen, die die empfohlene Dosis einnahmen, wiesen solche Veränderungen auf. Die Retentionen waren meist minimal, sofern nicht eine langfristige kontinuierliche Verabreichung von Clomifen FERRING erfolgt war oder falls nicht eine davon offenbar unabhängige Lebererkrankung bestand. Andere Leberfunktionsproben waren normal. In einer späteren kontrollierten rand-omisierten Studie, in der Patientinnen über 6 aufeinanderfolgende Monate Clomifen FERRING (50 oder 100 mg täglich über 3 Tage) oder Placebo eingenommen hatten, wurden die Retentionstests bei insgesamt 94 Patientinnen durchgeführt. Überschreitungen von 5 % wurden bei 11 Patientinnen festgestellt, 6 von ihnen hatten Clomifen FERRING, 5 Placebo eingenommen. Eine Patientin (Einzelfallbericht) hatte am 19. Behandlungstag einen Ikterus. Die Leberbiopsie ergab eine Cholestase ohne Zeichen einer Hepatitis.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Eine akute Überdosierung von Clomifen FERRING wurde bisher nicht berichtet. Eventuell zu erwarten sind folgende Symptome: Nausea, Erbrechen, Hitzewallungen, Sehstörungen wie verschwommenes Sehen oder Blitzen, Skotome und Ovarvergrößerungen mit Schmerzen im Becken- oder Bauchbereich. Eine Hyperstimulation kann theoretisch mit Gewichtszunahme und Ascites einhergehen. Eine maximale Vergrößerung der Ovarien kann u. U. erst einige Tage nach Absetzen des Präparates auftreten.
Beim Auftreten von Intoxikationen sollten Magenspülungen durchgeführt oder Brechmittel eingesetzt werden. Ein spezifisches Antidot ist nicht bekannt. Die unerwünschten Wirkungen von Clomifen FERRING sind vorübergehend und verschwinden nach Absetzen der Tabletteneinnahme. Da das Ansprechen der Ovarien auf Clomifen FERRING einige Zeit benötigt, sollten Patientinnen im gebärfähigen Alter, die eine Überdosis genommen haben, über etwa 2 bis 3 Wochen wegen einer möglichen Ovarvergrößerung beobachtet werden.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Ovulationsauslöser, synthetisch ATC-Code: G03GB02
Das Ansprechen der Ovarfunktion auf Clomifen FERRING erfolgt offensichtlich durch eine vermehrte Ausschüttung von hypophysären Gonadotropinen, die wiederum die Reifung und endokrine Aktivität des Follikels im Ovar sowie anschließend die Ausbildung und Funktion des Corpus luteum stimulieren. Die Rolle der Hypophyse geht aus der gesteigerten Gonadotropinausscheidung im Urin und der Reaktion des Ovars, die mit einer gesteigerten Ausscheidung von Östrogenen im Urin verbunden ist, hervor.
Der Wirkungsmechanismus von Clomifen FERRING ist noch nicht vollständig geklärt. Die Mehrzahl der Untersucher beschreibt ihn wie folgt: Durch Besetzung der Östrogenrezeptoren wird der Negativrückkopplungsmechanismus auf die Hypophyse aufgehoben, und es kommt zu einer vermehrten Freisetzung von Gonadotropinen. Diese vermehrte Gonadotropinfreisetzung stimuliert Reifung und endokrine Aktivität des Follikels im Ovar sowie anschließend Ausbildung und Funktion des Corpus luteum.
Klinische Studien Mehrlingsschwangerschaften
Bei 2369 Schwangerschaften im Rahmen klinischer Prüfungen traten 2183 (92,1 %) Einzelschwangerschaften, 165 (6,9 %) Zwillings-, 11 (0,5 %) Drillings-, 7 (0,3 %) Vierlings- und 3 (0,13 %) Fünflingsschwangerschaften auf (insgesamt 186 = 7,9 % Mehrlingsschwangerschaften.). Bei den 165 Zwillingsschwangerschaften, von denen ausreichende Informationen Vorlagen, lag das Verhältnis von monozygoten zu dizygoten Zwillingen bei 1 zu 5.
Klinische Studien Aborte und Anomalien
Unter den spontan berichteten Geburtsanomalien nach clomifeninduzierter Schwangerschaft befanden sich einige Neuralrohrstörungen. In Populationsstudien konnte jedoch kein Zusammenhang mit der Ovulationsinduktion gefunden werden. Es wurden vereinzelt Berichte über die mögliche Erhöhung des Risikos eines Down-Syndroms und eine Steigerung der Trisomie-Rate bei Aborten von subfertilen Frauen, die ovulationsinduzierende Medikamente (keine Frau mit Clomifen FERRING alleine und ohne weitere ovulationsauslösende Medikamente) veröffentlicht. Es gibt jedoch bisher keinen Anhalt für die Annahme eines erhöhten Risikos derartiger Störungen, die eine Amniozentese zur Ermittlung eines potentiellen Risikos rechtfertigen würden.
Die Ergebnisse aller Untersuchungen während der klinischen Studien mit Clomifen FERRING zu Fruchtabgängen ergaben eine Rate von 21,4 %. Die Abortrate lag bei 19 %. Ektopische Schwangerschaften wurden in 1,18 %, Molen in 0,17 %, ein Fetus papyraceous in 0,04 % und Totgeburten in 1,01 % der Fälle festgestellt. Eine versehentliche Einnahme von Clomifen FERRING nach einer Konzeption wurde von insgesamt 158 der 2369 Patientinnen in den klinischen Studien berichtet. Von diesen Neugeborenen wiesen 8 Kinder (geboren von 7 Müttern) Anomalien auf. Es bestand zwischen der berichteten Inzidenz von Geburtsdefekten in Abhängigkeit von der Einnahme von Clomifen FERRING vor dem 19. oder zwischen dem 20. und 35. Tag kein Unterschied. Die Inzidenz der Anomalien lag innerhalb des Bereichs, der für die Gesamtbevölkerung angegeben wird.
5.2 Pharmakokinetische Eigenschaften
Oral eingenommenes 14C-markiertes Clomifendihydrogencitrat wird beim Menschen rasch
14
resorbiert. Die kumulative Ausscheidung der C-markierten Substanz über Urin und Stuhl lag 5 Tage nach Einnahme bei 6 Probanden im Durchschnitt bei 50 % der oralen Dosis. Die mittlere Urinausscheidung betrug 7,8 %, die mittlere fäkale Ausscheidung 42,4 %. Im Urin
14
und Stuhl von 6 Probanden wurde eine mittlere Ausscheidungsrate der C-markierten Substanz von 0,73 % pro Tag nach 31 bis 35 und 0,54 % pro Tag nach 42 bis 45 Tagen über 14 bis 53 Tage nach Clomifen-Einnahme gefunden. Die verbleibende Restmenge des Stoffs bzw. der Metaboliten wird wahrscheinlich aus einem abgegrenzten enterohepatischen Rezir-kulationsgebiet langsam ausgeschieden. Eine geringe Menge von Clomifen FERRING und/
14
oder seinen Metaboliten (hier gemessen als C-markierte Substanzen) scheint deshalb bei Frauen, die während des durch Clomifen FERRING ausgelösten Zyklus empfangen haben, während der Schwangerschaft im Körper zu verbleiben.
Bioverfügbarkeit
Im Rahmen eines randomisierten 3-Phasen-Crossovers wurden insgesamt 24 gesunde Frauen mit einer Einzeldosis von 50 mg Clomifen FERRING in drei Formulierungen untersucht.
Resultate:
Pharmakokinetische Parameter nach Einmalgabe von 50 mg Clomifen FERRING
|
Formulierung |
Cmax1) (ng/ml) |
Tmax2) (h) |
AUC0-243) (ng/ml/h) |
AUC0 -336 ^ (ng/ml/h) |
|
Serophene |
8,38 |
6,61 |
129,55 |
655,08 |
|
Clomid (Canada) |
8,38 |
6,48 |
130,49 |
639,87 |
|
Clomid (USA) |
8,93 |
6,65 |
131,89 |
631,26 |
1) Cmax: Maximale Konzentration
2)
Tmax: Zeitpunkt der max. Konzentration
3)
AUC0-24: Fläche unter der Kurve 0 - 24 Std.
4)
AUC0-336: Fläche unter der Kurve 0 - 336 Std.
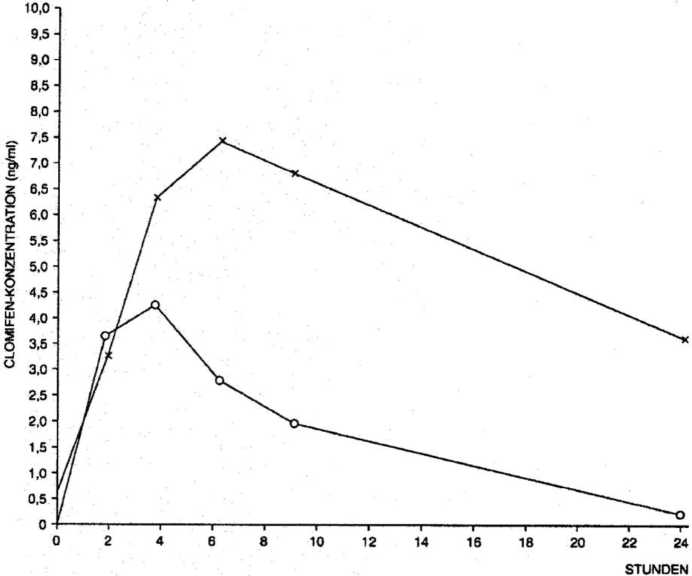
Abb.: Mittelwerte der Plasmakonzentrationen von cis-Clomifen (x - x) und trans-Clomifen (o -o) nach Einmalgabe von 50 mg Clomifen FERRING
5.3 Präklinische Daten zur Sicherheit
Die LD50 für die orale Anwendung betrug bei der Ratte 5750 mg und bei der Maus 1700 mg pro kg Körpergewicht. Die entsprechenden Werte bei intraperitonealer Applikation lagen bei beiden Spezies bei 530 bzw. 390 mg/kg Körpergewicht.
Die chronische Toxizität wurde bei Ratten und Hunden untersucht. Ratten erhielten 5, 15 und 40 mg pro kg Körpergewicht pro Tag bis zu 53 Wochen lang. Die maximale Verträglichkeit lag bei einer Tagesdosis von 40 mg pro kg Körpergewicht. Sämtliche Dosishöhen verringerten in geringem Maß Wachstumsrate und Futterverbrauch. Es wurden keine signifikanten hämatologischen Abweichungen beobachtet. Bei Tieren, die 5 bis 40 mg pro kg Körpergewicht pro Tag über die Dauer von 53 Wochen erhielten, lichtete sich das Fell, wobei sich der Umfang der Veränderungen nach Dosishöhe und Anwendungsdauer richtete. Subkapsuläre Katarakte traten bei 4 von 29 Tieren, die 53 Wochen lang 40 mg pro kg Körpergewicht pro Tag erhielten, auf. Bei einem dieser Tiere zeigte sich die Trübung erst nach der 31. Woche. Bei Ratten, die 5 bis 15 mg pro kg Körpergewicht pro Tag 53 Wochen erhielten, wurden keine Katarakte beobachtet.
Bei Hunden, denen Clomifen FERRING in Dosen von 5, 15 und 40 mg pro kg Körpergewicht über 53 Wochen verabreicht wurde, zeigten sich keine signifikanten Änderungen bezüglich Futterverbrauch, Körpergewicht, hämatologischem Befund oder Urinstatus. Auch Se-rumtransaminasen, alkalische Phosphatase, Bilirubin, Glukose, Harnstoff-Stickstoff und Urinanalyse blieben im Normbereich. Unter einer Dosis von 15 und 40 mg pro kg Körpergewicht pro Tag sank der Plasmacholesterinspiegel, die Plasmadesmosterinwerte stiegen an.
Untersuchungen zum Einfluss auf die Teratogenese wurden an Ratten und Kaninchen vorgenommen. Trächtige Ratten erhielten während des Zeitraums der Organogenese 1,6 bis 200 mg pro kg Körpergewicht pro Tag Clomifen FERRING oral. In der Gruppe, die 8 mg pro kg KG/die erhalten hatte, wurden Missbildungen bei einem von 5 Würfen festgestellt. Höhere orale Dosen (40 bis 200 mg pro kg Körpergewicht pro Tag) hemmten die fetale Entwicklung.
Subkutane Clomifen-Gaben von 1,6 bis 1000 mg pro kg KG/die an einem Tag (dem 12.) der Trächtigkeit während der Organogenese führen zu einer dosisabhängigen Zunahme der Häufigkeit von Missbildungen. Nach oraler Gabe von 20 und 40 mg pro kg KG/die vom 8. bis 15. Tag der Tragzeit wurden bei Kaninchen deformierte Feten beobachtet. Nach oralen Dosen von 8 mg pro kg KG/die wurden keine deformierten Feten festgestellt.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Sucrose, Lactose-Monohydrat, Maisstärke, Vorverkleisterte Stärke (Mais), Magnesiumstea-rat (Ph. Eur.), Eisen (III)-hydroxid-oxid.
6.2 Inkompatibilitäten
Inkompatibilitäten sind bisher nicht bekannt.
6.3 Dauer der Haltbarkeit
5 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
6.5 Art und Inhalt des Behältnisses
PVC/Aluminiumblister mit 10 Tabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen
7. Inhaber der Zulassung
FERRING Arzneimittel GmbH
Fabrikstraße 7
24103 Kiel
Tel.: (0431) 5852-0
Fax.: (0431) 5852-74
8. Zulassungsnummer
3374.00.00
9. Datum der Erteilung der Zulassung / Verlängerung der Zulassung
19.09.1983 / 20.07.2010
10. Stand der Information
Juli 2014
11. Verkaufsabgrenzung Verschreibungspflichtig
Sollten Sie weitere Fragen haben, wenden Sie sich bitte an folgende e-mail Adresse: info-service@ferring.de
12/12