Dipidolor
F achinform ation
1. Bezeichnung des Arzneimittels
Dipidolor, 7,5 mg/ml Injektionslösung
2. Qualitative und quantitative Zusammensetzung Wirkstoff: Piritramid
1 ml Injektionslösung enthält 7,5 mg Piritramid.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Injektionslösung
Dipidolor ist eine klare, farblose Lösung.
4. Klinische Angaben
4.1 Anwendungsgebiete
Starke und stärkste Schmerzen.
4.2 Dosierung, Art und Dauer der Anwendung
Dosierung und Dauer der Anwendung
Erwachsene
Intramuskuläre oder subkutane Anwendung:
Es wird eine Einzeldosis von 15-30 mg empfohlen.
Intravenöse Anwendung (nur wenn ein besonders rascher Wirkungseintritt erforderlich ist): Langsame Injektion (10 mg pro Minute) einer Einzeldosis von 7,5-22,5 mg.
Pädiatrische Patienten
Intramuskuläre oder subkutane Anwendung:
Es wird eine Einzeldosis von 0,05-0,2 mg/kg KG empfohlen.
Intravenöse Anwendung (nur wenn ein besonders rascher Wirkungseintritt erforderlich ist): Langsame Injektion einer Einzeldosis von 0,05-0,1 mg/kg KG.
Weitere zurzeit vorliegende Daten zu Kleinkindern sind in Abschnitt 5.2 beschrieben.
Besondere Personengruppen
Bei kachektischen, geschwächten oder älteren Patienten oder bei Patienten mit eingeschränkter Leber- und Nierenfunktion sollte die Anfangsdosis reduziert werden.
Art der Anwendung
Dipidolor ist zur einmaligen oder wiederholten i.m., s.c. und i.v. Anwendung geeignet.
Hinweise
Die Einzeldosen bei intramuskulärer, subkutaner und intravenöser Anwendung können bei nachlassender analgetischer Wirkung alle 6-8 Stunden wiederholt werden.
Dosiserhöhungen von Dipidolor sollten vorsichtig gehandhabt werden, um eine Akkumulation von Piritramid zu vermeiden, die das Risiko einer Atemdepression erhöhen kann. Es kann bis zu 24 Stunden dauern, bis ein Patient vom vollen analgetischen Effekt einer Dipidolor-Dosis profitiert.
Zur Erhaltungstherapie sollte eine ausreichend hohe Dosis gegeben werden und gleichzeitig die im Einzelfall kleinste analgetisch wirksame Dosis angestrebt werden. Bei der Therapie chronischer Schmerzen ist der Dosierung nach festem Zeitplan der Vorzug zu geben.
Vorsichtsmaßnahmen bei der Handhabung / vor der Anwendung des Arzneimittels Anweisungen zur Verdünnung des Arzneimittels vor der Anwendung, siehe Abschnitt 6.6.
4.3 Gegenanzeigen
• Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile
• Komatöse Zustände
• Atemdepression
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
• Wie unter anderen Opioiden auch, können bei Patienten unter Dipidolor zentral dämpfende Wirkungen und/oder Atemdepression einschließlich Atemstillstand und respiratorische Insuffizienz auftreten.
• Ein p-Opioidantagonist sollte jederzeit zur Verfügung stehen. Aufgrund der langen Wirkdauer von Dipidolor kann eine wiederholte Anwendung des Antagonisten erforderlich sein.
• Nach der Verabreichung von Dipidolor kann ein Blutdruckabfall auftreten. Dieser Effekt kann bei hypovolämischen Patienten oder in Anwesenheit zusätzlich verabreichter sedierender Arzneimittel das übliche Ausmaß überschreiten.
• Da Bradykardien auftreten können, sollte Dipidolor bei Patienten mit Bradyarrhythmien nur mit Vorsicht angewendet werden. Diese Patienten sollen zunächst die niedrige Dosis erhalten und während einer Dosistitration engmaschig überwacht werden.
• Dipidolor darf nur mit besonderer Vorsicht angewendet werden bei: akuter Alkoholintoxikation, konvulsiven Erkrankungen, Kopfverletzungen und Zuständen mit erhöhtem Hirndruck.
• Vorsicht ist angeraten bei Hypothyreose, Nebennierenrindeninsuffizienz, Prostatahypertrophie und Schock oder wenn der Patient zentral dämpfende Substanzen (wie Alkohol, Barbiturate, Hypnotika, bestimmte Benzodiazepine etc.) eingenommen hat.
• Vorsicht ist ebenfalls angezeigt bei kachektischen, geschwächten oder älteren Patienten, bei Patienten mit eingeschränkter Leber- und Nierenfunktion oder mit eingeschränkter Atemfunktion. Bei diesen Patienten soll mit einer reduzierten Dosis begonnen und die Dosistitration engmaschig überwacht werden (siehe Abschnitt 4.2).
• Wie bei anderen Opioiden auch, kann sich bei Patienten eine physische und psychische Abhängigkeit von Dipidolor entwickeln (siehe Abschnitt 4.8). Das Abhängigkeitsrisiko nimmt gewöhnlich mit der Anwendungsdauer und bei steigender Dosis zu. Bei längerer Anwendungsdauer kann eine höhere Dosis erforderlich sein, um den gleichen analgetischen Effekt zu erzielen (Toleranz).
• Absetzen, Ersatz durch ein weniger potentes Opioid oder Anwendung eines Antagonisten
kann ein Entzugssyndrom auslösen. Die Symptome hierfür schließen
Gleichgewichtsstörungen, Tremor, Ängstlichkeit, Erbrechen, Diarrhö und/oder einen erhöhten Blutdruck ein.
• Wie andere Opioide auch, sollte Dipidolor mit Vorsicht angewendet werden bei: Gallenwegserkrankungen, obstruktiven und entzündlichen Darmerkrankungen, Phäochromozytom, Pankreatitis und Kindern unter 1 Jahr.
Bei Anwendung hoher Dosen sollte Intubations- und Beatmungsbereitschaft gewährleistet sein.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Piritramid wird in erheblichem Umfang und vor allem über CYP3A4 metabolisiert. Eine gemeinsame Anwendung mit CYP3A4-Inhibitoren kann zu einer ca. 4-fachen Steigerung der Piritramid-Konzentration führen. Bei gleichzeitiger Anwendung von CYP3A4-Inhibitoren kann das Risiko für eine Atemdepression erhöht sein. Daher kann es nötig sein, die Anfangsdosis von Dipidolor zu reduzieren. Dosiserhöhungen müssen vorsichtig gehandhabt werden (siehe Abschnitt 4.2).
Die gleichzeitige Anwendung von Piritramid und anderen zentral dämpfend wirkenden Substanzen, z. B. Barbituraten, Benzodiazepinen, Phenothiazinen, Inhalationsanästhetika oder anderen nicht-selektiven Hypnotika, sowie Alkohol kann zu einer Verstärkung der Nebenwirkungen von Piritramid, insbesondere der Atemdepression, führen.
Bei Vormedikation von Monoamino-Oxidase (MAO)-Hemmern innerhalb der letzten 14 Tage vor der Opioid-Anwendung sind lebensbedrohende Wechselwirkungen auf Zentralnervensystem (paroxysmale ZNS-Stimulation), Atem- und Kreislauffunktion (Hypertonie) mit Pethidin beobachtet worden und mit Piritramid nicht auszuschließen. Daher müssen MAO-Hemmer mindestens 10 Tage vor einer Behandlung mit Dipidolor abgesetzt werden. Durch Pentazocin werden die Wirkungen von Piritramid, z. B. die Analgesie, teilweise antagonisiert.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen keine Daten vom Menschen zur Anwendung von Piritramid in der Schwangerschaft vor. Eingeschränkt aussagekräftige tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Das mögliche Risiko der Anwendung beim Menschen ist nicht bekannt. Daher darf Dipidolor während der Schwangerschaft nicht angewendet werden, es sei denn, es ist zwingend erforderlich.
Stillzeit
Es ist nicht bekannt, ob Piritramid in die Muttermilch übergeht. Bei anderen Opioiden ist jedoch bekannt, dass sie in die Muttermilch übergehen. Dipidolor soll während der Stillzeit nicht angewendet werden, es sei denn, es ist zwingend erforderlich. Das Stillen soll während der Behandlung mit Dipidolor unterbrochen und frühestens 24 Stunden nach der letzten Piritramidgabe wieder aufgenommen werden.
Es ist nicht auszuschließen, dass die chronische Anwendung während der Schwangerschaft zur Gewöhnung und nach der Geburt zu Entzugserscheinungen beim Neugeborenen führt.
Fertilität
Es liegen keine Daten zu den Auswirkungen von Piritramid auf die Fertilität vor.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Dipidolor kann eine Sedierung verursachen. Daher wird empfohlen, dass Patienten nach der Anwendung von Dipidolor für mindestens 24 Stunden kein Fahrzeug führen oder Maschinen bedienen.
4.8 Nebenwirkungen
Die Sicherheit von Dipidolor wurde in 7 klinischen Studien mit 526 Probanden ausgewertet. Den Patienten wurden mindestens einmal 15 mg Pritramid zur Behandlung akuter Schmerzen als intramuskuläre Injektion verabreicht.
Die am häufigsten beobachteten Nebenwirkungen in diesen Studien (gepoolte Daten) waren (in / Inzidenz) erhöhte ^Herzfrequenz (15,0), erniedrigter Blutdruck (13,1) und Stupor (9,9).
Neben den oben aufgeführten Nebenwirkungen zeigt Tabelle 1 Nebenwirkungen, die unter der Anwendung von Dipidolor in klinischen Studien und nach Markteinführung berichtet wurden.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig Häufig Gelegentlich Selten Sehr selten Nicht bekannt
(> 1/10)
(> 1/100, < 1/10)
(> 1/1.000, < 1/100)
(> 1/10.000, < 1/1.000)
(< 1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Tabelle 1: Nebenwirkungen, die in klinischen Studien und nach Markteinführung berichtet wurden
|
Systemorgan klassen |
Sehr häufig |
Häufig |
Gelegentlich |
Nicht bekannt |
|
Erkrankungen des Immunsystems |
Anaphylaxie, Anaphylaktischer Schock | |||
|
Psychiatrische Erkrankungen |
Abhängigkeit |
Entzugssyndrom | ||
|
Erkrankungen des Nervensystems |
Stupor, Schwindel, Somnolenz |
Kopfschmerzen |
Bewusstlosigkeit | |
|
Augenerkran kungen |
Miosis | |||
|
Herzerkran kungen |
Bradykardie, B radyarrhythmie, Zyanose | |||
|
Gefäßerkran kungen |
Hypotonie | |||
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Atemstillstand, respiratorische Insuffizienz, Status asthmaticus, Bronchospasmus, Dyspnoe | |||
|
Erkrankungen des Gastrointestinal trakts |
Übelkeit, Erbrechen, Würgereiz | |||
|
Erkrankungen der Haut und des Unterhautzell gewebes |
Blässe |
Hyperhidrose |
Allergische Dermatitis, Pruritus | |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Reaktionen am Verabreichungsort | |||
|
Untersuchungen |
erhöhte Herzfrequenz, erniedrigter Blutdruck |
verminderte Atemfrequenz |
Eine Notwendigkeit, die Opioidwirkung zu antagonisieren, wurde bei 0,4% der Studienteilnehmer beobachtet.
Wie unter anderen Opioiden auch, kann bei Patienten, die Dipidolor erhalten, eine Hemmung der gastrointestinalen Motilität auftreten, die zu Obstipation führt.
Unter anderen Opioiden wurden darüber hinaus Mundtrockenheit, Tonuserhöhung der Sphinkteren der Gallen- und Pankreasgänge sowie der Harnblase und in seltenen Fällen Probleme beim Wasserlassen berichtet.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website:
http://www.bfarm.de, anzuzeigen.
4.9 Überdosierung
Symptome
Bei Überdosierung von Dipidolor kann es zu einer Verstärkung der pharmakologischen Wirkung und der Nebenwirkungen kommen. Es kann eine Atemdepression auftreten, deren Schweregrad von Bradypnoe bis Apnoe variieren kann.
Behandlung
Diese Wirkungen können durch die Verabreichung eines Opioidantagonisten abgemildert werden, der vorsichtig in wiederholten kleinen Dosen zu verabreichen ist, weil die Wirkdauer des Opioidantagonisten kürzer ist als die von Piritramid. Intensivmedizinische Maßnahmen (insbesondere Intubation und Beatmung) können erforderlich werden, ebenso Maßnahmen zum Schutz vor Wärmeverlusten und zur Volumentherapie.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Analgetika, Opioide, Diphenylpropylamin-Derivate ATC-Code: N02AC03
Wirkmechanismus
Piritramid ist ein reiner p-Opioid-Rezeptor-Agonist, der eine etwas geringere analgetische Potenz als Morphin aufweist. Die Analgesie resultiert aus einer Aktivierung der p-Opioid-Rezeptoren im Bereich des Rückenmarks und den höheren Schmerzzentren wie Thalamus und Hirnrinde. Hierdurch erhöhen sich Schmerzschwelle und die Fähigkeit, Schmerz auszuhalten.
Pharmakodynamische Wirkungen
Klinische Studien haben einen raschen Wirkungseintritt gezeigt: Die Analgesie tritt nach intravenöser Gabe nach 1-2 Minuten und nach intramuskulärer oder subkutaner Gabe nach 10-15 Minuten ein. Die Wirkdauer beträgt ca. 5-8 Stunden.
5.2 Pharmakokinetische Eigenschaften
Resorption
Spitzenplasmaspiegel werden nach i.m.-Verabreichung nach 15 Minuten erreicht.
Verteilung
Die Proteinbindung von Piritramid beträgt annähernd 95%. Das initiale Verteilungsvolumen nach einem Einfachbolus beträgt 0,7 bis 1,0 l/kg, im Steady-state zwischen 4,7 und 6 l/kg. Das Verteilungsvolumen nach verlängerter Verabreichung steigt im Steady-state auf 11,1 l/kg an.
Biotransformation
Piritramid wird vorwiegend in der Leber metabolisiert. Es existieren mindestens vier verschiedene Metabolite. Das Cytochrom CYP3A4 Enzym ist der Hauptabbauweg.
Elimination
Die Plasmaeliminationshalbwertszeit liegt zwischen 4 und 10 Stunden. Nach verlängerter Verabreichung steigt sie auf 17,4 Stunden an. Nach einem intravenösen Bolus beträgt die Clearance annähernd 600 ml/min und steigt bei verlängerter intravenöser Verabreichung auf 1100 ml/min. an, die renale Clearance beträgt 1,4% der Gesamt-Clearance.
Besondere Personengruppen
Pädiatrische Patienten
Bei Kindern zwischen 2 Monaten und 4 Jahren beträgt die terminale Eliminationshalbwertszeit circa 2,7 Stunden. Das Verteilungsvolumen beträgt bei Kleinkindern im Alter von 2-4 Monaten 1,7 l/kg und steigt bei Kindern im Alter von 4 Monaten bis 4 Jahren auf annähernd 7,0 l/kg an. Die Gesamt-Clearance beträgt 9,8 ml/kg/min bei Kleinkindern zwischen 2 und 4 Monaten und 25 ml/kg/min bei Kindern zwischen 4 Monaten und 4 Jahren. Der Anstieg der Elimination kann eine Dosisanpassung erforderlich machen.
5.3 Präklinische Daten zur Sicherheit
In präklinischen Studien wurden Effekte, die in Zusammenhang mit der pharmakologischen Wirkung des Arzneimittels stehen, Veränderungen der hämatologischen Werte sowie eine Verminderung des Körpergewichts in Dosisbereichen beobachtet, die etwas über der humantherapeutischen Dosis bezogen auf die Körperoberfläche lagen.
Karzinogenität undMutagenität
In-vitro-T ests zur Genotoxizität ergaben keinen Hinweis auf ein mutagenes Potential. Studien zur Karzinogenität wurden nicht durchgeführt.
Reproduktionstoxikologie
Zum Übertritt von Piritramid über die Plazentaschranke bzw. in die Muttermilch liegen keine Studien vor. Zur kurzfristigen postnatalen Entwicklung und zur Fertilität wurden ebenfalls keine Studien durchgeführt. Studien zur embryofetalen Entwicklung zeigten keine Hinweise auf Teratogenität. Es wurde jedoch in den meisten Dosisbereichen eine Embryotoxizität beobachtet, die nicht dosisabhängig war.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Weinsäure (Ph. Eur.)
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Dieses Arzneimittel darf nicht mit anderen Arzneimitteln gemischt werden, außer mit 0,9%iger NaCl- oder 5,0%iger Glucoselösung, da der Wirkstoff Piritramid ausfallen kann (siehe auch Abschnitt 6.6).
6.3 Dauer der Haltbarkeit
5 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Die chemische und physikalische Stabilität bei Raumtemperatur und unter Lichteinfluss einer gebrauchsfertigen Verdünnung wurde für 5%ige Glucoselösung zur Injektion und für 0,9%ige NaCl-Lösung zur Injektion für 72 Stunden nachgewiesen.
Aus mikrobiologischer Sicht sollte die gebrauchsfertige Zubereitung sofort verwendet werden, es sei denn, die Methode des Verdünnens schließt das Risiko einer mikrobiellen Kontamination aus. Wenn die gebrauchsfertige Zubereitung nicht sofort verwendet wird, ist der Anwender für die Dauer und Bedingung der Aufbewahrung verantwortlich.
6.5 Art und Inhalt des Behältnisses
Originalpackung:
5 Ampullen zu je 2 ml Injektionslösung (entsprechend 15 mg Piritramid)
Klinikpackung:
50 (10 x 5) Ampullen zu je 2 ml Injektionslösung (entsprechend 15 mg Piritramid)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Die Injektionslösung darf ausschließlich mit 0,9%iger NaCl- oder 5%iger Glucoselösung verdünnt werden. Jedes andere Produkt kann eine Ausfällung von Piritramid verursachen (aufgrund einer pH-Wertänderung). Daher soll eine Verdünnung der Injektionslösung mit Vorsicht durchgeführt werden (nur saubere Materialien und keine angebrochenen physiologischen Lösungen verwenden).
Vor Anwendung von Dipidolor ist unmittelbar vor Injektion auf sichtbare Ausfällung in der aufgezogenen Spritze bzw. nach Verdünnung z. B. in der Infusionslösung zu prüfen; bei vorhandener Ausfällung ist die Lösung zu verwerfen.
Öffnen der Ampullen
Tragen Sie Handschuhe, wenn Sie die Ampulle öffnen.
ft

Farbringe farbiger Punkt Bruchstelle
|
!: j: | |
|
i | |
Fassen Sie die Ampulle so zwischen Daumen und Zeigefinger, dass die Spitze der Ampulle frei bleibt.
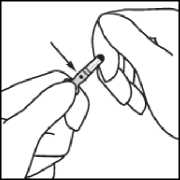
Fassen Sie mit der anderen Hand die Spitze der Ampulle, indem Sie den Zeigefinger an den Hals der Ampulle und den Daumen auf den farbigen Punkt parallel zu den Farbringen legen.
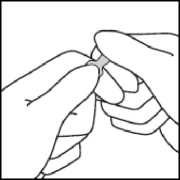
Während Sie die Ampulle mit der einen Hand festhalten, belassen Sie den Daumen der anderen Hand weiter auf dem farbigen Punkt und brechen die Spitze der Ampulle scharf ab.
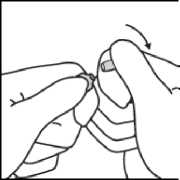
Bei versehentlichem Hautkontakt soll die betroffene Stelle mit Wasser gewaschen werden. Es sollen keine Seife, Alkohol oder andere Reinigungsmittel verwendet werden, die chemische oder physikalische Hautschäden verursachen könnten.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. Inhaber der Zulassung
JANSSEN-CILAG GmbH 41457 Neuss Telefon: (02137) 955-955 Internet: www.ianssen-cilag.de
8. Zulassungsnummer
6762359.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
25.09.2002
10. STAND DER INFORMATION
September 2014
11. Verkaufsabgrenzung
V erschreibungspflichtig, Betäubungsmittel
Seite 8 von 8