Doxazosin Stada 8 Mg Tabletten
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SPC)
1. Bezeichnung des Arzneimittels
Doxazosin STADA® 8 mg Tabletten
2. Qualitative und quantitative Zusammensetzung
1 Tablette enthält 8 mg Doxazosin als Doxazosinmesilat.
Sonstiger Bestandteil mit bekannter Wirkung: 1 Tablette enthält 80,88 mg Lactose-Monohydrat.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Tablette
Weiße bis fast weiße, runde, bikonvexe Tablette mit beidseitiger Kreuzbruchkerbe (STADA Vario-Tab®) und Prägung „D", „Z", „S" und „8" auf einer Seite
Die Tablette kann in gleiche Dosen geteilt werden.
4. Klinische Angaben
4.1 Anwendungsgebiete
Doxazosin STADA® ist angezeigt zur Behandlung der essenziellen Hypertonie.
4.2 Dosierung und Art der Anwendung Dosierung
Zu Beginn der Behandlung wird 1-mal täglich 1 mg Doxazosin eingenommen. Die Dosis kann individuell - in Anpassung an die Blutdrucksituation des Patienten - nach 1-2 Wochen auf 2 mg Doxazosin 1-mal täglich und wenn notwendig, auf 4 mg Doxazosin 1-mal täglich, und schließlich auf 8 mg Doxazosin 1-mal täglich gesteigert werden.
Durchschnittliche Tagesdosis für die Erhaltungstherapie: 2-4 mg Doxazosin 1-mal täglich morgens.
Die maximale Tagesdosis beträgt 16 mg Doxazosin.
Als Vorschlag für den Therapiebeginn kann folgendes Dosierungsschema empfohlen werden: 1.-8. Tag: morgens 1 mg Doxazosin.
9.-14. Tag: morgens 2 mg Doxazosin.
Anschließend individuelle Einstellung auf die erforderliche Erhaltungsdosis. Hinweis:
Die Darreichungsform von Doxazosin STADA® 8 mg ist aufgrund ihres hohen Wirkstoffgehalts nicht für den Therapiebeginn geeignet.
Für den Therapiebeginn und die individuelle Erhaltungsdosis stehen Tabletten zu 1 mg, 2 mg und 4 mg Doxazosin zur Verfügung.
Ältere Patienten und Patienten mit Niereninsuffizienz Da die pharmakokinetischen Eigenschaften von Doxazosin bei älteren Patienten oder bei Patienten mit Niereninsuffizienz unverändert sind, kann die Behandlung dieser Patienten mit der üblichen Dosis durchgeführt werden. Dennoch sollte die Dosis so niedrig wie möglich gehalten werden und eine Dosissteigerung nur unter genauer Beobachtung erfolgen.
Da Doxazosin einer starken Proteinbindung unterliegt, kann es durch Dialyse nicht eliminiert werden.
Patienten mit Leberinsuffizienz
Wie alle Arzneimitteln, die vollständig über die Leber metabolisiert werden, sollte Doxazosin bei Patienten mit eingeschränkter Leberfunktion besonders vorsichtig eingesetzt werden. Bei Patienten mit schwerwiegender Leberfunktionsstörung liegen keine klinischen Erfahrungen vor (siehe Abschnitt 4.4).
Kinder und Jugendliche
Aufgrund ungenügender Erfahrungen kann die Anwendung von Doxazosin bei Kindern nicht empfohlen werden.
Art der Anwendung
Die Tabletten sollen morgens mit ausreichend Flüssigkeit eingenommen werden. Der Einnahmezeitpunkt ist unabhängig von den Mahlzeiten. Die Dauer der Einnahme wird vom behandelnden Arzt festgelegt.
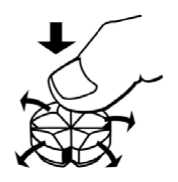
Hinweis zur Teilung der Doxazosin STADA® 8 mg Tablette (STADA Vario-Tab®) Zur Erleichterung einer individuellen Dosierung steht Doxazosin STADA® 8 mg als Tablette mit Kreuzbruchkerbe (STADA Vario-Tab®) zur Verfügung. Legen Sie die Tablette (STADA Vario-Tab®) mit der Bruchkerbe nach oben auf eine harte flache Unterlage. Durch leichten Daumendruck von oben zerteilen Sie die Tablette in 4 gleich große Teile.
4.3 Gegenanzeigen
• Überempfindlichkeit gegen den Wirkstoff, andere Chinazoline (z.B. Prazosin, Terazosin) oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile,
• anamnestisch bekannte orthostatische Hypotonie,
• benigne Prostatahyperplasie und gleichzeitig bestehende Stauung im oberen Harntrakt, chronische Harnwegsinfektion oder Blasensteine,
• Stillzeit (siehe Abschnitt 4.6).
Doxazosin ist kontraindiziert als Monotherapie bei Patienten mit Überlaufblase oder Anurie mit oder ohne progredienter Niereninsuffizienz.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Therapiebeginn
Aufgrund der alphablockierenden Eigenschaften von Doxazosin kann es bei Patienten zu einer orthostatischen Hypotonie kommen, die sich als Schwindelgefühl und Schwäche oder selten als Ohnmacht (Synkope) äußert, insbesondere bei Therapiebeginn. Deshalb empfiehlt es sich, den Blutdruck bei Therapiebeginn zu überwachen, um das Risiko orthostatischer Effekte zu verringern. Der Patient sollte angewiesen werden, vorsichtshalber Situationen zu meiden, in denen Verletzungsgefahr bestehen könnte, falls bei Einleitung der Doxazosin-Therapie Schwindelgefühl oder Schwäche auftritt.
Anwendung bei Patienten mit akuten Herzerkrankungen Wie bei anderen gefäßerweiternden Antihypertensiva empfiehlt es sich, bei der Anwendung von Doxazosin bei Patienten mit den folgenden akuten Herzerkrankungen Vorsicht walten zu lassen:
• Lungenödem infolge einer Aorten- oder Mitralklappenstenose,
• High-Output-Herzinsuffizienz,
• Rechtsherzinsuffizienz infolge von Lungenembolie oder Perikarderguss,
• Linksherzinsuffizienz mit niedrigem Füllungsdruck.
Anwendung bei Patienten mit Leberinsuffizienz
Wie alle Arzneimittel, die vollständig durch die Leber metabolisiert werden, sollte Doxazosin bei Patienten mit Anzeichen einer eingeschränkten Leberfunktion besonders vorsichtig angewendet werden. Da keine klinischen Erfahrungen bei Patienten mit schwerer Leberfunktionsstörung vorliegen, wird die Anwendung bei diesen Patienten nicht empfohlen.
Anwendung zusammen mit PDE-5-Inhibitoren
Die gleichzeitige Anwendung von Phosphodiesterase-5-Inhibitoren (z.B. Sildenafil, Tadalafil, Vardenafil) und Doxazosin STADA® kann bei einigen Patienten zu einer symptomatischen Hypotonie führen. Um das Risiko für die Entwicklung einer orthostatischen Hypotonie zu vermindern, sollten die Patienten stabil auf die Alpha-Blocker-Therapie eingestellt sein, wenn sie Phosphodiesterase-5-Inhibitoren anwenden. Weiterhin wird empfohlen, mit der niedrigsten Dosis des Phosphodiesterase-5-Inhibitors zu beginnen und diesen in einem zeitlichen Abstand zur Gabe von Doxazosin (mindestens 6 Stunden) einzunehmen.
Anwendung bei Patienten, die sich einer Kataraktoperation unterziehen Bei einigen Patienten, die gleichzeitig oder bis kurz vorher mit Tamsulosin behandelt wurden, trat während Katarakt-Operationen das sog. „intraoperative Floppy Iris Syndrome" (IFIS, eine Variante des Syndroms der engen Pupille) auf. Da auch bei Anwendung anderer Alpha-Blocker vereinzelt das Auftreten eines IFIS gemeldet wurde, kann ein Gruppeneffekt nicht ausgeschlossen werden. IFIS kann zu Komplikationen während der Operation führen. Deshalb sollten Kataraktchirurgen und Augenärzte vor einer Kataraktoperation darüber informiert werden, ob die Patienten aktuell Alpha-Blocker anwenden oder diese früher erhielten.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Doxazosin STADA® nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die gleichzeitige Anwendung von Phosphodiesterase-5-Inhibitoren (z.B. Sildenafil, Tadalafil, Vardenafil) kann bei manchen Patienten zu einer symptomatischen Hypotonie führen (siehe Abschnitt 4.4).
Doxazosin ist im Plasma überwiegend (zu 98%) an Proteine gebunden. Aus In-vitro-Daten im Humanplasma geht hervor, dass Doxazosin keinen Einfluss auf die Proteinbindung von Digoxin, Warfarin, Phenytoin oder Indometacin hat.
Gebräuchliches Doxazosin wurde mit Thiaziddiuretika, Furosemid, Betablockern, nichtsteroidalen Antirheumatika, Antibiotika, oralen Antidiabetika, Urikosurika und Antikoagulanzien angewendet, ohne dass in der klinischen Erfahrung Arzneimittelwechselwirkungen auftraten. Jedoch liegen keine Daten aus formalen Arzneimittelwechselwirkungsstudien vor.
Doxazosin verstärkt die blutdrucksenkende Wirkung anderer Alphablocker und anderer Antihypertensiva.
In einer offenen, randomisierten und placebokontrollierten Studie bei 22 gesunden männlichen Probanden führte die Verabreichung einer Einzeldosis von 1 mg Doxazosin an Tag 1 einer 4-tägigen Behandlung mit oralem Cimetidin (2-mal täglich 400 mg) zu einer Zunahme der mittleren AUC von Doxazosin um 10%, dagegen zu keinen statistisch signifikanten Veränderungen der mittleren Cmax und der mittleren Halbwertszeit von Doxazosin. Die Zunahme der mittleren AUC von Doxazosin um 10% bei gemeinsamer Anwendung mit Cimetidin liegt innerhalb der interindividuellen Variabilität (27%) der mittleren AUC von Doxazosin zusammen mit Plazebo.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Da keine adäquaten und gut kontrollierten Studien bei schwangeren Frauen vorliegen, ist die Sicherheit von Doxazosin während der Schwangerschaft nicht nachgewiesen. Deshalb sollte Doxazosin während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das Risiko übersteigt. Auch wenn in tierexperimentellen Untersuchungen keine teratogenen Wirkungen festgestellt wurden, wurde bei Tieren nach extrem hohen Dosen eine geringere Überlebensrate der Feten beobachtet (siehe Abschnitt 5.3).
Stillzeit
Unter einer Therapie mit Doxazosin darf nicht gestillt werden, da das Arzneimittel in der Milch laktierender Ratten akkumuliert und keine Informationen zur Ausscheidung des Wirkstoffs in die Muttermilch beim Menschen vorliegen. Alternativ sollten Mütter abstillen, wenn eine Behandlung mit Doxazosin notwendig ist (siehe Abschnitt 5.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Die Fähigkeit zur Durchführung von Tätigkeiten wie das Bedienen von Maschinen oder das Lenken eines Kraftfahrzeugs kann beeinträchtigt sein, insbesondere bei Behandlungsbeginn.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt: sehr häufig (>1/10), häufig (>1/100 bis <1/10), gelegentlich (>1/1.000 bis <1/100), selten (>1/10.000 bis <1/1.000), sehr selten (<1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
|
Systemorg anklasse |
Sehr häufig |
Häufig |
Gelegentlic h |
Selten |
Sehr selten |
Nicht bekannt |
|
Infektionen und parasitäre Erkrankung en |
Atemwegs infektion, Harnwegsi nfektion | |||||
|
Erkrankung en des Blutes und |
Leukope nie, Thrombo |
|
Systemorg anklasse |
Sehr häufig |
Häufig |
Gelegentlic h |
Selten |
Sehr selten |
Nicht bekannt |
|
des Lymphsyste ms |
zytopeni e | |||||
|
Erkrankung en des Immunsyste ms |
Allergische Arzneimittel reaktionen | |||||
|
Stoffwechse l- und Ernährungs störungen |
Anorexie |
Gicht, gesteigerter Appetit | ||||
|
Psychiatrisc he Erkrankung en |
Angst, Schlaflosi gkeit, Nervosität |
Agitiertheit, Depression | ||||
|
Erkrankung en des Nervensyst ems |
Schwind elgefühl, Kopfsch merzen |
Schwindel bei Lagewech sel, Parästhesi e Schläfrigk eit |
Zerebrovas kulärer Insult, Hypästhesi e, Synkope, Tremor | |||
|
Augenerkra nkungen |
Verschw ommens ehen |
Intraoper atives Floppy- Iris Syndrom (siehe Abschnitt 4.4) | ||||
|
Erkrankung en des Ohrs und des Labyrinths |
Vertigo |
Tinnitus | ||||
|
Herzerkrank ungen |
Palpitation en, T achykard ie |
Angina pectoris, Myokardinfa rkt, Arrhythmien |
Bradykar die | |||
|
Gefäßerkra nkungen |
Hypotonie, Blutdrucka bfall bei Lagewech sel |
Hitzewallun gen | ||||
|
Erkrankung en der Atemwege, des |
Bronchitis, Husten, Dyspnoe, Rhinitis |
Epistaxis. |
Broncho spasmus |
|
Systemorg anklasse |
Sehr häufig |
Häufig |
Gelegentlic h |
Selten |
Sehr selten |
Nicht bekannt |
|
Brustraums und Mediastinu ms | ||||||
|
Erkrankung en des Gastrointest inaltrakts |
Abdominal schmerze n, Dyspepsie j Mundtrock enheit, Übelkeit, Diarrhö |
Obstipation, Flatulenz, Erbrechen, Gastroenter itis |
Geschm acksstör ungen | |||
|
Leber- und Gallenerkra nkungen |
Anomale Leberfunkti onswerte |
Cholesta se, Hepatitis, Ikterus | ||||
|
Erkrankung en der Haut und des Unterhautze llgewebes |
Pruritus |
Hautaussch lag, Haarausfall, Purpura |
Urtikaria | |||
|
Skelettmusk ulatur-, Bindegewe bs- und Knochenerk rankungen |
Rückensc hmerzen, Muskelsch merzen |
Gelenksch merzen, Muskelkräm pfe, Muskelschw äche | ||||
|
Erkrankung en der Nieren und Harnwege |
Zystitis, Harninkon tinenz |
Dysurie, häufigeres Wasserlass en, Hämaturie, Polyurie |
Verstärkt e Diurese, Miktionss törungen j Nykturie | |||
|
Erkrankung en der Geschlecht sorgane und der Brustdrüse |
Impotenz |
Gynäko mastie, Priapism us |
Retrogra de Ejakulati on | |||
|
Allgemeine Erkrankung en und Beschwerd en am Verabreichu ngsort |
Schwäche j Brustkorbs chmerzen, grippeähnl iche Symptome , periphere |
Schmerzen, Gesichtsöd eme |
|
Systemorg anklasse |
Sehr häufig |
Häufig |
Gelegentlic h |
Selten |
Sehr selten |
Nicht bekannt |
|
Ödeme, Müdigkeit, Unwohlsei n | ||||||
|
Untersuchu ngen |
Gewichtszu nahme |
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn
Website: Fehler! Hyperlink-Referenz ungültig.www.bfarm.de anzuzeigen.
4.9 Überdosierung
Bei Hypotonie infolge einer Überdosierung sollte der Patient auf dem Rücken in Kopftieflage gebracht werden. Falls diese Maßnahme nicht ausreicht, sollte ein Schock zuerst mit Volumenexpandern behandelt werden. Falls notwendig, kann anschließend ein Vasopressor gegeben werden. Die Nierenfunktion sollte überwacht und, falls erforderlich, unterstützt werden. Da Doxazosin vorwiegend proteingebunden vorliegt, ist eine Dialyse nicht indiziert.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antihypertonika, ATC-Code: C02CA04
Doxazosin bewirkt durch selektive und kompetitive Blockade von postsynaptischen Alpha-1-Rezeptoren eine periphere Vasodilatation.
Die Anwendung von Doxazosin beim Hypertoniker führt zur Senkung des Blutdrucks durch Verminderung des peripheren Gefäßwiderstandes. Bei einer einmal täglichen Dosierung ist die Wirkung noch 24 Stunden nach der Einnahme nachzuweisen. Nach Therapiebeginn kommt es zu einer allmählichen Senkung des Blutdrucks, orthostatische Reaktionen können auftreten. Die maximale Blutdrucksenkung wird normalerweise 2-6 Stunden nach der Tabletteneinnahme erzielt. Bei Hypertonikern sind die Blutdruckwerte unter Doxazosin STADA® im Liegen und im Stehen ähnlich.
Eine Toleranzentwicklung bezüglich der antihypertensiven Wirkung wurde bei Langzeittherapie mit Doxazosin nicht beobachtet. Gelegentlich kommt es bei fortgesetzter Anwendung zum Anstieg der Plasma-Renin-Aktivität und zu Tachykardien. Die Zwischenauswertung der ALLHAT-Studie (Antihypertensive and Lipid lowering Treatment to Prevent Heart Attack Trial) zeigte, dass das Risiko für eine schwerwiegende Herzinsuffizienz bei mit Doxazosin behandelten Bluthochdruckpatienten mit mindestens einem weiteren KHK-Risikofaktor im Vergleich zu den mit Chlorthalidon behandelten Patienten etwa doppelt so hoch war. Außerdem war bei diesen Patienten das Risiko für das Auftreten von schwerwiegenden kardiovaskulären Komplikationen um 25% höher als in der Gruppe der Chlorthalidon-Patienten. Aufgrund dieser Ergebnisse wurde der Doxazosin-Arm der ALLHAT-Studie abgebrochen. Unterschiede im Hinblick auf die Mortalität waren zu diesem Zeitpunkt nicht vorhanden. Die Ergebnisse sind noch nicht abschließend ausgewertet.
Bei Patienten mit symptomatischer benigner Prostatahyperplasie werden die Urodynamik und die symptomatischen Beschwerden durch die Gabe von Doxazosin signifikant verbessert. Dieser Effekt beruht vermutlich auf einer selektiven Blockade der Alpha-1-Rezeptoren in der Muskulatur von Prostata und Blasenhals.
Unter Behandlung mit Doxazosin konnte eine Regression der linksventrikulären Hypertrophie festgestellt werden.
5.2 Pharmakokinetische Eigenschaften
Nach oraler Applikation wird Doxazosin gut resorbiert, die Plasmaspitzenkonzentrationen werden nach 2 Stunden erreicht. Die Plasmaelimination verläuft biphasisch, die terminale Halbwertszeit beträgt 22 Std. und ermöglicht somit eine tägliche Einmalgabe.
Bioverfügbarkeit
Die absolute Bioverfügbarkeit beträgt nahezu 63%.
98,3% des Doxazosin im Plasma liegen in proteingebundener Form vor. Doxazosin wird hauptsächlich metabolisiert (O-Demethylierung und Hydroxylierung), wobei die Elimination hauptsächlich über die Faeces erfolgt (weniger als 5% der verabreichten Dosis werden unverändert über die Faeces ausgeschieden). 6'Hydroxydoxazosin ist ein potenter und selektiver a-Blocker und entspricht beim Menschen 5% einer peroral aufgenommenen Dosis. Daher trägt 6' Hydroxydoxazosin wenig zur antihypertensiven Wirkung von Doxazosin bei.
Studien bei älteren Personen und Patienten mit Niereninsuffizienz haben keine relevanten pharmakokinetischen Unterschiede ergeben.
Es liegen nur in begrenztem Umfang Daten über den Einsatz bei Patienten mit Leberinsuffizienz und die Wirkung von Medikamenten mit bekanntem Einfluss auf den Leberstoffwechsel (z.B. Cimetidin) vor. In einer klinischen Studie mit 12 Patienten mit geringgradiger Leberinsuffizienz war die Fläche unter der Plasma-Konzentrations-Zeit-Kurve (AUC) um 43% erhöht und die Clearance nach oraler einmaliger Applikation um 30% vermindert.
Da Doxazosin nahezu vollständig über die Leber metabolisiert wird, sollte die Dosierung von Doxazosin bei Patienten mit eingeschränkter Leberfunktion vorsichtig angepasst werden (siehe Abschnitt 4.4).
5.3 Präklinische Daten zur Sicherheit
Tierversuche zur Sicherheitspharmakologie, chronischen Toxizität, Reproduktionstoxizität, Mutagenität und Kanzerogenität ergaben keine Hinweise auf ein erhöhtes Risiko für die Anwendung beim Menschen.
Obwohl tierexperimentelle Untersuchungen keinen Hinweis auf eine teratogene Wirkung ergeben haben, wurde bei Tieren mit Dosen, die etwa 300-mal höher waren als die empfohlene Höchstdosis beim Menschen, eine verringerte fetale Überlebensrate beobachtet.
Bei Versuchen mit Ratten zeigte sich nach oraler Einmalgabe von 1 mg/kg [2-14C]-Doxazosin, dass Doxazosin in der Muttermilch mit maximal dem etwa 20Fachen der mütterlichen Plasmakonzentration akkumuliert.
Für weitere Informationen siehe Abschnitt 4.6.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Carboxymethylstärke-Natrium (Typ A) (Ph.Eur.), Mikrokristalline Cellulose, Lactose-Monohydrat, Magnesiumstearat (Ph.Eur) [pflanzlich], Natriumdodecylsulfat, Hochdisperses Siliciumdioxid.
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
5 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über +25°C lagern.
6.5 Art und Inhalt des Behältnisses
PVC/PVDC/Aluminium-Blister.
Originalpackung mit 20, 30, 50, 60 und 100 Tabletten.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. Inhaber der Zulassung
STADApharm GmbH Stadastraße 2-18 61118 Bad Vilbel Telefon: 06101 603-0 Telefax: 06101 603-259 Internet: www.stada.de
8. Zulassungsnummer
49253.03.00
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung
16.02.2001/ 21. 07.2009
10. Stand der Information
Juli 2014
11. Verkaufsabgrenzung
Verschreibungspflichtig
11