Flecadura 100 Mg Tabletten
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTEL
flecadura 50 mg Tabletten flecadura 100 mg Tabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jede flecadura 50 mg Tablette enthält 50 mg Flecainidacetat, entsprechend 43,67 mg Flecainid. Jede flecadura 100 mg Tablette enthält 100 mg Flecainidacetat, entsprechend 87,34 mg Flecainid. Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Tablette
flecadura 50 mg Tabletten:
Weiße, konvexe 6,5 mm runde, nicht überzogene Tabletten mit Prägung „FC“ über „50“ auf der einen Seite und „G“ auf der anderen Seite.
flecadura 100 mg Tabletten:
Weiße, konvexe 8,5 mm runde, nicht überzogene Tabletten mit Bruchkerbe und Prägung „FC“ über „100“ auf der einen Seite und „G“ auf der anderen Seite.
Die Tablette kann in gleiche Dosen geteilt werden.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Flecainidacetat ist angezeigt bei Patienten mit den folgenden Herzrhythmusstörungen:
Schwere symptomatische supraventrikuläre Arrhythmien.
AV-junktionale Tachykardie
Herzrhythmusstörungen bei WPW-Syndrom (Wolff-Parkinson-White-Syndrom) und ähnliche Zustände bei vorliegenden akzessorischen Leitungsbahnen.
Paroxysmales Vorhofflimmern bei Patienten mit eingeschränkter körperlicher Leistungsfähigkeit nach Kardioversion.
Patienten mit strukturellen Herzerkrankungen und/oder eingeschränkter linksventrikulärer Funktion sollten aufgrund des erhöhten Risikos einer proarrhythmischen Wirkung nicht mit Flecainidacetat behandelt werden. Vor Kurzem erworbene Arrhythmien werden eher ansprechen.
Symptomatische anhaltende ventrikuläre Tachykardie.
Vorzeitige ventrikuläre Kontraktionen und/oder nichtanhaltende ventrikuläre Tachykardie, die körperliche Einschränkungen verursachen, wenn andere Therapieformen unwirksam sind oder nicht vertragen werden.
flecadura Tabletten können zur Erhaltung eines normalen Herzrhythmus nach Konversion durch andere Mittel eingesetzt werden.
4.2 Dosierung und Dauer der Anwendung
Dosierung
Die klinische Entscheidung über die Einleitung einer Flecainidbehandlung sollte in Absprache mit einem Spezialisten getroffen und die Behandlung stationär begonnen werden. Bei Patienten mit einer zugrunde liegenden organischen Kardiopathie und insbesondere bei Patienten mit Myokardinfarkt in der Vorgeschichte sollte die Flecainidbehandlung nur begonnen werden, wenn andere, nicht zur Klasse Ic gehörende Antiarrhythmika (vor allem Amiodaron) unwirksam sind oder nicht vertragen werden und wenn eine nicht-medikamentöse Behandlung (Operation, Ablation, implantierter Defibrillator) nicht angezeigt ist. Während der Behandlung ist eine strenge ärztliche EKG-Kontrolle und Kontrolle der Flecainidplasmaspiegel erforderlich.
Erwachsene:
Supraventrikuläre Arrhythmien: Die empfohlene Anfangsdosis beträgt zweimal täglich 50 mg. Die meisten Patienten sind mit dieser Dosis gut eingestellt. Bei Bedarf kann die Dosis auf maximal 300 mg täglich erhöht werden.
Ventrikuläre Arrhythmien: Die empfohlene Anfangsdosis beträgt zweimal täglich 100 mg. Die maximale Tagesdosis beträgt 400 mg und ist normalerweise kräftigen Patienten vorbehalten oder wenn eine schnelle Beherrschung der Herzrhythmusstörung notwendig ist. Nach 3-5 Tagen wird eine schrittweise Anpassung auf die niedrigste zur Kontrolle der Rhythmusstörungen erforderliche Erhaltungsdosis empfohlen. Während einer Langzeitbehandlung kann die Dosis unter Umständen reduziert werden.
Kinder und Jugendliche:
Flecainidacetat wird bei Kindern unter 12 Jahren nicht empfohlen, da nur unzureichende Daten zur Anwendung in dieser Altersgruppe vorliegen.
Ältere Patienten:
Bei älteren Patienten sollte die maximale Anfangsdosis 100 mg täglich (oder 50 mg zweimal täglich) betragen, da die Plasmaeliminationsrate von Flecainidacetat bei älteren Menschen reduziert sein kann.
Plasmaspiegel:
Um den maximalen therapeutischen Effekt hinsichtlich der Suppression vorzeitiger ventrikulärer Kontraktionen zu erzielen, scheinen Plasmaspiegel von 200-1000 ng/ml notwendig zu sein. Plasmaspiegel über 700-1000 ng/ml erhöhen die Wahrscheinlichkeit unerwünschter Ereignisse.
Dosierung bei eingeschränkter Nierenfunktion:
Bei Patienten mit signifikanter Einschränkung der Nierenfunktion (Kreatinin-Clearance < 35 ml/min/1,73 m2) sollte die maximale Anfangsdosis 100 mg täglich (oder 50 mg zweimal täglich) betragen. Bei diesen Patienten wird eine häufige Kontrolle der Plasmaspiegel dringend angeraten. Es wird empfohlen, die Behandlung mit Flecainidacetat stationär einzuleiten.
Dosierung bei eingeschränkter Leberfunktion:
Patienten mit Einschränkung der Leberfunktion sollten streng überwacht werden, und die Dosis sollte 100 mg täglich oder 50 mg zweimal täglich nicht überschreiten.
Dosierung bei Patienten mit Schrittmacher:
Bei Patienten mit einem permanenten Schrittmacher in situ sollte die Behandlung mit Vorsicht erfolgen. Die Dosis sollte 100 mg zweimal täglich nicht überschreiten.
Dosierung bei Patienten, die gleichzeitig mit anderen Arzneimitteln behandelt werden:
Bei Patienten unter gleichzeitiger Behandlung mit Cimetidin oder Amiodaron ist eine engmaschige Überwachung erforderlich. Bei einigen Patienten kann eine Reduktion der Dosis erforderlich sein. Die Dosis sollte 100 mg zweimal täglich nicht überschreiten. Die Patienten sollten zu Beginn der Behandlung und während der Erhaltungstherapie überwacht werden.
Während der Behandlung wird eine Kontrolle der Plasmaspiegel und eine EKG-Kontrolle in regelmäßigen Abständen (EKG einmal pro Monat und Langzeit-EKG alle 3 Monate) empfohlen. Bei Einleitung der Behandlung und Dosiserhöhung sollte alle 2-4 Tage ein EKG durchgeführt werden.
Bei Patienten mit Dosiseinschränkungen sollte die EKG-Kontrolle häufiger (zusätzlich zur regelmäßigen Kontrolle der Flecainidplasmaspiegel) erfolgen. Eine Dosisanpassung sollte in Abständen von 6-8 Tagen erfolgen. Bei diesen Patienten sollte die individuelle Dosierung durch EKG-Kontrollen in der 2. und 3. Therapiewoche überprüft werden.
Art der Anwendung Zum Einnehmen.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Flecainidacetat ist kontraindiziert bei Herzinsuffizienz und bei Patienten nach Myokardinfarkt bei Vorliegen asymptomatischer ventrikulärer Ektopien oder asymptomatischen, nicht anhaltenden ventrikulären Tachykardien.
Weitere Kontraindikationen sind reduzierte oder eingeschränkte Ventrikelfunktion, kardiogener Schock, schwere Bradykardie, schwere Hypotonie und gleichzeitige Anwendung von Disopyramid.
Flecainidacetat ist auch kontraindiziert bei Patienten mit anhaltendem Vorhofflimmern, bei denen eine Konversion zum Sinusrhythmus nicht versucht wurde, und bei Patienten mit hämodynamisch wirksamem Herzklappenfehler.
Bekanntes Brugada-Syndrom
Falls kein Schrittmacher vorhanden ist, sollte Flecainidacetat bei Patienten mit Sinusknotendysfunktion, atrialen Leitungsstörungen, AV-Block 2. oder höheren Grades, Schenkelblock oder distalen Leitungsstörungen nicht angewendet werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die intravenöse Behandlung mit Flecainidacetat sollte im Krankenhaus eingeleitet werden.
Die Behandlung von Patienten mit anderen Indikationen sollte weiterhin im Krankenhaus eingeleitet werden.
Die Behandlung mit Flecainidacetat sollte im Krankenhaus oder unter direkter Aufsicht eines Facharztes erfolgen für Patienten mit:
• AV-junktionaler Tachykardie, Arrhythmien in Verbindung mit dem Wolff-Parkinson-White-Syndrom und ähnlichen Zuständen mit akzessorischen Leitungsbahnen.
• Paroxysmalem Vorhofflimmern und eingeschränkter körperlicher Leistungsfähigkeit.
Für alle Patienten, die eine Bolus-Injektion erhalten, wird eine kontinuierliche EKG-Überwachung empfohlen.
Wie andere Antiarrhythmika kann Flecainidacetat proarrhythmische Effekte hervorrufen, d. h. es kann möglicherweise eine schwerere Form einer Arrhythmie verursachen, die Frequenz einer bestehenden Arrhythmie oder den Schweregrad der Symptome erhöhen (siehe Abschnitt 4.8).
Die Anwendung von Flecainidacetat sollte bei Patienten mit struktureller Herzerkrankung oder abnormer linksventrikulärer Funktion vermieden werden (siehe Abschnitt 4.8).
Bei Patienten mit einem akuten Einsetzen von Vorhofflimmern nach Herzoperationen ist Flecainidacetat mit Vorsicht anzuwenden.
Flecainid besitzt eine selektive Wirkung, die zu einer Erhöhung der Refraktärperiode der anterograden und besonders der retrograden Erregungsleitungen führt. Flecainidacetat verlängert das QT-Intervall und verbreitert den QRS-Komplex um 12-20 %. Die Wirkung auf das JT-Intervall ist unerheblich. Es wurden jedoch Verlängerungen des JT-Intervalls von bis zu 4 % beschrieben. Diese Wirkung ist jedoch weniger ausgeprägt als bei den Antiarrhythmika der Klasse Ia.
Durch die Behandlung mit Flecainidacetat kann möglicherweise ein Brugada-Syndrom demaskiert werden. Sollten sich während der Behandlung mit Flecainidacetat EKG-Veränderungen entwickeln, die auf ein Brugada-Syndrom hindeuten, ist ein Behandlungsabbruch in Erwägung zu ziehen.
Da die Plasmaelimination von Flecainidacetat bei Patienten mit signifikanter Einschränkung der Leberfunktion erheblich verzögert sein kann, sollte Flecainidacetat bei diesen Patienten nur nach kritischer Nutzen-Risiko-Abwägung angewendet werden. Die Kontrolle der Plasmaspiegel ist bei diesen Patienten dringend angeraten.
Flecainidacetat sollte bei Patienten mit Nierenfunktionsstörung (Kreatinin-Clearance < 35 ml/min/1,73 m2) nur mit Vorsicht angewendet werden und eine therapeutische Arzneimittelüberwachung wird empfohlen.
Die Plasma-Eliminationsrate von Flecainidacetat kann bei älteren Patienten reduziert sein. Dies sollte bei Dosisanpassungen berücksichtigt werden.
Flecainidacetat wird für die Anwendung bei Kindern unter 12 Jahren nicht empfohlen, da keine ausreichenden Erfahrungen mit der Anwendung in dieser Altersgruppe vorliegen (siehe Abschnitt 4.2).
Elektrolytstörungen (z. B. Hypo- und Hyperkaliämie) sollten vor Behandlungsbeginn mit Flecainidacetat ausgeglichen werden (siehe Abschnitt 4.5, dort sind einige Arzneimittel genannt, die Elektrolytstörungen verursachen)
Schwere Bradykardie oder ausgeprägte Hypotonie sollten vor Behandlungsbeginn mit Flecainidacetat korrigiert werden.
Es ist bekannt, dass Flecainidacetat die endokardiale Reizschwelle erhöht, d. h. die endokardiale Reizempfindlichkeit senkt. Diese Wirkung ist reversibel und bei akuten Schrittmacheranwendungen ausgeprägter als bei chronischen. Deshalb ist Flecainidacetat bei allen Patienten mit permanenten Herzschrittmachern oder temporären Schrittmacherelektroden mit Vorsicht zu verwenden und sollte bei Patienten mit bestehender, schlecht eingestellter Reizschwelle oder nicht-programmierbaren Herzschrittmachern nur angewendet werden, wenn ein geeigneter Schrittmacher für Notfälle bereit steht.
Flecainidacetat sollte bei Patienten mit Sinusknoten-Syndrom (sick sinus syndrome) mit Vorsicht angewendet werden.
Im Allgemeinen ist eine Verdopplung der Impulsstärke oder der Spannung ausreichend, um die Schrittmacherfunktion wiederherzustellen. Es kann jedoch unter Flecainidacetat schwierig sein, zum Zeitpunkt der initialen Implantation ventrikuläre Reizschwellen von weniger als 1 Volt zu erzielen.
Die geringfügig negativ inotrope Wirkung von Flecainidacetat kann bei Patienten mit Prädisposition zur Herzinsuffizienz von Bedeutung sein. Schwierigkeiten bei der Defibrillation wurden vor allem bei vorbestehender Herzerkrankung mit Herzvergrößerung, Myokardinfarkt in der Vorgeschichte, arteriosklerotischen Herzerkrankungen und Herzinsuffizienz beschrieben.
Unter Flecainidacetat wurde ein erhöhtes Mortalitätsrisiko von Post-Myokardinfarkt-Patienten mit asymptomatischen ventrikulären Arrhythmien beobachtet.
In einer groß angelegten, placebokontrollierten klinischen Studie mit Patienten nach Myokardinfarkt und mit asymptomatischen ventrikulären Herzrhythmusstörungen war die Mortalitätsrate und die Zahl der Patienten mit nicht tödlich verlaufendem Herzstillstand unter oralem Flecainidacetat im Vergleich zu dem entsprechenden Placebo um das 2,2fache höher. In dieser Studie wurde eine sogar noch höhere Mortalität unter Flecainidacetat bei Patienten mit mehr als einem Myokardinfarkt beobachtet. Vergleichbare placebokontrollierte, klinische Studien zu der Frage, ob Flecainidacetat auch bei anderen Patientengruppen mit einer erhöhten Mortalität verbunden ist, wurden nicht durchgeführt.
Milchprodukte (Milch, Säuglingsmilchnahrung und möglicherweise Joghurt) könnten die Absorption von Flecainidacetat bei Kindern und Kleinkindern reduzieren. Flecadura ist nicht für Kinder unter 12 Jahren zugelassen, es wurde jedoch über Flecainid-Vergiftungen bei Kindern berichtete, die ihre Milchaufnahme verringerten, sowie bei Säuglingen, die von Milchnahrung auf dextrosehaltige Nahrung umgestellt wurden.
Da Flecainid ein enges therapeutisches Spektrum besitzt, ist eine engmaschige Überwachung bei der Umstellung auf andere Darreichungsformen erforderlich.
Weitere Warnhinweise und Vorsichtsmaßnahmen siehe Abschnitt 4.5.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Klasse I-Antiarrhythmika: Flecainidacetat sollte nicht gleichzeitig mit anderen Antiarrhythmika der Klasse I verabreicht werden. Die gleichzeitige Anwendung von Chinidin reduziert die Eliminationsrate von Flecainidacetat um 23 %.
Klasse II-Antiarrhythmika: Die Möglichkeit additiver negativ inotroper Wirkungen bei gleichzeitiger Anwendung von Klasse II-Antiarrhythmika z. B. Betablockern und anderen kardiodepressiv wirkenden Arzneimitteln mit Flecainidacetat sollte beachtet werden.
Klasse III-Antiarrhythmika: Bei gleichzeitiger Behandlung mit Amiodaron sollte die übliche Flecainidacetat-Dosis um 50 % reduziert und der Patient engmaschig auf Nebenwirkungen kontrolliert werden. In diesen Fällen ist die Plasmaspiegelüberwachung dringend zu empfehlen.
Klasse IV-Antiarrhythmika: Die Anwendung von Flecainidacetat mit Calcium-Antagonisten, z. B. Verapamil sollte mit Vorsicht in Erwägung gezogen werden.
Wechselwirkungen, die erhöhte Plasmakonzentrationen verursachen, können zu lebensbedrohlichen oder sogar tödlichen Nebenwirkungen führen (siehe Abschnitt 4.9). Flecainid wird weitgehend durch CYP2D6 metabolisiert. Die gleichzeitige Anwendung von Arzneimitteln, die dieses Isoenzym hemmen (z. B. Antidepressiva, Neuroleptika, Propranolol, Ritonavir, einige Antihistaminika) oder induzieren (z. B. Phenytoin, Phenobarbital, Carbamazepin), kann die Konzentration von Flecainid im Plasma erhöhen oder vermindern (siehe unten).
Eine Erhöhung der Plasmaspiegel kann auch durch eine verminderte Clearance von Flecainid, aufgrund einer Nierenfunktionsstörung hervorgerufen werden (siehe Abschnitt 4.4).
Hypokaliämie, aber auch Hyperkaliämie oder andere Elektrolytstörungen sollten vor Behandlungsbeginn mit Flecainid korrigiert werden. Die gleichzeitige Anwendung von Diuretika, Kortikosteroiden oder
Laxantien kann eine Hypokaliämie verursachen.
Antivirale Wirkstoffe: Ritonavir, Lopinavir und Indinavir erhöhen die Plasmakonzentration von Flecainid (erhöhtes Risiko ventrikulärer Arrhythmien) (die gleichzeitige Anwendung ist zu vermeiden).
Malariamittel: Chinin erhöht die Plasmakonzentration von Flecainid.
Antihistaminika.: Erhöhtes Risiko ventrikulärer Arrhythmien (gleichzeitige Einnahme mit Mizolastin und Terbinafin vermeiden).
Antidepressiva: Fluoxetin, Paroxetin und andere Antidepressiva erhöhen die Flecainid-Plasmakonzentrationen; Trizyklika erhöhen das Arrhythmie-Risiko; der Hersteller von Reboxetin empfiehlt Vorsicht.
Antiepileptika: Begrenzte Daten bei Patienten, die bekannte Enzyminduktoren erhalten (Phenytoin, Phenobarbital, Carbamazepin), weisen eine nur 30 %ige Zunahme für die Eliminationsrate von Flecainid auf.
Antipsychotika: Clozapin - erhöhtes Risiko von Arrhythmien.
Antimykotika: Terbinafin kann aufgrund der Hemmung der CYP2D6-Aktivität die Plasmakonzentrationen von Flecainid erhöhen.
Diuretika: Kardiotoxizität infolge einer Hypokaliämie (Klasseneffekt).
H-Antihistaminika (zur Behandlung von Magengeschwüren): Der H2-Antagonist Cimetidin hemmt den Stoffwechsel von Flecainid. Bei gesunden Personen, die Cimetidin (1 g täglich) eine Woche erhielten, erhöhte sich die AUC von Flecainid um etwa 30 % und die Halbwertszeit um etwa 10 %.
Arzneimittel zur Raucherentwöhnung: Die gleichzeitige Gabe von Bupropion (metabolisiert durch CYP2D6) mit Flecainid sollte mit Vorsicht und initial in niedrigen Dosen erfolgen. Bei Patienten, die bereits mit Flecainidacetat behandelt werden, sollte bei einer zusätzlichen Verabreichung von Bupropion die Notwendigkeit einer Dosisreduzierung des ursprünglichen Arzneimittels in Betracht gezogen werden.
Herzglykoside: Flecainidacetat kann zu einem Anstieg der Digoxinplasmaspiegel um ca. 15 % führen, was für Patienten mit Plasmaspiegeln im therapeutischen Bereich wahrscheinlich keine klinische Relevanz hat. Es wird empfohlen, bei digitalisierten Patienten die Digoxinplasmaspiegel frühestens 6 Stunden nach einer Digoxin-Dosis zu bestimmen, vor oder nach der Gabe von Flecainidacetat.
Orale Antikoagulantien: Die Behandlung mit Flecainidacetat ist mit der Anwendung von oralen Antikoagulanzien kompatibel.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen keine Erfahrungen beim Menschen zur Sicherheit der Anwendung in der Schwangerschaft vor. In Tierstudien führten hohe Dosen von Flecainidacetat bei weißen Neuseeland-Kaninchen zu fetalen Fehlbildungen. Diese Nebenwirkungen wurden bei Dutch Belted Kaninchen oder Ratten jedoch nicht beobachtet (siehe Abschnitt 5.3). Die Bedeutung dieser Beobachtungen für den Menschen ist nicht untersucht worden. Daten von Patientinnen, die Flecainidacetat während der Schwangerschaft eingenommen haben, haben gezeigt, dass Flecainidacetat placentagängig ist.
Flecainid sollte in der Schwangerschaft nur angewendet werden, wenn der Nutzen die Risiken überwiegt. Wird Flecainidacetat eingenommen, sollten die mütterlichen Plasmaspiegel während der Schwangerschaft überwacht werden.
Stillzeit
Flecainidacetat wird beim Menschen in die Muttermilch ausgeschieden, die Konzentration ist ähnlich der im mütterlichen Blut. Die Plasmakonzentrationen beim gestillten Säugling sind 5 bis 10-mal niedriger als die therapeutischen Arzneimittelkonzentrationen (siehe Abschnitt 5.2). Obwohl das Risiko unerwünschter Nebenwirkungen für den Säugling sehr gering ist, sollte Flecainidacetat während der Stillzeit nur angewendet werden, wenn der Nutzen die Risiken überwiegt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Unerwünschte Wirkungen wie Schwindel und Sehstörungen wurden beschrieben. Diese Wirkungen sind normalerweise vorübergehend, können jedoch die Verkehrstüchtigkeit, das Bedienen von Maschinen und Arbeiten ohne sicheren Halt beeinträchtigen.
4.8 Nebenwirkungen
Die Nebenwirkungen sind nach Systemorganklassen und Häufigkeit aufgeführt. Bei den Häufigkeitsangaben werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10), häufig (> /100 bis < 1/10), gelegentlich (> 1/1.000 bis < 1/100), selten (> 1/10.000 bis < 1/1.000) und sehr selten (< 1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Erkrankungen des Blutes und des Lymphsystems:
Gelegentlich: Verringerung der roten und weißen Blutkörperchen und Blutplättchen. Diese Veränderungen sind gewöhnlich geringfügig.
Erkrankungen des Immunsystems:
Sehr selten: Zunahme von antinuklearen Antikörpern mit oder ohne systemische Entzündungen. Psychiatrische Erkrankungen:
Selten: Halluzinationen, Depression, Verwirrtheit , Angstzustände, Amnesie, Schlaflosigkeit, Nervosität. Erkrankungen des Nervensystems:
Sehr häufig: Schwindel und Benommenheit, die in der Regel vorübergehend sind.
Selten: Während der Langzeittherapie wurden einige Fälle von peripherer Neuropathie, Parästhesie und Ataxie berichtet. Seltene Fälle von Dykinesie wurden berichtet, die sich nach Absetzen der Flecainidacetat-Behandlung besserten. Hypästhesie, Hyperhidrose, Synkope, Tremor, Schläfrigkeit, Kopfschmerzen und Krämpfe.
Erkrankungen des Auges:
Sehr häufig: Sehstörungen, z. B. Doppeltsehen und Verschwommensehen. Diese Nebenwirkungen sind gewöhnlich vorübergehend und klingen nach Fortsetzung oder Dosisreduzierung ab.
Sehr selten: Hornhautablagerungen.
Erkrankungen des Ohrs und des Labyrinths:
Selten: Tinnitus, Vertigo.
Herzerkrankungen:
Häufig: Proarrhythmien (vor allem bei Patienten mit strukturellen Herzerkrankungen und/oder signifikanter Einschränkung der linksventrikulären Funktion).
Gelegentlich: Patienten mit Vorhofflattern können eine 1:1-AV-Überleitung mit erhöhter Herzfrequenz entwickeln. Diese Nebenwirkungen treten besonders häufig nach Anwendung einer Injektion zur akuten Konversion auf. Sie sind in der Regel kurzlebig und klingen nach Beendigung der Therapie rasch ab. Nicht bekannt: AV-Block (2. und 3. Grades), Herzstillstand, Bradykardie, Herzinsuffizienz/kongestive Herzinsuffizienz, Brustschmerzen, Hypotonie, Myokardinfarkt, Palpitationen, Sinusarrest und
Tachykardie (AT oder VT). Demaskierung eines bestehenden Brugada Syndroms. Dosisabhängiger Anstieg der PR und QRS-Intervalle kann auftreten (siehe Abschnitt 4.4). Veränderte Reizschwelle (siehe Abschnitt 4.4).
Gefäßerkrankungen
Selten: Hautrötungen (Flushing)
Erkrankungen der Atemwege, des Brustraumes und des Mediastinums:
Häufig: Dyspnoe.
Selten: Pneumonitis.
Nicht bekannt: Lungenfibrose, interstitielle Lungenerkrankung.
Erkrankungen des Gastrointestinaltrakts:
Gelegentlich: Übelkeit, Erbrechen, Verstopfung, Bauchschmerzen, Appetitlosigkeit, Durchfall,
Dyspepsie, Flatulenz.
Sehr selten: Mundtrockenheit, Geschmacksstörungen.
Leber- und Gallenerkrankungen:
Selten: erhöhte Leberenzymwerte, mit und ohne Gelbsucht. Bislang war dies bei Abbruch der Behandlung immer reversibel.
Nicht bekannt: Leberfunktionsstörungen.
Erkrankungen der Haut und des Unterhautzellgewebes:
Gelegentlich: allergische Dermatitis, einschließlich Hautausschlag, Alopezie.
Selten: ernste Formen von Urtikaria.
Sehr selten: Lichtempfindlichkeitsreaktion.
Skelettmuskulatur-. Bindegewebs- und Knochenerkrankungen:
Sehr selten: Arthralgie, Myalgie.
Erkrankungen der Geschlechtsorgane und der Brustdrüse:
Sehr selten: Impotenz.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Häufig: Asthenie, Müdigkeit, Pyrexie, Ödeme.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de, anzuzeigen.
4.9 Überdosierung
Eine Überdosierung mit Flecainidacetat ist ein potentiell lebensbedrohlicher medizinischer Notfall. Eine erhöhte Arzneimittelempfindlichkeit und Plasmakonzentrationen, die die therapeutischen Spiegel überschreiten, können auch durch Arzneimittelwechselwirkungen verursacht werden (siehe Abschnitt 4.5). Ein spezifisches Gegenmittel ist nicht bekannt. Es ist keine Methode bekannt, um Flecainidacetat rasch aus dem Organismus zu entfernen. Weder Dialyse noch eine Hämoperfusion sind wirksam.
Die Behandlung sollte unterstützend sein und kann die Entfernung des nicht resorbierten Arzneistoffs aus dem Gastrointestinaltrakt umfassen. Zu den weiteren möglichen Behandlungen gehören inotrope Substanzen oder Herzstimulanzien, wie z. B. Dopamin, Dobutamin oder Isoproterenol, sowie kreislaufunterstützende Maßnahmen (z. B. Ballonpumpe) und mechanische Beatmung. Bei Leitungsblock sollte die Implantation eines temporären transvenösen Schrittmachers in Betracht gezogen werden. Unter der Annahme einer Plasmahalbwertzeit von ca. 20 Stunden, können diese unterstützenden Behandlungen über einen längeren Zeitraum erforderlich sein. Forcierte Diurese mit Ansäuerung des Harns fördert theoretisch die Ausscheidung des Wirkstoffes.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antiarrhythmikum der Klasse Ic.
ATC-Code: C01BC04
Flecainidacetat ist ein Antiarrhythmikum der Klasse Ic mit negativ inotroper Wirkung. Es bindet an die Natriumkanäle der Muskelmembranen und führt dabei zu einer deutlichen Verlangsamung der kardialen Reizleitung und zur Suppression spontaner vorzeitiger Kammerkomplexe. Im Myokard bindet Flecainidacetat stark an schnelle Natriumkanäle und verlangsamt so die Depolarisationsgeschwindigkeit; die Überleitung in Vorhof, AV-Knoten, Ventrikel und Purkinje-Fasern ist vermindert. Der deutlichste Effekt zeigt sich an den Purkinje-Fasern. Die Aktivität von Flecainidacetat wird im EKG durch eine Verlängerung des PR-Intervalls und einer Verbreiterung des QRS-Komplexes widergespiegelt. Der Effekt auf das JT-Intervall ist nicht signifikant.
5.2 Pharmakokinetische Eigenschaften
Nach oraler Gabe wird Flecainidacetat fast vollständig resorbiert (90 %). Die maximalen Plasmakonzentrationen sind nach 3-4 Stunden erreicht. Die Plasmaeiweißbindung ist gering (40 %). In Patienten führten 200 bis 600 mg Flecainid pro Tag zu Plasmakonzentrationen innerhalb der therapeutischen Breite von 200-1000 ^g/L. Die Proteinbindung von Flecainid liegt innerhalb 32-58 %.
Die Resorption nach oraler Gabe scheint nicht durch Nahrungsmittel oder Antacida beeinflusst.
Bei gesunden Personen beträgt die Plasmahalbwertzeit von Flecainidacetat nach oraler Einzeldosis 12-13 Stunden. Die Plasmahalbwertzeit ist jedoch verlängert nach oraler Mehrfachgabe (16 Stunden) und bei Patienten mit ventrikulären Arrhythmien (20 Stunden).
Nach oraler Aufnahme wird Flecainidacetat in der Leber metabolisiert und einer extensiven Biotransformation unterzogen. Ca. 86 % einer Dosis werden im Harn ausgeschieden, 27 % als unverändertes Flecainidacetat und 59 % in Form von Metaboliten. Die beiden Hauptmetaboliten im Urin sind meta-O-dealkyliertes Flecainidacetat und meta-O-dealkyliertes Laktam des Flecainidacetat. (Nur 5 % einer oralen Dosis werden mit den Faeces ausgeschieden.)
Diese Metaboliten haben keine klinisch signifikanten antiarrhythmischen Effekte.
Die Plasmaeliminationsrate von Flecainidacetat ist bei Vorliegen von Nierenfunktionsstörungen, Lebererkrankungen oder kongestivem Herzversagen reduziert. Die Ausscheidung von Flecainidacetat im Harn ist bei Patienten mit Nierenfunktionsstörungen und in besonderem Maß bei Patienten mit schweren Nierenfunktionsstörungen reduziert.
5.3 Präklinische Daten zur Sicherheit
Flecainidacetat zeigte in tierexperimentellen Toxizitätsstudien bei wiederholten Gaben keine signifikante systemische Toxizität an den Zielorganen. Bei Ratten und Mäusen war es weder mutagen noch kanzerogen. Flecainidacetat ist placentagängig und geht in die Muttermilch über. Hohe Dosen führten bei Ratten zu fetotoxischen Effekten und bei weißen Neuseeland-Kaninchen, nicht aber bei Dutch Belted Kaninchen oder bei Ratten zu fetalen Missbildungen. Die Bedeutung dieser Beobachtungen für den Menschen ist nicht gesichert.
6.
PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Magnesiumstearat (Ph. Eur.)
Croscarmellose-Natrium Mikrokristalline Cellulose
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Keine besonderen Anforderungen.
6.5 Art und Inhalt des Behältnisses
Polyvinylchlorid-/Aluminiumblister überzogen mit Polyvinyldenchlorid.
Originalpackungen mit 20, 50 und 100 Tabletten. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Mylan dura GmbH Postfach 10 06 35 64206 Darmstadt
8. ZULASSUNGSNUMMERN
52955.00.00
52955.01.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 3. April 2002 Datum der letzten Verlängerung der Zulassung: 2. Juli 2010
10. STAND DER INFORMATION
November 2015
11. Verschreibungsstatus
V erschreibungspflichtig
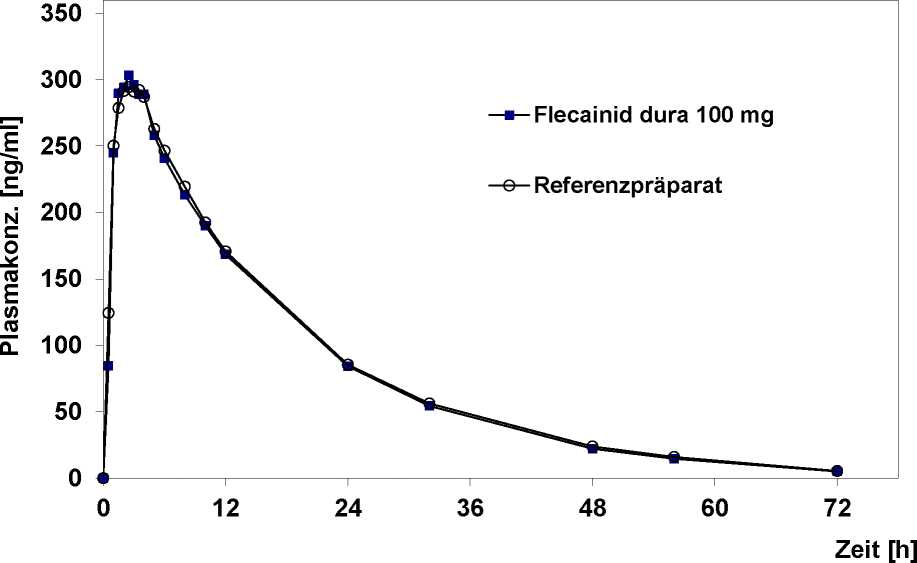
Zusätzliche Angaben der Firma Mylan dura GmbH zur Bioverfügbarkeit von flecadura
Eine von November 1997 bis Februar 1998 durchgeführte Bioverfügbarkeitsuntersuchung an 18 Probanden (13 männliche, 5 weibliche) ergab nach einmaliger Einnahme von 2 Tabletten Flecainid dura 100 mg (entsprechend 200 mg Flecainid) im Vergleich zum Referenzpräparat:
maximale Plasmakonzentration (cmax) in ng/ml:
Zeitpunkt der maximalen Plasmakonzentration (tmax) in h:
Fläche unter der Konzentrations-Zeit-Kurve (AUC0-») in ng/ml x h:
flecadura 100 mg 332,5 ± 81,4 2,22 ± 0,76 5852,7 ± 1718,1
Referenzpräparat
332,2 ± 78,0 2,63 ± 1,26
5998,6 ± 1868,7
Angabe der Werte als arithmetisches Mittel und Standardabweichung
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrations-ZeitDiagramm: